玉屏风口服液抑制小鼠前列腺癌皮下移植瘤的免疫学机制
隋 欣 贾 琼 李 辉 黄连弟 李俊玮 黄歆梅 曹 琛 李 娜 粟 栗
(长春中医药大学,吉林 长春 130017)
玉屏风口服液抑制小鼠前列腺癌皮下移植瘤的免疫学机制
隋欣贾琼李辉1黄连弟2李俊玮2黄歆梅2曹琛2李娜粟栗
(长春中医药大学,吉林长春130017)
〔摘要〕目的探讨玉屏风口服液对小鼠前列腺癌皮下移植瘤的抑制作用及其免疫学机制。 方法将体外培养的小鼠前列腺癌RM1细胞接种于C57B/L小鼠皮下,构建小鼠前列腺癌皮下移植瘤模型,荷瘤小鼠随机分为4组,分别灌胃给予玉屏风口服液0、0.5、1和2 ml,1次/d,共28 d,末次给药的第2天眼球取血处死小鼠,取瘤测瘤体积,苏木素-伊红(HE)染色检测组织学变化,取脾细胞检测淋巴细胞增殖能力和自然杀伤(NK)细胞杀伤活性,ELISA方法检测血清中白细胞介素(IL)-2、IL-4、干扰素(IFN)-γ及肿瘤坏死因子(TNF)-α水平。 结果玉屏风口服液处理后,小鼠前列腺癌皮下移植瘤体积缩小,肿瘤组织出现坏死及炎细胞浸润,淋巴细胞增殖能力和NK细胞杀伤活性增强,血清中IL-2、IFN-γ及TNF-α含量增加。 结论玉屏风口服液可抑制小鼠前列腺癌皮下移植瘤的生长,其抑瘤作用与增强小鼠免疫功能有关。
〔关键词〕玉屏风口服液;前列腺癌;抑瘤作用;免疫调节
前列腺癌患者以中晚期病例为主,失去了根治手术的机会,同时化疗、放疗效果不佳。玉屏风是扶正固表的经典方剂,由黄芪、白术和防风三味中药组成,具有益气、固表、止汗之功效,主要用于自汗恶风、表虚不固、体虚易感风邪者。临床适应证多与免疫力低下或变态反应有关,不仅可用于治疗各种免疫性疾病如肾炎、荨麻疹、过敏性鼻炎等,还可用于肿瘤辅助治疗,改善病人的生活质量〔1~5〕,但玉屏风对前列腺癌的作用尚未报道。本研究旨在探讨玉屏风口服液对前列腺癌皮下移植瘤的抑制作用及其作用机制。
1材料与方法
1.1主要试剂小鼠前列腺癌RM1细胞购自ATCC,RPMI 1640及胎牛血清购自美国Hyclone公司,C57B/L小鼠购自吉林大学基础医学院实验动物中心,ELISA试剂盒购自美国RND公司,Con A、MTT为美国sigma公司产品,玉屏风口服液为江西南昌济生制药厂产品,兔抗CD3、CD4、CD8单克隆抗体及HRP标记的羊抗兔二抗购自美国protein tech公司。
1.2细胞培养常规复苏RM1细胞,将细胞接种于含10%胎牛血清的RPMI 1640培养液中,37℃、5%CO2饱和湿度条件下培养,细胞生长达80%融合时用0.25%胰蛋白酶消化传代,选取对数生长期细胞进行实验。
1.3分组与给药将40只C57雄性小鼠随机分为空白对照组、玉屏风口服液高剂量组(2.0 ml/kg)组、玉屏风中剂量组(1.0 ml/kg)和玉屏风低剂量组(0.5 ml/kg),每组10只。预给药1 w后调整RM1细胞浓度为1×107个/ml,接种于小鼠右侧腋窝皮下,每只200 μl,继续每日灌胃给药28 d,麻醉状态下眼球取血并分离血清,无菌条件下取出脾脏及瘤组织,将瘤组织称重并计算抑瘤率。
1.4脾脏T淋巴细胞增殖能力测定参考文献方法〔6,7〕,无菌取大鼠脾脏,以含10%胎牛血清的RPMI l640完全培养液吹打出单细胞,1 200 r/min离心5 min。弃上清后加红细胞裂解液2 ml,在冰上裂解2 min,再加入培养基至10 ml,1 200 r/min离心5 min。离心后洗涤2次,弃上清,用1 ml培养基重悬细胞,台盼蓝拒染法检测细胞活力>95%,调整细胞浓度为2×107/ml,加入96孔培养板,每孔100 μl。刺激孔加入ConA至终浓度20 μg/ml,设6个重复孔。细胞置37℃、5% CO2饱和湿度条件下培养48 h。每孔加5 mg/ml MTT溶液10 μl,继续培养3 h。每孔加 DMSO 150 μl,震荡10 min,490 nm处读取OD值,计算刺激指数(SI):实验组的平均OD值/对照组的平均OD值。
1.5自然杀伤(NK)细胞杀伤活性检测消化悬浮对数生长期RM1细胞,调整细胞浓度为1×105个/ml。调整脾细胞浓度为5×106个/ml。96孔培养板中先后加入RM1细胞悬液和脾细胞悬液各100 μl。设效应细胞对照孔和靶细胞对照孔:其中效应细胞对照孔加脾细胞和1640培养液各100 μl;靶细胞对照孔加RM1细胞和1640培养液各100 μl。每个样本做6个复孔。37℃、5% CO2孵箱中培养24 h。每孔加入MTT 10 μl,继续孵育4 h。吸弃上清后每孔加150 μl DMSO,酶标仪测定490 nm处的OD值,NK细胞活性(%)=〔1-(ODE+T-ODE)/ODT〕×100%(ODE:效应细胞孔的OD值;ODE+T:效应细胞+靶细胞的OD值;ODT:靶细胞孔的OD值)。
1.6ELISA方法检测细胞因子血清白细胞介素(IL)-2,IL-4,干扰素(IFN)-γ,肿瘤坏死因子(TFN)-α水平检测按照ELISA试剂盒使用说明书进行。将样品稀释液40 μl及样品10 μl加入酶标板孔底部,混匀后37℃温育30 min,洗涤5次,拍干;每孔加入酶标试剂50 μl,37℃温育30 min,洗涤5次,拍干;加入显色剂,37℃避光显色10 min,加入终止液,于450 nm处检测各孔OD值。根据标准曲线的直线回归方程计算样品细胞因子含量。
1.7苏木素-伊红(HE)染色肿瘤组织用4%的多聚甲醛固定石蜡包埋,4 μm连续切片。二甲苯脱蜡后常规HE染色,梯度酒精脱水,二甲苯透明后树胶封片置于,显微镜下观察。
1.8统计学分析采用SPSS17.0软件行t检验。
2结果
2.1移植瘤组织体积给予玉屏风口服液灌胃后,前列腺癌皮下移植瘤生长速度变缓,肿瘤体积减小,其中以中剂量和高剂量组移植瘤体积减小最为明显。
2.2HE染色与对照组相比,治疗组可见较多死亡细胞,表现为核固缩、碎裂或崩解,并出现较多细胞碎片,组织结构消失呈均质红染等形态学改变,伴有淋巴细胞浸润。见图1。
2.3淋巴细胞、NK细胞转化实验结果与对照组相比,玉屏风口服液高剂量组小鼠脾脏T淋巴细胞的增殖能力显著增强,NK细胞的活性明显增强(P<0.05)。见表1。
2.4细胞因子的检测结果与对照组相比,玉屏风口服液高剂量组小鼠血清中IL-2、TNF-α明显升高(P<0.05),中剂量组及高剂量组小鼠血清中IFN-γ显著升高(P<0.01)。见表1。
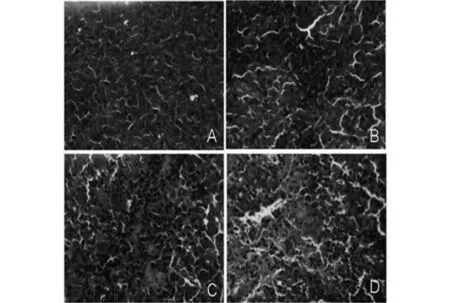
A:对照组;B:低剂量组;C:中剂量组;D:高剂量组图1 玉屏风口服液对前列腺癌皮下移植瘤组织学的影响(HE)

组别SINK细胞活性(%)IL-2(ng/L)IL-4(pg/ml)IFN-γ(ng/L)TNF-α(ng/L)对照组1.05±0.0273.64±2.93162.85±24.6012.24±1.4984.92±7.7119.95±0.52低剂量组1.08±0.1380.56±8.09188.61±19.4211.12±0.52114.9±30.9020.80±1.53中剂量组1.18±0.061)86.80±8.251)197.70±18.4611.89±0.97134.92±3.401)20.46±0.80高剂量组1.26±0.081)87.13±7.411)214.67±49.211)11.01±0.38155.75±7.631)21.48±0.261)
与对照组比较:1)P<0.05
3讨论
近年来前列腺癌发病率呈逐年上升趋势,严重危害老年男性健康。前列腺癌早期可采用激素疗法和手术切除治疗,晚期则主要依靠化疗。由于前列腺癌早期无明显临床症状,一旦发现则往往已属晚期。目前治疗前列腺癌的化疗药物价格昂贵且存在较大毒副作用,而中药则可通过调节机体免疫辅助治疗肿瘤。
中医认为,肿瘤的发生与正虚邪实关系密切,邪实既指感受邪气,又指体内邪气过盛,无论外感六淫,内伤七情,还是饮食劳伤,皆可导致机体脏腑功能失调,阴阳失和,七血紊乱,或为痰凝,或为血瘀。而淤血、痰块作为致病因素,在正虚的条件下,内外合邪,毒邪留滞,致发肿瘤。因此关于肿瘤的治疗多采用扶正结合祛邪,增强后天功能和机体免疫力是当前常用的恶性肿瘤治疗法则,可有效改善患者生活质量、延长带瘤生存期。玉屏风是扶正固表的良方,玉屏风口服液对前列腺癌皮下移植瘤有明显的抑瘤作用,免疫学机制可能参与玉屏风的抑瘤作用。NK细胞是机体免疫功能的重要执行细胞,可杀伤某些肿瘤或受病毒感染的细胞,为机体抗肿瘤的第一道防线。T淋巴细胞是参与获得性免疫应答的主要细胞之一,它主要在胸腺内分化成熟,到达外周免疫器官后发挥细胞和体液免疫调节作用。本研究表明玉屏风口服液可激活机体的免疫系统。NK细胞的杀伤作用具有非特异性,可通过其受体识别靶细胞配体直接杀伤靶细胞或通过抗体依赖性细胞介导的细胞毒作用直接杀伤靶细胞,NK细胞的这些免疫效应在抗肿瘤免疫作用中具有非常重要的地位。NK细胞还可分泌TNF-α和IFN-γ等细胞因子,增强NK细胞的杀伤活性,同时增加自身的抗肿瘤免疫效应。本研究中玉屏风口服液处理组TNF-α和IFN-γ显著增高,可能是由于NK细胞活化后,导致细胞因子分泌增加的结果。本研究结果提示,恶性肿瘤引起的宿主自身免疫抑制是治疗肿瘤的有效靶点,应用药物增强免疫是抗肿瘤的有效方式。
4参考文献
1高锐卿,苗相本.玉屏风散在呼吸系统疾病中的药理及临床研究进展〔J〕.浙江中医杂志,2003;(7):318-9.
2周若梅,李来秀.玉屏风口服液的药理学研究〔J〕.陕西中医,2004;25(1):71-3.
3辛洪涛,侯林江,徐少华,等.玉屏风散的免疫药理研究进展〔J〕.中国中药杂志,1998;23(8):505-7.
4侯林江,辛洪涛.玉屏风散的免疫药理研究进展〔J〕.中国中西医结合杂志,1998;18(11):701-3.
5陈向涛,李俊.玉屏风散的免疫药理研究进展〔J〕.安徽医药,2003;7(4):241-3.
6Thomasset DN.Use of MTT colorimetric assay to measure cell activation〔J〕.J Immunol Methods,1986;94(1-2):57-63.
7Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays〔J〕.J Immunol Methods,1983;65(1-2):55-63.
〔2015-12-12修回〕
(编辑滕欣航)
基金项目:吉林省教育厅科研基金资助课题(吉教科合字〔2015〕第342号);吉林省卫生厅科研项目(2012Z024)
通讯作者:李娜(1978-),女,副研究员,主要从事药理学研究。
〔中图分类号〕R258.5
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2611-02;
doi:10.3969/j.issn.1005-9202.2016.11.019
1吉林省前卫医院2吉林大学白求恩医学部
粟栗(1974-),女,副教授,主要从事膏方剂学研究。
第一作者:隋欣(1984-),女,博士在读,讲师,主要从事中药药剂学研究。

