结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例及功能
欧阳书睿 郑兴斌 梁金龙 谢 铭
(遵义医学院附属医院胃肠外科,贵州 遵义 563000)
结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例及功能
欧阳书睿郑兴斌梁金龙谢铭
(遵义医学院附属医院胃肠外科,贵州遵义563000)
〔摘要〕目的观察结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞数量和功能的改变。方法选取结直肠癌患者20例及同期入院进行健康体检者20例,抽取受试者清晨空腹外周血10 ml。采用流式细胞术测定其外周血Vδ1 T细胞及Vδ2 T细胞比例,并检测Vδ1 T细胞表面Foxp3表达情况及Vδ2 T细胞穿孔素表达情况。结果结直肠癌患者外周血Vδ1 T细胞比例为(1.45±0.52)%,Vδ2 T细胞比例为(5.46±1.42)%;健康对照外周血Vδ1 T细胞比例为(2.62±0.89)%,Vδ2 T细胞比例为(0.93±0.34)%;与健康对照相比,结直肠癌患者外周血Vδ1 T细胞比例显著升高(P<0.01),而Vδ2 T细胞比例显著降低(P<0.01)。结直肠癌患者外周血Vδ1 T细胞Foxp3表达水平(2.45±1.32)%较健康对照(6.82±2.14)%相比显著升高(P<0.01)。结直肠癌患者外周血Vδ2 T细胞穿孔素表达水平(32.73±11.74)%较健康对照(21.73±7.42)%相比显著降低(P<0.01)。随着结直肠癌患者病理分级的升高,结直肠癌患者外周血Vδ1 T细胞比例逐渐升高(P<0.01);随着病情严重性的增加,结直肠癌患者外周血Vδ2 T细胞比例逐渐降低(P<0.01)。结论结直肠癌患者外周血Vδ1 T细胞比例升高且免疫抑制作用增强,而Vδ2 T细胞比例降低且杀伤功能减弱,结直肠癌患者免疫功能的这种改变可能与结直肠癌的发生发展及转移密切相关。
〔关键词〕结直肠癌;T细胞;免疫调节;穿孔素
尽管结直肠癌的诊断和治疗手段目前都有显著提高,然而手术和化疗的疗效仍然不能令人满意〔1,2〕。δ T细胞仅占外周血CD3+T细胞的1%~10%〔3〕。人类δ T细胞主要分为两大亚群,即Vδ1 T细胞和Vδ2 T细胞〔4,5〕。Vδ1 T细胞主要存在于上皮相关的淋巴组织,而Vδ2 T细胞主要存在于外周血中。Vδ1 T细胞主要功能为免疫调节作用〔6〕,而Vδ2 T细胞主要为肿瘤杀伤功能〔7〕。Vδ1 T细胞和Vδ2 T细胞在肿瘤发生发展中的作用已有大量文献报道〔8~10〕。但目前关于Vδ1 T细胞和Vδ2 T细胞数量和功能的改变在结直肠癌中的比例和功能研究很少有文献报道。本研究通过考察结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例和功能的变化,明确结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例和功能的变化与结直肠癌发生发展和转移之间的关系。
1材料与方法
1.1临床资料选取2013 年10月30日至2014 年12月30日在我科住院的结直肠癌患者20例。患者术前均未接受化学治疗、放射治疗或免疫治疗。收集患者清晨空腹外周血,同时收集20例健康对照外周血作为对照。20例患者的平均年龄(58.35±11.52)岁,健康对照平均年龄(57.84±12.73)岁。所有结直肠癌患者均经手术治疗,并经病理医生评估患者的临床病理分期。
1.2外周血单个核细胞(PBMC)分离方法抗凝血管无菌采集受试者的空腹外周血,抗凝血采用无菌PBS按1∶1的比例稀释,随后按2∶1的比例缓缓加入已预加淋巴细胞分离液的15 ml离心管中,800 r/min离心18 min;采用无菌滴管吸取淋巴细胞分离液上层的白膜层,加入装有10 ml无菌PBS的15 ml离心管中,600 r/min离心15 min;细胞沉淀以10 ml无菌PBS重悬,400 r/min离心8 min;再用1 ml无菌PBS将细胞沉淀重悬,台盼蓝染色计数后制备成浓度为2×106个/ml的细胞悬液。
1.3外周血Vδ1 T细胞和Vδ2 T细胞比例测定无菌分选获取的PBMC,以含1%BSA 的PBS洗涤2次后,加入相应荧光抗体(APC-CD3、FITC-TCR Vδ1,PE-TCR Vδ2),4℃避光孵育30 min;以含1%BSA 的PBS洗涤两次后,细胞重悬于0.1 ml 1%多聚甲醛固定液中待流式细胞仪检测。
1.4Vδ1 T细胞表面Foxp3表达检测无菌分选获取的PBMC,以含1%BSA 的PBS洗涤2次后,加入相应荧光抗体(PE-CD3、FITC-TCR Vδ1),4℃避光孵育30 min;以含1%BSA 的PBS洗涤2次后加入0.5 ml细胞膜固定透化液重悬细胞,室温避光30 min;以透化液洗涤细胞2次后加入相应荧光抗体(APC-Foxp3),室温避光30 min;以透化液洗涤细胞2次,细胞重悬于0.2 ml 1%多聚甲醛固定液中待流式细胞仪检测。
1.5Vδ2 T细胞穿孔素表达检测无菌分选获取的PBMC,以PMA和Ion预先刺激6 h,随后采用上述1.4染色方法进行Vδ2 T细胞穿孔素表达检测。
1.6统计学处理采用SPSS16.0软件。两组数据间比较采用t检验,多组数据比较采用ANOVA分析。
2结果
2.1结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例结直肠癌患者外周血Vδ1 T细胞比例为(1.45±0.52)%,显著高于健康对照〔(2.62±0.89)%〕(P<0.01);结直肠癌患者外周血Vδ2 T细胞比例为(5.46±1.42)%,显著低于健康对照〔(0.93±0.34)%〕(P<0.01)。
2.2结直肠癌患者外周血Vδ1 T细胞Foxp3表达结直肠癌患者外周血Vδ1 T细胞Foxp3表达水平为(2.45±1.32)%,显著高于健康对照〔(6.82±2.14)%〕(P<0.01)。
2.3结直肠癌患者外周血Vδ2 T细胞穿孔素表达结直肠癌患者外周血Vδ2 T细胞穿孔素表达水平为(32.73±11.74)%,显著高于健康对照〔(21.73±7.42)%〕(P<0.01)。
2.4结直肠癌患者外周血Vδ1 T、Vδ2 T细胞比例与临床分期关系如图1所示,随着病情严重性的增加,结直肠癌患者外周血Vδ1 T细胞比例逐渐升高(P<0.01),Vδ2 T细胞比例逐渐降低(P<0.01)。
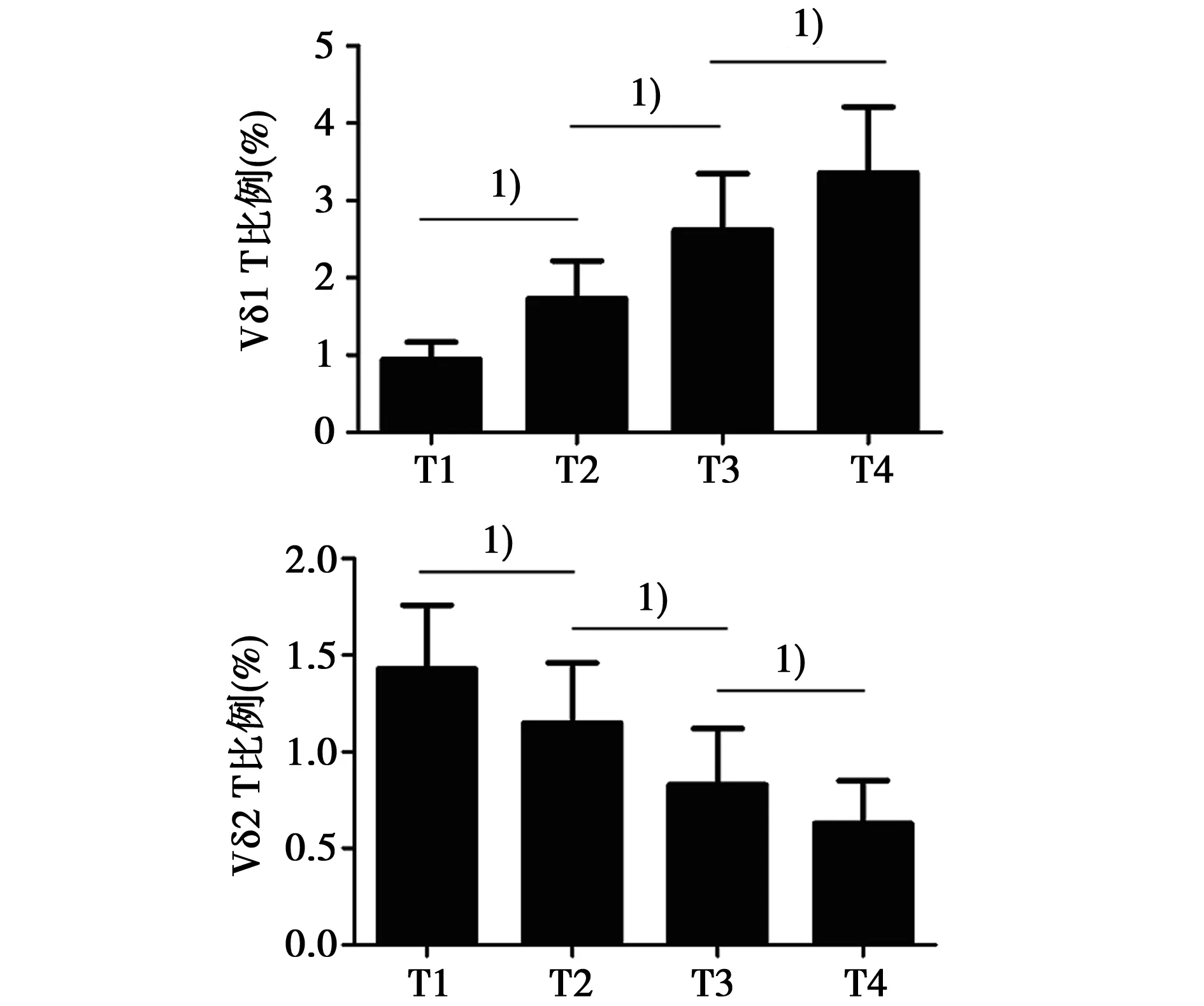
1)P<0.05图1 结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例与临床分期关系
3讨论
尽管结直肠癌的诊断和治疗手段目前都有显著提高,然而手术和化疗的疗效仍然不能令人满意〔1〕。本研究证实结直肠癌患者外周血Vδ1 T细胞比例显著升高,而Vδ2 T细胞比例显著降低。人类δT细胞主要分为两大亚群,即主要存在于上皮相关淋巴组织的Vδ1 T细胞和主要存在于外周血中的Vδ2 T细胞〔2,3〕。Vδ1 T细胞主要功能为免疫调节作用〔4〕,而Vδ2 T细胞主要为肿瘤杀伤功能〔5〕。本研究结果证实,结直肠癌患者外周血Vδ1 T细胞的免疫调节作用显著增强。Vδ2 T细胞主要通过穿孔素-颗粒酶途径杀伤肿瘤细胞〔6〕,本研究同时证实Vδ2 T细胞的肿瘤杀伤功能显著降低。上述结果提示结直肠癌患者外周血免疫功能处于免疫抑制状态,这种免疫抑制状态可能与结直肠癌的发生和发展以及转移密切相关,尤其是血液途径的转移。
δ T细胞主要以主要组织相容性复合体(MHC)非限制性方式识别多种肿瘤相关抗原〔7~9〕,并能分泌多种细胞因子〔10,11〕。因此,近年来δ T细胞已成为肿瘤过继免疫治疗的优势候选细胞〔12〕。在肿瘤患者化疗后的适当时机给予患者Vδ2 T细胞过继免疫治疗可增强患者的抗肿瘤免疫活性〔13〕。而与Vδ2 T细胞不同的是,Vδ1 T细胞主要表现为免疫抑制作用,肿瘤患者体内表达水平升高的Vδ1 T细胞可促进肿瘤的发生和发展〔14〕。本研究明确了结直肠癌患者外周血Vδ1 T细胞和Vδ2 T细胞比例和功能的变化情况,为结直肠癌的发生发展和转移机制提供了进一步的科学依据。
4参考文献
1Quan Y,Xu M,Cui P,etal.Grainyhead-like 2 promotes tumor growth and is associated with poor prognosis in colorectal cancer〔J〕.J Cancer,2015;6(4):342-50.
2Hayday AC.〔gamma〕〔delta〕cells:a right time and a right place for a conserved third way of protection〔J〕.Ann Rev Immunol,2000;18:975-1026.
3Christmas SE.Subpopulations of human peripheral T gamma delta lymphocytes〔J〕.Immunol Today,1989;10(11):361.
4Li X,Kang N,Zhang X,etal.Generation of human regulatory gammadelta T cells by TCRgammadelta stimulation in the presence of TGF-beta and their involvement in the pathogenesis of systemic lupus erythematosus〔J〕.J Immunol,2011;186(12):6693-700.
5Accardo-Palumbo A,Giardina AR,Ciccia F,etal.Phenotype and functional changes of Vgamma9/Vdelta2 T lymphocytes in Behcet′s disease and the effect of infliximab on Vgamma9/Vdelta2 T cell expansion,activation and cytotoxicity〔J〕.Arthritis Res Ther,2010;12(3):R109.
6Yin S,Zhang J,Mao Y,etal.Vav1-phospholipase C-γ1(Vav1-PLC-γ1)pathway initiated by T cell antigen receptor(TCRγδ)activation is required to overcome inhibition by ubiquitin ligase Cb1-b during γδT cell cytotoxicity〔J〕.J Biol Chem,2013;288(37):26448-62.
7Moser B,Eberl M.Gammadelta T cells:novel initiators of adaptive immunity〔J〕.Immunol Rev,2007;215:89-102.
8Kabelitz D,Wesch D,He W.Perspectives of gammadelta T cells in tumor immunology〔J〕.Cancer Res,2007;67(1):5-8.
9Morita CT,Mariuzza RA,Brenner MB.Antigen recognition by human gamma delta T cells:pattern recognition by the adaptive immune system〔J〕.Springer Semin Immunopathol,2000;22(3):191-217.
10卢益中,江松平,徐建欧.脑心通胶囊合天麻钩藤饮颗粒序贯治疗中风后眩晕症的临床体会〔J〕.内蒙古中医药,2014;33(25):7-8.
11郑万利.自拟止眩汤治疗老年人眩晕40例〔J〕.陕西中医,2013;34(2):173-4.
12周晓玲,谢胜,殷小兰.中医辨证论治结合拉米夫定治疗慢性乙型肝炎临床疗效观察〔J〕.中西医结合肝病杂志,2010;20(2):80-2.
13Mattarollo SR,Kenna T,Nieda M,etal.Chemotherapy and zoledronate sensitize solid tumour cells to Vgamma9Vdelta2 T cell cytotoxicity〔J〕.Cancer Immunol Immunother,2007;56(8):1285-97.
14Peng G,Wang HY,Peng W,etal.Tumor-infiltrating gammadelta T cells suppress T and dendritic cell function via mechanisms controlled by a unique toll-like receptor signaling pathway〔J〕.Immunity,2007;27(2):334-48.
〔2015-11-19修回〕
(编辑徐杰)
通讯作者:谢铭(1967-),女,主任医师,主要从事消化道肿瘤研究。
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2016)11-2597-03;
doi:10.3969/j.issn.1005-9202.2016.11.012
第一作者:欧阳书睿(1987-),男,博士,医师,主要从事消化道肿瘤研究。

