活动期溃疡性结肠炎患者外周血中CD11c+髓样树突状细胞频数和细胞表型的变化
王香莉郑天送贾妮娜肖晋美高虹张继萍张桓虎
活动期溃疡性结肠炎患者外周血中CD11c+髓样树突状细胞频数和细胞表型的变化
王香莉1郑天送1贾妮娜2肖晋美2高虹2张继萍3张桓虎2
【摘要】目的 探讨活动期溃疡性结肠炎(UC)患者外周血中CD11c+髓样树突状细胞(mDC)频数和细胞表型的变化,以及与患者临床严重程度的关系。方法 流式细胞仪检测外周血中CD11c+mDC占外周血单个核细胞(PBMC)的比率;磁珠分选方法分离纯化CD11c+mDC,流式细胞仪检测CD11c+mDC表面共刺激分子CD80和CD86表达率。结果 与健康对照组比较,活动期UC患者外周血中CD11c+mDC 占PBMC的比率明显降低,差异有统计学意义[(0.31%±0.40%)vs.(0.78%±0.40%),P<0.05];患者组不同临床严重程度CD11c+mDC频数存在差异;新鲜分离的CD11c+mDC表面共刺激分子CD80和CD86表达较低,但患者组CD80和CD86的表达均高于健康对照组,差异有统计学意义[(6.83%±3.22%) vs.(2.50%±1.23%),(43.95%±16.42% )vs. (17.22%±7.53%),P<0.05]。结论 活动期UC患者外周血中CD11c+mDC频数降低,但CD11c+mDC表面共刺激分子CD80和CD86表达率并未严重受损;活动期UC患者外周血中CD11c+mDC频数降低可能与患者临床严重程度相关。
【关键词】溃疡性结肠炎;活动期;CD11c+髓样树突状细胞;频数;细胞表型
作者单位:1 030001太原,山西医科大学;2 030001太原,山西医科大学第二医院肝病科;3 030001太原,山西医科大学第二医院科技处
溃疡性结肠炎(ulcerative colitis,UC)是一种多因素的肠道疾病,表现为慢性非特异性。免疫应答异常和免疫调节失衡是导致UC发病的重要原因。UC免疫反应中主要的免疫细胞有T细胞和将其活化的抗原递呈细胞。树突状细胞(dendritic cells,DC)作为人体内功能最强并且是唯一能够活化初始型T细胞的抗原递呈细胞,在其中发挥着重要的联络作用。外周血中至少存在两类不同亚型DC,对其进行分选研究将有助于进一步阐明各自在机体免疫中的不同作用。对CD11c+髓样树突状细胞(myeloid dendritic cells,mDC)频数、细胞表面共刺激分子的表达和功能特点进行研究可以帮助我们认识其在UC发病中的作用机制,也可能为今后寻找治疗UC新方法提供依据。本研究主要对活动期UC患者外周血中CD11c+mDC占PBMC的比率及细胞表型进行检测,并分析其与患者临床严重程度的关系。
1 资料和方法
1.1 资料
收集2014年7月~2015年10月山西医科大学第二医院消化内科住院及门诊活动期UC患者40例,设为UC患者组,所有患者诊断符合2012年我国中华医学会消化病学分会炎症性肠病诊断与治疗的共识意见标准,并且有完整的结肠镜及病理学诊断资料。排除合并其他重要器官严重疾病患者、肿瘤患者、妊娠期及哺乳期患者。所有患者未用过或复发前6个月未用过可能影响机体免疫功能的相关药物,包括水杨酸制剂、糖皮质激素及免疫抑制剂。收集同期30例健康体检者作为健康对照组,性别、年龄与UC患者组相匹配,差异无统计学意义,见表1。所有患者及健康体检者血液采集均经本人知情同意,并经医院伦理委员会批准。淋巴细胞分离液为天津灏洋生物制品科技有限责任公司产品;异硫氰酸(FITC)标记鼠抗人Lineage(包括CD3、CD14、CD16、CD19、CD20、CD56)单克隆抗体及同型对照鼠IgG1购自晶美公司;藻红蛋白(PE)标记鼠抗人CD11c 单克隆抗体、别藻蓝蛋白(APC)标记鼠抗人HLA-DR单克隆抗体、FITC标记鼠抗人CD80单克隆抗体、PE标记鼠抗人CD86单克隆抗体及同型对照鼠IgG2a /IgGb均由eBioscience公司生产;BDCA-1树突状细胞分离试剂盒购自德国美天妮公司;美国BD公司产流式细胞仪,FACS Calibur。
表1 两组一般资料比较[n,(±s)]

表1 两组一般资料比较[n,(±s)]
注:两组比较,P>0.05
组别 例数 性别(男/女) 年龄(岁)UC患者组 40 19/21 36.4±14.2健康对照组 30 15/15 37.8±13.6
1.2 方法
1.2.1 PBMC分离 将肝素抗凝新鲜外周血2 ml缓慢加至淋巴细胞分离液液面上(注意不要使血液混入分离液),置于水平式离心机内以1 500 r/min离心30 min,吸取环状乳白色细胞层,获取PBMC。
1.2.2 外周血中CD11c+mDC频率检测 上述方法分离获得的PBMC用磷酸盐缓冲液(PBS)洗涤3次,100 μl PBS悬浮细胞,加入FITC标记鼠抗人Lineage(包括CD3、CD14、CD16、CD19、CD20、CD56)mAb,PE标记鼠抗人CD11c mAb,APC标记鼠抗人HLA-DR mAb各10 μl,同时设同型对照,室温避光孵育30 min,置于水平式离心机内以1 500 r/min离心5 min,4%多聚甲醛固定,上流式细胞仪检测。先圈出Lineage阴性,再圈出CD11c 和HLA-DR双阳性的细胞即为mDC。
1.2.3 外周血中CD11c+mDC的分离 PBMC行细胞计数,300 μl PBS悬浮细胞,加入100 μl FcR-阻断剂混匀,再加入100 μl BDCA-1磁珠混匀,4℃冰箱孵育15 min后用5 ml PBS洗涤,在磁分选单位上用MS柱阳选出BDCA-1+mDC即为CD11c+mDC。
1.2.4 新鲜分离的CD11c+mDC细胞表型测定 收集上述新鲜分离的CD11c+mDC,取>2×104细胞,用FITC标记鼠抗人CD80 mAb 和PE标记鼠抗人CD86 mAb各10 μl标记细胞,同时设同型对照,室温避光孵育30 min,置于水平式离心机内以1 500 r/min离心5 min,4%多聚甲醛固定,上流式细胞仪检测。
1.2.5 活动期UC患者疾病严重程度分级 采用改良Truelove和Witts疾病严重程度分型标准[1],按疾病活动性的严重程度分为轻、中、重度,见表2。
1.3 统计学方法
应用SPSS 17.0软件进行统计学处理,计量资料用(均数±标准差)(±s)表示。两组均数比较采用t 检验,单因素方差分析用于多组均数的显著性检验,P<0.05为差异有统计学意义。
2 结果
2.1 外周血中CD11c+mDC占PBMC的比率
流式细胞仪检测出lineage阴性,CD11c和HLA-DR双阳性细胞占PBMC的比率。对40例活动期UC患者及30例健康对照者外周血中CD11c+mDC占PBMC的比率进行t检验,差异有统计学意义(P<0.05),活动期UC患者外周血中CD11c+mDC占PBMC的比率低于健康对照组[(0.31%±0.40%)vs. (0.78%±0.40%)],P<0.05,如图1。
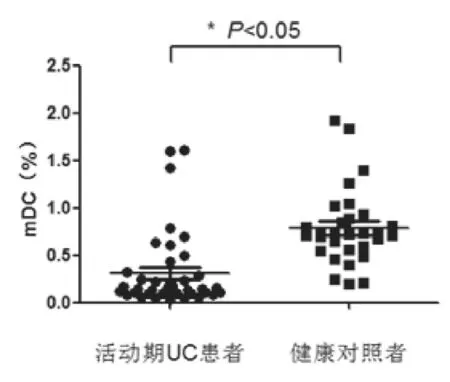
图1 外周血中CD11c+mDC频率的变化
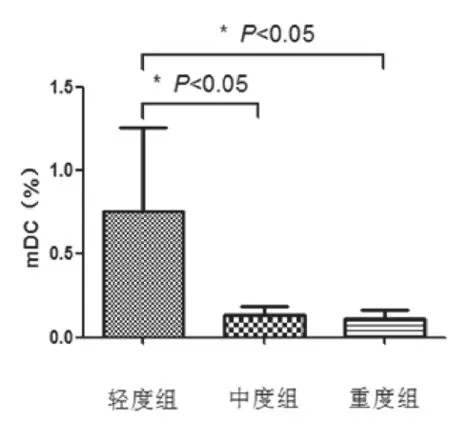
图2 不同临床严重程度CD11c+mDC频数
2.2 不同临床严重程度活动期UC患者外周血中CD11c+mDC频数比较
活动期UC患者按疾病活动性的严重程度分为轻、中、重度3组,其中轻度患者12例,中度15例,重度13例。3组CD11c+mDC频数分别(0.76%±0.50%),(0.13%±0.05%),(0.11%±0.05%)。中度组和重度组CD11c+mDC频数均低于轻度组,差异有统计学意义(P<0.05);中度组和重度组CD11c+mDC频数比较差异无统计学意义,如图2。
2.3 新鲜分离外周血中CD11c+mDC细胞表型的变化
流式细胞仪检测新鲜分离的CD11c+mDC表面共刺激分子CD80和CD86,活动期UC患者组CD80和CD86表达率分别为(6.83%±3.22%),(43.95%±16.42%),健康对照组CD80和CD86表达率为(2.50%±1.23%),(17.22%±7.53%)。活动期UC患者组CD80和CD86表达率均高于健康对照组,差异有统计学意义(P<0.05),如图3。

表2 改良Truelove和Witts疾病严重程度分型
3 讨论
UC属于炎症性肠病(inflammatory bowel disease,IBD)范畴,近年来患病率明显增加,日益成为严重影响人类健康的消化系统疾病之一。研究认为,包括环境、遗传、自由基损伤、免疫等多种因素共同导致UC的发病[2],而免疫应答异常和免疫调节失衡被认为是发病的重要环节[3]。DC是人体内功能强大的抗原递呈细胞,通过活化初始型T细胞并将抗原递呈给T细胞,使UC免疫反应中最重要的效应细胞发挥免疫作用。外周血DC根据其表型和功能可分为髓样树突状细胞(mycloid dendritic cell,mDC)和浆样树突状细胞(plasmacytoid dendritic cells,pDC)[4]。既往研究多以单核细胞来源的树突状细胞(monocyte-derived dendritic cells,moDC)在细胞因子刺激下长时间体外培养,DC本身的免疫应答会发生改变。因此,将外周血CD11c+mDC和CD123+pDC分选研究可能有助于进一步阐明不同亚型DC在机体免疫中的不同作用以及与活动期UC患者临床严重程度的关系。CD11c+mDC在体内主要发挥抗原提呈功能,促进Th1细胞极化和细胞免疫的发生[5]。pDC激活后主要产生机体内源性Ⅰ型干扰素(Ⅰ-IFN),它既能直接抑制病毒复制,又能激活NK细胞、淋巴细胞和mDC,从而诱导并增强免疫应答反应[6]。所以,我们对mDC和pDC进行分离研究可以完善以往对DC缺陷引起机体免疫功能紊乱的新认识。
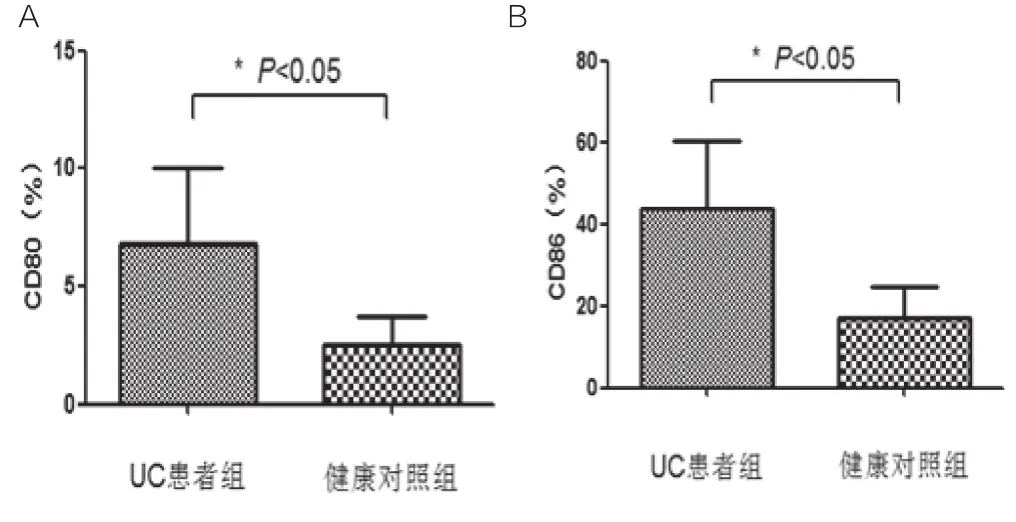
图3 新鲜分离CD11c+mDC表面共刺激分子CD80和CD86表达率
近来有研究表明,肠道DC在UC的病理过程中发挥重要作用[7],Drakes等[8]在小鼠结肠炎的模型中将结肠DC与自体固有层的T细胞共同培养,刺激IFN-γ和IL-6的产生时,其数量显著高于DC与同源或异源脾脏T细胞共同培养时产生的IFN-γ 和IL-6。DC与UC密切相关[9-10]。若单纯比较DC亚群数量变化意义不大,本实验结合患者临床严重程度指标来探讨临床现象与免疫研究之间的相关性。结果显示:活动期UC患者外周血中CD11c+mDC占PBMC的比率下降,可能与下列因素有关:(1)肠道病原微生物及其产物直接感染CD11c+mDC,诱导其凋亡,导致CD11c+mDC数量下降。(2)CD11c+mDC参与肠道免疫活动而转移到炎症部位。本研究根据疾病严重程度分级,将活动期不同疾病严重程度UC患者CD11c+mDC相对数量作比较,发现中度组和重度组CD11c+mDC占PBMC的比率均低于轻度组,提示外周血中CD11c+mDC激活后迁移到肠道炎症部位,从而使外周血中CD11c+mDC数量减少,这与之前Baumgart等[11]研究结果一致。Baumgart等研究还发现IBD患者结肠黏膜上pDC高表达,并且其分泌的TNF-α、IL-6、IL-8也较正常对照增高[12]。
成熟DC表达共刺激分子CD80(B7-1)和CD86(B7-2),它们与表达于T细胞表面的CD28结合,形成第二信号,刺激T细胞活化。当强烈的共刺激信号形成后,CTL等免疫活性细胞被激活,进而产生免疫应答。以往有研究测定UC患者结肠黏膜上CD80和CD86的表达,结果提示CD80仅在部分患者中能检测到,CD86存在于所有患者,而健康对照组均未能检出[13]。本研究对CD11c+mDC分离纯化,通过直接检测未经刺激DC细胞表型来反映其在外周血中的活化状态。研究结果显示:UC患者组与健康对照组CD11c+mDC表面共刺激分子CD80和CD86表达率均低下,说明循环中DC绝大部分为未成熟DC。活动期UC患者CD86表达率高于健康对照组,原因可能是UC患者外周血中mDC加工递呈抗原,通过淋巴管迁移至脾脏和淋巴结,完成成熟过程,同时表面共刺激分子表达增加;在这个过程中可能还会检测到外周血中mDC的CD86表达升高。同时也提示:UC患者外周血CD11c+mDC在受到病原微生物及其产物刺激后形成共刺激信号,其能力并未受明显影响[14]。
如果体内DC免疫功能异常将会影响到机体免疫的各个环节。本研究表明,活动期UC患者外周血中CD11c+mDC数量减少可能与肠道病原微生物及其产物作用以及肠道炎症均有关系。CD11c+mDC数量减少导致机体特异性免疫反应产生能力降低,但细胞表面共刺激分子生成能力却并未严重受损。本研究对于探讨活动期UC发病的免疫机制及今后寻找新的治疗UC的药物靶点具有重要意义。
参考文献
[1] 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年)[J]. 中华内科杂志,2012,51(10):818-831.
[2] 樊代明. 炎症性肠疾病的免疫学基础及免疫治疗[J]. 中国实用外科杂志,2007,27(3):183-185.
[3] Targan SR,Karp LC. Defects in mucosal immunity leading to ulcerative colitis[J]. Immunol Rev.,2005,206:296-305.
[4] Robinson SP,Patterson S,English N, et al. Human peripheral blood contains two distinct lineages of dendritic cells[J]. Eur J Immunol,1999,29(9):2769-2778.
[5] Coombes JL,Powrie F. Dendritic cells in intestinal immune regulation[J]. Nat Rev Immunol,2008,8(6):435-446.
[6] McKenna K,Beignon AS,Bhardwaj N. Plasmacytoid dendritic cells:linking innate and adaptive immunity[J]. J Virol.,2005,79(1):17-27.
[7] Nijhuis Laurens EJ,Olivier Brenda J,de Jonge Wouter J.Neurogenic regulation of dendritic cells in the intestine[J]. Biochem Pharmacol,2010,80(12):2002-2008.
[8] Drakes ML,Blanchard TG,Czinn SJ. Colon lamina propria dendritic cells induce a proinflammatory cytokine response in lamina propria T cells in the SCID mouse model of colitis[J]. J Leukoc Biol.,2005,78(6):1291-1300.
[9] Jostins L,Ripke S,Weersma RK,et al. Host-microbe interactions have shaped the genetic architecture of inflammatory bowel disease[J].Nature,2012,491(7422):119-124.
[10] Khor B,Gardet A,Xavier RJ. Genetics and pathogenesis of inflammatory bowel disease[J]. Nature,2011,474 (7351):307 -317.
[11] Baumgart DC,Metzke D,Schmitz J,et al. Patients with active inflammatory bowel disease lack immature peripheral blood plasmacytoid and myeloid dendritic cells[J]. Gut.,2005, 54(2):228-236.
[12] Baumgart DC,Metzke D,Guckelberger O,et al. Aberrant plasmacytoid dendritic cell distribution and function in patients with Crohn's disease and ulcerative colitis[J]. Clin Exp Immunol,2011,166(1):46-54.
[13] Scarpa M,Behboo R,Angriman I,et al. The role of costimulatory molecules CD80 and CD86 and INFgamma in the pathogenesis of ulcerative colitis[J]. Dig Dis Sci.,2004,49(11-12):1738-1744.
[14] 王润江. 溃疡性结肠炎的外科治疗[J]. 中国继续医学教育,2015,7(22):87-88.
·临床研究·
Changes in Frequency and Phenotype of Circulating CD11c+Myeloid Dendritic Cells in Patients With Active Ulcerative Colitis
WANG Xiangli1ZHENG Tiansong1JIA Ni’na2XIAO Jinmei2GAO Hong2ZHANG Jiping3ZHANG Huanhu2, 1 Shanxi Medical University, Taiyuan 030001, China, 2 Department of liver diseases, the second hospital of Shanxi Medical University, Taiyuan 030001, China, 3 Science and Technology Department of the second hospital of Shanxi Medical University, Taiyuan 030001, China
[Abstract]Objective To investigate the frequency and phenotype of circulating CD11c+myeloid dendritic cells (mDC) in patients with active ulcerative colitis. Methods CD11c+mDC were isolated by immunomagnetic selection. Flow cytometry was used to analyze the frequency of circulating CD11c+mDC and costimulatory molecules CD80 and CD86 on freshly isolated mDCs. Results The frequency of peripheral CD11c+mDC in patients with active ulcerative colitis was significantly decreased as compared with that in the healthy controls [(0.31%±0.40%) vs. (0.78%±0.40%), P<0.05]. Statistic differences of the CD11c+mDC frequency also existed among patients with different clinical severity. Both CD80 and CD86 expression on freshly isolated CD11c+mDC surface were lower, however, both CD80 and CD86 expression in the patients was relatively higher than that in the control [(6.83%±3.22%) vs. (2.50%±1.23%), (43.95%±16.42%) vs. (17.22%±7.53%), P<0.05]. Conclusion Reduce the active UC patients and in the peripheral blood of CD11c+mDC frequency, but the surface of the CD11c+mDC costimulatory molecules CD80 and CD86 expression rate was not seriously damaged, active UC patients and in the peripheral blood of CD11c+mDC frequency decreased and were correlated with the clinical severity.
[Key words]Ulcerative colitis, Active, CD11c+myeloid dendritic cell, Frequency, Phenotype
【中图分类号】R512
【文献标识码】A
【文章编号】1674-9308(2016)05-0033-03
doi:10.3969/j.issn.1674-9308.2016.05.022
基金项目:山西省卫生厅科研课题(201201073)
通讯作者:张桓虎,E-mail:zhhh31@163.com

