结直肠癌患者外周血PD-1的表达及其临床意义*
吴佳茗 陈卫昌 张海玲 张光波 陶丽华 刘 忆
苏州大学附属第一医院消化内科1(215006) 苏州大学临床免疫研究所2
结直肠癌患者外周血PD-1的表达及其临床意义*
吴佳茗1#陈卫昌1&张海玲1张光波2陶丽华1刘忆1
苏州大学附属第一医院消化内科1(215006)苏州大学临床免疫研究所2
背景:协同刺激分子的异常表达与肿瘤细胞免疫逃逸关系密切。程序性死亡受体-1(PD-1)是重要的负性协同刺激分子,与相关配体结合后可诱导并维持肿瘤细胞的免疫耐受,从而促进肿瘤的发生、发展。目的:探讨结直肠癌患者外周血PD-1的表达及其临床意义。方法:选取2015年3月—2015年9月苏州大学附属第一医院的88例结直肠癌患者,以16名健康志愿者作为对照。采用ELISA法检测血清可溶性PD-1(sPD-1)含量,流式细胞术检测外周血CD3+T细胞上PD-1的表达。结果:结直肠癌患者外周血sPD-1含量和CD3+T细胞上PD-1阳性表达率均显著高于对照组(P<0.05),且sPD-1含量与肿瘤分化程度、淋巴结转移和Dukes分期相关(P<0.05),而与患者的性别、年龄和肿瘤部位无关(P>0.05)。结论:结直肠癌患者外周血PD-1高表达,且与肿瘤分期、转移呈正相关。检测PD-1有助于估计病情的进展,有望成为新的肿瘤标记物或抗肿瘤靶点。
关键词结直肠肿瘤;程序性死亡受体-1;酶联免疫吸附测定;流式细胞术
Flow Cytometry
结直肠癌是常见的消化道恶性肿瘤,其发生、发展是一个多因素、多阶段、多步骤的复杂生物学过程。该过程与机体免疫功能状态关系密切。肿瘤细胞的免疫逃逸对恶性肿瘤的进一步发展和转移起有非常重要的作用[1]。程序性死亡受体-1(programmed death-1, PD-1)是近年发现的非常重要的负性协同刺激分子,有研究认为其可协同程序性死亡因子配体-1(programmed death ligand-1, PD-L1)通过抑制T细胞的免疫应答而造成肿瘤细胞的免疫逃逸[2-4]。目前研究表明,PD-1高表达与部分肿瘤的发生、发展相关[5]。但PD-1与结直肠癌的关系尚不清楚。本研究通过ELISA法检测结直肠癌患者血清PD-1含量,同时检测CD3+T细胞上PD-1的表达,旨在探讨PD-1表达对结直肠癌发生、发展的临床意义。
对象与方法
一、研究对象
选择2015年3月—2015年9月苏州大学附属第一医院普外科收治的88例结直肠癌初诊患者,住院前均未接受过手术或放化疗或任何免疫制剂治疗,并经术后病理报告证实为结直肠癌且排除转移性结直肠癌。其中男58例,女30例;年龄35~88岁,平均(64.03±11.67)岁;<60岁者28例,≥60岁者60例;结肠癌40例,直肠癌48例;高分化10例,中分化69例,低分化9例;有淋巴结转移36例,无淋巴结转移52例;根据2003年修改的国际抗癌联盟(UICC)和美国癌症联合委员会(AJCC)联合制定的改良版Dukes分期法:A期26例,B期24例,C期30例,D期8例。选取同期16名性别、年龄匹配的健康志愿者作为对照,其中男10名,女6名,年龄35~71岁,平均(56.00±12.15)岁。本研究方案经苏州大学附属第一医院伦理委员会批准,并获得受试者知情同意。
二、主要仪器与试剂
可溶性PD-1(sPD-1) ELISA检测试剂盒(由苏州大学临床免疫研究所,医学生物技术研究所制备[6]),COULTER Epics XL流式细胞仪(Beckman公司),红细胞裂解液(BD公司),FITC anti-human CD3抗体、PE anti-human PD-1抗体(BioLegend公司),PBS由本实验室配制。
三、标本收集
清晨空腹状态下,分别用促凝管和肝素钠抗凝管抽取入选者外周静脉血4 mL,其中促凝管以3 500 r/min 离心5 min,分离血清放入无菌EP管,置于-80 ℃冰箱中为ELISA检测sPD-1保存备用;肝素钠抗凝管内外周血标本于6 h内完成流式细胞术检测。
四、实验方法
1. ELISA法检测血清sPD-1含量:按照ELISA试剂盒说明书操作,测定各标本中sPD-1含量,检测450 nm波长处的吸光度(A)值,绘制标准曲线,计算sPD-1含量(pg/mL)。
2. 流式细胞术检测外周血CD3+T细胞上PD-1表达率:结直肠癌组和对照组各取10例患者。实验设3管,分别加入抗凝全血100 μL,第1管均为空白管,第2管加入FITC anti-human CD3抗体5 μL,第3管加入FITC anti-human CD3抗体和PE anti-human PD-1抗体各5 μL。4 ℃避光孵育30 min,加入红细胞裂解液2 mL;室温避光15 min,离心 5 min,弃上清后PBS重悬,上流式细胞仪检测。流式数据分析和图片采集均使用FlowJo软件。
五、统计学分析
结果
一、血清sPD-1含量
结直肠癌患者血清sPD-1含量明显高于对照组,差异有统计学意义(P<0.05)(图1)。
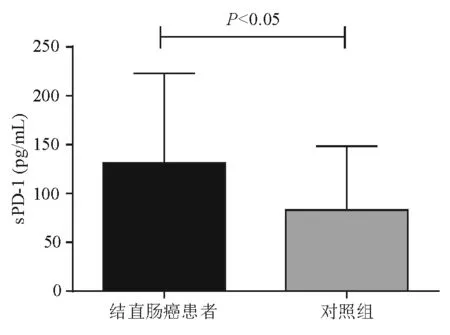
图1 结直肠癌患者和对照组血清sPD-1含量比较
二、结直肠癌患者血清sPD-1含量与临床病理特征的关系
结直肠癌患者血清sPD-1含量与肿瘤分化程度、淋巴结转移和Dukes分期相关(P<0.05),而不同性别、年龄、肿瘤部位的结直肠癌患者血清sPD-1含量相比差异无统计学意义(P>0.05)(表1)。
三、外周血CD3+T细胞上PD-1表达
结直肠癌患者外周血CD3+T细胞上PD-1表达率为35.11%±4.25%,明显高于对照组的18.20%±4.20%,差异有统计学意义(P<0.01)(图2)。

图2 结直肠癌患者和对照组CD3+T细胞上PD-1表达的流式细胞图


临床病理特征例数sPD-1含量P值性别 男58128.82±102.170.870 女30131.82±87.37年龄(岁) <6028140.96±116.660.146 ≥6060126.06±78.79肿瘤部位 结肠40142.48±101.490.222 直肠48121.07±83.32肿瘤分化程度 高分化1081.49±25.01<0.05 中分化69122.12±74.21 低分化9252.13±156.46淋巴结转移 无52100.36±30.87<0.01 有36174.76±127.80Dukes分期 A+B期5097.06±26.52<0.01 C+D期38175.20±124.30
讨论
结直肠癌位列我国消化道恶性肿瘤死因的第3位, 且其发病率和死亡率呈逐年上升和年轻化的趋势[7]。因结直肠癌的发生、发展相对隐匿,多数患者确诊时往往已处于中晚期阶段,故结直肠癌的早期诊断和治疗显得尤为重要。
目前肿瘤发生、发展的机制尚未完全明确。肿瘤抗原虽然可被宿主T细胞识别,肿瘤却很少被清除。近年研究发现免疫逃逸在多种肿瘤的发生、发展中发挥重要作用。目前普遍认为通过免疫逃逸,肿瘤细胞可免受防御系统的监控和杀伤,并能不断增殖[8]。效应T细胞的诱导凋亡和无反应性是肿瘤细胞免疫逃逸的重要机制之一。T细胞的有效活化除需抗原呈递信号(第一信号)外,还需要适时、适度的获得正性或负性协同刺激信号(第二信号)的共同作用。协同刺激信号的缺失,将造成T细胞反应无能,甚至程序性死亡[9]。
B7/CD28家族成员为极其重要的第二信号分子。PD-1又称CD279,属于B7/CD28家族共刺激分子,广泛表达于活化的T细胞、B细胞和单核细胞表面[10]。有研究显示,PD-1高表达与T细胞免疫缺陷密切相关[11]。PD-1为抑制性受体,与配体PD-L1结合后可通过抑制T细胞的活化、增殖以及相关细胞因子的分泌,诱导并维持T细胞对肿瘤细胞的免疫耐受,从而促进肿瘤的发生、发展[3,12-13]。相关研究[14-16]已证实在部分肿瘤的发生、发展过程中PD-1高表达,并与患者的预后密切相关。目前以PD-1为靶点针对肺癌的靶向治疗药物PD-1抑制剂Nivolumab已进入Ⅲ期临床研究阶段,有望成为肿瘤免疫治疗领域的一项重大突破[17]。
本研究通过ELISA法发现结直肠癌患者外周血sPD-1含量较对照组明显增高(P<0.05),且其含量与肿瘤分化程度、淋巴结转移和Dukes分期相关,即分化程度低、有淋巴结转移或Dukes C或D期者的外周血sPD-1含量明显升高。提示sPD-1与结直肠癌的肿瘤负荷和累及范围可能有关。本研究通过流式细胞术还发现结直肠癌患者外周血CD3+T细胞上PD-1表达较对照组明显上调(P<0.01),与目前有关PD-1作用机制的研究结果相符,即活化T细胞表面PD-1高表达,发挥负性调节作用,抑制T细胞的正常免疫功能,从而导致结直肠癌细胞出现免疫逃逸。
综上所述,结直肠癌患者外周血sPD-1含量和CD3+T细胞上PD-1的表达较健康志愿者明显上调,且sPD-1含量与结直肠癌患者的多种临床病理参数相关,故PD-1可能与结直肠癌发生、发展具有密切联系,有望作为一个新的辅助诊断指标应用于临床。但由于实验方法的局限,本研究尚未从分子和基因水平阐明PD-1在结直肠癌发生、发展中的作用,后续可采用体外功能学实验,进一步观察并验证PD-1分子对结直肠癌生物学效应的影响,从而为以PD-1为靶点的免疫和基因治疗提供有力的理论基础。
参考文献
1 Ferrone S, Whiteside TL. Tumor microenvironment and immune escape[J]. Surg Oncol Clin N Am, 2007, 16 (4): 755-774, viii.
2 Dong H, Zhu G, Tamada K, et al. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion[J]. Nat Med, 1999, 5 (12): 1365-1369.
3 Okazaki T, Honjo T. The PD-1-PD-L pathway in immunological tolerance[J]. Trends Immunol, 2006, 27 (4): 195-201.
4 Dong H, Strome SE, Salomao DR, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion[J]. Nat Med, 2002, 8 (8): 793-800.
5 Konishi J, Yamazaki K, Azuma M, et al. B7-H1 expression on non-small cell lung cancer cells and its relationship with tumor-infiltrating lymphocytes and their PD-1 expression[J]. Clin Cancer Res, 2004, 10 (15): 5094-5100.
6 吴海竞, 陈永井, 苗瞄, 等. 可溶性PD-1酶联检测试剂盒的研制及其应用[J]. 中国免疫学杂志, 2008, 24 (9): 825-827.
7 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90.
8 Ye Y, Zhou L, Xie X, et al. Interaction of B7-H1 on intrahepatic cholangiocarcinoma cells with PD-1 on tumor-infiltrating T cells as a mechanism of immune evasion[J]. J Surg Oncol, 2009, 100 (6): 500-504.
9 Chambers CA. The expanding world of co-stimulation: the two-signal model revisited[J]. Trends Immunol, 2001, 22 (4): 217-223.
10Nishimura H, Agata Y, Kawasaki A, et al. Developmentally regulated expression of the PD-1 protein on the surface of double-negative (CD4-CD8-) thymocytes[J]. Int Immunol, 1996, 8 (5): 773-580.
11Keir ME, Butte MJ, Freeman GJ, et al. PD-1 and its ligands in tolerance and immunity[J]. Annu Rev Immunol, 2008, 26: 677-704.
12刘书漫, 孟青, 张钦宪, 等. B7-H1及其受体PD-1在胃癌组织中的表达与意义[J]. 中华肿瘤杂志, 2008, 30 (3): 192-195.
13Carter L, Fouser LA, Jussif J, et al. PD-1:PD-L inhibitory pathway affects both CD4(+) and CD8(+) T cells and is overcome by IL-2[J]. Eur J Immunol, 2002, 32 (3): 634-643.
14Sznol M, Chen L. Antagonist antibodies to PD-1 and B7-H1 (PD-L1) in the treatment of advanced human cancer[J]. Clin Cancer Res, 2013, 19 (5): 1021-1034.
15李超, 汪宏, 周勇. PD-1在胃癌患者CD8+T细胞表面的表达特点及临床意义[J]. 胃肠病学和肝病学杂志, 2011, 20 (5): 419-422.
16马薇, 罗殿中, 陈源, 等. PD-L1和PD-1在非小细胞肺癌中的表达及其临床意义[J]. 实用医学杂志, 2011, 27 (9): 1551-1554.
17Ascierto PA, Simeone E, Sznol M, et al. Clinical experiences with anti-CD137 and anti-PD1 therapeutic antibodies[J]. Semin Oncol, 2010, 37 (5): 508-516.
(2015-11-03收稿;2015-12-24修回)
Expression of Peripheral Blood PD-1 and its Clinical Significance in Patients with Colorectal CancerWUJiaming1,CHENWeichang1,ZHANGHailing1,ZHANGGuangbo2,TAOLihua1,LIUYi1.1DepartmentofGastroenterology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,JiangsuProvince(215006);2InstituteofImmunology,SoochowUniversity,Suzhou,JiangsuProvince
Correspondence to: CHEN Weichang, Email: chenwc_suzhou@163.com
Background: The abnormal expression of costimulatory molecules is closely related to immune escape of tumor cells. Programmed death-1 (PD-1) is an important negative costimulatory molecule, and can induce and maintain the immune tolerance of tumor cells by binding with related ligands, thus promotes the development and progress of tumor. Aims: To investigate the expression of peripheral blood PD-1 and its clinical significance in patients with colorectal cancer. Methods: Eighty-eight patients with colorectal cancer from March 2015 to September 2015 at the First Affiliated Hospital of Soochow University were enrolled, and 16 healthy volunteers were served as controls. Level of soluble PD-1 (sPD-1) was determined by ELISA. The expression of PD-l on CD3+T cells in peripheral blood was measured by flow cytometry. Results: Level of sPD-1 and expression of PD-l on CD3+T cells in peripheral blood in colorectal cancer patients were significantly higher than those in controls (P<0.05). Level of sPD-1 in colorectal cancer patients was closely related to tumor differentiation, lymph node metastasis and Dukes’ stage (P<0.05), but not related to gender, age and tumor location (P>0.05). Conclusions: Peripheral blood PD-1 is highly expressed in patients with colorectal cancer, and is positively correlated with tumor stage and metastasis. The detection of PD-1 is helpful to estimate the progress of colorectal cancer, and it may become a new tumor marker or a target for anti-tumor targeted therapy.
Key wordsColorectal Neoplasms;Programmed Death-1;Enzyme-Linked Immunosorbent Assay;
DOI:10.3969/j.issn.1008-7125.2016.05.004
*基金项目:国家自然科学基金资助项目(K112226512)
#Email: 20134232030@stu.suda.edu.cn
&本文通信作者,Email: chenwc_suzhou@163.com

