纳他霉素高产菌株选育及发酵工艺优化
张帅滢,韦兰兰,张 颖,何 佳,2,王大红,2
(1.河南科技大学 食品与生物工程学院,河南 洛阳 471023;2.洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
纳他霉素高产菌株选育及发酵工艺优化
张帅滢1,韦兰兰1,张颖1,何佳1,2,王大红1,2
(1.河南科技大学 食品与生物工程学院,河南 洛阳 471023;2.洛阳市微生物发酵工程技术研究中心,河南 洛阳 471023)
摘要:以纳塔尔链霉菌(Streptomyces natalensis)4.3505为出发菌株,以紫外线作为诱变方法,筛选抗乙酸钠高产纳他霉素的突变菌株,优化发酵条件,筛选诱导子及添加工艺。研究结果表明:高产突变菌株为纳塔尔链霉菌HW-2,其纳他霉素产量在发酵120 h后达到452.2 mg/L,比原始菌株提高了242.6%,该菌株遗传性能稳定。纳塔尔链霉菌HW-2生产纳他霉素最佳发酵条件:接种量为发酵液总体积的6%,250 mL三角瓶装液量为30 mL,初始pH值为7.5。乙酸钠为最佳前体物质,乙酸钠的质量分数为0.2%,添加时间为发酵后24 h。
关键词:纳塔尔链霉菌;纳他霉素;菌株选育;发酵条件
0引言
纳他霉素(natamycin,也称匹马菌素)是由褐黄孢链霉菌(Streptomycesgilvosporeus)、纳塔尔链霉菌(Streptomycesnatalensis)和恰塔努加链霉菌(Streptomyceschattanoogensis)等菌株产生的一种能有效抑制真菌生长和真菌毒素产生的二十六元环多烯类抗真菌抗生素[1],具有低剂量、高效率和高安全性等特点。该物质无抗细菌活性,与乳酸链球菌肽结合使用可起到很好的防腐作用[2]。因此,1982年,美国食品和药物管理局正式批准纳他霉素可以用作食品防腐剂。1997年,中国卫生部批准纳他霉素可以用作食品防腐剂[3]。
虽然纳他霉素在食品原料保鲜和成品防腐方面的应用显示了良好前景,但是因成本太高而限制了其使用。目前,发酵法生产纳他霉素是一个很好的发展方向。工业上纳他霉素的生产菌主要为纳塔尔链霉菌和褐黄孢链霉菌[4]。国外关于纳他霉素发酵方面的研究比较深入和成熟[5],文献[6]报道了连续发酵法可使纳他霉素产量达6~12 g/L。国内的学者也做了相关的研究工作[7-8],对褐黄孢链霉菌研究较多,而对纳塔尔链霉菌的菌株选育研究较少[9]。因此,本文主要根据纳他霉素的生物合成途径,筛选抗乙酸钠的高产突变菌株,并对其发酵工艺进行了研究。
1材料与方法
1.1材料
纳塔尔链霉菌(Streptomycesnatalensis)4.3505,购于中国普通微生物菌种保藏管理中心;纳他霉素标准品,Sigma公司生产;蛋白胨、酵母粉、麦芽浸粉、牛肉膏、胰蛋白胨,购于北京奥博星公司;葡萄糖、乙酸钠、丙酸钠,国药集团生产。
试验仪器:高效液相色谱(HPLC1260),安捷伦公司;LS-B50型灭菌器,上海博迅设备厂;HYL-C型恒温摇床,江苏太仓强乐实验设备厂。
纳塔尔链霉菌培养基分为平板培养基、种子培养基和发酵培养基。平板培养基成分为:葡萄糖10 g/L,麦芽浸粉3 g/L,蛋白胨5 g/L,酵母粉3 g/L,琼脂20 g/L,水1 L,pH7.0。种子培养基成分为:葡萄糖10 g/L,胰蛋白胨5 g/L,氯化钠10 g/L,水1 L,pH7.0。发酵培养基成分为:葡萄糖30 g/L,酵母浸膏2 g/L,牛肉膏10 g/L,水1 L,pH7.0。
1.2方法
1.2.1纳塔尔链霉菌培养及孢子悬液的制备
将S.natalensis4.3505接种于斜面培养基,28 ℃培养5~7 d,观察其生长情况。取斜面试管中生长较好的菌种,加入10 mL已经灭过菌的生理盐水,将孢子振荡洗下,然后倒入50 mL灭过菌的含有玻璃珠的三角瓶中,用振荡器振荡30 min后过滤,将溶液的孢子浓度调至108个/mL。
1.2.2纳他霉素的发酵和菌体生物量的测定
将培养48 h的纳他霉素种子培养基以2%(体积分数)的接种量加入发酵培养基中,在28 ℃、180 r/min条件下培养108 h。发酵结束后取3 mL发酵液置于已知质量的5 mL干燥离心管中,10 000 r/min离心10 min,弃上清液。沉淀中再加入3 mL去离子水洗涤沉淀2次,弃上清留沉淀后将沉淀置于65 ℃的烘箱内干燥8 h,称质量。
1.2.3纳他霉素含量的测定
取2 mL发酵液和18 mL甲醇混合,摇床上充分振荡2 h后,10 000 r/min离心10 min,吸取离心后的上清液,使用0.45 μm微孔滤膜过滤,过滤液即为待测液。
色谱柱:型号为YMC-Pack ODS C18,柱长250 mm,柱直径4.6 mm,流动相为V(水)∶V(甲醇)=35∶65,流速为0.8 mL/min,检测波长λ=304 nm。
1.2.4高产纳他霉素菌株的选育
(1)不同质量分数乙酸钠溶液对菌体生成的影响
制备含有不同质量分数乙酸钠溶液(0.02%、0.04%、0.08%、0.10%、0.15%和0.20%)的平板培养基,将制备好的0.2 mL孢子悬液分别涂布于平板培养基上,28 ℃恒温培养箱中培养5~7 d。观察不同平板培养基上的菌落生长情况,确定乙酸钠对该菌的最低抑制质量分数。
(2)纳塔尔链霉菌的紫外线诱变处理
取浓度为108个/mL的孢子悬液10 mL置于直径为9 cm的已灭菌的培养皿中,在距15 W紫外灯30 cm处进行不同时间的照射 (照射时间分别为5 s、10 s、20 s、30 s、40 s、50 s和60 s),同时均匀搅拌。对每个样品进行梯度稀释,分别取稀释度为10-4、10-5和10-6的菌悬液0.2 mL,将其涂布在平板培养基上,每个梯度进行3次重复,28 ℃培养,7 d后计算菌落数,统计致死率并确定诱变时间。
(3)高产菌株的筛选
选择最佳诱变时间处理菌悬液0.2 mL,将其涂布于含有最低抑制质量分数的乙酸钠平板培养基上,28 ℃恒温培养7~10 d,观察菌落生长状况。待菌落长出后,将菌落分别接种于斜面培养基中,28 ℃培养7~10 d,测定其发酵性能。
1.2.5高产菌株的遗传稳定性试验
将诱变获得的抗乙酸钠高产菌株连续培养5代,经发酵测定其纳他霉素的产量,观察突变菌株的遗传稳定性。
1.2.6发酵条件的优化和前体物质的筛选
分别考察接种量、溶氧和初始pH值对纳他霉素产生的影响。在发酵培养基中分别添加质量分数为0.1%的乙酸钠、丙酸钠,体积分数为0.1%的乙醇、正丁醇、乳酸、柠檬酸和异丁醇作为前体添加物,筛选出最佳前体物质,并对添加量和添加时间进行了优化。
2结果与分析
2.1不同质量分数乙酸钠溶液对菌体生成的影响
根据纳他霉素的生物合成途径,二碳和三碳小分子物质为其生物合成的前体,但前体也具有一定的毒性,浓度越大,其毒性越强。因此,通过测定不同质量分数乙酸钠溶液对菌体生长的影响,确定最低抑制质量分数,结果见表1。从表1中可以看出:0.15%乙酸钠能够完全抑制纳塔尔链霉菌的生长。

表1 不同质量分数乙酸钠溶液对菌体生长的影响
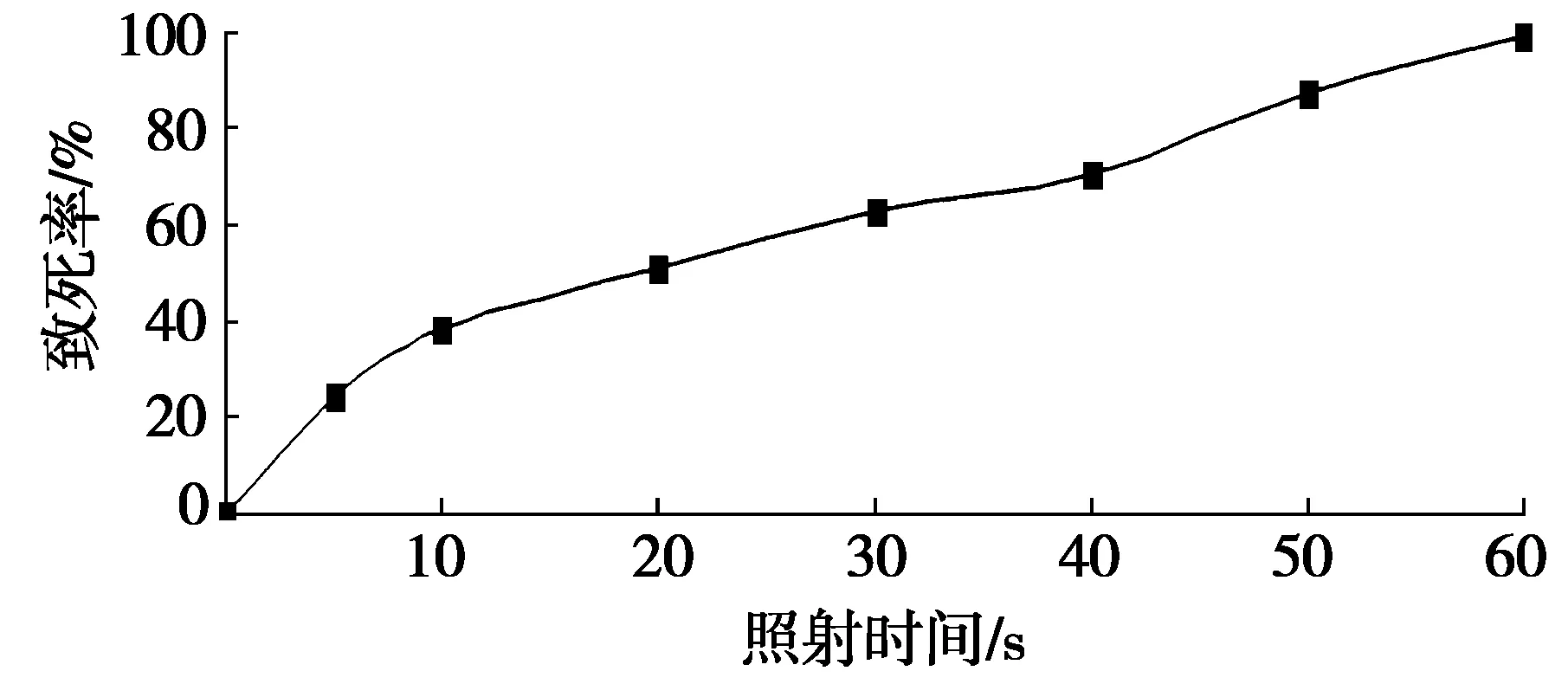
图1 紫外线照射时间对纳塔尔链霉菌致死率的影响
2.2紫外线照射时间的确定
在一定的范围内,照射时间越长,微生物突变率也越高,但超过此范围时,突变率将下降。本研究采用紫外线照射,照射距离为30 cm,照射时间分别为5 s、10 s、20 s、30 s、40 s、50 s和60 s,以不经过紫外照射的菌株为对照。不同紫外线照射时间对纳塔尔链霉菌致死率的影响结果见图1。
致死率过高或过低都不利于诱变菌株的筛选,一般致死率为85%~90%效果较好[10],菌株的正突变概率较高,有利于突变株的进一步筛选。从图1中可以看出:照射时间为50 s时,纳塔尔链霉菌的致死率为87.10%,处于85%~90%区间内,所以选择最佳诱变时间为50 s。
2.3紫外线照射诱变结果
经过紫外线照射诱变,共获得56株突变菌株,经过发酵性能测试,其中5株菌株出现了正突变,分别命名为HW-2、HW-8、HW-10、HW-12和HW-26。5株突变菌株的纳他霉素产量如表2所示。由表2可知:5株诱变菌株与亲本的纳他霉素产量相比,HW-2产量最高,为452.2 mg/L。

表2 5株突变菌株的纳他霉素产量 mg/L
2.4突变菌株遗传稳定性研究
为了观察筛选到的高产突变菌株的遗传稳定性,对诱变选育的5株菌株分别进行传代,共传5代,结果见表3。由表3可以看出:HW-2、HW-12和HW-26菌株遗传性比较稳定,其中,HW-2菌株纳他霉素产量基本维持在450 mg/L左右,说明突变菌HW-2具有较好的遗传稳定性,而HW-8和HW-10菌株的遗传稳定性较差。

表3 高产突变菌株遗传稳定性试验

图2 纳塔尔链霉菌突变菌株HW-2的发酵过程曲线
2.5纳他霉素摇瓶发酵过程曲线
对纳塔尔链霉菌HW-2的发酵时间进行了考察,在发酵第1~7天,分别检测纳他霉素和细胞生长的变化,结果如图2所示。从图2中可以看出:纳他霉素的产量从第2天到第6天快速上升,第6天时,产量上升到513 mg/L。但是随着发酵时间的延长,纳他霉素产量下降。因此,纳他霉素的最佳发酵时间是6 d。而发酵液中纳塔尔链霉菌的菌体质量浓度在第4天时达到最大值62 g/L。
2.6发酵条件的优化
2.6.1接种量
接种量的大小与菌种特性和发酵条件等有关,不同微生物发酵的接种量有所不同。将种子液分别按体积分数为1%、2%、3%、4%、5%、6%和7%的接种量接入发酵培养基中,培养6 d后测定纳他霉素的产量,结果见表4。

表4 接种量对纳他霉素产量的影响
由表4可以看出:不同接种量对菌体产纳他霉素的影响很大。菌体的生长需要一定的密度,接种量小会导致菌体生长缓慢,菌体生长会消耗掉大量营养物质,从而影响了纳他霉素的产量;接种量大会使菌体生长过快,导致菌体过早衰老,也会影响纳他霉素的产量。接种量在6%(体积分数)时,纳他霉素的产量最大,达531 mg/L。
2.6.2溶氧
纳塔尔链霉菌是好氧菌,氧气对菌体生长和纳他霉素产生的影响很大。在固定摇床转速条件下,设置不同的摇瓶装液量,导致发酵培养基中的溶解氧不同,纳他霉素的产量会不同。表5为溶氧对纳他霉素产量的影响。由表5可以看出:当250 mL三角瓶中装液量为30 mL时,纳他霉素产量达到最大值830 mg/L。
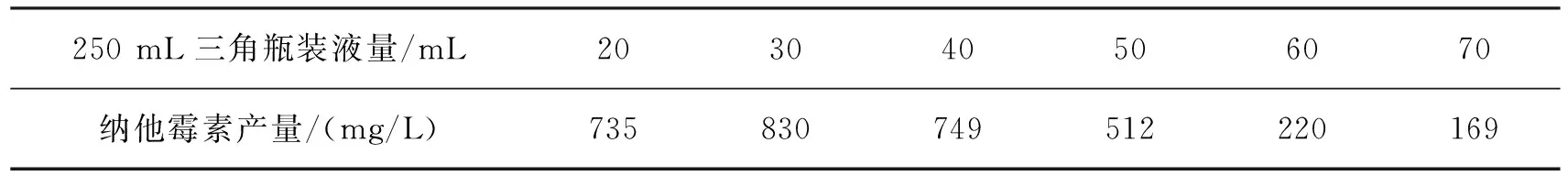
表5 溶氧对纳他霉素产量的影响
2.6.3初始pH值
在250 mL三角瓶中装入28.2 mL发酵培养基,并分别用1 mol/L HCl或1 mol/L NaOH溶液将培养基pH值调为6.0、6.5、7.0、7.5、8.0和8.5,接入1.8 mL种子液,培养6 d后,测定纳他霉素的产量。结果如表6所示。

表6 初始pH值对纳他霉素产量的影响
从表6可以看出:初始pH值在7.5时,纳他霉素的产量最高,达885 mg/L。但随着初始pH值的进一步升高,纳他霉素产量开始下降。这可能是因为在不同的pH值条件下,纳他霉素合成途径中一些关键酶的活性不同。所以在纳他霉素发酵时,应将初始pH值控制在7.5。
2.7前体物质对纳他霉素产量的影响

表7 不同前体物质对纳他霉素合成的影响 mg/L
2.7.1不同前体物质对纳他霉素产量的影响
根据纳他霉素的生物合成途径,本试验选用乙酸钠、丙酸钠、乙醇、正丁醇、乳酸、柠檬酸和异丁醇作为前体添加物,在发酵时按0.1%的比例分别加入,采用上文已优化的发酵条件,发酵6 d,纳他霉素产量如表7所示。由表7可知:添加乙酸钠或丙酸钠后,纳他霉素产量有显著的提高,其中以乙酸钠效果最好,产量达到1 150 mg/L,比对照提高了35%。因此试验最终选用乙酸钠为前体物质。
2.7.2乙酸钠添加量和添加时间对纳他霉素产量的影响
分别向发酵培养基中添加质量分数为0.05%、0.10%、0.20%、0.40%、0.60%、0.80%和1.00%的乙酸钠,发酵6 d后检测纳他霉素的产量,结果如表8所示。从表8可以看出:在乙酸钠质量分数为0.20%时,纳他霉素的产量最高,达到1 380 mg/L。当质量分数大于0.20%时,纳他霉素的产量却降低,这主要是因为大量的乙酸钠会对菌体造成一定的毒性,导致纳他霉素的产量降低,乙酸钠质量分数越大,其毒性越大。因此,最终选择乙酸钠添加量为0.20%。
分别在发酵培养0 h、12 h、24 h、36 h、48 h、60 h、72 h和84 h时加入0.20%乙酸钠,发酵6 d后检测纳他霉素的产量,结果如表9所示。由表9可看出:在发酵24 h时添加乙酸钠效果最好,纳他霉素的产量最高,达到了1 550 mg/L。因此,本试验选择在发酵24 h时添加0.20%乙酸钠。
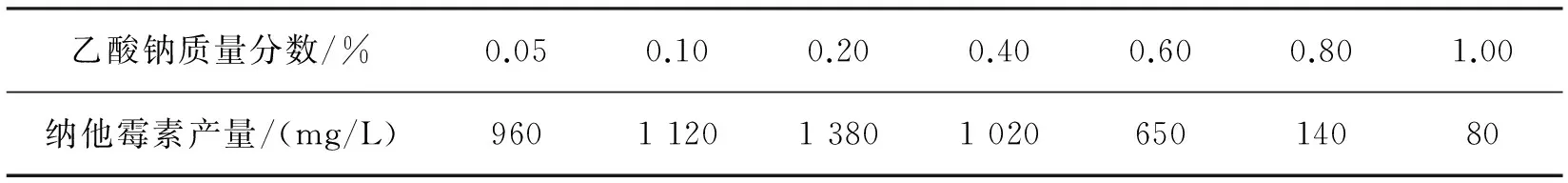
表8 乙酸钠质量分数对纳他霉素产量的影响
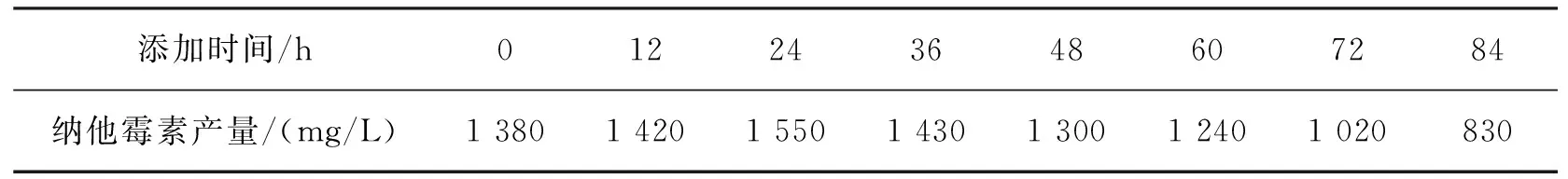
表9 乙酸钠添加时间对纳他霉素产量的影响
3讨论
近年来,以乳酸链球菌素和纳他霉素为代表的生物防腐剂受到全球市场的青睐,有逐渐替代化学防腐剂的趋势。目前,纳他霉素的生产主要采用发酵法。中国对于纳他霉素的研究始于1995 年,研究者分别采用了菌株选育、发酵条件优化和真菌诱导等方式来提高纳他霉素的产量[11-13],但与国外报道的产量相比,还有一定的差距。除此之外,采用物理方法和化学方法对微生物菌种进行选育也是最普遍的方法,并结合抗生素、前体和结构类似物等筛选剂进行选择性筛选[14]。文献[15-16]分别采用亚硝基胍和紫外线对纳他霉素产生菌进行选育,并对其发酵条件进行优化,均获得了较好的效果。
纳他霉素的生物合成途径可以分解为活化前体(乙酰辅酶A 和丙二酰辅酶A)的生成、大环内酯的生物合成和氨基糖的形成,二碳和三碳类物质是该物质的前体(如乙酸、丙酸和丁醇等),但过量的前体物质严重影响S.natalensis的生长和纳他霉素的生物合成[17],因此,选育耐前体突变株是提高纳他霉素产量的有效方法。本文采用紫外诱变与乙酸钠抗性筛选相结合的方法,筛选到一株遗传性能稳定的纳他霉素高产菌株S.natalensisHW-2,并采用摇瓶发酵试验得出筛选到的菌种性能比原始菌株提高了2倍,使原菌种生产纳他霉素的能力提高,而且该突变株更能够耐受乙酸钠。研究了S.natalensisHW-2发酵过程曲线,优化了该菌的发酵条件。探讨了不同的前体物质对纳他霉素生物合成的影响,认为乙酸钠为最佳前体物质,并优化了乙酸钠的添加时间和添加量。通过发酵条件的优化和前体物质的添加,有效地提高了纳他霉素的产量。虽然本研究所采用的抗乙酸钠筛选方法有一定的效果,但未考虑其他生物途径中其他前体物质对纳他霉素生物合成的影响,在高产菌的筛选上存在着一定的局限性,并且诱变后菌株出现正突变的概率比较小。因此,今后可以选用化学方法诱变或者物理化学复合诱变的方法来提高纳他霉素的产量。
参考文献:
[1]CLARA F,MARTIN M,MIGUEL A,et al.Cerqueira functional characterisation and antimicrobial efficiency assessment of smart nanohydrogels containing natamycin incorporated into polysaccharide-based films[J].Food and bioprocess technology,2015,8(7):1430-1441.
[2]高玉荣,王雪平.天然抗真菌食品生物防腐剂-纳他霉素的性质及在食品中的应用[J].农产品加工(学刊),2009(5):7-9.
[3]李勃,冯光利,王长晔.纳他霉素产业发展现状及前景分析[J].保鲜与加工,2011,11(2):49-53.
[4]李东,杜连祥,路福平.生物食品防腐剂-纳他霉素发酵工艺研究[J].食品工业科技,2004,25(10):111-114.
[5]ATTA H M,EL-SAYED A S,EL-DESOUKEY M A,et al.Biochemical studies on the natamycin antibiotic produced byStreptomyceslydicus:fermentation,extraction and biological activities[J].Journal of Saudi chemical society,2015,19(4):360-371.
[6]P.T.奥尔森.连续发酵法生产纳他霉素:CN1070688A[P].1993.
[7]LUO J,LI J,LIU D,et al.Genome shuffling ofStreptomycesgilvosporeusfor improving natamycin production[J].Journal of agriculture food chemistry,2012,60:6026-6036.
[8]LIANG J,XU Z,LIU T,et al.Effects of cultivation conditions on the production of natamycin withStreptomycesgilvosporeusLK-196[J].Enzyme microbiology technology,2008,2:145-150.
[9]骆健美.纳他霉素高产菌株选育、发酵条件优化、发酵动力学及溶解度的研究[D].杭州:浙江大学,2005.
[10]卜美玲.纳他霉素高产菌株的诱变选育及发酵工艺的优化[D].洛阳:河南科技大学,2012.
[11]WANG D,YUAN J,GU S,et al.Influence of fungal elicitors on biosynthesis of natamycin byStreptomycesnatalensisHW-2[J].Applied microbiololgy and biotechnology,2013,97(6):5527-5534.
[12]WANG S,LIU F,HOU Z,et al.Enhancement of natamycin production onStreptomycesgilvosporeusby chromosomal integration of the vitreoscilla hemoglobin gene (vgb)[J].World journal of microbiology and biotechnology,2014,30(4):1369-1376.
[13]LIU S P,YU P,YUAN P H,et al.Sigma factor WhiGchpositively regulates natamycin production inSreptomyceschattanoogensisL10[J].Applied microbiology and biotechnology,2015,99(6):2715-2726.
[14]刘胜男,王亚洲,石林霞,等.γ-亚麻酸产生菌的低能离子束诱变选育[J].河南科技大学学报(自然科学版),2015,36(3):76-85.
[15]杨东靖,陈冠群,王敏,等.纳他霉素高产菌株的链霉素抗性选育及其发酵工艺的优化[J].药物生物技术,2003,10(2):84-87.
[16]蔡秀云,朱小容,包如胜,等.纳他霉素高产菌株的诱变选育[J].食品与发酵工业,2011,37(11):108-112.
[17]RECIO E,APARICIO J F,RUMBERO A,et al.Glycerol,ethylene glycol and propanediol elicit pimaricin biosynthesis in the PI factor-defective strainStreptomycesnatalensisnpi287 and increase polyene production in several wild-type actinomycetes[J].Microbiology,2006,152:3147-3156.
基金项目:国家自然科学基金项目(3140101119)
作者简介:张帅滢(1992-),男,河南巩义人,硕士生;何佳(1965-),男,河南洛阳人,教授,博士,硕士生导师,主要研究方向为发酵工程.
收稿日期:2016-01-21
文章编号:1672-6871(2016)04-0081-06
DOI:10.15926/j.cnki.issn1672-6871.2016.04.017
中图分类号:TQ927;Q939.97
文献标志码:A

