取精后至冷冻前的间隔时间对精子冷冻复苏效果的影响*
陈碧张维马天仲荆霞张云山彭彩玲
取精后至冷冻前的间隔时间对精子冷冻复苏效果的影响*
陈碧①张维①马天仲①荆霞①张云山①彭彩玲①
【摘要】目的:探讨取精后至冷冻前的间隔时间对精子冷冻复苏率的影响,规范精液标本冷冻技术操作,进一步提高冻存标本的复苏率。方法:选取2015年3月在门诊行精液分析的30例参数正常精液标本,同一例精液一式3份,分别在精液取出后15、30 min及60 min后行精液冻存,即按所有样本按孵育时间的不同分为A(15 min)、B(30 min)、C(60 min)三组,每组30例。分析三组标本冷冻前后前向运动(PR)精子数、存活率及精子畸形率,比较各组精子的冷冻复苏率。结果:A组的PR精子冷冻复苏率(55.35±13.94)%及B组的(51.55±15.94)%均高于C组的(38.13±14.24)%,比较差异均有统计学意义(P<0.05);而A组与B组PR精子冷冻复苏率比较差异无统计学意义(P>0.05),但A组略高。三组精子存活率及正常形态精子百分率比较差异无统计学意义(P>0.05)。结论:精子取出后应尽快完成冷冻,有助于提高精子冷冻复苏效果。
【关键词】精子; 低温保存; 精子参数; 精子冷冻复苏率
①广东医学院附属医院 广东 湛江 524001
First-author’s address:Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001,China
精子冷冻技术的发展,使患者因各种因素需要冷冻自身精子用于后续辅助生殖技术(Assisted Reproductive Technology,ART)治疗成为可能,如取精困难、梗阻性无精症患者在门诊穿刺检查时获得的精子、隐匿精子症等患者要求冷冻的自身精子。自精冻存成为生殖中心实验室常规实施的技术。近年来,精子冷冻技术得到了快速发展,常用的方法包括程序降温法与快速冷冻法[1-2],在临床应用时仍需进一步完善。对临床实验室而言,需要在保证最大限度冷冻精子质量的同时,力求实验方法快速、简便、有效。研究表明,液氮一步熏蒸法可显著提高冻存精子的质量[3]。世界卫生组织《人类精液检查与处理实验室手册》(第5版)指出,室温下正常精液标本大都在15 min内完全液化,很少超过60 min[4]。因而推荐精液液化后应立即进行分析,最好在30 min内完成,不要超过1 h。而取精后至冷冻前的间隔时间没有明确的规定,不同的生殖中心时间不同。目前未见相关文献报道。此次研究旨在通过探索精液取出后至冷冻前的时间对精子冷冻复苏率的影响,优化一步熏蒸法,以规范精液标本冷冻技术操作,进一步提高冻存标本的复苏率。
1 资料与方法
1.1一般资料 选取于2015年3月在本院行精液分析患者的30例精液标本,患者年龄25~35岁(平均31岁),禁欲2~7 d,手淫法取精。精液量2~5 mL,15 min内均完全液化。同一例精液一式3份,分别在精液取出后15、30 min及60 min后行精液冻存,即按所有样本按孵育时间的不同分为A(15 min)、B(30 min)、C(60 min)三组,每组30例,每例标本精液量为0.5 mL。冷冻前精子浓度均≥15×106/mL,前向运动(progressive motility,PR)精子≥32%,正常形态精子≥4%。
1.2试剂与仪器 冷冻保护剂使用Quinn’s Advantage TM Sperm Freezing Medium,液氮罐为MVE XC47/11-10型,标本在液氮蒸气中直接熏蒸降温。精子冷冻储存容器选用 Greiner bio-one 生产的1 mL低温冻存管(REF:123278)。
1.3方法
1.3.1精子冷冻 对精液按不同时间进行冻存,逐滴把一份精子冷冻培养基(Quinn’s Advantage TM Sperm Freezing Medium)加进一份液化好的精液样本。每加一滴培养基时要不断混合以确保精子细胞与冷冻培养基能彻底平衡。混合后室温平衡10 min。将冷冻管平放在离液氮面10~20 cm高度20~30 min,把冷冻管放在铝架上,然后移至液氮罐保存。
1.3.2精子解冻 从液氮罐取出冷冻管,立即置于35 ℃水浴直至完全溶解。把解冻后的精子溶液倒进试管,缓慢一滴一滴地在30 s内把3份精子冲洗培养基与精子溶液彻底混合以确保精子冷冻培养基已被稀释。300 g离心10 min,弃去上清,加入精子冲洗培养基定容至0.5 mL,重悬精子后进行精液分析,主要检测PR精子。
1.4观察指标及评价方法 按照《WHO人类精液检查与处理实验室手册》第5版进行精液常规分析及精子形态学分析,主要包括精液量、精子浓度、PR精子百分率、正常形态精子百分率及存活率等。同时比较精子冷冻复苏率。
1.4.1精子存活率(vitality assessment of human sperm,VA) 精液标本20μL与5 g/L的伊红Y溶液1:1混匀,并覆盖盖玻片,30 s后在400倍光学显微镜下观察。必须立即观察这些玻片,活精子不着色(白色);死细胞被染成红色。计算精子存活率。重复计数2次,两次结果应满足95%的可信区间检验,报告结果取平均值。
1.4.2正常形态精子百分率 精液标本涂片,使用改良巴氏法染色,油镜下观察,计数200个精子中正常形态精子所占比例,重复计数2次,两次结果应满足95%的可信区间检验,结果取平均值。
1.4.3精子冷冻复苏率 精子冷冻复苏率=冻后PR精子百分率/冻前PR精子百分率。
1.5统计学处理 采用SPSS 19.0软件对所得数据进行统计学分析,计量资料用(±s)表示,组间均数比较用Friedman秩和检验,两两比较用Wilcoxon法,以P<0.05为有统计学意义。
2 结果
2.1冷冻前各组PR精子百分率、存活率及正常形态精子百分率的比较 A组、B组及C组PR精子百分率随着时间的延长逐步降低,但组间比较差异无统计学意义(P>0.05)。B组及C组存活率略有下降,但差异无统计学意义(P>0.05)。各组正常形态精子百分率较接近,差异无统计学意义(P>0.05),见表1。
表1 冷冻前各组PR精子百分率、存活率及正常形态精子百分率的比较(±s) %
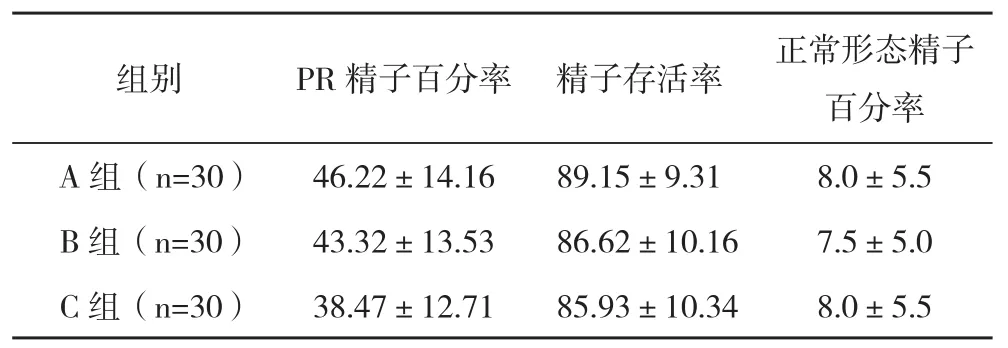
表1 冷冻前各组PR精子百分率、存活率及正常形态精子百分率的比较(±s) %
组别 PR精子百分率 精子存活率 正常形态精子百分率A组(n=30) 46.22±14.16 89.15±9.31 8.0±5.5 B组(n=30) 43.32±13.53 86.62±10.16 7.5±5.0 C组(n=30) 38.47±12.71 85.93±10.34 8.0±5.5
2.2复苏后各组PR精子百分率、冷冻复苏率、存活率及正常形态精子百分率的比较 A组与B组复苏后PR精子百分率比较差异无统计学意义(P>0.05),而A组与C组、B组与C组复苏后PR精子百分率比较差异均有统计学意义(P<0.05)。A组PR精子复苏率略高于B组,但比较差异无统计学意义(P>0.05),而A组与B组PR精子复苏率均高于C组,差异均有统计学意义(P<0.05)。三组精子存活率及正常形态精子百分率之间比较差异无统计学意义(P>0.05),见表2。
3 讨论
随着辅助生殖技术的发展,给越来越多的不孕症患者带来福音。不孕症夫妇中大约30%是男方因素导致不育而就诊的,卵胞浆内单精子注射(ICSI)技术是治疗男性不育的有效方法[5]。张丹等[6]对比射出精液、经皮附睾穿刺和经皮睾丸穿刺取精子、供精行ICSI助孕的结局,认为不同来源的精子对受精率、卵裂率、优质胚胎率及最终妊娠结局没有影响。精子的成熟度、精子的冷冻可能并不影响最终的妊娠率。

表2 复苏后各组PR精子百分率、冷冻复苏率、存活率及正常形态精子百分率的比较 %
目前对小鼠冷冻精子的胚胎发育和表观遗传学的研究发现,与新鲜精子组相比,冷冻精子的胚胎的表观遗传重组动态进程并没有改变[7]。目前精子冷冻方法主要有慢速冷冻和玻璃化冷冻,两种冷冻方法之间精子活动率下降及DNA损伤无显著差异[8]。在国内一些人类精子库已开展肿瘤患者的精液冻存[9],拓宽了不孕不育的治疗范围,给越来越多不孕症患者带来福音。
作为辅助生殖技术发展的基础,精子冻存技术的完善对于保存男性生育力尤为重要。不同的精液标本、精子本身质量、冷冻保护剂、冷冻方法及解冻方法对精子冷冻保存后的活力影响较大。在精子冷冻过程中,低温损伤也同时影响了精子的活力、形态、精子DNA完整性及线粒体的功能等[10-13],多种因素均可能影响精子冷冻复苏率。目前关于精子活力与冷冻复苏率之间的关系仍存在较大的争议,Keel等[14]研究认为精子冷冻前的活力与冷冻后精子活力呈正相关,Chan等[15]认为,用冷冻前精子活力来预测冷冻复苏率的价值是有限的。
杜金龙等[16]认为精子活力也受年龄、禁欲时间、季节、生理因素等诸多因素的影响。精子常规检查应标准化。精液标本取出后随着放置时间的延长,精子活动率逐渐下降,这可能与脱水、pH值改变、渗透压变化、温度变化等因素相关。世界卫生组织《人类精液检查与处理实验室手册》(第5版)指出,室温下正常精液标本大都在15 min内完全液化,很少超过60 min。因而推荐精液液化后应立即进行分析,最好在30 min内完成,不要超过1 h。而取精后至冷冻前的间隔时间没有明确的规定,不同的生殖中心时间不同。目前未见相关文献报道。此次研究旨在通过探索精液取出后至冷冻前的时间对精子冷冻复苏率的影响,进一步提高冻存标本的复苏率。结果显示,取精后A组前向运动(PR)精子冷冻复苏率略高于B组,但比较差异无统计学意义(P>0.05),而A组与B组均高于C组,比较差异均有统计学意义(P<0.05),表明取精后应在30 min内进行冷冻操作,精子离体后超过30 min行冷冻将显著降低精子冷冻复苏率。
精液从附睾中射出含有大量的死精子及精子以外的细胞成分,而离体细胞的脂类分解产物,能够从细胞溢出,携带自由基,损伤其他细胞并包括精子[17]。精子质膜的损伤使脂质过氧化产物可能从细胞逸出,进而扩大了脂质过氧化作用的范围,加重了精子氧化损伤程度。
精子的长时间孵育会导致精液中ROS的过量生成,不但破坏精子膜的流动性和完整性,还可导致DNA单链形成或双链DNA断裂等,并且ROS也可单独诱导DNA损伤。徐鸿毅等[18]认为精子过长时间的孵育可影响IVF妊娠结局,可能由于长时间的孵育产生的有害物质影响了胚胎的潜在发育。精子DNA完整性与人工授精妊娠结局密切相关,DNA完整性越好,精子质量越好,妊娠率越高。
虽然本研究的结果显示A组与B组PR精子复苏率比较差异无统计学意义,A组略高于B组,但为避免精子过长时间的孵育可能对胚胎的潜在发育产生影响,取得更好的临床结局,精子取出后应尽可能在15 min内进行冷冻操作。
参考文献
[1]Vutyavanich T,Piromlertamorn W,Nunta S.Rapid freezing versus slow programmable freezing of human spermatozoa[J].Fertil Steril,2010,93(6):1921-1928.
[2]平述煌,杨世华.精子冷冻保存技术及研究进展[J].中国比较医学杂志,2011,21(3):67-71.
[3]刘勇,肖玉芳,赵东,等.人类精液一步熏蒸法冻融的实验研究[J].中华男科学杂志,2012,18(3):227-230.
[4]World Health Organization.WHO Laboratory Manual for the Exami-nation and Processing of Human Wemen[J].Fifth Edition.Switzerland:WHO Press,2010:21.
[5]Palermo G,Joris H,Dovroey P,et al.Pregnancies after intracytoplasmic injection of single spermatozoa into an oocyte[J].Lancet,1992,340(8810):17-18.
[6]张丹,谭丽,赵冬梅.三种不同来源精子行卵胞浆内单精子注射临床结局的比较[J].中国医学创新,2014,11(32):11-13.
[7]巢时斌,李建春,金萱,等.小鼠冷冻精子的胚胎发育和表观遗传学[J].中国科学:生命科学,2012,23(5):31-36.
[8]张静静,章志国,贺小进,等.玻璃化冷冻与慢速冷冻对微量精子活动力和DNA完整性的影响[J].安徽医学,2013,26 (5):105-108.
[9]平萍,朱晓斌,刘勇,等.上海地区男性生殖保险6年回顾性分析[J].中国男科学杂志,2009,23(8):41-44.
[10]Darvishnia H,Lakpour N,Lahijani M S,et al.Effects of very rapid versus vapor phase freezing on human sperm parameters[J].Cell Tissue Bank,2013,14(4):679-685.
[11]Zribi N,Chakroun N F,Ben Abdallah F,et al.Effect of freezing-thawing process and quercetin on human sperm survival and DNA integrity[J].Cryobiology,2012,65(3):326-331.
[12]Degl’Innocenti S,Filimberti E,Magini A,et al.Semen cryopreservation for men banking for oligospermia,cancers,and other pathologies: Prediction of post-thaw outcome using basal semen quality[J].Fertil Steril,2013,100(6):1555-1563.
[13]Omes C,Marchetti A L,Masanti M L,et al.Human spermatozoa cryopreservation: Comparison of three different freezing protocols[J].Cryo Letters,2013,34(5):535-543.
[14]Keel B A,Karow A M Jr.Motility characteristics of human sperm,non-frozen and cryopreserved[J].Arch Androl,1980,4 (3):205-212.
[15]Chan S Y,Craft I L,Chan Y M,et al.The hypoosmotic swelling test and cryosurvival of human spermatozoa[J].Hum Reprod,1990,5(6):715-718.
[16]杜金龙,屈爱春.实验室精液检验与男性不育原因探讨[J].中国医学创新,2010,7(4):143-144.
[17]陈瑗,周玫.自由基医学基础与病理生理[M].北京:人民卫生出版社,2002:73.
[18]徐鸿毅,罗清炳,董毅飞,等.缩短精子孵育时间对体外受精-胚胎移植结局的影响[J].湖北医药学院学报,2012,31 (1):1-3.
The Effect of the Pre-freezing Incubation Time on the Cryosurvival of Human Sperm
CHEN Bi,ZHANG Wei,MA Tian-zhong,et al.//Medical Innovation of China,2016,13(11):001-004
【Abstract】Objective:To investigate the effect of the time of sperm incubation pre-freezing on the cryosurvival of human sperm and to optimize the protocol of direct fumigation for the freeze-thawing of human sperm.Method:Thirty semen samples from healthy donors in March 2015 were collected as the objects,which were divided into three groups according to the difference of the incubation time pre-freezing at room temperature before the cryopreservation:15 minutes group(group A),30 minutes group(group B) and 60 minutes group(group C).The sperm motility parameters,sperm vitality and survival rate of the semen samples before freezing and postthawed were detected by computer-assisted semen analysis.Result:The survival rate of progressive sperm motility was(55.35±13.94)% in group A and (51.55±15.94)% in group B,which were remarkably higher than (38.13±14.24)% in group C,the differences were statistically significant(P<0.05),there was no significant difference between the group A and the group B(P>0.05),but the group A was higher.There were no significant differences in sperm vitality among the three groups(P>0.05).Conclusion:The short time incubation of sperm pre-freezing can evidently improve the progressive motility of post-thaw sperm.
【Key words】Sperm; Cryopreservation; Sperm parameter; Survival rate of post-thaw sperm
*基金项目:国家自然科学基金项目(81300484);广东医学院博士启动基金(B2012027);湛江市财政资金科技专项竞争性分配项目(2013A1006)
通信作者:马天仲
doi:10.3969/j.issn.1674-4985.2016.11.001
收稿日期:(2015-12-08) (本文编辑:刘蕾)

