猪圆环病毒2型的自然感染、免疫和遗传多样性研究综述
Cheryl M.T. Dvorak,Michael P. Murtaugh(明尼苏达州大学兽医和生物科学系,圣保罗,明尼苏达州,美国)//杜 宪,朱迪国,张 志(译)(中国动物卫生与流行病学中心,山东青岛 266032)
猪圆环病毒2型的自然感染、免疫和遗传多样性研究综述
Cheryl M.T. Dvorak,Michael P. Murtaugh
(明尼苏达州大学兽医和生物科学系,圣保罗,明尼苏达州,美国)//
杜 宪,朱迪国,张 志(译)
(中国动物卫生与流行病学中心,山东青岛 266032)
摘 要:猪圆环病毒2型(PCV2)是一个基因保守的猪病原体。PCV2感染最早发生在子宫内的胎儿发育期间或出生后通过接触感染病毒的母猪以及被病毒污染的产仔环境而感染,其传播不受病毒血症水平或免疫水平的影响。PCV2及其抗体很容易进入初乳、母乳和口鼻分泌物中,但在这些液体中的抗体水平不会影响仔猪病毒血症的水平。仔猪在断奶时常已经感染PCV2或已有母源抗体。目前还不清楚早期PCV2感染或母源抗体的存在对疫苗免疫效果会产生多大的影响,但它们有可能受到PCV2 相关疫病(PCVAD)的干扰。对怀孕前的母猪进行免疫,可使其血清、初乳均能获得较高的抗体水平,但加强母源免疫不会影响病毒向仔猪传播或母猪中的病毒量。在美国的流行病学调查显示,从2006年实施大规模免疫后,猪群PCV2流行率出现大幅下降,这说明PCV2 或许可以根除。
关键词:猪圆环病毒2型;免疫;感染;动力学模型;遗传多样性
PCV2是引起圆环病毒相关疾病(PCVAD)的主要病原体,在全球广泛存在。20世纪90年代,首先在加拿大,然后在欧洲,发现PCV2与育成猪的多系统消耗综合征相关[1-2]。自从在猪群中经常出现PCV2与猪繁殖与呼吸综合征病毒(PRRSV)的交叉感染,并从感染慢性病、外观健康的猪群中发现PCV2以来,PCV2的诊断越来越具有挑战性。如,因PRRSV的混合感染,感染和健康猪群中出现PCV2,已无法建立一个表明PCV2是病原的疾病模型,这使诊断变得十分复杂。
2006—2007年研究发现,对断奶仔猪实施PCV2免疫,有效降低了育成猪的死亡率。虽然PCV2免疫有效控制了PCAD的发生,降低了血液中的病毒水平,但并不能根除感染的发生[3-6]。当时,免疫保护机制、病毒在猪体内的相互作用、感染猪只的年龄等还没有研究清楚。猪只何时、以何种暴露感染方式以及如何变成有效感染,对了解PCV2免疫机制非常必要,这也是为了有效免疫、预防和消除PCV2。
通过在美国猪群中对免疫前后的PCV2流行病学、自然农场猪只PCV2交叉感染的影响等方面开展的广泛研究,开始逐渐获得了对育成猪PCV2感染和疾病的理解。PCV2在主动免疫的情况下依然可以感染猪只。PCV2感染主要发生在母猪子宫内或出生后不久。国家层次的长期免疫计划可以大幅降低猪群中的病毒量。免疫已经改变了PCV2的感染动力,从而可以在猪群中根除该疫病。
1 育成猪群中的PCV2流行病学
在尚未实施免疫的2005年和2006年,PCV2 在20周龄左右的育成猪群中广泛流行。99%以上的出栏猪、55%~100%的个体猪只中都能发现PCV2,病毒平均载量几乎接近105/mL血清,7%的猪只带有>107的病毒复制/mL[6]。无临床症状的高水平病毒血症(>107的病毒复制/mL)说明了PCV2交互作用的复杂程度,因为此前曾有报道称高水平的病毒血症与疾病相关[7]。高水平的病原载量与病毒、致病菌感染相符,因此无症状但超过109/mL的较高病毒血症水平说明还有其他因素影响了对PCV2感染结果的确定。
基因变异和免疫,这两个因素能够直接影响PCV2在宿主间的交互作用。虽然从2000年才开始发现PCV2a 到 PCV2b的基因移动,但PCV2的 2个主要基因PCV2a 和 PCV2b在实施疫苗控制PCVAD之前就已广泛存在[8-12];尽管PCV2b基因越来越普遍,但PCV2毒性的差异似乎主要来自毒株间的差异性,而不是毒株的基因型[10]。对明尼苏达州兽医诊断实验室分离到的PCV2毒株的基因分析显示,这2个基因型经常被发现(图1)。有趣的是,PCV2b分离株的基因变异实质上远比PCV2a有限,暗示PCV2a基因更加古老,而PCV2b最近才出现。
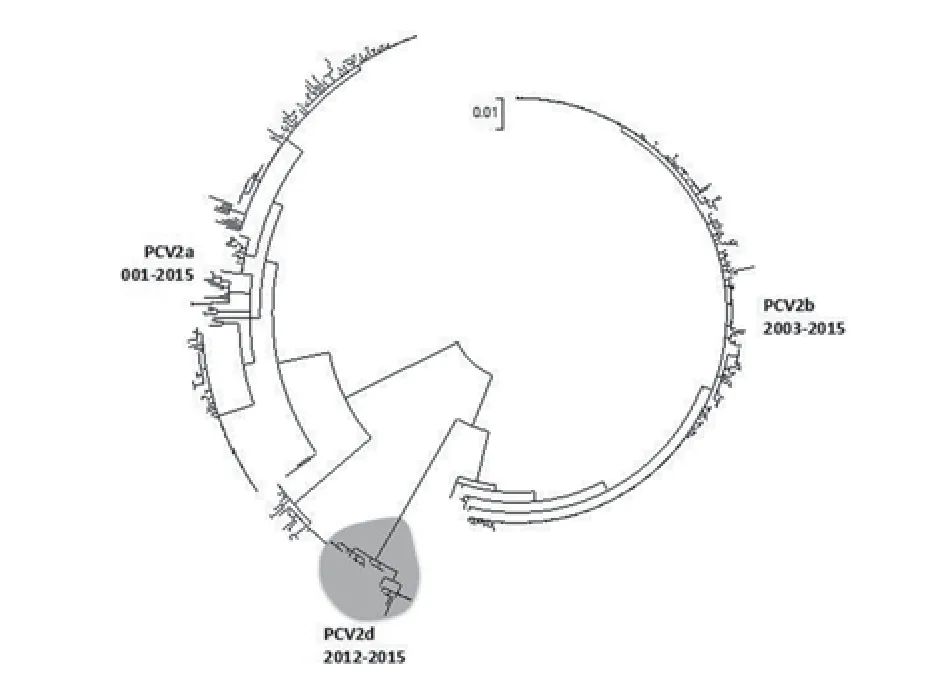
图1 PCV2a、PCV2b基因进化树
免疫可能减弱了高病毒滴度/效价,因此提供了一个不表现临床症状的感染状况。目前已有一个无病状态下的带有高病毒效价的病毒感染模型——老鼠乳酸脱氢酶提升病毒(LDV)。在高中和抗体滴度出现之前,LDV引起了一个持久的病毒血症感染[13]。在4 140份血清样品中病毒血症和抗体状况直接对比显示,66%的育肥猪对PCV2 基因和抗衣壳蛋白抗体均是阳性[2]。因此,要确定是感染还是发病,相对含量的抗体和病毒测定可能比单独的病毒含量测定更重要。
2 免疫对猪群感染状况的影响
2006年,北美地区开始广泛使用预防和控制PCVAD的疫苗。据零星报道显示,在美国,超过98%的猪只在断奶前后进行免疫。Meta分析显示,免疫提高了猪只的生产性能,降低了死亡率[14]。这说明PCV2对猪群水平的卫生状况有正面影响,即使其致病机制还没有搞清楚。虽然免疫不能消除感染,但多次实验研究结果充分说明,它可以减少病毒血症的发生[15]。另有证据证明,即便有报道称丹麦的2个猪群通过PCR检测为阴性,但免疫的猪群中仍有PCV2的感染[16]。另外,在美国,免疫前猪群中观察到的高水平病毒血症连续大幅度减少了6年。在2006年,大约50%农场中的所有猪均是PCV2阳性,99.5%的农场中至少有1只阳性[2]。如图2A所示,在2012年,51%的农场完全是阴性的,99%的农场至少有1只阴性猪。另外,病毒血症水平急剧降低,81%的猪只经PCR检测为PCV2阴性,只有4%的猪只为强阳性(>106基因组拷贝/mL),见图2B。
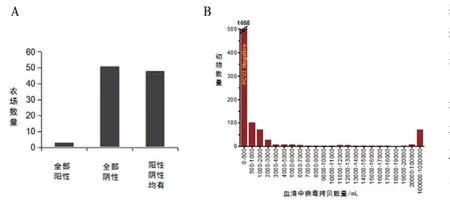
图2 2012年美国PCV2感染情况

图3 免疫前后的PCV2基因型分布
免疫也可能不同程度地改变了猪群中PCV2a 和PCV2b基因型的流行。2006年从免疫前的1 000头育肥猪中随机抽取样本,使用PCV2特定基因型PCR检测[17],发现28%的猪只感染了PCV2a,38%的猪只感染了PCV2b,9%的猪只同时感染了这2种基因型,23%的猪只PCR检测为阴性(图3A)。而在一个相对封闭的、PCV2在母猪和仔猪之间传播的研究中,发现60%的样品只污染了 PCV2b,约3%的样品只污染了PCV2a,没有发现PCV2a 和PCV2b的双重感染,如图3B所示。因为在疫苗使用之前就已发现PCV2b的流行逐渐加重,因此免疫对基因漂移向PCV2b的作用并不确定[1,8,9,10,12]。
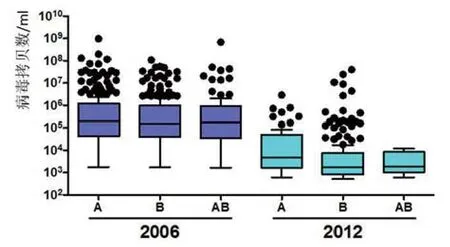
图4 2006年和2012年育肥猪中PCV2 A和B基因的病毒血症水平
免疫对美国猪群病毒载量的影响非常明显。2006年,1 000头育肥猪的平均病毒血症水平>105/mL(不考虑基因型感染状况,如图3A所示)。需要特别指出的是,PCV2a感染的水平范围同PCV2b和2种基因型双重感染的水平相同(图4)。2012年,育肥猪群的总体流行率从82%下降到19%,感染猪中的病毒载量也减少了1%~10%,同样也没有基因型的差异(图4)。
3 猪何时感染PCV2
根据猪病的参考标准,一般4~11周龄的猪对PCV2易感,而哺乳仔猪感染率较低[20]。育肥猪的小部分感染和高效价的免疫抗体已经证实了这一观点[21-22]。然而,美国育肥猪的PCV2感染无处不在,甚至高效价抗体的猪群也感染了PCV2。这些现象表明PCV2的感染是持久的,仅靠免疫无法解决,成年母猪有可能一直是该病的传染源[6]。如果母猪经常出现病毒血症,那么它会作为主要传染源,为病毒的宫内传播或胎儿的外界感染提供条件。这些传播途径非常重要,正是因为这些证据,对已感染的猪只来说,在断奶时注射疫苗已成为养猪业的通用做法。
检查母猪、哺乳前仔猪的病毒学和免疫状态及其生产环境,从而可以确定PCV2暴露风险、传播动力学以及分娩时的免疫学影响。据观察,在美国中西部有分娩母猪的农场里,PCV2广泛存在[17]。在所有农场的母猪体内,很容易检测到PCV2,且常处于较高水平。在血清中的病毒阳性率为73%,在初乳中的病毒阳性率为76%,而在流涎中的病毒阳性率为80%(图5),其中42%的母猪出现腹泻。在细胞培养中可以重新获得感染性PCV2,基因测序显示其基因全部是PCV2b基因[17]。在母猪体内多个部位均有PCV2的存在,这证明仔猪的感染存在多种途径暴露感染。但感染无法确定,因为抗病毒抗体已存在。如图6所示,所有农场母猪的血清和初乳中都容易检测到抗体。有趣的是,第3农场和第5农场抗体水平最高和最均匀,在母猪产前3~4周注射了一头份剂量疫苗。
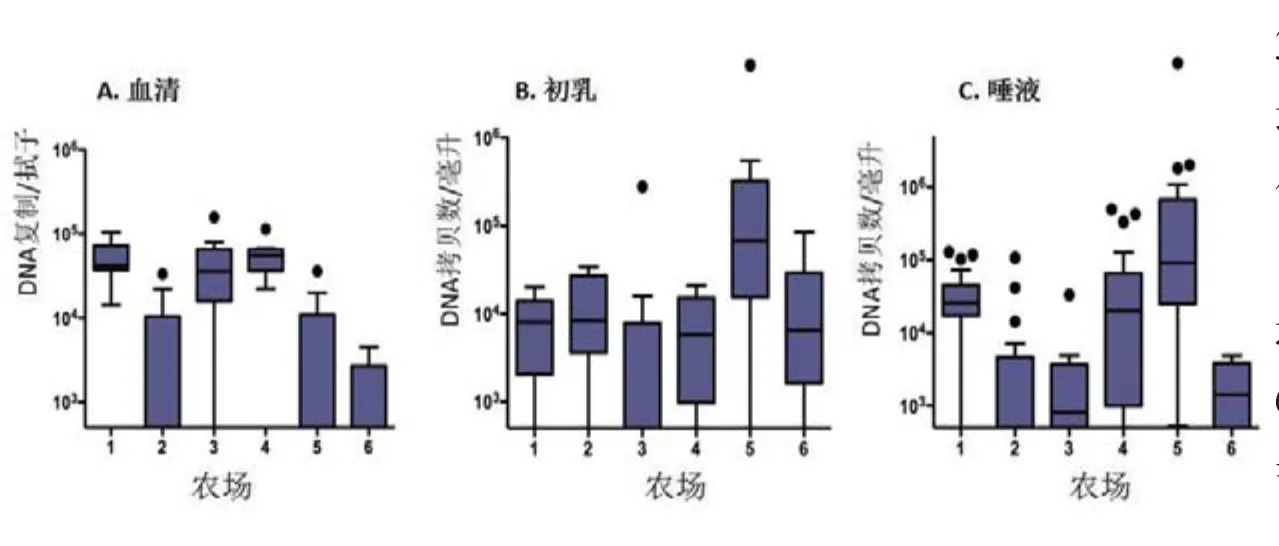
图5 分娩母猪血清(A)、初乳(B)和唾液(C)中的病毒情况
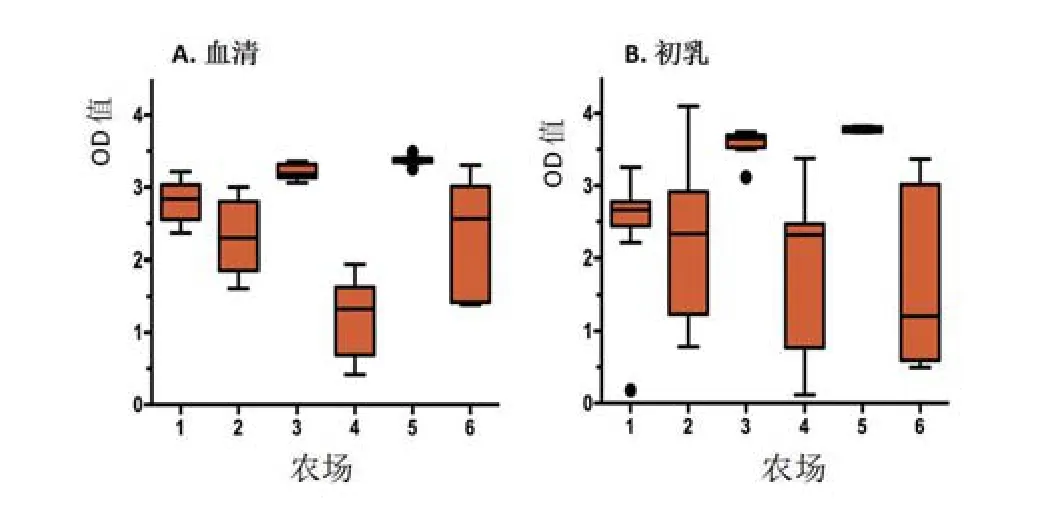
图6 抗衣壳蛋白抗体IgG在母猪血清(A)和初乳(B)中的OD值
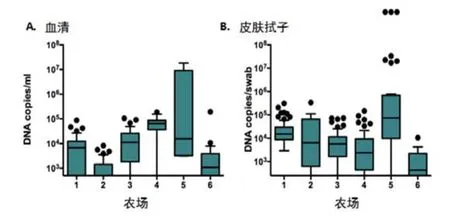
图7 定量PCR结果
无论抗体在什么水平,PCV2容易通过宫内感染,由母猪传播到仔猪。61%(n = 176)的仔猪一出生就带有病毒血症(图7),93%的仔猪前肢腋窝皮肤拭子检测呈PCR阳性,说明病毒在仔猪与分娩室的环境接触之前就已经存在(图7)。仔猪皮肤上的这些病毒最有可能来源于子宫或产道。在免疫猪群中,PCV2从母猪到仔猪的传播没有差异,这表明血清和初乳中抗体的存在并不影响病毒的传播,母猪的胎次对病毒的传播也没有影响[17]。
这些研究是在2009年和2010年同时进行的,包括在农场的检测,当时PCV2疫苗接种在整个养猪业普通推行。疫苗接种对控制PCVAD非常有效,但病毒血症感染仍然很常见[17]。研究结果表明,高滴度抗体不能有效防止病毒从母猪传播到仔猪,并且在猪的生活中可持续感染,甚至在出现有效的免疫应答之前就已感染。
4 PCV2感染的动力学模型
据报道,继1974年发现猪圆环病毒病以来,PCV1在猪体内普遍存在。但由于缺乏特异性检测方法,使得这一结论并不确定[1]。然而在PCV1很少出现的同时,2006年却出现了PCV2的地方性流行[2,6,22]。PCV2感染通常被认为需要其它因素诱发。2006至2007年,美国的大面积疫苗计划虽然没有消除感染,但却控制住了疾病蔓延。通过定量PCR检测发现,持续密集地疫苗接种大大降低了PCV2的流行率。
PCV2感染模式与免疫必须与现代养猪业生产实践相关联,体现出宿主病原体相互作用的自然特征,包括感染和免疫状态的感染。这些细节对PCV2而言是至关重要的,因为即使面对一个强免疫反应,感染似乎也是持续性的[2,17,19,23]。
感染动力学主要基于实地调查,调查抗体的存在是为了防止感染[24],尽管血清或牛初乳中的抗体并不能防止感染[17]。图8表明,天生携带阳性抗体的25只仔猪,其血清、初乳、唾液的病毒学和免疫学状态都呈阳性(图5、图6中的农场2)。这项研究是在2006年开始接种疫苗前到2012年后的一段时间开展的田间试验研究,当时许多猪群经PCR检测是PCV2阴性,见图2。由于母源抗体的缘故,仔猪抗体水平在断奶时较高,在25周龄主动免疫时,抗体水平略微下降,但仍保持在有效水平。然而,在整个测试期间,病毒血症的平均水平稳步上升,到第10周,流行率从37%增加到100%(图8 B和C)。
在没有免疫的情况下,感染动力学模型如图9A所示。该模型基于持续的PCV2感染,抗体的存在不能防止感染以及作为主要感染途径的从母猪到仔猪的垂直传播这一主要途径。该模型预测,通过病毒血症抑制,母源抗体抑制了仔猪感染,但当母源抗体保护力下降至仔猪获得主动免疫期间,仔猪的病毒载量会回升。这也预示育成猪的病毒载量将会增加,同时在诱发因素的作用下,增加了PCV2发病的风险。相比之下,图9B展示了仔猪免疫实施过程中病毒传播和感染的模型,该模型显示免疫可以逐渐把病毒载量降低到一个难以检测出的水平。在这个模型中,母源抗体结合仔猪断奶时免疫,有效抑制了仔猪中病毒的增长,能够刺激仔猪产生更加积极的免疫反应,使得仔猪在生长过程中,能够持续控制感染的发生。因此,免疫使组织和血液中的病毒载量得到抑制,控制了临床发病,随着时间的推移,PCV2将最终得以根除。
该模型显示,通过将母源抗体转移至初乳和牛奶中,使病毒垂直传播或通过相关环境因素传播给仔猪的现象得到控制。因此,在母源抗体下降时,对断奶仔猪继续接种疫苗,病毒就会继续被抑制,从而使仔猪临床不发病。
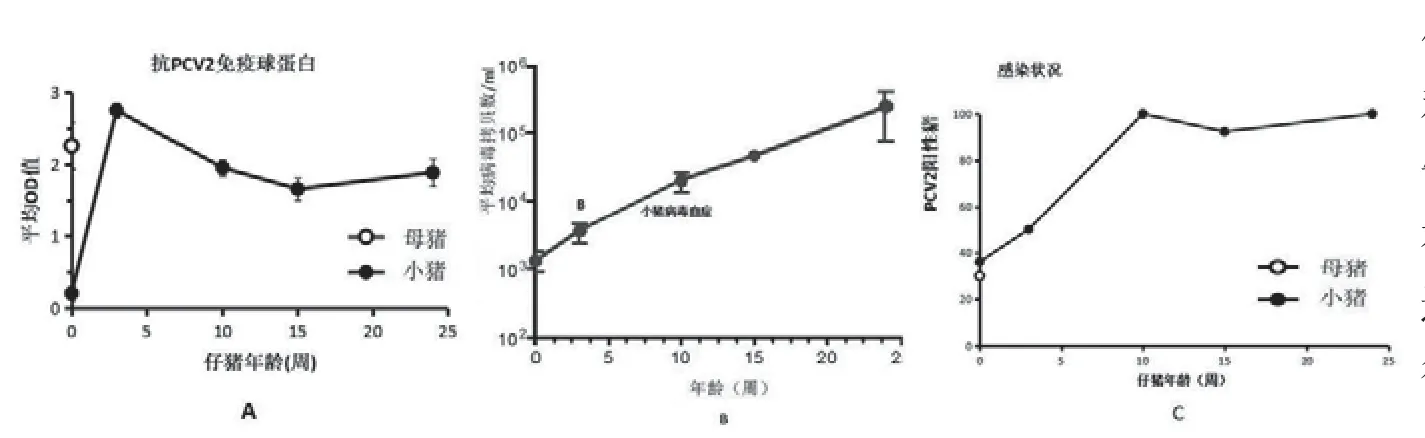
图8 病毒阳性母猪所产仔猪的感染和免疫应答情况
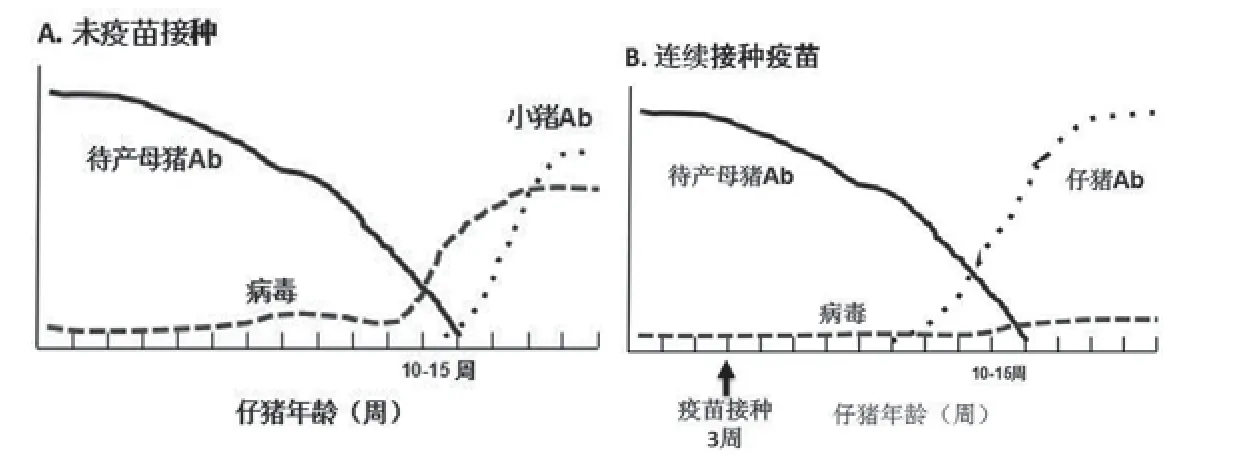
图9 未接种疫苗和连续接种疫苗的PCV2感染模型
在养猪生产各个阶段的病毒载量和PCV2抗体水平的定量分析表明,主动和被动免疫不能有效预防和控制PCV2感染[2,17]。由于仔猪在断奶时易被感染,所以人们通常在容易发生感染的时候进行疫苗免疫。因此,该模型过去常被用于阐明PCV2感染时的免疫保护机制。此外,PCV2疫苗预防疾病的能力表明,疫苗诱导免疫与天然免疫不同,尽早提高免疫力对充分控制感染非常重要。所有包含细胞培养表达的衣壳蛋白或非复制灭活病毒制剂的PCV2疫苗,一般都能刺激机体产生抗体反应。自然抗体反应的细微差别或者T细胞反应的差异,以及通过疫苗刺激机体产生抗
PCV2抗体来对抗自然感染的过程均存在差异,这些都有助于解释为什么不同疫苗的免疫效力存在差异。
致谢:本文得到了美国农业部合作研究署(the Cooperative State Research Service,USDA)在MIN-63-110项目中的支持。
参考文献:
[1] Allan G M,Ellis J A. Porcine circoviruses:a review[J]. J Vet Diagn Invest,2000(12):3-14.
[2] Puvanendiran S,Stone S,Yu W,et al. Absence of porcine circovirus type 1 (PCV1) and high prevalence of PCV 2 exposure and infection in swine fi nisher herds[J]. Virus Res,2011,157:92-8.
[3] Fort M,Sibila M,Allepuz A,et al. Porcine circovirus type 2 (PCV2) vaccination of conventional pigs prevents viremia against PCV2 isolates of different genotypes and geographic origins[J]. Vaccine,2008(26):1063-1071.
[4] Opriessnig T,Patterson A R,Elsener J,et al. Influence of maternal antibodies on efficacy of porcine circovirus type 2 (PCV2) vaccination to protect pigs from experimental infection with PCV2[J]. Clin Vaccine Immunol,2008a(15):397-401.
[5] Opriessnig T,Patterson A R,Madson DM,et al. Comparison of the effectiveness of passive (dam) versus active (piglet)immunization against porcine circovirus type 2 (PCV2) and impact of passively derived PCV2 vaccine-induced immunity on vaccination[J]. Vet Microbiol ,2010a(142):177-83.
[6] Haley C,Wagner B,Puvanendiran S,et al. Diagnostic performance measures of ELISA and quantitative PCR tests for porcine circovirus type 2 exposure using Bayesian latent class analysis[J]. Prev Vet MedMurtaugh,2011(101):79-88.
[7] Brunborg I M,Moldal T,Jonassen C M. Quantitation of porcine circovirus type 2 isolated from serum/plasma and tissue samples of healthy pigs and pigs with postweaning multisystemic wasting syndrome using a TaqMan-based real-time PCR[J]. Journal of Virological Methods, 2004(122):171-178.
[8] Allan G,Krakowka S,Ellis J,et al. Discovery and evolving history of two genetically related but phenotypically different viruses[J]. Virus Res,2012(164):4-9.
[9] Dupont K,Nielsen E O,Baekbo P,et al. Genomic analysis of PCV2 isolates from Danish archives and a current PMWS
case-control study supports a shift in genotypes with time[J]. Vet Microbiol,2008(128):56-64.
[10] Opriessnig T,Ramamoorthy S,Madson D M,et al. Differences in virulence among porcine circovirus type 2 isolates are unrelated to cluster type 2a or 2b and prior infection provides heterologous protection[J]. Gen Virol,2008b(89):24-91. [11] Patterson A R,Opriessnig T. Epidemiology and horizontal transmission of porcine circovirus type 2 (PCV2)[J]. Anim Health Res Rev,2010(11):217-34.
[12] Segalés J,Kekarainen T. The natural history of porcine circovirus type 2: from an inoffensive virus to a devastating swine disease[J]. Vet Microbiol,2013(165):13-20.
[13] van den Broek M F,Sporri R,Even C,et al. Lactate dehydrogenase-elevating virus (LDV): lifelong coexistence of virus and LDV-specifi c immunity[J]. Immunol,159(15):85-86.
[14] da Silva N,Carriquiry A,O'Neill K,et al. Mixed treatment comparison meta-analysis of porcine circovirus type 2 (PCV2)vaccines used in piglets[J]. Prev Vet Med,2014(117):24-413.
[15] Kixmöller M,Ritzmann M,Eddicks M,et al. Reduction of PMWS-associated clinical signs and co-infections by vaccination against PCV2[J]. Vaccine,2008(26):34-51.
[16] Kristensen C S,Hjulsager C K,Larsen L E. Investigation of PCV2-status in danish herds - one year lognitudinal study[J]. International Symposium on Emerging and Reemerging Pig Diseases,2011(98):8-250.
[17] Dvorak C M,Lilla M P,Baker S R. Multiple routes of porcine circovirus type 2 transmission to piglets in the presence of maternal immunity[J]. Vet Microbiol,2013(166):74-365.
[18] Opriessnig T,Patterson A R,Madson D M. Comparison of efficacy of commercial one dose and two dose PCV2 vaccines using a mixed PRRSV-PCV2-SIV clinical infection model 2-3-months post vaccination[J]. Vaccine,2009(27):1002-1007.
[19] Opriessnig T,Prickett J R,Madson D M. Porcine circovirus type 2 (PCV2)-infection and re-inoculation with homologous or heterologous strains: virological, serological, pathological and clinical effects in growing pigs[J]. Vet Res,2010b (41):31.
[20] Zimmerman J J,Karriker L A,Ramirez A. Diseases of Swine[J]. Wiley-Blackwell,2012(20):11.
[21] McIntosh K A,Harding J C,Ellis J A. Detection of Porcine circovirus type 2 viremia and seroconversion in naturally infected pigs in a farrow-to-fi nish barn[J]. Canadian journal of veterinary research,2006(70):58-61.
[22] Rodriguez A G M,Segales J,Calsamiglia M,et al. Dynamics of porcine circovirus type 2 infection in a herd of pigs with postweaning multisystemic wasting syndrome[J]. Am J Vet Res,2002(63):7-354.
[23] Prickett JR,Johnson J,Murtaugh M P,et al. Prolonged detection of PCV2 and anti-PCV2 antibody in oral fl uids following experimental inoculation[J]. Transbound Emerg Dis,2011 (58):7-121.
[24] Grau R L,Fraile L. Recent advances in the epidemiology,diagnosis and control of diseases caused by porcine circovirus type 2[J]. Segales,2011(187):23-32.
(责任编辑:杜宪)
PCV2 Natural Infection,Immunity and Genetic Diversity
Cheryl M.T. Dvorak,Michael P. Murtaugh
(Department of Veterinary and Biomedical Sciences, University of Minnesota,St. Paul,MN,USA)
Abstract:Porcine circovirus 2 (PCV2) is a genetically conserved porcine pathogen;Faccination at weaning controls disease associated with all genotypes. Viral infection occurs early in life in utero during fetal development or shortly after birth through contact with infected sows and a contaminated farrowing environment. Transmission is not affected by level of viremic infection or level of immunity. PCV2 and antibodies are readily shed in colostrum,milk and oro-nasal secretions,but the level of antibodies in these fl uids does not affect levels of viremia in piglets. PCV2 vaccination at weaning occurs when piglets are already infected and have maternal antibodies to the virus. The consequences of early infection and maternal antibody presence on vaccine effi cacy are not known,although they do not appear to interfere with control of PCV2-associated disease(PCVAD). Sow vaccination before farrowing appears to give uniformly high antibody levels in serum and colostrum but increased maternal immunity does not affect PCV2 transmission to piglets or the viral load in sows. Epidemiology surveys in the United States indicate a dramatic reduction in herd prevalence in the years following widespread introduction of vaccination in 2006,indicating that elimination of PCV2 from swine herds may be possible.
Key words:porcine circovirus virus type 2;immune;infection;dynamic model;genetic diversity
中图分类号:S851.3 献标识码:A
文章编号:1005-944X(2016)05-0056-06
DOI:10.3969/j.issn.1005-944X.2016.05.019

