乌司他丁辅助高容量血液滤过对严重脓毒血症血清细胞黏附分子-1、胆碱酯酶和凝血功能的影响
陈 伟,胡志华,杨远征
(海南医学院附属医院重症医学科,海南海口570102)
乌司他丁辅助高容量血液滤过对严重脓毒血症血清细胞黏附分子-1、胆碱酯酶和凝血功能的影响
陈伟,胡志华,杨远征
(海南医学院附属医院重症医学科,海南海口570102)
摘要:目的探讨乌司他丁辅助高容量血液滤过治疗严重脓毒血症的临床疗效,以及对患者血清细胞黏附分子-1(ICAM-1)、胆碱酯酶和凝血功能的影响。方法选取2012年1月-2014年12月在该院接受治疗的106例严重脓毒症患者作为研究对象,回顾性分析其临床资料,按治疗方案分为对照组(47例)和观察组(59例)。在常规治疗基础上,对照组给予高容量血液滤过治疗,观察组在对照组基础上给予乌司他丁辅助治疗。比较两组患者生理学与慢性健康状况评分(APACHEⅡ)、全身感染相关器官功能障碍评分(SOFA)、Marshall评分,28 d弥漫性血管内凝血(DIC)发生率、多功能器官障碍综合征(MODS)发生率、病死率、血清ICAM-1、胆碱酯酶和凝血功能指标。结果治疗7d后,与对照组比较,观察组APACHEⅡ、SOFA及Marshall评分降低(P<0.05)。28 d时,对照组DIC发生率和MODS发生率分别为17.0%和23.4%,观察组的分别为3.4%和8.5%,与对照组比较,观察组DIC和MODS发生率降低,差异有统计学意义(P<0.05)。观察组的病死率为15.3%,对照组为29.8%,组间比较差异无统计学意义(P>0.05)。与对照组比较,观察组治疗后凝血酶原时间(PT)、激活部分凝血酶原时间(APTT)降低,纤维蛋白原(FIB)、血小板(PLT)升高,ICAM-1水平下降,胆碱酯酶水平升高,差异有统计学意义(P<0.05)。结论乌司他丁辅助高容量血液滤过能够明显改善患者凝血功能,降低ICAM-1,提高胆碱酯酶水平,从而提高严重脓毒症的临床疗效,值得进一步研究。
关键词:乌司他丁;高容量血液滤过;严重脓毒血症;凝血功能;细胞黏附分子-1;胆碱酯酶
严重脓毒血症是感染、创伤等导致的严重并发症,是一种全身炎症反应综合征,治疗难度大,如果不能得到及时有效治疗,病情进展可能出现弥漫性血管内凝血(disseminated intra-vascular coagulation,DIC)及多功能器官障碍综合征(multiple organ dysfunction syndrome,MODS)等,严重威胁患者生命[1-2]。随着发病机制研究的不断深入,凝血功能紊乱与炎症反应已被证实为脓毒血症发生、发展的关键因素[3-4]。高血容量血液滤过是血液净化的重要治疗方式,在脓毒血症治疗中具有重要价值,但其治疗有效性有限[5]。乌司他丁是一种广谱蛋白酶抑制剂,具有改善凝血功能、调控炎症反应等作用,逐渐应用于脓毒症的治疗[6]。但目前关于乌司他丁辅助高容量血液滤过治疗严重脓毒血症的研究较少。本文通过回顾性分析乌司他丁辅助高容量血液滤过治疗严重脓毒血症的临床疗效及对患者血清细胞黏附分子-1 (intercellular adhesion molecule-1,ICAM-1)、胆碱酯酶(cholinesterase,chE)和凝血功能的影响,以期为脓毒血症的治疗提供一定参考依据。
1 资料与方法
1.1 研究对象
选取2012年1月-2014年12月于本院接受治疗的106例严重脓毒症患者作为研究对象,回顾性分析其临床资料,按治疗方案分为对照组(47例)和观察组(59例)。所有患者符合严重脓毒症的相关诊断标准[7],并排除血液系统疾病、肿瘤、免疫系统疾病、治疗≤7 d出院或者死亡等患者。对照组男性27例,女性20例;年龄25~63岁,平均(56.3±8.4)岁;病程0.5d~4.5d,平均(2.4±0.5)d;原发疾病:重症肺部感染24例,重症胰腺炎6例,创伤后继发严重感染7例,腹膜炎10例。观察组男性33例,女性26例;年龄23岁~65岁,平均(57.1±9.2)岁;病程0.5~5.0 d,平均(2.6±0.6)d;原发疾病:重症肺部感染30例,重症胰腺炎8例,创伤后继发严重感染8例,腹膜炎13例。对照组与观察组性别、年龄、病程及原发疾病等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
1.2.1 治疗方法所有患者给予原发病病因治疗(包括针对病因的手术、禁食及胃肠减压等治疗)、早期广谱抗生素抗感染、维持酸碱、水电解质平衡、补充血容量、营养支持等常规治疗措施。常规治疗基础上,对照组给予高容量血液滤过治疗,置换液剂量维持>50 ml/(kg·h),滤过时间12 h/d,疗程3 d。观察组在对照组基础上给予乌司他丁注射液(广东天普生化医药股份有限公司,国药准字H20040505)20 万u+生理盐水20 ml,静脉推注,3次/d,疗程7 d。
1.2.2 观察指标治疗前与治疗7d后,评定生理学与慢性健康状况评分(acute physiology and chronic health evaluation scoring system,APACHEⅡ)[8]、全身感染相关器官功能障碍评分(sequential organ failure assessment,SOFA)[9]、Marshall评分[10],分值越低,治疗效果越好;观察治疗28 d内患者DIC发生率、MODS发生率及病死率;治疗前后常规生化检测凝血酶原时间(Prothrombintime,PT)、激活部分凝血酶原时间(activated partial prothrombin time,APTT)、纤维蛋白原(Fibrinogen,FIB)及血小板(Platelet,PLT)等凝血功能指标。酶联免疫吸附试剂盒检测ICAM-1和chE水平,试剂盒购自德国西门子公司。
1.3 统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,计数资料以率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后APACHEⅡ、SOFA及Marshall评分比较
治疗前,两组患者APACHEⅡ、SOFA及Marshall评分比较,经t检验,差异无统计学意义(t=0.533、0.227和0.317,P=0.595、0.821和0.752)。两组治疗前后APACHEⅡ、SOFA及Marshall评分比较,经t检验,差异有统计学意义(对照组:t=5.695、4.894和5.967,P=0.000;观察组:t=9.175、11.572和11.366,P=0.000),两组治疗后有不同程度下降。治疗后,两组APACHEⅡ、SOFA及Marshall评分比较,经t检验,差异有统计学意义(t=2.942、和4.023,P=0.004、0.000和0.000),观察组治疗后APACHEⅡ、SOFA及Marshall评分较对照组下降。见表1。
表1 两组治疗前后APACHEⅡ、SOFA及Marshall评分比较(分,±s)

表1 两组治疗前后APACHEⅡ、SOFA及Marshall评分比较(分,±s)
注:1)与治疗前比较,P<0.05;2)与对照组治疗后比较,P<0.05
组别 APACHEⅡ评分 SOFA评分 Marshall评分对照组(n=47)治疗前 22.44±5.25 8.49±2.55 11.58±3.41治疗后 16.19±5.391)6.31±1.681)7.45±3.301)观察组(n=59)治疗前 21.87±5.63 8.60±2.43 11.37±3.38治疗后 13.43±4.271)2)4.36±1.421)2)5.21±2.431)2)
2.2 两组患者DIC发生率、MODS发生率、病死率比较
治疗28 d,对照组DIC发生率和MODS发生率分别为17.0%和23.4%,观察组的分别为3.4%和8.5%,经χ2检验,差异有统计学意义(P<0.05),观察组DIC和MODS发生率较对照组降低。观察组的病死率为15.3%,对照组为29.8%,经χ2检验,差异无统计学意义(P>0.05)。见表2。

表2 两组患者DIC发生率、MODS发生率、病死率比较例(%)
2.3 两组患者治疗前后凝血功能比较
治疗前,两组PT、APTT、FIB、PLT等凝血功能指标比较,差异无统计学意义(t=0.255、0.366、0.635和0.185,P=0.799、0.715、0.527和0.854)。两组治疗前后PT、APTT、FIB、PLT比较,经t检验,差异有统计学意义(对照组:t=3.142、4.829、7.299和11.569,P=0.002、0.000、0.000和P=0.000;观察组:t=10.412、9.800、13.837和22.662,P=0.000),治疗后两组PT、APTT不同程度下降,FIB、PLT不同程度升高。治疗后两组PT、APTT、FIB、PLT比较,经t检验,差异有统计学意义(t=7.561、3.600、6.155和8.670,P=0.000),观察组治疗后较对照组PT、APTT降低,FIB、PLT升高。见表3。
表3 两组患者治疗前后凝血功能比较(±s)
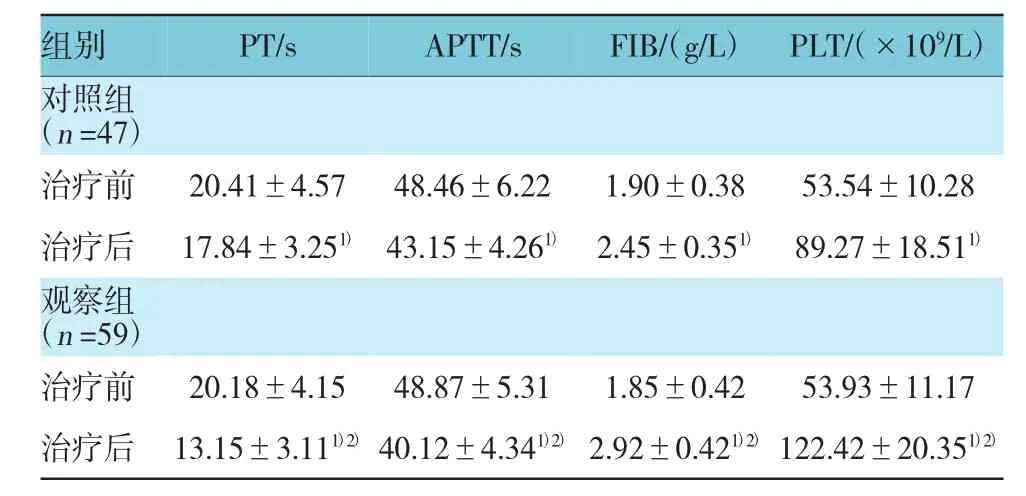
表3 两组患者治疗前后凝血功能比较(±s)
注:1)与治疗前比较,P<0.05;2)与对照组治疗后比较,P<0.05
组别 PT/s APTT/s FIB/(g/L) PLT/(×109/L)对照组(n=47)治疗前 20.41±4.57 48.46±6.22 1.90±0.38 53.54±10.28治疗后 17.84±3.251)43.15±4.261)2.45±0.351)89.27±18.511)观察组(n=59)治疗前 20.18±4.15 48.87±5.31 1.85±0.42 53.93±11.17治疗后 13.15±3.111)2)40.12±4.341)2)2.92±0.421)2)122.42±20.351)2)
2.4 两组患者治疗前后血清ICAM-1和chE水平比较
治疗前,两组患者ICAM-1和chE水平比较,经t检验,差异无统计学意义(t=0.473和0.382,P=0.637 和0.703)。两组治疗前后ICAM-1和chE水平比较,经t检验,差异有统计学意义(对照组:t=20.442和10.438,P=0.000;观察组:t=36.321和21.234,P=0.000)治疗后两组ICAM-1和chE水平不同程度下降。治疗后两组ICAM-1和chE水平比较,经t检验,差异有统计学意义(t=13.507和6.968,P=0.000),与对照组比较,观察组治疗后ICAM-1下降,chE水平升高。见表4。
表4 两组患者治疗前后血清ICAM-1和chE水平比较(±s)

表4 两组患者治疗前后血清ICAM-1和chE水平比较(±s)
注:1)与治疗前比较,P<0.05;2)与对照组治疗后比较,P<0.05
组别 ICAM-1/(ng/L) chE/(U/L)对照组(n=47)治疗前 932.5±105.4 4 180.4±927.6治疗后 480.6±108.91)6 174.2±924.31)观察组(n=59)治疗前治疗后943.4±126.8 230.9±81.41)2)4 251.5±876.4 7 224.7±623.41)2)
3 讨论
血液净化一直是脓毒血症治疗中争论的焦点问题,随着研究的深入,相关指南推荐持续性肾脏替代治疗在脓毒血症中的应用[12]。高容量血液滤过是在持续性肾脏替代治疗基础上发展的一种血液净化治疗模式,主要通过增加置换液输入量提高大中分子溶质对流清除作用,达到改善脓毒症患者机体状况的目的,而该作用可能与有效清除炎性介质、清除激活的损伤内皮细胞、增强心肌能量代谢、清除水分、减轻水肿、改善心肺功能等因素有关[13]。但是,该治疗方式存在一定不足,在清除炎性介质的同时,会清除体内的抗炎介质,降低机体的抗菌能力及免疫能力,其疗效有待进一步提高[14]。乌司他丁为新鲜人尿中提取的一种能抑制多种蛋白水解酶活力的糖蛋白,具有广谱的蛋白酶抑制作用,外源性给予乌司他丁后,能够通过控制炎性介质释放、保护血管内皮等多种途径发挥保护脏器功能作用,逐渐在脓毒症中取得一定疗效[15]。目前,关于乌司他丁辅助高容量血液滤过治疗严重脓毒血症的研究较少。本研究中,治疗后两组患者反映机体健康状况的APACHEⅡ、SOFA及Marshall评分均不同程度下降,而乌司他丁辅助治疗组下降更明显。与高容量血液滤过组比较,乌司他丁辅助治疗组28 d DIC发生率、MODS发生率降低,差异有统计学意义。另外,虽然两组28 d病死率比较差异无统计学意义,但是乌司他丁辅助治疗组病死率比例较低。结果表明,该辅助治疗方案在严重脓毒症中具有明显的治疗优势,分析其原因,可能在给予乌司他丁后,能够在一定程度上弥补高容量血液滤过,同时清除抗炎介质而导致机体抗菌能力及免疫能力的不足,从而提高治疗疗效。
近年来,凝血功能紊乱逐渐被证实为脓毒症的关键因素,在脓毒症发生、发展过程中贯穿始末[16]。研究显示,发生脓毒血症时,凝血系统的活化还会促进炎症反应的进一步加重[17]。因此,改善凝血功能紊乱是脓毒血症治疗的关键环节。本研究中,尽管高容量血液滤过也可以在一定程度上改善患者凝血功能,但使辅以乌司他丁可使凝血功能改善程度显著提高,这可能是其提高严重脓毒血症疗效的重要作用机制之一。ICAM-1主要介导细胞间稳固黏附,参与机体免疫应答和调节,当受到炎症因子刺激后会显著升高,并聚集中性粒细胞造成多器官损伤[18]。而关于如何降低脓毒症患者ICAM-1水平以减轻病情尚未见报道,本研究中,乌司他丁辅助治疗可使ICAM-1分子水平显著降低,这可能是观察组MODS发生率显著降低的重要原因。ChE是肝脏产生的一种糖蛋白,是肝脏功能的重要指标。研究显示,其水平越高,脓毒症病情越严重,预后越差[19]。本研究中首次发现,乌司他丁辅助高容量血液滤过治疗可以显著提高患者chE水平,与患者预后较好密切相关。
综上所述,乌司他丁辅助高容量血液滤过能够明显改善患者凝血功能,降低患者ICAM-1,提高chE水平,从而提高严重脓毒血症临床治疗效果,值得进一步研究。
参考文献:
[1]ODDEN A J,GOVINDAN S,SHETH J,et al. A systematic assessment of the surviving sepsis campaign's evidence supporting the care of patients with severe sepsis on the wards[J]. Ann Am Thorac Soc,2015,12(6): 956-958.
[2]卢中秋,卢才教,洪广亮,等. 34例创伤弧菌脓毒症患者的流行病学特点及临床诊治[J].中华急诊医学杂志,2009,18(7): 732-736.
[3]田虹,王洪霞.老年脓毒症患者凝血功能紊乱及与预后的关系[J].中国急救医学,2014(11): 966-969.
[4]苏伟,杨智,王思荣,等.血必净注射液对重症脓毒症患者机体炎性反应和细胞免疫功能的影响[J].中国医师进修杂志,2012,35(1): 29-32.
[5]罗琼湘,廖晓星,黄松彬,等.持续高容量血液滤过在严重脓毒症患者中的临床应用[J].中国急救医学,2013,33(11): 966-968.
[6]赵梦雅,李昂,张淑文,等.参麦注射液及乌司他丁对重症脓毒症患者微循环的影响[J].首都医科大学学报,2012,33(3): 297-300.
[7]BONE R C,BALK R A,CERRA F B,et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM consensus conference committee. american college of chest physicians/society of critical care medicine[J]. Chest,1992,101(6): 1644-1655.
[8]KNAUS W A,DRAPER E A,WAGNER D P,et al. APACHE Ⅱ: a severity of disease classification system[J]. Crit Care Med,1985,3(10): 818-829.
[9]MARSHALL J C,COOK D J,CHRISTOU N V,et al. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome[J]. Crit Care Med,1995,23(10): 1638-1652.
[10]叶宁,骆雪萍.动态监测序贯器官衰竭估计评分在危重病患者预后评估中的应用价值[J].中国全科医学,2012,15(26):3071-3073.
[11]陈勉,胡志华,陈伟,等.持续血液净化疗法治疗外伤继发性脓毒症临床效果及对高迁移率族蛋白1、肿瘤坏死因子-α和促血管生成素2的影响[J].中国现代医学杂志,2014,24(34): 61-64.
[12]DELLINGER R P,LEVY M M,RHODES A,et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med,2013,41(2): 580-637.
[13]孙冰峰,付强,唐元明,等.高容量血液滤过治疗严重脓毒血症及脓毒性休克的疗效[J].实用临床医学,2014(5): 1-4.
[14]RONCO C,TETTA C,MARIANO F,et al. Interpreting the mechanisms of continuous renal replacement therapy in sepsis: the peak concentration hypothesis[J]. Artif Organs,2003,27(9): 792-801.
[15]周昌娥,方志成.血必净联合乌司他丁治疗脓毒血症临床研究[J].临床肺科杂志,2013,18(4): 647-648.
[16]杨德淑,杨平,张艳,等.不同抗凝方案在严重脓毒血症血小板减少患者CRRT中的应用[J].重庆医学,2014,28: 3724-3726.
[17]王思荣,苏伟,黄昭,等.连续性肾脏替代治疗对重症脓毒症患者凝血系统的影响[J].广东医学,2008,29(2): 294-296.
[18]金娴,梁永杰. 120例危重病患者高密度脂蛋白及炎症因子的监测分析[J].中国急救医学,2014,34(7): 5-11.
[19]林化,马春林,王荣辉,等.脓毒症患者血清胆碱酯酶和碱性磷酸酶及前清蛋白的变化及其临床意义[J].中国全科医学,2013,16(9): 1023-1025.
(童颖丹编辑)
Effect of Ulinastatin adjuvant to high-volume hemofiltration on serum levels of ICAM-1,cholinesterase and coagulation function in patients with severe sepsis
Wei Chen,Zhi-hua Hu,Yuan-zhen Yang
(Department of Intensive Medicine,the Affiliated Hospital of Hainan Medical University,Haikou,Hainan 570102,China)
Abstract:Objective To study clinical efficacy of Ulinastatin adjuvant to high-volume hemofiltration in treating severe sepsis and its effects on serum levels of intercellular adhesion molecule -1(ICAM -1),cholinesterase and coagulation function. Methods A total of 106 patients of severe sepsis in our hospital from January 2012 to December 2014 were collected as research objects and their clinical materials were retrospectively analyzed. According to therapeutic schemes,these patients were divided into control group(n=47)and observation group(n=59). Besides conventional treatments,the control group was treated with highvolume hemofiltration,while the observation group was treated with high-volume hemofiltration and Ulinastatin. Then,the scores of Acute Physiology and Chronic Health Evaluation Scoring System(APACHEⅡ),Sequential Organ Failure Assessment(SOFA)and Marshall,incidence of disseminated intravascular coagulation(DIC)and multiple organ dysfunction syndrome(MODS)and mortality,the coagulation function and serum levels ofICAM-1 and cholinesterase were compared between the two groups. Results After treatment for 7 days,the scores of APACHEⅡ,SOFA and Marshall were significantly lower in the observation group than those in the control group(P<0.05). After treatment for 28 days,the incidence of DIC and MODS was 3.4%and 8.5%respectively in the observation group,which were significantly lower than those(17.0%and 23.4%respectively)in the control group(P<0.05). The mortality of the observation group and the control group were 15.3%and 29.8%respectively,with no statistical difference(P>0.05). After treatment,the prothrombin time and activated partial prothrombin time shortened,and the levels of fibrinogen and platelets increased in the observation group in comparison with the control group(P<0.05). As to inflammatory factors,the level of ICAM-1 statistically decreased and cholinesterase increased in the observation group(P<0.05). Conclusions Ulinastatin adjuvant to high-volume hemofiltration is effective in treating severe sepsis. It can significantly decrease ICAM-1 level,increase cholinesterase level and improve coagulation function,which is worthy of further study in future.
Keywords:Ulinastatin;high-volume hemofiltration;severe sepsis;coagulation function;intercellular adhesion molecule-1;cholinesterase
中图分类号:R631.2
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.11.011
文章编号:1005-8982(2016)011-0054-05
收稿日期:2015-12-25

