胃癌患者术前血液中钾、钠、氯、镁、磷的相关性及其对生存预后的影响*
李旭哲,刘斌正,马雅静,张文杰
(1.石河子大学医学院病理系,新疆石河子832000;2.石河子大学第一附属医院检验科,新疆石河子832002)
胃癌患者术前血液中钾、钠、氯、镁、磷的相关性及其对生存预后的影响*
李旭哲1,刘斌正1,马雅静2,张文杰1
(1.石河子大学医学院病理系,新疆石河子832000;2.石河子大学第一附属医院检验科,新疆石河子832002)
摘要:目的探讨胃癌(GC)患者术前血液电解质离子钾、钠、氯、镁、磷的相关性,以及与患者临床资料的相关性和对生存预后的影响。方法收集该院320例大样本GC手术患者的临床资料,术前检测血液电解质水平,以及进行术后随访(最长随访时间为10年7个月)。统计学分析GC患者术前血液电解质水平的相关性、与侵袭转移的关系以及对患者生存预后的影响。结果①电解质离子与GC患者临床资料间的相关性:钾离子水平与癌细胞分化程度相关(P=0.022),氯离子水平与年龄相关(P=0.042)。②GC患者电解质离子水平之间存在相关性:如氯离子与钠离子相关(r=0.610,P=0.000),氯离子与钾离子相关(r=0.206,P=0.000),氯离子与镁离子相关(r=0.115,P=0.047)。③GC患者电解质水平对生存预后的影响:按正常范围分组,钾离子水平在3.5~5.3mmol/L时患者生存预后最好,>5.3 mmol/L时预后最差(P=0.005);按中位数分组,磷离子水平≥1.04 mmol/L组预后明显好于≤1.04 mmol/L组(P=0.008)。结论钾离子水平与GC细胞分化程度相关,并影响患者生存预后。磷离子水平高低也影响患者生存预后。结合临床和影像诊断,GC患者术前检测血液电解质水平作为潜在的预警信号,可以对生存预后进行评估,将有助于制定最佳手术方案、术后放射和化学药物治疗策略,从而尽可能地提高治疗质量及延长生存时间。
关键词:胃癌;血液电解质离子;生存预后;生存预警;相关性分析
胃癌(gastric cancer,GC)是临床上最常见的消化道恶性肿瘤之一。全球癌症状况数据统计(Global Cancer Statistics,GLOBOCAN)2012[1]数据显示,胃癌的发病率在常见恶性肿瘤中位列第三,死亡率位列第四。近年来,胃癌有年轻化趋势。中国胃癌发病人数约占世界胃癌总人数的42.5%(40.5万人),2005~2009年中国胃癌的年龄标化5年净生存率为31.3%,远远低于南韩(58.0%)和日本(54.0%),甚至低于非洲岛国毛里求斯(41.0%)[2],说明我国胃癌的诊断和治疗质量严重偏低。造成这种极低生存率的可能原因包括:术前未能制定最佳个体化手术方案、合理的放射和化学药物治疗(以下简称放化疗)策略,以及缺乏对患者手术风险及术后生存风险进行预警评估的指标。我国人口众多,在国家医疗投入和个体医疗保险不足的当下,很难开展大规模胃癌筛查。而非经筛查,胃癌的早诊困难,晚期治疗效果不佳,因而患者的生存预后差,严重影响个体生活质量和劳动力质量。因此,寻找一种廉价、省时、省力,能够在术前预警胃癌患者生存预后的常规检测指标具有重要的临床意义。
钾(K+)、钠(Na+)、氯(Cl-)、镁(Mg2+)、磷(P2+)是机体内主要的无机离子,在正常以及病理状态下发挥重要的生理、生化功能,是临床上胃癌患者入院时的常规检查指标。钾、钠、氯的主要功能是维持体液渗透压平衡,镁离子是酶的激活剂,而磷离子主要形成磷灰石是骨组织成份。另外,这些离子在维持内环境电荷平衡、调节酸碱平衡及神经肌肉应激性、参与细胞间信息传递等方面具有重要作用。因此,临床上常常通过检测血清离子浓度来判机体健康状况。细胞微环境的改变在癌症的发生、发展中具有重要作用。这种微环境的改变除有信号传导分子和炎症细胞因子参与外,也包括一些电解质离子浓度的异常改变。本研究探讨胃癌患者术前电解质离子钾、钠、氯、镁和磷的变化,以及这些变化与临床病理特征和生存预后的相关性,旨在发现其在胃癌早期辅助诊断以及生存预警中的潜在作用。
1 资料与方法
1.1 临床资料
选取2004年1月-2013年6月新疆石河子大学附属第一医院病理科确诊的胃癌患者514例,并对该人群进行随访。截止2014年10月,共随访到320例患者;最长随访时间为127个月(10年7个月),中位生存时间30个月。其中,154例存活,166例死亡;男性237例,女性83例;年龄27~86岁,平均60岁,中位年龄64岁。胃癌组织分期参照美国癌症联合委员会(Amercian Joint Committee on Cancer,AJCC)2010年修订第七版的TNM分期标准,浸润深度T1+T2100例,T3+T4220例;有淋巴结转移者186例,无淋巴结转移者134例;有远处转移30例;无远处转移290例;高分化14例,中分化94例,低分化212例:TNM分期Ⅰ+Ⅱ期182例,Ⅲ+Ⅳ期138例。
1.2 离子浓度测定方法及临床参考值
收集住院胃癌患者空腹12 h后静脉血3 ml,加入0.2 ml肝素抗凝,离心分离血清。K+、Na+、Cl-浓度的检测采用选择性电极(直接法),Mg2+浓度的检测采用Calmagite比色法,P2+浓度测定用钼酸紫外线终点法。根据第三版《全国临床检验操作规程》标准[3],电解质K+、Na+、Cl-、Mg2+、P2+的临床参考值分别为K+3.5~5.3 mmol/L,Na+137~147 mmol/L,Cl-99~110 mmol/L,Mg2+0.61~1.10 mmol/L,P2+0.85~1.60 mmol/L。
1.3 统计学方法
采用SPSS 17.0统计软件进行数据分析。胃癌患者术前电解质离子K+、Na+、Cl-、Mg2+、P2+水平与临床特征间的相关性用非参数检验;相关性用Spearman等级相关分析;按照正常参考范围将胃癌患者电解质指标分成低于正常范围水平组,正常范围水平组和高于正常范围水平组并用Kaplan-Meier生存分析。中位数分组方法将各指标按中位数为节点分为高组和低组,分析与生存预后的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 电解质离子与胃癌患者临床资料的相关性
分别分析K+、Na+、Cl-、Mg2+、P2+与年龄、性别、浸润深度、淋巴结转移、远处转移、分化程度及TNM分期的相关性。K+水平在不同分化程度比较差异有统计学意义(P=0.022),Cl-水平在以60岁为节点的年龄分组中比较,差异有统计学意义(P=0.042)。见表1。
表1 临床资料与电解质离子的相关性(mmol/L,±s)

表1 临床资料与电解质离子的相关性(mmol/L,±s)
变量 钾 钠 氯 镁 磷年龄<60岁(n=120) 4.05±0.49 139.4±13.7 100.7±9.3 0.84±0.01 1.10±0.25 ≥60岁(n=200) 4.05±0.60 141.5±4.6 102.4±3.8 0.86±0.14 1.12±1.37 P值 0.391 0.058 0.042 0.360 0.873性别男(n=237) 4.10±0.49 140.6±4.0 101.9±4.0 0.86±0.13 1.10±1.30女(n=83) 4.05±0.49 141.3±5.0 102.1±4.1 0.84±0.12 1.16±0.50 P值 0.471 0.262 0.650 0.443 0.711浸润深度T1+T2(n=100) 4.10±0.54 141.2±4.4 102.3±4.0 0.86±0.15 1.04±0.26 T3+T4(n=220) 4.08±0.51 141.2±5.0 102.0±4.1 0.85±0.11 1.15±1.34 P值 0.724 0.992 0.593 0.821 0.422淋巴结转移无(n=134) 4.10±0.49 140.8±4.7 102.0±4.6 0.85±0.10 1.08±0.45有(n=186) 4.08±0.54 141.5±4.9 102.1±3.7 0.85±0.14 1.03±0.28 P值 0.774 0.233 0.823 0.820 0.191远处转移无(n=290) 4.10±0.51 141.2±4.9 101.8±7.4 0.85±0.12 1.12±1.15有(n=30) 3.96±0.61 141.0±3.2 101.7±2.8 0.85±0.12 1.06±0.34 P值 0.191 0.894 0.982 0.804 0.803分化程度高+中(n=108) 4.18±0.50 141.6±3.3 102.5±3.9 0.86±0.10 1.11±0.47低(n=212) 4.03±0.50 140.9±5.3 101.4±8.2 0.85±0.13 1.11±1.30 P值 0.022 0.261 0.174 0.482 0.984 TNM分期Ⅰ+Ⅱ(n=182) 4.66±7.40 141.0±4.4 101.5±8.9 0.86±0.10 1.17±1.45 Ⅲ+Ⅳ(n=138) 4.07±0.54 141.3±5.3 102.0±3.7 0.84±0.15 1.03±0.28 P值 0.371 0.640 0.544 0.353 0.283
2.2 胃癌患者各电解质离子水平的相关性
5种离子交叉比较两两间的相关性,结果显示,氯离子和钠离子、氯离子和钾离子、氯离子和镁离子、钠离子和镁离子、镁离子和磷离子、钾离子和磷离子相关(r=0.610、0.206、0.115、0.179、0.128和0.174,P=0.000、0.000、0.047、0.002、0.026和0.002)。
2.3 胃癌患者电解质水平对生存预后的影响
5种离子采用正常范围分组和中位数分组两种不同方法,探讨其与生存预后的相关性。按照正常范围分组,仅有K+水平与胃癌患者生存预后相关;3.5~5.3 mmol/L组钾离子生存预后最好,差异有统计学意义(P=0.005);按照中位数分组,仅有P2+水平与胃癌患者生存预后相关;P2+≥1.04 mmol/L时生存预后好于≤1.04 mmol/L组,差异有统计学意义(P=0.008)。钠、镁和磷正常范围分组和中位数分组与生存预后无关。见附图和表2。

A:K+水平正常范围分组;B:K+水平中位数分组;C:P2+正常范围分组;D:P2+水平中位数分组;E:Na+水平正常范围分组;F:Na+水平中位数分组附图 钾、磷、钠与胃癌患者生存预后的生存曲线
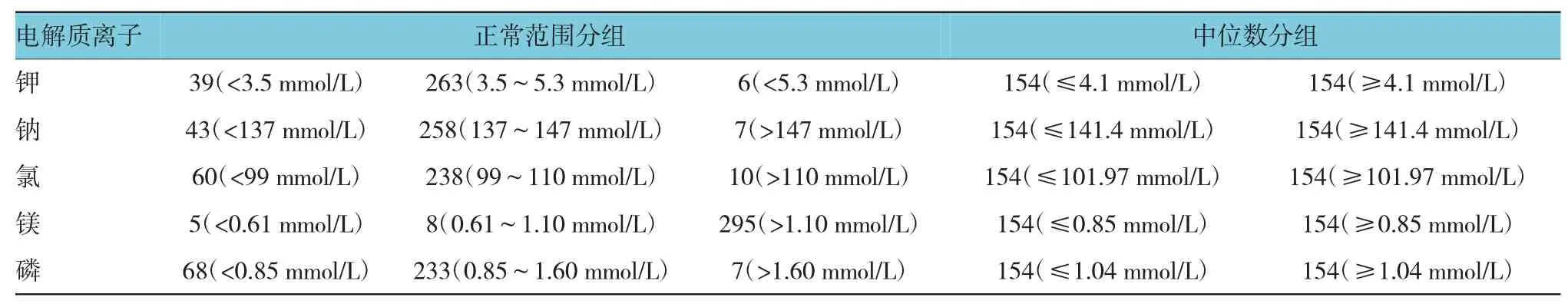
表2 电解质离子的两种分组方法及例数(n=308)
3 讨论
胃癌是严重危害人类生命健康的一类重大疾病,除给机体造成组织、器官损害外,还可导致机体内环境及组织细胞微环境的稳态失调,离子平衡发生紊乱。胃癌患者术后生存时间的长短是评价诊断和治疗(包括手术及放化疗)效果的重要且客观的指标。与胃癌预后相关的因素已有诸多报道,其中肿瘤浸润深度、淋巴结转移、远处转移和临床分期是预测胃癌患者生存的公认指标。然而,上述指标只有在胃癌术后才能获得,医生无法在术前对患者术后生存进行评估。由于胃癌手术治疗方案复杂,从治愈性手术到非治愈性手术再到保守性手术都因人而异[4],而在手术中临时决定方案往往会误判。虽然有一些与胃癌生存预后有关的分子标记物,但多需要进行专业检测[5-7],因而费时、费力、费钱。所以,如何在术前对患者进行评估,并制定最佳个体化手术方案、术后放化疗策略及适当的随访间隔时间就显得非常重要。
电解质离子是住院患者的常规检查项目,对很多疾病有重要的诊断提示作用。杨胜萍等[8]在七种恶性肿瘤血清离子检测水平分析中报道,与正常值比较,胃癌血清氯离子水平升高,钙离子水平降低。王英[9]和郭林等[10]报道恶性肿瘤患者血清钙离子水平明显低于正常人群,并提出适量补充钙和维生素D对肿瘤的预后和健康人群肿瘤的预防可能有积极作用。同时郭林等[10]还分析血磷的水平,认为血磷水平与对照组比较差异无统计学意义,低血钙的患者血磷水平可以升高,也可以下降,大多表现为正常,恶性肿瘤对血磷水平影响不大[11-12]。李琼等[13]在微量元素与恶性肿瘤关系的探讨中报道,血清钙离子、镁离子与正常对照组比较,差异无统计学意义。魏树等[14]则报道,恶性肿瘤转移到骨,由于溶骨作用可引起高钙血症,并建议用降钙素进行治疗。以上文献对电解质离子与肿瘤的相关性结论不一致,提示恶性肿瘤电解质离子代谢紊乱的复杂性,可能与恶性肿瘤所处不同时期有关。临床上关于电解质离子的研究更多的是手术前后患者离子水平的比较对疾病后期的影响与评估[15],而对生存预后的研究却很少。
本实验研究胃癌患者主要血清电解质钾、钠、氯、镁和磷离子水平与生存预后的相关性。结果表明,钾离子和磷离子影响胃癌患者的预后,正常范围水平的钾离子患者预后最好,高水平组预后最差;磷离子高水平组预后好于低水平组。在离子间的相关性结果中,钾离子与磷离子水平相关,提示相对于钠、氯等其他离子,钾和磷在胃癌中可能扮演更重要的角色。钾离子和钠离子是细胞外液主要的阳离子,钠离子主要作用是维持细胞外液晶体渗透压平衡,其浓度的稳定受神经体液和内分泌的的调节,靶器官主要是肾脏。有研究提到恶性肿瘤水钠潴留与抗利尿激素(antidiuretic hormone,ADH)异位分泌有关,放化疗引起消化道反应从而导致低钠血症,低钠是恶性肿瘤晚期最常见的离子紊乱[16]。本研究中血清钠离子水平对胃癌生存预后无明显影响,说明大部分胃癌患者血清钠离子水平与正常值范围水平相当,钠离子水平的变化对生存预后无明显影响。其他离子水平改变,可能是患者饮食量减少、消化道吸收障碍及肾脏排出增多等原因引起;氯离子与钠离子水平相互偶联,所以与钠离子水平趋势一致;钾离子和磷离子在胃癌患者中水平的改变可能更加敏感,钾是维持细胞膜静息电位的物质基础,与钠离子相似。钾参与多种新陈代谢过程,与糖原和蛋白质合成密切相关。胃癌是消化道的严重疾病,手术前后钾离子水平的差异影响术后患者的恢复,进而可能对生存预后产生一定的影响。有报道提出,食管贲门癌术后血钾并非升高,而是呈减低趋势[17]。所以这也许对胃癌中钾离子水平高的患者预后好于水平低者有提示作用。磷的代谢与钙离子密切相关,钙离子在肿瘤的研究中说法不一,但多数认为补钙有益于疾病的恢复。胃癌中钙离子的研究较少,未见有钙磷相关性与胃癌生存预后的报道,其原因可能需要结合离子机制的研究加以解释。因为胃癌发现多为中、晚期,该期患者大多机体代谢消耗大于合成,容易产生恶液质,且术前体重越低生存预后越差[18]。
综上所述,本实验在胃癌患者对电解质离子与癌浸润深度和/或癌远处转移、以及生存预后的相关性进行尝试性研究。尽管观察到的这些重要临床现象尚需进一步验证,但并不影响进行深入研究,如扩大胃癌患者样本量、延长随访时间进行观察等。由于胃癌手术方案及术后放化疗策略的选择复杂多样,而正确的策略决定治疗的质量。因此笔者建议,临床上应该充分利用术前容易获得的电解质离子指标,结合临床及影像诊断,在术前对具体胃癌患者进行手术利弊、成功概率及生存预后的评估,为制定最佳个体化医疗方案,如手术方案[4]、术后放化疗策略,以及随访周期提供指导依据,尽可能地提高手术和放化疗质量,改善患者术后生活质量,延长生存时间。
参考文献:
[1]FERLAY J,SOERJOMATARAM I,ERVIK M,et al. GLOBOCAN 2012 v1.0,cancer incidence and mortality worldwide: IARC cancer base No. 11[OL]. http: //globocan.iarc.fr.
[2]ALLEMANI C,WEIR H K,CARREIRA H,et al. Global surveillance of cancer survival 1995~2009: analysis of individ-ual data for 25676887 patients from 279 population-based reg istries in 67 countries(CONORD-2)[J]. Lancet,2015,385(9972): 977-1010.
[3]中华人民共和国卫生部医政司.全国临床检验操作规程[S].第3版.江苏:东南大学出版社,2006: 1-1017.
[4]Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010(ver.3)[J]. Gastric Cancer,2011,14: 113-123.
[5]KIM J P,LEE J H,KIM S J,et al. Clinicopathologic characteristics and prognostic factors in 10783 patients with gastric cancer[J]. Gastric Cancer,1998,1(2): 125-133.
[6]SIEWERT J R,BÖTTCHER K,STEIN H J,et al. Relevant prognostic factors in gastric cancer: ten-year results of the german gastric cancer study[J]. Ann Surg,1998,228(4): 449-461.
[7]YASUI W,OUE N,AUNG P P,et al. Molecular-pathological prognostic factors of gastric cancer: a review[J]. Gastric Cancer,2005,8(2): 86-94.
[8]杨胜萍,张青云.七种恶性肿瘤血清离子检测水平分析[J].中国现代医学杂志,2014,24(1): 9-12.
[9]王英,朱波,黄玲莎.广西地区273例恶性肿瘤患者血清微量元素检测结果分析[J].广东微量元素科学,2004,11(2): 27-28.
[10]郭林,高翔.癌症患者血清钙的测定及其临床意义[J].中国癌症杂志,1999,3(1): 45-46.
[11]LIPKIN M,NEWMARK H. Effect of added dietary calcium on colonic epithelial-cell proliferation in subjects at high risk for familial colonic cancer[J]. N Eng J Med,1985,313(22): 1381-1384.
[12]林清.维生素D和钙离子水平在胃癌患者中的临床意义[D].济南:山东大学,2010.
[13]李琼,张卫华.微量元素与恶性肿瘤关系的探讨[J].实用预防医学,2005,12(5): 1134.
[14]魏树均.恶性肿瘤与钙代谢[J].北京医学,1982,4(1): 48.
[15]马洪强.胆道术后体液中钾、钠、氯、钙、磷、镁的分布观察[J].安徽医科大学学报,1991,26(2): 109-111.
[16]张印发,孙兰国,于印春,等.食管贲门癌围手术期钾代谢的临床研究[J]. 2000,12(22): 896.
[17]RAGHUNAND N,HE X,VAN SLUIS R,et al. Enhancement of chemotherapy by manipulation of tumor PH[J]. Br J Cancer,1999,80(7): 1005-1011.
[18]崔景利,梁寒,邓靖宇,等.胃癌患者术前体重减轻对预后影响的临床研究[J].中华外科杂志,2014,52(6): 409-414.
(童颖丹编辑)
Correlations among preoperative blood electrolytes and their influences on survival prognosis of gastric cancer patients*
Xu-zhe Li1,Bin-zheng Liu1,Ya-jing Ma2,Wen-jie Zhang1
(1. Department of Pathology,School of Medicine,Shihezi University,Shihezi,Xinjiang 832000,China;2. Department of Clinical Laboratory,the First Affiliated Hospital of Shihezi University,Shihezi,Xinjiang 832002,China)
Abstract:Objective To investigate the correlations among preoperative electrolytes K+,Na+,Cl-,Mg2+,P2+,their relationships with clinical data,and their effects on survival prognosis in patients with gastric cancer (GC). Methods The complete clinical and follow-up(up to 127 months)information of 320 GC patients were collected from our Department of Pathology registered from January 2004 to June 2013. Blood electrolytes were tested before surgery and statistically analyzed. Results There were correlations between electrolytes and clinical data in the GC patients. The level of K+was correlated with cell differentiation(P=0.022). The level of Cl-in the GC patients was correlated with age(P=0.042). There were correlations between Cl-and Na+(r=0.610,P=0.000),Cl-and K+(r=0.206,P=0.000),Cl-and Mg2+(r=0.115,P=0.047). Patients'survival prognosis was impacted by K+based on reference range grouping and the patients with 3.5-5.3 mmol/L K+had the best prognosis(P=0.005). The patients with P2+≥1.04 mmol/L had better prognosis than those with P2+≤1.04 mmol/L(P=0.008)based on median grouping. Conclusions Blood level of K+is correlated with cell differentiation and can influence the survival prognosis of GC patients. The level of P2+also has an impact on the survival prognosis of GC patients. We propose that,combined with clinical and imaging diagnoses,utilizing electrolyte levels to preoperatively assess survival prognosis may help to select the best personalized strategies for surgery,chemotherapy,radiotherapy and follow-up intervals. These personalized strategies may help to achieve quality treatments,therefore improve quality of life and prolong survival of GC patients.
Keywords:gastric cancer;electrolyte ion;survival prognosis;survival warning;correlation analysis
中图分类号:R735.2
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.11.007
文章编号:1005-8982(2016)011-0034-06
收稿日期:2015-12-16
*基金项目:国家科技部科技支撑计划项目(No:2009BAI82B02);新疆自治区研究生科研创新计划项目(No:XJGRI2015056)
[通信作者]张文杰,E-mail:zhangwj82@yahoo.com

