提高番茄品质的番茄去泛素化酶基因AMSH3
刘艳红,李光伟,刘永胜
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
提高番茄品质的番茄去泛素化酶基因AMSH3
刘艳红,李光伟,刘永胜
(合肥工业大学 生物与食品工程学院,安徽 合肥230009)
摘要:AMSH3酶是去泛素化酶中MPN(+)/JAMM 蛋白酶家族的一员,能结合泛素化蛋白上的泛素分子。文章在番茄中发现了一去泛素化酶基因SlAMSH3,与拟南芥去泛素化酶基因AtAMSH3在核酸水平和蛋白水平分别有81%和71%的相似性。拟南芥中去泛素化酶AtAMSH3会影响植物液泡的形成和液泡蛋白的运输途径。文章构建了SlAMSH3果实特异表达的过表达载体,并通过根瘤农杆菌介导转化到野生型番茄中,通过筛选获得SlAMSH3在果实中高表达阳性株系,实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)分析显示,转基因番茄果实中SlAMSH3的表达量明显高于野生型果实(p<0.05)。文章测定了阳性番茄株系绿熟期果实叶绿素质量浓度及红熟期果实的单果质量、果实糖度、果实硬度、番茄红素质量浓度和β-胡萝卜素质量浓度。结果表明,转基因番茄果实的叶绿素总质量浓度、番茄红素和β-胡萝卜素比野生型分别提高178.61%、40.53%和74.86%,其他指标无显著差异。因此,SlAMSH3果实特异过表达的方法能够改良番茄果实品质,为基因工程方法改良番茄果实品质做出了新尝试。
关键词:AMSH3基因;果实特异过表达;遗传转化;转基因番茄;果实品质改良
0引言
植物生长发育的各个阶段,包括胚胎发生、种子萌发、营养生长、果实成熟和叶片衰老等都受到多种激素信号的控制[1]。虽然植物激素的分子结构比较简单,但具有十分复杂的生理效应[2]。大量研究表明,泛素蛋白酶体途径(ubiquitin-proteasome pathway,UPP)在植物生长发育,包括激素合成、感知和下游信号传导、自交不亲和、抗病、表观遗传及植物形态建成等过程都发挥着重要作用[3]。该途径也是一个被严格调控的可逆过程,其中去泛素化酶的调节是一个重要的环节。
目前研究证实,细胞内广泛存在许多去泛素化酶(deubiquitinating enzymes,DUBs),主要分为以泛素羧基末端水解酶家族和泛素特异性加工酶家族为主的5种类型,分别为泛素羧基末端水解酶家族(ubiquitin C2 terminal hydrolases,UCHs)、泛素特异性加工酶家族(ubiquitin-specific processing enzymes,UBPs或ubiquitin- specific proteases,USPs)、卵巢肿瘤(OTU)相关蛋白酶、Ataxin-3、MPN(+)/JAMM 蛋白酶[4]。这些不同类型的去泛素化酶均能水解底物蛋白上的泛素链之间的链接,起到去泛素化的作用,对蛋白降解进行反向调节,从而影响蛋白质的功能。去泛素化酶是一类数量很大的蛋白酶家族,去泛素化酶识别泛素、底物或者蛋白酶体的特异性序列[5],主要是作用于泛素-蛋白酶体系统中已泛素化的蛋白底物,通过水解泛素羧基末端的酯键、肽键或异肽键,将泛素分子特异性从连接有泛素的蛋白或者前体蛋白上脱离出来,重新进入细胞内蛋白调节的循环中[6]。
AMSH3酶是去泛素化酶中MPN(+)/JAMM 蛋白酶家族的一员,是一类能结合泛素化蛋白上泛素分子的金属蛋白酶,具有MPN序列,或称JAMM(Jab1/MPN domain associated metalloisopeptidase)序列。这一序列含有较为保守的2个组氨酸残基和1个天冬氨酸残基,它们与二价锌离子共同构成催化中心[7]。泛素和去泛素不仅对各种细胞的生理过程有重要的影响,也对细胞器的形成发挥着重要作用。在拟南芥中,AtAMSH3酶不仅能够水解植物体外和积累在体内的K48-和K63-链接的2种泛素链,而且是苯乙烯基染料FM64和生长素调节因子PIN2进行高效细胞内吞作用所必须的。而AMSH3突变体植株不仅不能形成中央裂解大液泡和积累吞噬体,还会将液泡蛋白错误地运输到细胞间隙中[8]。
成熟的番茄果实是人类摄取天然类胡萝卜素和番茄红素的主要来源,研究人员为了提高番茄果实品质,通过基因工程技术进行了广泛尝试,研究发现使用果实特异性表达启动子TMF7比使用CaMV35S等组成型启动子效果好很多[9-10]。
一方面,使用CaMV35S等组成型启动子增加或降低某一关键基因的表达会引起许多负面效应;另一方面,TMF7启动子由于可以控制外源基因在果实中高效表达,避免了外源基因在植物的其他组织器官中的积累,减少了对植物的不利影响[9-10]。因此通过组织、器官特异性启动子实现对基因表达的精确调控,成为提高外源基因表达效率的有益实验而得到广泛应用[11]。
本文通过生物信息比对,在番茄中发现了与拟南芥AtAMSH3同源性较高的SlAMSH3,克隆了番茄SlAMSH3基因,利用植物过表达载体pBI121-TMF7,在番茄植株中过表达SlAMSH3基因,采用农杆菌介导法对野生型番茄进行遗传转化,并利用转基因植株研究了SlAMSH3果实特异过表达对番茄品质的影响。
1材料与方法
番茄(Solanum lycopersicum Mill.cv.Ailsa Craig)、大肠杆菌(Escherichia coli)DH5α菌株、农杆菌(Agrobacterium tumefaciens)菌株EHA105及PBI121-35S-GFP 载体和番茄表达载体pBI121-TMF7 均为本实验室保存;Trizol购自于Invitrogen;反转录酶、Taq DNA 聚合酶、pEASY-Blunt载体、T4 DNA连接酶、限制性内切酶购自TaKaRa公司;质粒提取试剂盒、琼脂糖凝胶回收试剂盒购自TIANGEN 公司。
1.1番茄AMSH3基因的克隆
按照Sol Genomics Network中番茄SlAMSH3基因序列(登录号Solyc01g060280.2.1)设计引物AMSH3-F1、AMSH3-R1,用于构建pBI121-TMF7-SlAMSH3载体。提取野生型番茄幼苗总RNA,通过实时荧光定量聚合链式反应(polymerase chain reaction,PCR)扩增SlAMSH3基因。PCR条件为:94℃预变性5 min;94℃30 s;57℃ 30 s;72℃ 108 s,32 个循环;72℃ 10 min。将PCR 产物与pEASY-Blunt载体连接后转化大肠杆菌,对重组子进行PCR和酶切验证,阳性克隆送南京金斯瑞生物技术服务有限公司测序。
1.2AMSH3果实特异过表达载体构建
参照载体pEASY-Blunt和pBI121-TM-F7的酶切位点,采用Sequencher软件对SlAMSH3基因序列进行限制性内切酶分析,运用软件Primer Premier 5设计带酶切位点的特异引物,见表1所列。分别以测序正确后的SlAMSH3重组质粒和pBI121-TMF7载体做双酶切并胶回收目的片段和载体片段,将目的片段连接到pBI121-TMF7载体上,则构建成番茄果实特异的pBI121-TMF7-SlAMSH3植物过表达载体。将得到的连接产物转化进入大肠杆菌感受态细胞,筛选出阳性菌落,提取质粒酶切验证。

表1 本研究所用的引物
1.3番茄的遗传转化及转基因植株的鉴定
根据文献[12-13],将重组质粒pBI121-TMF7-SlAMSH3通过液氮冷击法导入农杆菌EHA105,在含有利福平和卡那霉素(50 mg/L)的培养基上28℃培养2 d,阳性菌用以转化野生型番茄。番茄种子用自来水浸泡12 h,先用75%的酒精漂洗2 min,再用15%的次氯酸钠溶液浸泡消毒15 min,用无菌水漂洗6次后播种至1/2 MS培养基。22℃,4 d左右,露白后转至光照下培养。待子叶完全舒展开时,将子叶剪下置于预培养基(MS+1 mg/L 6-BA+0.04 mg/L IAA)上培养2 d;将带有pBI121-TMF7-SlAMSH3载体的农杆菌28℃过夜培养,室温下5 000 r/min离心5 min收集菌。
用稀释后的农杆菌浸染预培养3 d的子叶10 min;吸去子叶上多余菌液后,将子叶转到共培养基(MS+1 mg/L KT+1 mg/L 2,4-D+10 mg/L ACE)上培养2 d;然后转到筛选培养基(MS+500 mg/L SB+2 mg/L 6-BA+50 mg/L KANA+0.2 mg/L IAA)上,22℃下光照培养(16 h 光照,8 h黑暗),每21 d更换1次培养基;待愈伤组织上长出的不定芽长至2 cm左右时,将芽切下转移至生根培养基(MS+500 mg/L SB+2 mg/L IAA+50 mg/L KANA)上生根;移入营养土,放于温室中栽培,提取番茄基因组DNA。以DNA为模版,pBI121-TMF7质粒为阳性对照,同时用野生型番茄DNA作为阴性对照,根据pBI121 载体筛选标记基因新霉素磷酶基因(NPTⅡ)(登录号 AF485783)序列合成引物NPTⅡ-F 和NPTⅡ-R,对转基因植株进行PCR 鉴定。PCR 反应条件:95℃预变性5 min;95℃变性30 s,64℃退火30 s,72℃延伸50 s,30个循环;最后72℃延伸5 min。
1.4实时荧光定量PCR
分别提取野生型和转基因T1代果实总RNA,反转录合成cDNA,以此为模板进行实时荧光定量PCR。SlAMSH3基因使用的引物是AMSH3DL-F、AMSH3DL-R。以番茄UBI为内参基因(登陆号X58253),其PCR扩增引物为UBIDL-F、UBIDL-R。PCR 反应条件为:95℃预变性30 s;95℃变性5 s,60℃退火20 s,40个循环;95℃15 s,60℃延伸1 min,95℃15 s。
1.5叶绿素质量浓度的测定
叶绿素质量浓度测定按照文献[14-16]介绍的方法,剪取番茄绿熟期果实果皮0.2~0.5 g,液氮充分研磨,用1 mL 80%的丙酮充分萃取,萃取液离心后用分光光度计检测,读取645 nm和663 nm下的光吸收值A645和A663。按照MacKinney常数计算叶绿素a和叶绿素b的质量浓度,其具体计算公式为:
ρ(叶绿素a)=12.7(A663)-2.69(A645),
ρ(叶绿素b)=22.9(A645)-4.48(A663)。
1.6番茄红素和β-胡萝卜素质量浓度的测定
番茄红素和β-胡萝卜素质量浓度的测定按照参考文献[17],取同一红熟期的番茄果实相同部位的果皮0.5~1.0 g,液氮充分研磨,加2 mL丙酮室温下萃取10 min。再加入2 mL的二氯甲烷震荡静置10 min,短瞬离心后,吸取带有颜色的上清低温保存(整个过程要避光)。萃取的样品使用C18色谱柱Spherisorb ODS-2 column(silica 5 mm,3.2 mm×250 mm)(Phenomenex®)进行高效液相色谱法(high performance liquid chromatography,HPLC)分析。每个萃取的样品吸取20 μL上柱,流动相的组成为乙晴、二氯甲烷、甲醇,三者的体积比为7∶2∶7,流速1 mL/min。使用二极管检测器(Waters 2996 photo diode-array detector)在260~600 nm范围内检测光的吸收峰,记录所有的峰图和特征光谱。同时,用番茄红素和β-胡萝卜素的标准样品进行HPLC分析,作为阳性对照,将其特征光谱、保留时间与待测样品进行比较,采用HITACHI软件(EZChrom Elite for Hitachi Version 3.1.5a)分析算出样品中番茄红素和β-胡萝卜素的质量浓度。
2结果与分析
2.1SlAMSH3基因扩增与测序
以番茄cDNA为模板,分别以AMSH3-F1和AMSH3-R1为引物进行PCR 扩增,产物进行电泳检测显示,扩增产物为一条特异条带,如图1所示。
由图1可知,与预期的番茄SlAMSH3基因片段大小1 740 bp一致。测序结果序列与番茄SlAMSH3基因的预测序列一致。

M—DNA marker DL2000 plus 1.目的基因
2.2表达载体鉴定
用XbaⅠ和SacⅠ进行双酶切得到与预期结果相同的SlAMSH3片段,如图2所示,证明SlAMSH3已经连接到植物表达载体pBI121上。
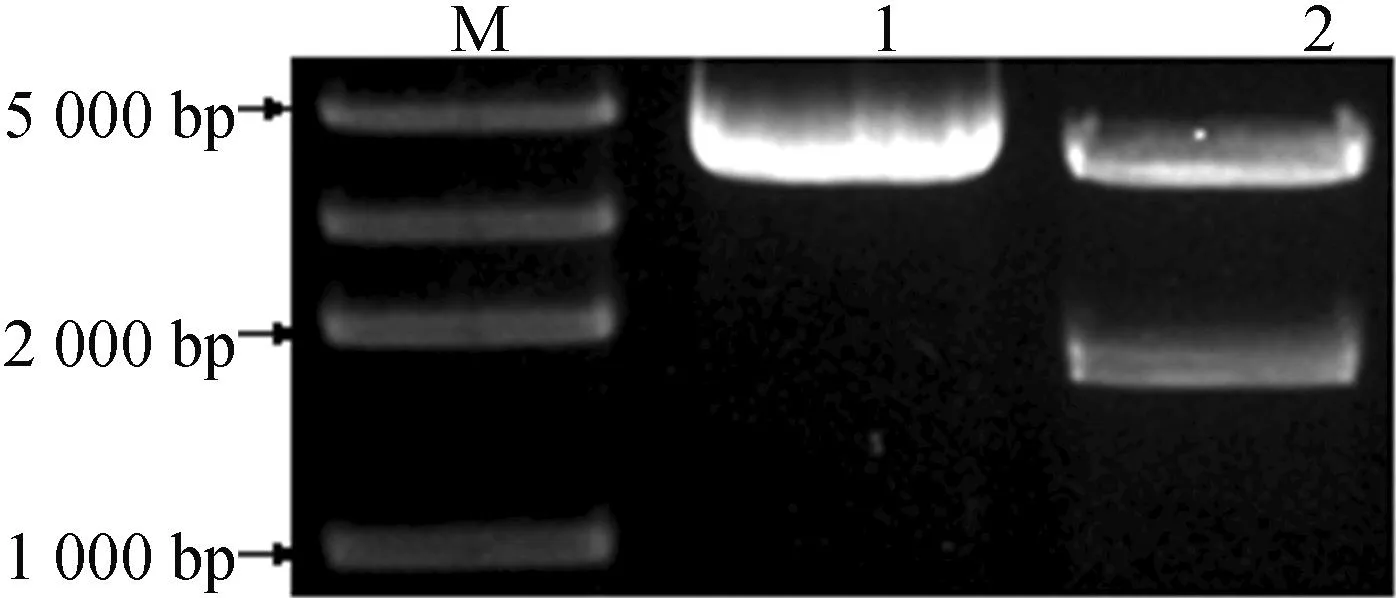
M—DNA marker DL2000 plus
2.3转基因植株的鉴定
通过植物组织培养获得转基因番茄植株,从叶片中提取转基因植株的基因组DNA,利用植物表达载体pBI121 携带的新霉素磷酸转移酶Ⅱ(NPTⅡ)基因对植株进行阳性鉴定,预期扩增片段长度为 857 bp。共得到组培苗8株,其中6株经过鉴定为转基因番茄苗。
8株的PCR鉴定结果如图3所示,图3表明,对照野生型植株未能扩增出857 bp 的条带,而抗性植株和阳性对照扩增出857 bp 的条带,说明携带NPTⅡ基因的载体片段已整合于受体植株核染色体组中。

M—DNA marker DL2000 plus
2.4转基因植株的表型
pBI121-TMF7-SlAMSH3转基因植株与野生型相比,具有明显差异。转基因植株的果实颜色在各生长发育时期均比野生型植株的果实要更深一些,更绿一些。成熟转基因植株的果实也比野生型植株的果实更红一些。
2.5SlAMSH3的表达水平
根据实时荧光定量PCR的分析结果,分析转基因植株果实中过表达基因SlAMSH3的表达水平,结果如图4所示,转基因植株SLAMSH3基因的表达水平很高。说明转入pBI121-TMF7-SlAMSH3植物过表达载体后,番茄SlAMSH3基因得到了显著过表达(p<0.05)。

图4 转基因番茄SlAMSH3表达实时荧光定量PCR分析
2.6果实叶绿素质量浓度的测定
每一植株取绿熟期番茄果实各6个,每组重复测定3次,果实叶绿素的质量浓度如图5所示。由图5可看出,转基因植株果实的总叶绿素和叶绿素a的质量浓度比野生型分别提高约178.61% 和185.51%。
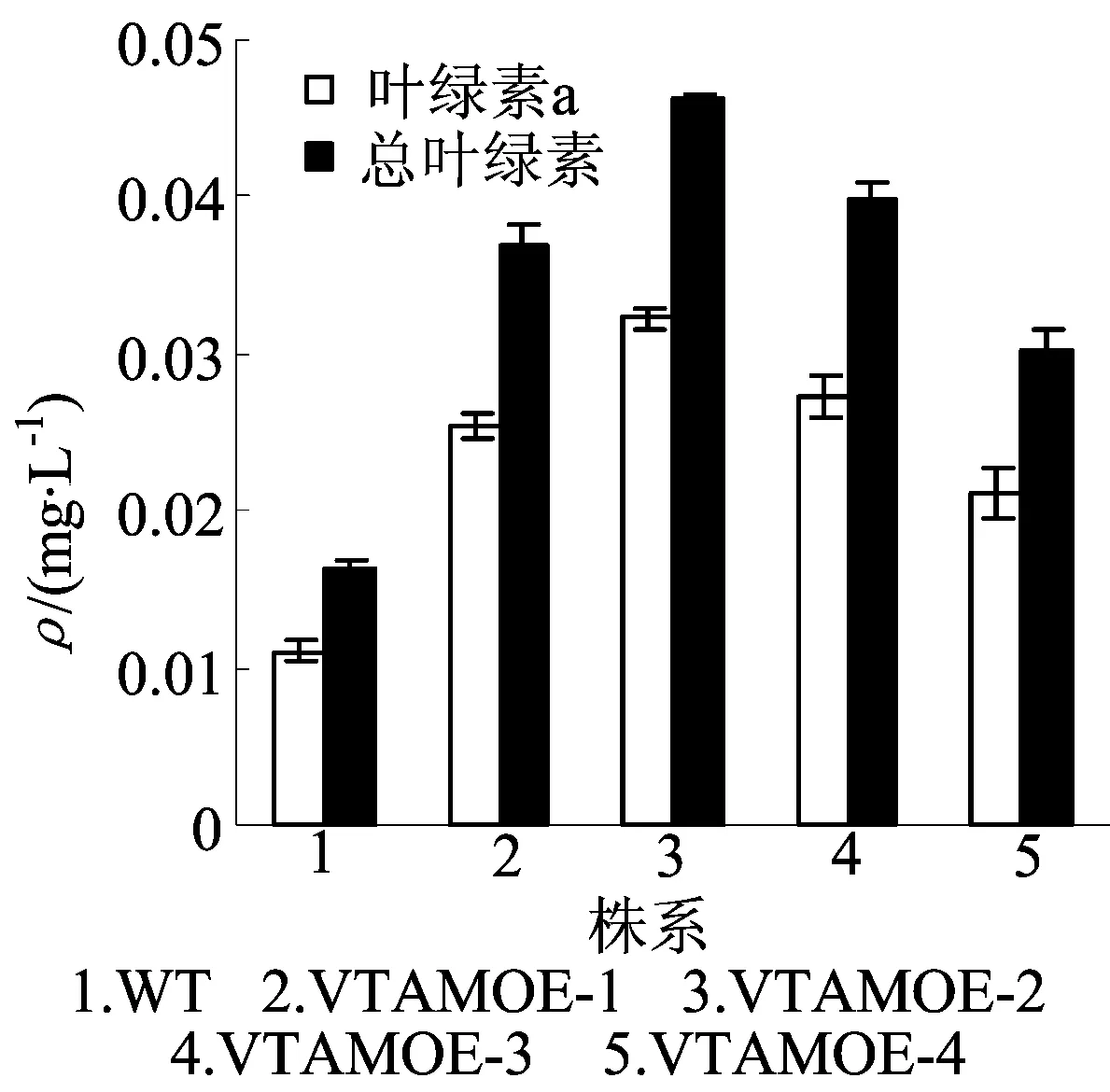
图5 野生型和转基因番茄果实叶绿素质量浓度
2.7番茄红素及β-胡萝卜素质量浓度的测定
野生型与转基因番茄果实番茄红素和β-胡萝卜素质量浓度如图6所示。
由图6可以看出,在转基因番茄果实熟果中的番茄红素和β-胡萝卜素的质量浓度均比野生型中两者的质量浓度高,分别提高约40.53%和74.86%。
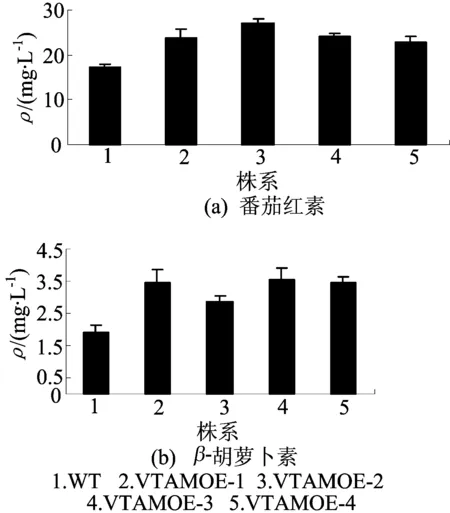
图6 番茄红素和β-胡萝卜素质量浓度分析
2.8果实糖度、直径、质量及硬度的测定
取每一植株红熟期番茄果实各15个,每组3次重复测定果实糖度、直径、单果质量及硬度,结果如图7所示。
由图7可看出,转基因番茄果实的糖度、质量、直径及硬度比野生型番茄的均有所提高,但无显著性的差异。

图7 红熟期番茄果实糖度、直径、质量及硬度的分析
3结果与讨论
研究表明,在植物体内,SlAMSH3基因影响细胞器的发育[8],本文将番茄的SlAMSH3基因通过pBI121-TMF7载体在番茄中过表达,实时荧光定量PCR检测结果显示,转基因植株中SlAMSH3基因在番茄植株得到了过表达,转基因植株表现出绿果颜色变深性状。
本实验研究表明,过表达SlAMSH3的转基因植株绿熟期果实的总叶绿素质量浓度比同期野生型果实提高约178.61%。过表达SlAMSH3的转基因植株红熟期果实的番茄红素和类胡萝卜素的质量浓度比野生型的分别提高约40.53%和74.86%。过表达SlAMSH3的转基因番茄果实的糖度、质量及硬度均比野生型番茄的有所提高,但无显著性的差异。
本文将SlAMSH3在番茄植株中过表达,并且发现SlAMSH3过表达可以提高番茄果实中的叶绿素、番茄红素、类胡萝卜素等的质量浓度,并没有对SlAMSH3的相关功能及其作用机理作出分析,后续试验将深入研究SlAMSH3在番茄中的功能作用及其可能的作用机制。
[参考文献]
[1]覃碧.泛素蛋白酶体途径及其对植物激素信号转导的调 控[J].热带农业科学,2013,33(4):39-44.
[2]宋素胜,谢道昕.泛素蛋白酶体途径及其对植物生长发育的调控[J].植物学通报,2006,65(5):324-328.
[3]Santner A,Calderon-Villalobos L I,Estelle M.Plant hormones are versatile chemical regulators of plant growth[J].Nature Chemical Biology,2009,268(5):89-92.
[4]王素霞,刘媛,吴慧娟,等.去泛素化酶的研究及其进展[J].临床与实验病理学杂志,2008,24(6):201-204.
[5]Li Y,Song P.The biochemical and biological functions of ubiquitination/deubiquitination system[J].Chemistry of Life,2006,26(6):1000-1336.
[6]Schreiner P,Chen K,Husnjak K,et al.Ubiquitin docking at the proteasome through a novel pleckstrin-homology domain interaction[J].Nature,2008,453(7194):548-552.
[8]Erika I,Anthi K,Isabel K M,et al.The deubiquitinating enzyme AMSH3 is required for intracellular trafficking and vacuole biogenesis in arabidopsis thaliana[J].Plant Cell,2010,22:1826-1837.
[9]周昂,牛向丽,刘永胜.猕猴桃AcGLK2a基因过表达载体的构建及在番茄中的遗传转化[J].合肥工业大学学报:自然科学版,2015,38(2):246-249.
[10]Liu Y,Roof S,Ye Z,et al.Manipulation of light signal transduction as a means of modifying fruit nutritional quality in tomato[J].Proc Natl Acad Sci USA,2004,101:9897-9902.
[11]Davuluri G R,Tuinen A,Fraser P D,et al.Fruit-specific RNAi-mediated suppression of DET1 enhances carotenoid and flavonoid content in tomatoes[J].Nat Biotechnol,2005,23:890-895.
[12]Gao Y F,Liu J K,Zhang Z G,et al.Functional characterization of two alternatively spliced transcripts of tomato ABSCISIC ACID INSENSITIVE3(ABI3)gene[J].Plant Mol Biol,2013,82:131-145.
[13]Tang X F,Tang Z Z,Huang S X,et al.Whole transcriptome sequencing reveals genes involved in plastid/chloroplast division and development are regulated by the HP1/DDB1 at an early stage of tomato fruit development[J].Planta,2013,238:923-936.
[14]Liu J K,Gao Y F,Niu X L,et al.Construction and transformation of co-RNAi vector of tomato HP1 and HP2 genes[J].Chin J Appl Environ Biolm,2009,15:591-595.
[15]Pemg Y S,Liu E.Studies of method on extract chlorophyll a and b[J].Journal of China Agricultural University,1992,18:247-250.
[16]Meng F J,Xu X Y,Li J F.Study on correlation of the tomato fruit’s pigment content and surface colour[J].J Northeast Agric Univ,2006,37:459-462.
[17]Wang S H,Liu J K,Feng Y Y,et al.Altered plastid levels and potential for improved fruit nutrient content by downregulation of the tomato DDB1-interacting protein CUL4[J].The Plant Journal,2008,55:89-103.
(责任编辑闫杏丽)
Tomato de-ubiquitination enzymes AMSH3 gene improving tomato quality
LIU Yan-hong,LI Guang-wei,LIU Yong-sheng
(School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
Abstract:AMSH3 enzyme is a member of de-ubiquitination enzymes in MPN(+)/JAMM protease family,which can bind ubiquitinated protein ubiquitin molecule.The similarities of the de-ubiquitination enzyme gene SlAMSH3 in tomato were 81% and 71% in nucleic acid and protein levels in comparison with AtAMSH3 enzyme gene in Arabidopsis thaliana.In Arabidopsis,the formation of vacuole and the pathway to transport vacuole protein are affected by de-ubiquitination enzymes AMSH3.In this paper,the SlAMSH3 fruit-specific overexpression vector was constructed and transferred into tomato plants through a reproducible agrobacterium-mediated transformation.The transgenic plants expressing SlAMSH3 highly in fruit were confirmed by screening.The analysis result of fluorescence quantitative reverse transcription polymerase chain reaction(RT-PCR)showed that the expression quantity of SlAMSH3 increased in the transgenic plants compared to that of wild type plants.The chlorophyll concentration of the positive tomato at green ripe stage and the single fruit weight,brix content,firmness,lycopene concentration and β-carotene concentration of the fruit at red ripe stage were determined.The chlorophyll concentration,lycopene,β-carotene in the transgenic tomato fruit were improved 178.61%,40.53% and 74.86% respectively,while other indicators showed no significant differences.Therefore,fruit-specific overexpression of tomato SlAMSH3 is a useful genetic engineering approach to improve fruit quality.
Key words:AMSH3 gene;fruit-specific overexpression;genetic transformation;transgenic tomato;fruit quality improvement
收稿日期:2015-01-03;修回日期:2015-04-24
基金项目:国家自然科学基金资助项目(31171179)
作者简介:刘艳红(1989-),女,河南周口人,合肥工业大学硕士生;刘永胜(1964-),男,重庆市人,博士,合肥工业大学教授,博士生导师.
doi:10.3969/j.issn.1003-5060.2016.04.023
中图分类号:Q785;S641.2
文献标识码:A
文章编号:1003-5060(2016)04-0548-06

