新型前哨淋巴结示踪剂的制备及动物实验研究
丛斌斌,孙 晓,宋现让,曹晓珊,刘雁冰,赵 桐,
田崇麟1,2,于金明4,王永胜21.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250200;2.山东大学附属山东省肿瘤医院乳腺病中心,山东 济南 250117;3.山东大学附属山东省肿瘤医院基础实验室,山东 济南 250117;4.山东大学附属山东省肿瘤医院放疗科,山东 济南 250117
新型前哨淋巴结示踪剂的制备及动物实验研究
丛斌斌1,2,孙 晓2,宋现让3,曹晓珊1,2,刘雁冰2,赵 桐2,
田崇麟1,2,于金明4,王永胜2
1.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250200;2.山东大学附属山东省肿瘤医院乳腺病中心,山东 济南 250117;3.山东大学附属山东省肿瘤医院基础实验室,山东 济南 250117;4.山东大学附属山东省肿瘤医院放疗科,山东 济南 250117
[摘要]背景与目的:前哨淋巴结活检是临床腋窝淋巴结阴性早期乳腺癌患者治疗的标准。准确定位前哨淋巴结对分期、预后及治疗至关重要。该研究将利妥昔单抗与荧光示踪剂吲哚菁绿偶联,制备新型前哨淋巴结示踪剂,确定最佳偶联比例,并对其生物学特性、安全限度及定位性能进行研究。方法:直接偶联法制备新型前哨淋巴结吲哚菁绿-利妥昔单抗,双层析快速薄层层析-硅胶层析纸法测定标记率,非还原型SDS聚丙烯酰胺凝胶电泳法和双抗体夹心间接酶联免疫测定法检测新型示踪剂中单抗分子完整性和免疫活性,按中华药典要求检测新型示踪剂的安全限度及在小鼠体内前哨淋巴结的定位性能。结果:新型示踪剂中利妥昔单抗分子完整且保持了单抗的免疫活性,利妥昔单抗大分子上吲哚菁绿的标记率为100%,新型示踪剂为无菌、无致热原的溶液且局部注射不会产生危害。利妥昔单抗与吲哚菁绿质量比例为4∶1、6∶1偶联形成的新型示踪剂,前哨淋巴结显像效果最佳。前哨淋巴结定位与核素法一致。结论:吲哚菁绿-利妥昔单抗偶联的新型前哨淋巴结示踪剂的制备工艺简单且无放射性危害,其中单抗的分子完整性和免疫活性无破坏,为无菌、无致热原、无急性毒性的示踪剂,能够用于前哨淋巴结显像。
[关键词]前哨淋巴结;显像剂;利妥昔单抗;吲哚菁绿;淋巴显像
Correspondence to: WANG Yongsheng E-mail: wangysh2008@aliyun.com
前哨淋巴结(sentinel lymph node,SLN)是乳腺癌转移的第一站淋巴结,其病理情况对乳腺癌外科手术方式及术后综合治疗有重要的指导价值。前哨淋巴结活检(sentinel lymph node biopsy,SLNB)是乳腺癌淋巴结分期的技术手段,准确定位SLN是乳腺癌SLNB研究一直关注的技术领域。SLN定位的示踪剂包括染料、核素、荧光等,这些均为非特异性示踪剂,利用淋巴结内巨噬细胞吞噬作用将示踪剂滞留在SLN内。此类颗粒型示踪剂颗粒直径为50~200 nm,大小不均,每次注入颗粒总数不易控制,容易出现术中检出次级淋巴结的情况。本研究将淋巴结特异性结合的利妥昔单抗(rituximab)与荧光示踪剂吲哚菁绿(indocyanine green,ICG)偶联,制备新型SLN示踪剂ICG-利妥昔单抗,并对其体外特性、安全限度及定位性能进行研究。
1 材料和方法
1.1实验动物
BALB/c小鼠40只,18~20 g,雌性,无菌级,购自北京华阜康生物技术股份有限公司。
1.2主要实验试剂
利妥昔单抗,100 mg,购自瑞士巴塞尔豪夫迈罗氏有限公司;ICG(注射用吲哚菁绿),25 mg,购自丹东医创药业有限责任公司;灭菌注射用水,5 mL,购自天津药业集团新郑股份有限公司;半透膜直径22 mm,截留分子量4×103~6×103,购自美国光谱医学公司;荧光成像仪(MDM-I型荧光脉管系统),购自廊坊明德生物医药技术有限公司;γ探测仪(Neoprobe 2000)购自美国强生公司;磷屏显像仪(Cyclone磷屏成像系统)购自美国Packard公司;双层硅胶层析纸(ITLC-SG)购自德国Gelman公司;ELISA试剂盒(兔ELISA试剂盒)购自上海拜力生物科技有限公司;RPMI-1640培养基、胎牛血清购自美国Hyclone公司;PowerPac Basic电泳装置购自美国Bio-Rad公司;其他试剂为国产AR级。
1.3新型示踪剂的制备
室温下,按照无菌操作原则将100 mg利妥昔单抗用10 mL灭菌注射用水配制成10 mg/mL的溶液,置于50 mL无菌离心管内冷藏(2~8℃)保存备用;将25 mg ICG用10 mL灭菌注射用水配制成浓度为2.5 mg/mL的溶液,置于50 mL无菌离心管内避光保存备用。室温下,分别取6份体积为0.5 mL的已配制完成的10 mg/mL利妥昔单抗溶液置于10 mL离心管中,取利妥昔单抗与ICG质量比为3∶1、4∶1、6∶1、12∶1、30∶1 及32∶1的相应体积的2.5 mg/mL ICG溶液,将ICG溶液缓慢滴入利妥昔单抗溶液中。观察离心管内偶联反应后有无沉淀生成,若有沉淀产生,则将装有偶联反应物的离心管进行离心沉淀(2012×g,20 min)去除离心管底部的沉淀后,取上清液置于半透膜制成的透析袋中;若无沉淀产生则将混合液直接置于透析袋中,室温避光条件下以偶联反应物混合液与灭菌注射用水体积比为1∶200的比例进行透析,先用流水透析5 min,之后置于灭菌注射用水的容器中继续透析,每2 h更换灭菌注射用水透析液,取每次透析结束更换的透析液进行荧光成像仪检测,确定偶联物中有无游离的小分子ICG,通过此方法将透析袋中的小分子ICG完全洗脱出去,然后收集ICG-利妥昔单抗偶联物。
1.4新型示踪剂的体外特性
1.4.1标记率测定
采用双层析快速薄层层析-硅胶层析纸(ITLC-SG)法测定标记率。体系1为V吡啶∶V乙醇∶V水=5∶2∶1,体系2为丙酮。用体系1时ICG在原点,新型示踪剂在前沿;用体系2时利妥昔单抗和新型示踪剂在原点,ICG在前沿。
1.4.2分子完整性测定
8%非还原型SDS聚丙烯酰胺凝胶电泳法检测新型示踪剂中单抗分子的完整性,利妥昔单抗为阳性对照,确定新型示踪剂中单抗分子的完整性。
1.4.3免疫活性检测
采用双抗体夹心间接酶联免疫吸附(enzymelinked immunosorbent assay,ELISA)法检测新型示踪剂中单抗分子的免疫活性。兔抗鼠IgG-Fab抗体为包被抗体,采用质量分数为1%的牛血清白蛋白封闭1 h,加入利妥昔单抗与ICG质量比为4∶1、6∶1、12∶1、30∶1及32∶1的新型示踪剂,在室温条件下避光反应2 h,加入辣根过氧化物酶标记的羊抗人IgG-Fc段抗体,在室温条件下避光反应1 h,盐酸邻苯二胺显色,酶联仪测定D412 nm值。
1.5安全限度检测
1.5.1细菌检测
分别将0.5 mL利妥昔单抗与ICG质量比为4∶1、6∶1、12∶1、30∶1及32∶1的新型示踪剂移入含有10%胎牛血清培养液的RPMI-1640细胞培养基中进行细菌检测,在37℃下培养1周,观察有无细菌产生。
1.5.2致热原检测
以大肠杆菌内毒素(1 U/mL)为阳性对照,无菌、无致热原注射用水为阴性对照,应用鲎试验检测新型示踪剂是否存在致热原。用1 mL注射用水溶解鲎试剂,将待测样品加入到已溶解的鲎试剂中,于37℃下温育1 h。试剂若呈胶冻状为有致热原;若为澄清液体,则无致热原。
1.5.3急性毒性实验
BALB/c小鼠20只,雌性,体质量为(20±0.1)g,分为5组,每组4只。每组小鼠后肢脚垫皮下分别以1.2和12 mg/kg剂量注射5种不同质量比的新型示踪剂,相当于人体用量的10和100倍。观察1周内小鼠的生存情况。
1.6SLN定位性能
分别将10 μL 5种不同质量比的新型示踪剂分别注射于50只(每组10只)小鼠的后肢足垫皮下,用荧光成像仪持续观察24 h,详细记录出现SLN及次级淋巴结的时间。另外,将注射了新型示踪剂且已经利用荧光成像仪明确定位SLN位置的10只小鼠的后肢足垫皮下注射10 μL SLN标准示踪剂99mTc-硫胶体(10 μCi,185 kBq)。注射后2 min用γ探测仪定位放射性活性SLN位置并用磷屏显像仪进行小鼠腹股沟SLN显像,以明确新型示踪剂定位的SLN位置是否与核素法定位的一致。
1.7统计学处理
应用SPSS 17.0软件进行统计分析。两组独立样本间的比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1新型示踪剂的体外特性
在制备过程中发现,5种不同质量比的利妥昔单抗与ICG新型示踪剂在透析12 h之后均未见ICG浸入透析液,说明ICG经过偶联反应完全结合到利妥昔单抗上,而质量比为3∶1混合偶联时会出现沉淀,经过分析确定为ICG成分浓度过高引起的沉淀,其他质量比例的制备过程中均未见沉淀。鉴于沉淀会影响SLN显像的情况,因此3∶1质量比的新型示踪剂未进行进一步的实验。
ITLC-SG法检测显示,在5种不同质量比的利妥昔单抗与ICG的新型示踪剂中,利妥昔单抗大分子上ICG的标记率为100%。
5种不同质量比的利妥昔单抗与ICG的新型示踪剂,8%非还原型SDS聚丙烯酰胺凝胶电泳法检测显示未见明显降解条带,说明新型示踪剂中单抗分子完整(图1)。

图 1 8%非还原型SDS聚丙烯酰胺凝胶电泳法确定新型示踪剂单抗分子完整性Fig. 1 The new tracer was analyzed for molecular integrity by 8% sodium dodecyl sulfate-polyacrylamide gel electrophoresis
ELISA法显示,不同比的ICG-利妥昔单抗和利妥昔单抗显色反应均呈阳性,酶联仪测定D412 nm值未见明显差异,说明新型示踪剂中单抗分子保持了利妥昔单抗的免疫活性。
2.2安全限度检测
经过细菌检测和致热原检测显示,新型示踪剂为无菌、无致热原的溶液。分别注射了相当于人体用量10倍和100倍新型示踪剂的20只小鼠,48 h内注射局部及全身均未见明显异常,常规饲养1周均未见死亡,说明5种不同质量比的利妥昔单抗与ICG新型示踪剂的LD50大于12 mg/kg,局部注射不会对人体产生危害。
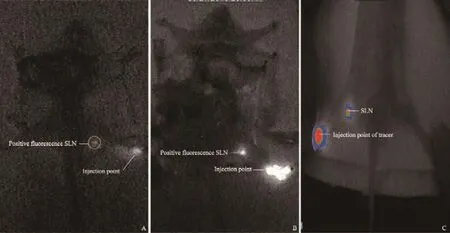
图 2 新型示踪剂前哨淋巴结定位性能的小鼠实验Fig. 2 Mouse experiment for SLN detection of new tracer
2.3SLN定位性能
5种不同质量比的ICG-利妥昔单抗新型示踪剂的SLN显像情况见表1。用荧光成像仪探测注射4∶1、6∶1的新型示踪剂的小鼠,SLN均显像清晰,而12∶1、30∶1及32∶1新型示踪剂的小鼠均有无SLN显像的情况出现,因此利妥昔单抗与ICG质量比为4∶1、6∶1的新型示踪剂是进行SLNB显像的最佳示踪剂。注射了这两种质量比例示踪剂的小鼠首次出现腹股沟SLN的时间分别为(13.62±1.79)min和(10.07±1.40)min(表1),而且48 h后仍只有SLN显像而未见次级淋巴结显像。明确定位SLN位置的10只小鼠的后肢足垫皮下注射10 μL99mTc-硫胶体,探测仪定位的SLN位置与新型示踪剂定位的SLN位置一致,荧光成像仪中的图像与磷屏显像仪中的SLN的位置也一致(图2)。
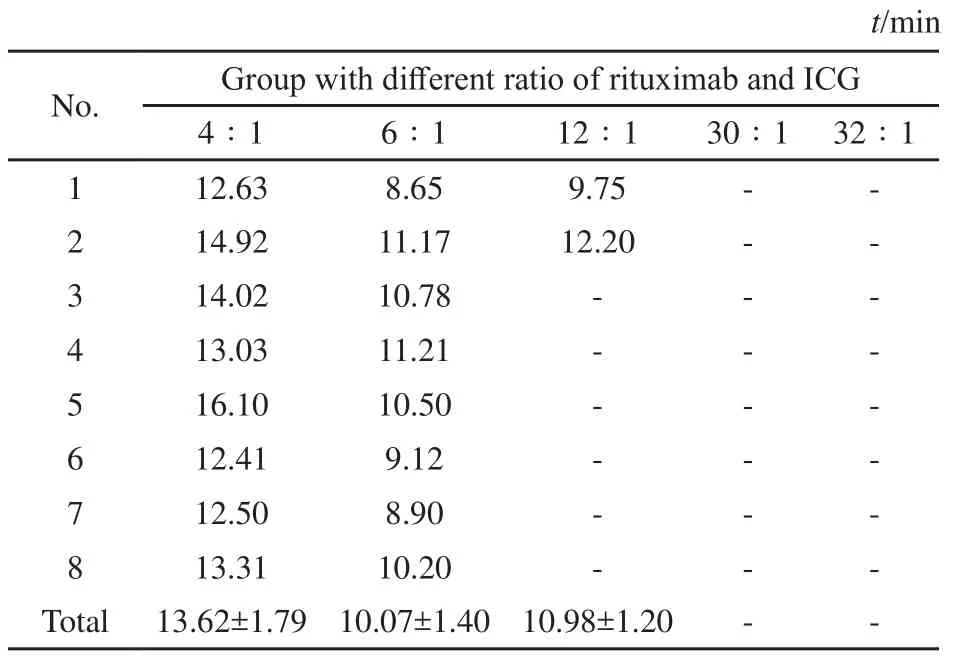
表 1 ICG-利妥昔单抗新型示踪剂首次出现SLN的时间 (min)Tab. 1 The first appearance time of SLN in new tracer ICG-rituximab
3 讨 论
SLNB作为一项腋窝准确分期的微创活检技术,代表着乳腺癌外科治疗的发展水平[1]。目前,SLN定位的示踪剂包括染料、核素、荧光等,这些均为非特异性示踪剂[2]。其中染料法(美兰、专利蓝和纳米碳)定位SLN主要是通过术前在乳腺原发肿瘤周围和(或)皮下注射染料,然后于腋窝区域循着被染料染色的淋巴管精细解剖找到第一枚被染色的淋巴结,从而确定SLN的具体位置,然而这种方法需要精湛的外科解剖技巧,并且经过学习曲线后仍存在较高的SLNB假阴性率,这导致SLNB的准确性难以把握[3-5];而核素法(99mTc-硫胶体)定位SLN是通过术前于乳腺原发肿瘤周围腺体和(或)皮下注射放射性核素,术中利用γ探测仪探测放射性计数,依据放射性计数找到计数较高的淋巴结,从而确定SLN(大于最高放射性计数10%的淋巴结)的具体位置,虽然该方法SLNB的准确率高、特异性好,但是目前部分国内医院无核医学科受到仪器设备条件的限制,以及在实际操作时存在放射性核素污染及医务人员放射性恐惧的问题,而且99mTc-硫胶体中的硫胶体并未通过中国食品药品监督管理局的批准,这些都限制了其在我国临床实际工作中的应用[6];荧光法定位SLN的方法与染料法相似,通过术前在乳腺原发肿瘤周围和(或)皮下注射荧光示踪剂,术中利用荧光成像仪循荧光显像发亮的淋巴管找到第一枚荧光显像的淋巴结,从而定位SLN的位置,然而由于淋巴管内滞留的荧光示踪剂较少,其被激发所释放出的荧光较弱,导致淋巴管荧光显像不明显,所以活检过程中很难发现位置较深的淋巴管,从而导致很难循荧光显像的淋巴管找到第一枚荧光显像的淋巴结,造成SLN的漏检,而位置较浅的淋巴管虽然可以清晰地发现荧光显像但在离断后其内的荧光示踪剂随淋巴液一起漏出,极易造成淋巴管周围组织荧光示踪剂显像污染,导致难以辨识淋巴管的位置,最终造成SLN漏检[7],这也不是理想的SLN示踪剂。
ICG是目前乳腺癌SLNB的示踪剂之一,是一种具有含硫活性基团的小分子化合物,可以被荧光脉管系统成像仪前的近红外光源(760 nm)激发产生荧光(820~830 nm),所产生的荧光可以穿透人体脂肪组织。因为淋巴结中滞留的ICG比淋巴管中的多,所以淋巴结荧光显像明显,利用成像仪可清晰直观地观察到淋巴结的显像位置。但是由于ICG分子量小并易于弥散造成了在SLNB方面的显像率高、敏感性高和准确性低,且极易导致SLN以外的次级淋巴结显像[7-8]。而利妥昔单抗是针对淋巴结中B淋巴细胞膜上CD20分子的特异性人源化单克隆抗体,能够与淋巴结内CD20+的分子特异性结合,并且结合后不易解离[9],另外其具备有与其他小分子结合的结构域,能够与小分子物质进行偶联反应[10]。我们将大分子的利妥昔单抗与小分子的ICG进行偶联,其原理为小分子ICG中的含硫活性基团在室温中性环境条件下与大分子利妥昔单抗中的自由氨基(主要为赖氨酸的ε-氨基)相结合,每个大分子的利妥昔单抗能偶联15~20个小分子ICG,新形成的偶联物综合了以上两种试剂的特点,既能够在近红外线的激发下使SLN荧光显像又能特异的定位SLN。本研究中的新型示踪剂为一种颗粒大小稳定的偶合物,通过投射电镜确认其粒径为200~300 nm,动物实验显示大剂量(100 μL)新型示踪剂注射能够出现小鼠腹腔和盆腔内次级淋巴结显像,而通过剂量梯度实验之后,适当剂量(10 μL)新型示踪剂小鼠足垫下注射仅能够使SLN显像,其原理为新型示踪剂进入SLN后与淋巴结中B淋巴细胞膜上CD20分子特异性结合,当剂量过大时示踪剂与CD20分子结合达到饱和,过量的示踪剂将向下一级淋巴结进行引流,而剂量适中时示踪剂与CD20分子结合未达到饱和,仅在SLN中滞留而不会向次级淋巴结引流。动物实验结果显示,该新型示踪剂进行SLNB时,通过浓度梯度实验获得SLN显像的示踪剂最佳浓度(10 μL),使得示踪剂只能滞留在SLN中而不向次级淋巴结引流。因此在人体进行应用时需通过浓度梯度试验获得SLN显像最佳浓度,通过该浓度的新型示踪剂指导进行SLNB时,不必再循荧光显像的淋巴管找寻SLN,只需术中用红外线荧光显像系统探测荧光显像的SLN的位置,将SLN周围组织解剖游离后,直接解剖检出荧光显像定位的SLN,从而避免了SLN的漏检和周围组织荧光显像污染的情况。
本研究结果表明,所制备的新型示踪剂ICG-利妥昔单抗中,利妥昔单抗大分子上ICG的标记率为100%,保持了抗体分子的完整性并保留了免疫活性,为无菌、无致热原和无急性毒性的溶液。本研究在核素示踪剂的前期小鼠实验中发现,10 μL99mTc-硫胶体注射于小鼠后肢足垫后,2 min时只存在SLN显像(盆腔腹腔解剖后),30 min后才有可能出现次级淋巴结显像,因此选择2 min时进行磷屏显像,以确定新型荧光示踪剂的SLN定位效果与核素示踪剂的效果一致。利妥昔单抗与ICG质量比例为4∶1、6∶1偶联形成的新型示踪剂,适当剂量(10 μL)进行小鼠后肢足垫注射后,SLN显像效果最佳,且与核素法定位的SLN相一致,说明新型示踪剂与核素示踪剂一样能够准确定位SLN,用于SLN定位显像。
总之,ICG-利妥昔单抗偶联的新型SLN示踪剂的制备工艺简单、标记率高且无放射性危害,其中单抗的分子完整性和免疫活性无破坏,为无菌、无致热原、无急性毒性的示踪剂,能够用于SLN显像,具有较好的临床应用前景。本研究结果为临床应用提供了依据。
[参 考 文 献]
[1] 王永胜. 乳腺癌前哨淋巴结活检: 共识与展望[J]. 中国普外基础与临床杂志, 2009, 16(7): 505-509.
[2] 李金锋, 欧阳涛, 王雪鹃, 等. 新型示踪剂99mTc-利妥昔用于原发性乳腺癌前哨淋巴结活检的初步研究[J]. 中华外科杂志, 2006, 44(9): 600-602.
[3] MARTIN R C, CHAGPAR A, SCOGGINS C R, et al. Clinicopathologic factors associated with false-negative sentinel lymph node biopsy in breast cancer[J]. Ann Surg,2005, 241(6): 1005-1012; discussion 1012-1015.
[4] DEGNIM A C, OH K, CIMMINO V M, et al. Is blue dye indicated for sentinel lymph node biopsy in breast cancer patients with a positive lymphoscintigram?[J]. Ann Surg Oncol, 2005, 12(9): 712-717.
[5] HUNG W K, CHAN C M, CHONG S F, et al. Randomized clinical trial comparing blue dye with combined dye and isotope for sentinel lymph node biopsy in breast cancer[J]. Br J Surg, 2005, 92(12): 1494-1497.
[6] 宣立学, 张保宁. 乳腺癌前哨淋巴结活检的临床应用[J]. 中国实用外科杂志, 2003, 23(3): 629-630.
[7] GUO W, ZHANG L, JI J, et al. Breast cancer sentinel lymph node mapping using near-infrared guided indocyanine green in comparison with blue dye[J]. Tumour Biol, 2014, 35(4):3073-3078.
[8] WISHART G C, LOH SW, JONES L, et al. A feasibility study (ICG-10) of indocyanine green (ICG) fluorescence mapping for sentinel lymph node detection in early breast cancer[J]. Eur J Surg Oncol, 2012, 38(8): 651-656.
[9] 李 艳, 李 囡, 翟士桢, 等. 特异性前哨淋巴结显像剂99mTc-rituximab药盒的制备及生物评价[J]. 同位素,2011, 24(B12): 85-89.
[10] 袁清安, 俞炜源, 黄翠芬. 鼠单克隆抗体人源化[J]. 细胞与分子免疫学杂志, 1997, 13(1): 68-72.
The preparation and experimental study of a new sentinel lymph node tracer
CONG Binbin1,2, SUN Xiao2, SONG Xianrang3, CAO Xiaoshan1,2, LIU Yanbing2, ZHAO Tong1, TIAN Chonglin1,2, YU Jinming4, WANG Yongsheng2(1.School of Medicine and Life Sciences, University of Jinan and Shandong Academy of Medical Sciences, Jinan 250200, Shandong Province, China; 2.Breast Cancer Center, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, Shandong Province, China; 3.Basic Laboratory,Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, Shandong Province, China;4.Radiotherapy Department, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117,Shandong Province, China)
[Key words]Sentinel lymph node; Imaging agent; Rituximab; Indocyanine green; Lymphoscintigraphy
[Abstract]Background and purpose: Sentinel lymph node biopsy is regarded as the standard of care in patients without clinical axillary lymph node metastases in early-stage breast cancer. Accurate detection of sentinel lymph node is an important step for staging, prognosis, and treatment. In this study, a new sentinel lymph node tracer was produced by the rituximab to combine with the fluorescence tracer (indocyanine green, ICG), and to identify the most appropriate combination ratio of the two agents. Its biological property and safety limitation were evaluated. Methods: Rituximab was combined directly with ICG. The new tracer was analyzed for labeled rate by instant thin-layer chroma-tography-silica gel, molecular integrity by sodium dodecyl sulfate-polyacrylamide gel electrophoresis and molecular immune activity by ELLAS. The safety limitation was tested according to the Chinese Pharmacopeia. The localization ability of sentinel lymph node was tested in mice. Results: The new tracer was intact and kept the immune activity of rituximab. The ICG labeled rate of rituximab was 100%. The new tracer was bacteria and pyogen free, and was safe to body with location injection. The most appropriate combination ratio of rituximab and ICG was 4∶1 and 6∶1 with the best sentinel lymph node imaging. The location of sentinel lymph node identified by the new tracer was accorded with the radiotracer. Conclusion: The preparation method of the new sentinel lymph node tracer is simple and no radioactive injury. The new tracer has no bacteria, no pyogen and no acute toxicity, and can be used in sentinel lymph node visualization.
DOI:10.3969/j.issn.1007-3969.2016.03.007
中图分类号:R73-35
文献标志码:A
文章编号:1007-3639(2016)03-0245-06
基金项目:山东省自然科学基金重点项目(ZR2014HZ003)。
通信作者:王永胜 E-mail:wangysh2008@aliyun.com
收稿日期:(2015-07-03 修回日期:2015-10-26)

