心血管疾病PET显像剂研究进展
马 慧,梁 宏,徐万帮,唐刚华
(1.中山大学附属第一医院 广东省医用放射性药物转化应用工程技术研究中心 核医学科,广东 广州 510080; 2.广东省药品检验所,广东 广州 510180)
心血管疾病发病率逐年上升,严重威胁人类健康,更加灵敏和特异的检测手段,对实现心血管疾病的早期诊断和个性化治疗具有重要有意义。正电子发射断层显像(PET)可以无创性地反映冠状动脉病变及心脏功能变化[1]。
心脏PET显像利用正电子放射性核素标记的化合物作为显像剂,在人体内以特异性或非特异性方式聚集于心脏血管或心肌内,通过对图像的采集及计算机软件后期重建,获得正常或病变心脏组织的形态、功能及代谢方面的信息,对疾病定性、定量、定位诊断和疗效评估。PET具有较高的灵敏度,空间分辨率;PET显像剂物理半衰期较短,体内清除较快,在显像质量不变的前提下,能降低患者可能接受的辐射剂量[2]。PET显像剂的研制和转化应用,是实现心血管疾病早期诊断,精准治疗和疗效评估的基础。本文主要介绍心血管疾病方面的PET显像剂及其应用进展。
1 常用心脏PET显像剂
PET显像剂可分为血流灌注型显像剂、代谢型显像剂、乏氧显像剂、凋亡显像剂和结合型显像剂[3],结合型显像剂包括心脏神经受体类显像剂、新生血管类显像剂和淀粉类显像剂等。目前主要用于科研和临床的常用心脏PET显像剂列于表1。
2 心脏PET显像剂及其应用
2.1 血流灌注型显像剂
心肌灌注显像(myocardial perfusion imaging, MPI)通过有功能的心肌细胞选择性摄取血流灌注显像剂,摄取量与心肌血流量成正比,而坏死或缺血心肌不摄取该显像剂。因此,可根据心肌对显像剂的摄取情况诊断心肌疾病,了解心肌供血情况和评价心肌活性。与单光子发射计算机断层成像(single photon emission computed tomography, SPECT)MPI相比,PET MPI具有较高的灵敏度和空间分辨率[4],是目前定量分析心肌血流灌注情况的金标准,其诊断准确率和提示预后能力也高于其他显像技术。
传统的血流灌注型PET显像剂有15O-H2O,82Rb-RbCl和13N-NH3。15O-H2O在心脏血池和心肌间自由扩散,首次通过率高,是理想的定量测定心肌血流的显像剂,但无法获得差异性MPI图像及区分左室心肌活动。82Rb-RbCl生产简单,不需要回旋加速器,但首次摄取率和空间分辨率较低,且心肌摄取时可能影响细胞代谢。13N-NH3血池清除率高,半衰期(约9.96 min)较15O-H2O(约2.05 min)长,可以满足负荷显像的要求,应用广泛。但是,这些传统显像剂半衰期较短,15O-H2O和13N-NH3显像时依赖回旋加速器,限制了临床应用。研究新型的MPI显像剂具有重要意义,其中以18F标记的显像剂研究最为深入[5],主要有还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide adenine dinucleotide, NADH)-泛醌氧化还原酶(或称线粒体复合物-Ⅰ,MC-Ⅰ)抑制剂类,如18F-Flurpiridaz(18F-BMS-747158-02)、18F-FP1OP、18F-FP2OP、18F-FP3OP和18F-RP1004等,以及亲脂性阳离子类似物,如4-氟-18-氟苄基三苯基膦(4-18F-fluorobenzyl triphenyl phosphonium,18F-FBnTP)、4-氟-18-氟苯基三苯基膦(4-18F-fluoro-phenyl triphenyl phosphonium,18F-FTPP)。
MC-Ⅰ是哒螨灵类似物,主要存在于心肌细胞线粒体内。18F-Flurpiridaz与MC-Ⅰ高度特异性结合,18F-Flurpiridaz可被心肌快速稳定地摄取,且首次摄取率高(>90%),滞留时间长。与13N-NH3和82Rb-RbCl相比,18F-Flurpiridaz射程短,半衰期长,可以延迟显像,图像质量与诊断准确率更高,具有较好的应用前景[6]。在大鼠心肌梗死(myocardical infarction, MI)模型中,Ji等[7]对比研究18F-FP1OP、18F-FP2OP和18F-FP3OP,发现18F-FP3OP稳定性较好,对坏死心肌的靶向亲和力最高。18F-FP3OP在鉴别坏死心肌、判断心肌活力方面最有潜力。18F-FBnTP的吸收依赖线粒体膜势能,犬在体实验显示,18F-FBnTP在健康心肌内聚集量随时间延长而增多,滞留时间长,生物分布理想,体内清除快,是一种潜在的新型显像剂[8]。18F-FTPP是四苯金鏻(tetraphenylphosphonium, TPP+)的类似物,聚集在线粒体内,兔心肌梗死模型的研究表明,18F-FTPP在心脏的摄取分布可与13N-NH3MPI相媲美[9]。另外,诸如62Cu-二甲基丙酮醛缩氨基硫脲(62Cu-pyruvaldehyde-bis-N-4-methylthiosemicarbazone,62Cu-PTSM)[10]和68Ga-BAPEN[11]等金属离子标记的放射性复合物显像剂,也有用于心脏显像方面的研究报道。这些新型显像剂中18F-Flurpiridaz正处于Ⅲ期临床实验,其他尚处于初期阶段或仅限于动物实验研究。
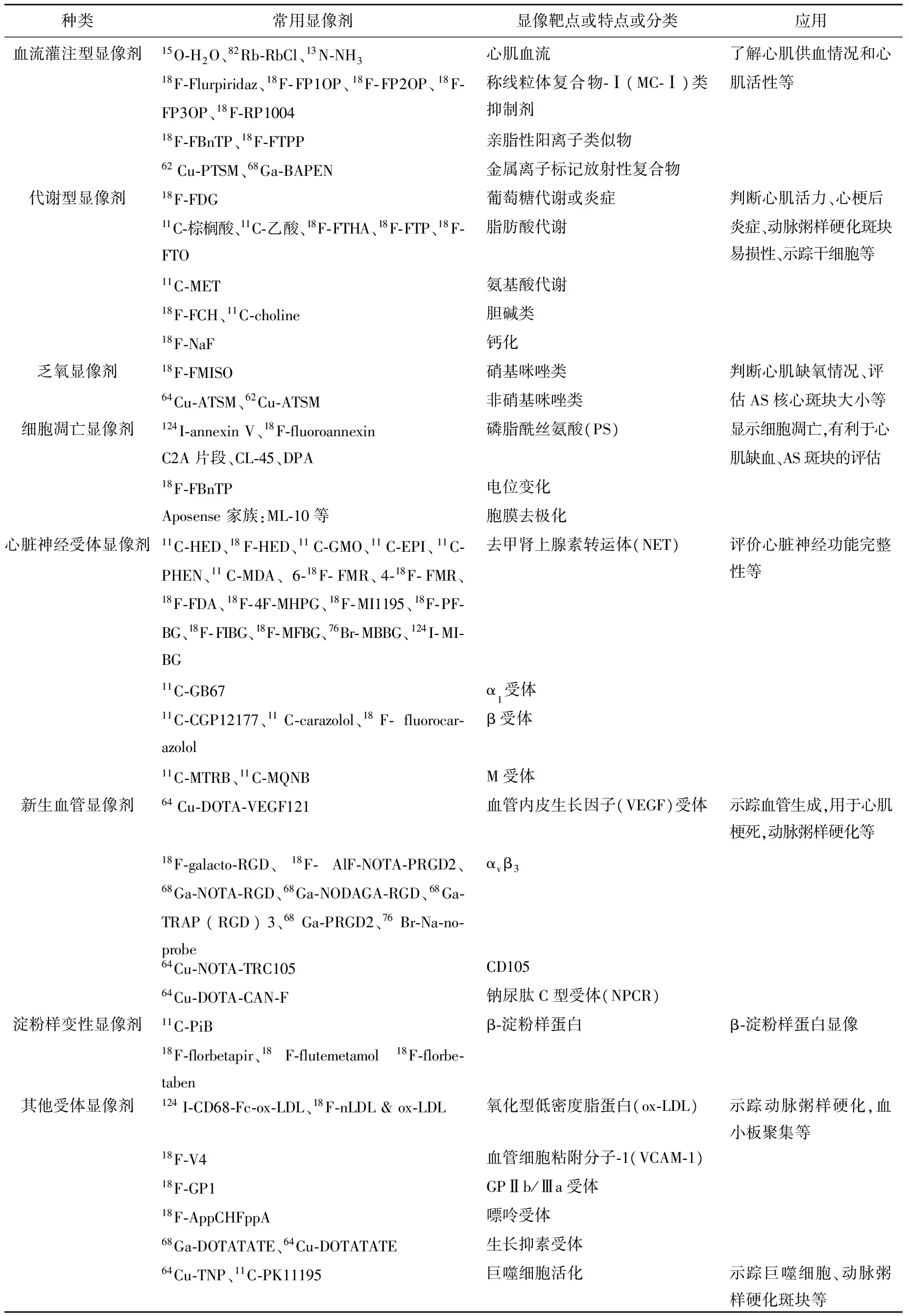
表1 常用心脏PET显像剂Table 1 The common cardic PET imaging tracers
2.2 代谢型显像剂
心肌缺血后有些心肌细胞暂时失去收缩功能,但仍存在不同程度的代谢(即存活心肌),一旦血流恢复,可能恢复正常功能。因此查探存活心肌有助于判断患者是否适合血运再通术,也影响着冠心病的治疗决策。通常情况下心肌细胞通过脂肪酸(fatty acid, FA)氧化获取能量,而缺血心肌脂肪酸代谢减少,葡萄糖代谢增多,故PET心肌代谢显像重点在于显示葡萄糖或脂肪酸的代谢变化。
2.2.1糖代谢类显像剂 心肌代谢显像最常用的显像剂为18F-脱氧葡萄糖(18F-fluorodeox-yglucose,18F-FDG)。FDG是葡萄糖的类似物,在血液中转运方式与葡萄糖相似,在心肌细胞内被己糖激酶催化变成6-P-18F-FDG,滞留于心肌细胞内,其聚集程度反映心肌细胞的葡萄糖代谢活性。临床上常用18F-FDG代谢显像,静息或负荷心肌血流灌注显像,如13N-NH3灌注显像相结合检测存活心肌,一般以“代谢-灌注不匹配”作为判断存活心肌的金标准。除心肌细胞可以摄取18F-FDG,其他细胞如巨噬细胞或炎症细胞也可以摄取18F-FDG,18F-FDG显像还可用于示踪巨噬细胞或炎症细胞。例如,MI后炎症细胞增多,已有文献报道,采用氯胺酮/甲苯噻嗪复合麻醉的方法抑制C57Bl/6小鼠正常心肌细胞对18F-FDG的摄取后,18F-FDG显像可监测MI后心肌炎症[12];巨噬细胞对18F-FDG的相对高摄取,使18F-FDG显像预测动脉粥样硬化(atherosclerosis, AS)斑块的易损性成为可能。此外,已有学者用18F-FDG监测MI后移植干细胞的生物学行为[13]。
2.2.2脂肪酸类显像剂11C-乙酸、11C-棕榈酸等是常见的脂肪酸类PET显像剂。11C-乙酸经三羧酸循环氧化为11C-CO2和H2O,11C-CO2可反映心肌耗氧量,受底物影响最低,11C-乙酸可被用于评价心肌有氧代谢情况[4]。Derlin等[14]证明了11C-乙酸显像评估AS斑块的脂肪酸代谢的可行性,为治疗AS提供了新思路。11C-棕榈酸是心肌脂肪酸代谢的主要底物之一,心肌缺血时局部显像剂摄取减少甚至无摄取,从而提示脂肪酸代谢的变化,反映心肌细胞的病理状况。由于复杂的药物代谢动力学及与代谢无关的反向扩散等问题,11C-棕榈酸显像并未在临床上广泛应用。与11C-棕榈酸、11C-乙酸相比,氟-18-6-硫-十七烷酸(18F-6-thia-14-fluoro-heptadecanoic acid,18F-FTHA)、氟-18-4-硫-棕榈酸(18F-fluoro-4-thia-palmitate,18F-FTP)、氟-18-4-硫-油酸(18F-fluoro-4-thia-oleate,18F-FTO)半衰期长,是长链脂肪酸类似物,心肌内的浓聚有利于评估长链脂肪酸的β氧化。18F-FTO在心肌内滞留时间较长,心肌显像质量较高,在显示FA氧化方面有广泛的应用前景[4]。
2.2.3氨基酸类显像剂 近年来,氨基酸代谢显像在心脏方面的应用也有报道,Thackeray等[15]发现在MI后促炎症的M1型巨噬细胞内,摄取的11C-蛋氨酸(11C-MET)超过抗炎症的M2型巨噬细胞,定位M1型巨噬细胞有助于判断MI后炎症区域,监测抗炎症治疗效果。
2.2.4胆碱类显像剂 活化的巨噬细胞摄取胆碱增多,为AS显像提供了新的靶点。Matter等[16]对AS模型小鼠进行18F-氟化胆碱(18F-fluorocholine,18F-FCH)显像,发现18F-FCH对AS斑块的显示优于18F-FDG。Laitinen等[17]也发现在小鼠体内AS斑块对11C-胆碱(11C-choline)高摄取。胆碱类显像剂可以评估AS斑块的稳定性,但不是易损斑块的特异性靶向显像剂。
2.2.5其他代谢显像剂18F-氟化钠(18F-NaF)虽为骨代谢显像剂,但由于多种心血管疾病时都出现钙化,如MI、AS,所以18F-NaF也可用于心血管疾病显像,尤其是18F-NaF对微小钙化灶的显示弥补了传统显像的不足。有报道提出易损斑块对18F-NaF高摄取,且周围心肌的低摄取使18F-NaF显像优于18F-FDG[18]。
2.3 乏氧显像剂
乏氧显像剂能迅速、准确地选择性滞留在乏氧组织或细胞中,直接反映组织血供和耗氧之间的平衡状态,为冠心病患者的再血管化治疗和预测预后直接提供依据,而心肌灌注缺损或局部心肌代谢改变仅提供了心肌缺血缺氧的间接证据。乏氧出现的一些细胞因子及血管因子可引起血管生成的不平衡,促使心肌病的发展。因此乏氧显像可用于监测心肌病的发生和进展,也可以用于评价血管活性因子对缺血性心脏病的治疗效果。
常用的PET乏氧显像剂主要包括硝基咪唑类如1-H-1-(3-18F-2-羟基丙基)-2-硝基咪唑(18F-fluoromisonidazole,18F-FMISO)和非硝基咪唑类如64Cu-二乙酰-二-N4-甲基氨基硫脲(64Cu-diacetyl-bis-N4-methylthiosemicarbazone,64Cu-ATSM)[19],他们通过各种机制选择性滞留于缺血导致的乏氧心肌组织内。18F-FMISO在细胞内的滞留程度取决于细胞内氧浓度,18F-FMISO可以通过测量斑块内缺氧的程度评估坏死核心斑块的大小[20]。但18F-FMISO存在一定的神经毒性,乏氧选择性不高,血液清除率低。Cu是一种乏氧细胞增敏剂,64Cu-ATSM是双-三氯甲基砜类衍生物,脂溶性高,可快速地进入心肌。但64Cu半衰期长,近年来研究者利用短半衰期的62Cu标记ATSM,Zhang等[21]利用62Cu-ATSM与62Cu-PTSM进行缺氧和灌注联合显像,有望成为一种新型显像方法。
乏氧显像窗口期较短,且体内环境复杂多变,所以乏氧显像比较复杂。在其临床潜力完全发挥之前,还须进行更多的临床研究。目前研究主要集中于乏氧显像剂在肿瘤显像方面的应用,在心肌方面的报道较少。
2.4 细胞凋亡显像剂
在很多心血管疾病中都存在细胞凋亡,如心肌梗死初期细胞凋亡,损失心肌细胞;动脉粥样硬化斑块中平滑肌细胞的凋亡促进了斑块的破裂,因此非侵袭性检测细胞凋亡对心血管疾病的诊治至关重要。凋亡时原本存在于细胞膜脂质双层内层的磷脂酰丝氨酸(phosphatidylserine, PS)外翻至外层,半胱天冬酶(caspase)激活,线粒体膜去极化,胞膜去极化等,这些变化都可以作为凋亡显像的靶点。
膜联蛋白Ⅴ(Annexin Ⅴ)是一种内源性生理蛋白,和凋亡细胞的PS结合有很高的亲和力,核素标记后被广泛用于凋亡显像,如124I-Annexin Ⅴ、18F-Annexin Ⅴ等[22-23],表现为凋亡灶热点显像,而正常心肌细胞不显影。也有关于突触结合蛋白I的C2A片段、表面修饰过的纳米粒子等作为配体,与PS靶向结合的报道。研究表明,这些配体显像清晰,但应用方面有待进一步研究[24-25]。18F-FBnTP对电位变化敏感,在小鼠短暂心肌缺血模型中,18F-FBnTP在缺血区域摄取稳定,但有报道称此显像剂可能出现凋亡假阳性结果[26]。Aposense家族的小分子化合物可进入凋亡早期细胞,是胞膜去极化的显像剂,其中18F-2-(5-氟-2-戊基)-2-甲基丙二酸(18F-2-(5-fluoropentyl)-2-methyl malonic acid,18F-ML-10)最早进入临床研究,安全性好,体内生物分布较好,清除快[27]。
2.5 结合型显像剂
配体-受体结合反应特异性和灵敏性高,受体显像可揭示体内受体的空间分布、密度和亲和力情况,可评价心脏神经分布的完整性、示踪血管生成情况、评估血小板的聚集等。
2.5.1心脏神经受体显像剂 心脏受交感神经和副交感神经的双重支配。完整的神经支配是心血管功能正常的基础,并且神经系统改变可发生于心脏出现明显结构和功能异常前。PET有助于无创性评估心脏神经分布的完整性、获取疾病状态下心脏神经系统的病理生理信息。目前研发的心脏神经受体显像剂主要为儿茶酚胺类或儿茶酚胺的类似物,经由去甲肾上腺素转运体(norepinephrine transporter, NET)转运,聚集于交感神经末梢,用于反映心脏交感神经功能的完整性。其中最常用的PET显像剂是11C-羟基麻黄素 (11C-meta-hydroxyephedrine,11C-HED),临床实验显示11C-HED PET显像可以定量评估心肌去神经化的范围,有助于评估患者是否适用于除颤器植入术。常用的11C标记的显像剂还有11C-肾上腺素(11C-epinephrine,11C-EPI),11C-苯肾上腺素(11C-phenylephrine,11C-PHEN)和N-11C-CH3-甲基多巴胺 (N-11C-CH3-dopamine,11C-MDA)等。11C-EPI 和11C-PHEN已用于临床实验,在心肌内有较高摄取,可定位于心脏交感神经。11C-MDA为肾上腺素在体内代谢的中间产物,在猪心肌缺血模型中,心肌受损部位对11C-MDA的摄取异常,比MPI显像更早、更灵敏地反映心肌受损情况,11C-MDA具有较好的临床研究前景。间羟胺(metaraminol, MR)、间碘苄胍(metaiodoenzylgu-anidine, MBIG)结构类似于去甲肾上腺素,前者在交感神经的摄取、储存与NE相似,目前合成的此类显像剂主要有6-氟代间羟胺(6-18F-fluorometaraminol, 6-18F-FMR)和4-18F-FMR[28]。MIBG类正电子显像剂多用124I、18F或76Br标记,如124I-MIBG、邻位氟代苄胍(para-18F-fluorobenzylguanidine,18F-PFBG)等,可用于靶向示踪NET[29]。
18F标记的PET受体显像剂半衰期长,主要有6-18F-多巴胺(6-18F-fluorodopamine,18F-FDA),18F-4-氟间羟基苯乙基胍(18F-4-fluoro-m-hydroxypheneth-ylguanidine,18F-4F-MHPG)和18F-N-[3-溴-4-(3-18F-氟代丙氧基)-苄基]-胍{N-[3-bro-mo-4-(3-18F-fluoropropoxy)-benzyl]-guanidine,18F-LMI1195}。18F-FDA的研究较为深入,Li等[30]发现心脏对18F-FDA的摄取量随年龄增长而减少,与中老年人心脏表面β肾上腺素受体减少相吻合,18F-FDA有望用于临床心脏受体分布评估。恒河猴18F-4F-MHPG的PET显像可见左心室显影清晰[31];18F-LMI1195在大鼠体内的研究表明,18F-LMI1195显像可以反映支配被动扩散摄取机制的神经受损情况[32]。虽然前期研究结果令人满意,但仍需要更多的临床工作。
β受体密度在心脏病理状态下如高血压、心力衰竭等发生变化,在疾病尤其心力衰竭的发展过程中起着重要的作用,11C-4-[3-[(1,1-Dimethylethyl)amino]2-hydroxypropoxy]-1,3-dihydro-2H-benzimidazol-2-one,11C-4-[3-[(1,1-二甲基乙基)氨基)2-羟丙氧基]-1,3-双氢-2H-苯并咪唑-2-one(11C-CGP12177),11C-卡拉洛尔(11C-carazolol)及18F-氟代卡拉洛尔(18F-fluorocarazolol)等可用于定量研究分析β肾上腺素受体密度,反映心脏收缩功能的变化,其中18F-fluorocarazolol已用于临床。11C-N2-{6-[4-氨基-6, 7-二甲氮基-2-喹唑啉基-(甲基)氨基]己基{-N2-甲基-2-糠酰胺}(11C-N2-{6-[4-amino-6, 7-dimethoxy-2-quinazolinyl-(methyl)amino]hexyl}-N2-methyl-2-furamide,11C-GB67)是α1受体显像剂,Asselin等[33]对猪进行11C-GB67 PET显像研究,发现11C-GB67可对心肌特异性结合的α1受体定量评估,为人体心肌α1受体显像提供依据。11C-甲基-二苯羟乙酸奎宁酯(11C-methyl-quinuclidinyl-benzilate,11C-MQNB)是副交感神经突触后显像剂,可用于心肌毒蕈碱受体显像。
2.5.2新生血管显像剂 心肌缺血时可因缺氧刺激血管生成,已发现多种因素影响血管生成,其中血管内皮生长因子(vascular endothelial growth factor, VEGF)是最主要的因素。此外,整合素也参与血管生成,αvβ3是增生的内皮细胞表面表达最丰富的整合素。VEGF和αvβ3整合素是PET血管显像剂中最受欢迎的靶点。如64Cu-DOTA-VEGF121在大鼠心肌梗死模型中成功示踪了VEGF受体,为监测冠心病病理变化提供了新的思路[34]。αvβ3整合素可识别精氨酸-甘氨酸-天冬氨酸序列(Arg-Gly-Asp,RGD),可将放射性核素如18F、64Cu、68Ga标记的RGD 多肽作为配体,进行靶向分子探针成像。已有文献显示18F-Galacto-RGD在人体MI后的血管生成显像方面有效[35]。除此之外,CD105(endoglin)和钠尿肽C型受体(NPCR)作为靶点示踪血管生成情况,也已成功用于动物实验[4]。
2.5.3淀粉样变性显像剂 心脏是淀粉样变性最常累积的器官,存在转体基因蛋白(transthyretin, TTR)型和轻链 (immunoglobulin light-chain, AL)型的心脏淀粉样变性。18F-NaF对于TTR阳性显像,而AL型不显像[36]。研究表明,11C-匹兹堡复合物B(11C-PiB)PET显像在评价AL型淀粉样变性的心脏受累程度方面发挥重要作用[37]。除了评价治疗效果,11C-PIB PET显像还可用于预测预后。18F-florbetapir,18F-flutemetamol和18F-florbetaben也被用于PET显像β-淀粉样蛋白[38],同时已被美国食品药物管理局批准用于阿尔兹海默疾病的诊断。
有关受体显像方面的报道还有很多,其中相应的靶点与显像剂有:氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL),124I-CD68-Fc-ox-LDL;血管细胞粘附分子-1(vascular cell adhesion molecule-1, VCAM-1),18F-V4;血小板膜表面表达糖蛋白(glucose protein, GP)Ⅱb/Ⅲa受体,18F-GP1;嘌呤受体,18F-AppCHFppA;生长抑素受体,68Ga-DOTATATE和64Cu-DOTATATE等[6,39]。这些受体显像剂可用于AS斑块的显像,示踪炎症、斑块内巨噬细胞情况及血小板聚集情况等,有利于AS斑块稳定性的鉴别,疗效评估等。
3 展望
近年来随着PET显像剂的发展,使分子层面认识心血管疾病成为可能,有利于临床医生做出最佳决策。具有成像、定位和治疗的新型PET显像剂成为研究热点[6]。正电子发射型断层磁共振成像(positron emission tomography/magnetic resonance imaging, PET/MRI)提供了新的显像方式,用于PET/MRI的显像剂也在不断研发中。目前用于研究的双模态显像剂多以纳米材料为基础[40],如靶向巨噬细胞的MDIO-64Cu-DOTA[41]。虽然此类显像剂仍未用于临床,PER/MRI的临床应用也面临着巨大挑战,但是初步的研究结果表明,PET/MRI在心脏核医学的临床应用中具有巨大潜力。如PET/MRI显像可以更精准和灵敏地评价心肌活性及心室功能,在监测动脉粥样硬化、心肌炎、心包炎、血管炎和其他心血管病变的病理过程方面具有潜在的应用前景[42-43]。随着显像剂的发展与显像技术的提升,PET将在心血管疾病的诊断、监测及治疗中起着越来越重要的作用。
参考文献:
[1] Ametamey S M, Honer M, Schubiger P A. Molecular imaging with PET[J]. Chem Rev, 2008, 108(5): 1 501-1 516.
[2] Small G R, Wells R G, Schindler T, et al. Advances in cardiac SPECT and PET imaging: overcoming the challenges to reduce radiation exposure and improve accuracy[J]. Can J Cardiol, 2013, 29(3): 275-284.
[3] 唐刚华. PET药物及其研究现状与进展[J]. 国际放射医学核医学杂志,1999,23(5):193-197.
Tang Ganghua. Research and development of PET agents[J]. Journal of Isotopes ,1999, 23(5): 193-197(in Chinese).
[4] Sogbein O O, Galarneau M P, Schindler T H, et al. New SPECT and PET radiopharmaceuticals for imaging cardiovascular disease[J]. BioMed Res Int, 2014, 2014(8): 1-24.
[5] 谢博洽. 正电子心肌灌注显像剂的临床应用及研究进展[J]. 同位素,2009,22(4):230-236.
Xie Boqia. Research progress and clinical applicationof cardiac positron emission tomography perfusion tracers[J]. Journal of Isotopes, 2009, 22(4): 230-236(in Chinese).
[6] Li Y, Zhang W, Wu H, et al. Advanced tracers in PET imaging of cardiovascular disease[J]. Biomed Res Int, 2014, 2014: 504-532.
[7] Ji A Y, Jin Q M, Zhang D J, et al. Novel18F-lbeled 1-hydroxyanthraquinone derivatives for necrotic myocardium imaging[J]. ACS Med Chem Lett, 2016, 8(2): 191-195.
[8] Madar I, Ravert H T, Du Y, et al. Characterization of uptake of the new PET imaging compound18F-fluorobenzyl triphenyl phosphonium in dog myocardium[J]. J Nucl Med, 2006, 47(8): 1 359-1 366.
[9] Shoup T M, Elmaleh D R, Brownell A L, et al. Evaluation of (4-[18F]Fluorophenyl) triphenylphosphonimion. A potential myocardial blood flow agent for PET[J]. Mol Imaging Biol, 2011, 13(3): 511-517.
[10] Aydinbelge F N, Sadic M, Korkmaz M. Current status of myocardial perfusion imaging radiopharmaceuticals for SPECT and PET imaging modalities[J]. Int J Res Med Sci, 2016, 5(1): 1-7.
[11] Yang B Y, Jeong J M, Kim Y J,et al. Formulation of68Ga-BAPEN kit for myocard-ial positron emission tomography imaging and biodistribution study[J]. Nucl Med Biol, 2010, 37(2):149-155.
[12] Thackeray J T, Bankstahl J P, Yong W, et al. Targeting post-infarct inflammation by PET imaging: comparison of68Ga-citrate and68Ga-DOTATATE with18F-FDG in a mouse model[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2): 317-327.
[13] Wu S, Zhu Y, Liu H, et al. In vivo dynamic metabolic changes after transplantation of induced pluripotent stem cells for ischemic injury[J]. J Nucl Med & Mol Imaging, 2016, 57(12): 2 012-2 015.
[14] Derlin T, Habermann C R, Lengyel Z, et al. Feasibility of11C-acetate PET/CT for imaging of fatty acid synthesis in the atherosclerotic vessel wall[J]. J Nucl Med, 2011, 52(12): 1 848-1 854.
[15] Thackeray J T, Bankstahl J P, Wang Y,et al. Targeting amino acid metabolism for molecular imaging of inflammation early after myocardial infarction[J]. Theranostics, 2016, 6(11): 1 768-1 779.
[16] Matter C M, Wyss M T, Meier P, et al.18F-choline images murine atherosclerotic plaques ex vivo[J]. Arterioscler Thromb Vasc Biol, 2006, 26(3): 584-589.
[17] Laitinen I E, Luoto P, Nagren K, et al. Uptake of11C-choline in mouse atherosclerotic plaques[J]. JNucl Med, 2010, 51(5): 798-802.
[18] Joshi N V, Vesey A T, Williams M C, et al.18F-fluoride positron emission tomography for identify-cation of ruptured and high-risk coronary atherosclerotic plaques: a prospective clinical trial[J]. Lancet, 2014, 383(9918): 705-713.
[19] 张弘,蒋宁一. 心肌乏氧显像及其临床应用[J]. 国际放射医学核医学杂志,2004,28(3):113-117.
Zhang Hong, Jiang Ningyi.Myocardial hypoxia imaging and clinical application[J]. Foreign Med Sci. Sec Radiat Med Nucl Med, 2004, 28(3): 113-117(in Chinese).
[20] Mateo J, Izquierdo-Garcia D, Badimon J J, et al. Noninvasive assessment of hypoxia in rabbit advan-ced atherosclerosis using18F-fluoromisonidazole positron emission tomographic imaging[J]. Circ Car-diovasc Imaging, 2014, 7(2): 312-320.
[21] Zhang T, Das S K, Fels D R, et al. PET with62Cu-ATSM and62Cu-PTSM is a useful imaging tool for hypoxia and perfusion in pulmonary lesions[J]. AJR Am J Roentgenol, 2013, 201(5): 698-706.
[22] Sharma S K. Pet radiopharmaceuticals for personalized medicine[J]. Curr Drug Targets, 2016, 17(999): 1 894-1 907.
[23] Hu S, Kiesewetter D O, Zhu L, et al. Longitudinal PET imaging of doxorubicin induced cell death with18F-annexin V[J]. Mol Imaging Biol, 2012, 14(6): 762-770.
[24] Zhao M, Zhu X, Ji S, et al.99mTc-Labeled C2A domain of synaptotagmin I as a target-specific Mo-lecular probe for noninvasive imaging of acute myocardial infarction[J]. J Nucl Med, 2006, 47(8): 1 367-1 374.
[25] Schellenberger E A, Reynolds F, Weissleder R, et al. Surface-functionalized nanoparticle library yields probes for apoptotic cells[J]. Chembiochem, 2004, 5(3): 275-279.
[26] Madar I, Huang Y, Ravert H,et al. Detection and quantification of the evolution dynamics of apoptosis using the PET voltage sensor18F-fluorobenzyl triphenyl phosphonium[J]. J Nucl Med, 2009,50(5): 774-780.
[27] Höglund J, Shirvan A, Antoni G, et al.18F-ML-10, a PET tracer for apoptosis: first human study[J]. J Nucl Med, 2011, 52(5): 720-725.
[28] 付占立,王荣福. 心脏神经显像[J]. 中华核医学与分子影杂志,2005,25(5):314-317.
Fu ZhanLi ,Wang RongFu. Cardiac neurological imaging[J] . Chin J Nucl Med, 2005, 25(5): 314-317(in Chinese).
[29] Zhang H, Huang R, Pillarsetty N V, et al. Synthesis and evaluation of [18F]Fluorine-labeled benzyl-guanidine analogs for targeting the human norepinephrine transporter[J]. Eur J Nucl Med Mol Imaging, 2014, 41(2): 322.
[30] Li S T, Holmes C, Kopin I J, et al. Aging-related changes in cardiac sympathetic function in humans, assessed by 6-18F-fluorodopamine PET scanning[J]. J Nuc Med, 2003, 44(10): 1 599-1 603.
[31] Jung Y W, Jang K S, Gu G, et al. [18F]Fluoro-Hydroxyphenethylguanidines: efficient synthesis and comparison of two structural isomers as radiotracers of cardiac sympathetic innervation[J]. ACS Chem Neurosci, 2017, Mar 27. [Epub ahead of print] doi: 10.1021/acschemneuro.7b00051.
[32] Gaertner F C, Wiedemann T, Yousefi B H, et al. Preclinical evaluation of18F-LMI1195 for in vivo imaging of pheochromocytoma in the MENX tumor model[J]. J Nucl Med,2013, 54(12): 2 111.
[33] Park-Holohan S J, Asselin M C, Turton D R, et al. Quantification of [11C]GB67 binding to cardiacalphal-adrenoceptors with positron emission tomography: validation in pigs[J]. Eur J Nucl Med Mol Imaging, 2008, 35(9): 1 624-1 635.
[34] Hendrikx G, Vöö S, Bauwens M, et al. SPECT and PET imaging of angiogenesis andarteriogenesis in preclinical models of myocardialischemia and peripheral-vascular disease[J]. Eur J Nucl Med Mol Imaging, 2016, 43(13): 2 433-2 447.
[35] Makowski M R, Ebersberger U, Nekolla S, et al. In vivo molecular imaging of angiogenesis, targeting alphavbeta3 integrin expression, in a patient after acute myocardial infarction[J]. Eur Hear J, 2008, 29(18): 2 201.
[36] Van Der Gucht A, Galat A, Rosso J, et al.18F-NaF PET/CT imaging in cardiac amyloidosis[J]. J Nucl Cardiol, 2016, 23(4): 846-849.
[37] Lee S P, Lee E S, Choi H, et al.11C-Pittsburgh B PET imaging in cardiac amyloidosis[J]. JACC Car-diovasc Imaging, 2015, 8(1): 50-59.
[38] Sarikaya I. Cardiac applications of PET[J]. Nucl Med Commun, 2015, 36(10): 971-985.
[39] Lohrke J, Siebeneicher H, Berger M, et al.18F-GP1, a novel fluorine-18 labeled tracer designed for PET imaging of thrombi with high detection sensitivity and low background[J]. J Nucl Med & Mol Imaging, 2017, Mar 16. [Epub ahead of print]. doi: 10.2967/jnumed.116.188896.
[40] Garcia J, Tang T, Louie A Y. Nanoparticle-based multimodal PET/MRI probes[J]. Nanomedicine, 2015, 10(8): 1 343-1 359.
[41] Tu C, Ng T S, Jacobs R E, et al. Multimodality PET/MRI agents targeted to activated macrophages[J]. Journal of Biological Inorganic Chemistry, 2014, 19(2): 247-258.
[42] 刘志弢,袁绍华. PET/MRI在心脏核医学中的应用研究[J]. 核电子学与探测技术, 2013,33(3):263-271.
Liu Zhitao,Yuan Shaohua. Analysis on the application trends of PET/MRI in nuclear cardiology[J]. Nuclear Electronics & Detection Technology, 2013, 33(3): 263-271(in Chinese).
[43] Torigian D A, Zaidi H, Kwee T C, et al. PET/MR imaging: technical aspects and potential clinical applications[J]. Radiology, 2013, 267(1): 26-44.

