异甜菊醇对骨肉瘤细胞U-2OS生长的影响
王小侠,张 珏,李 建,夏咏梅,潘 红
1.江南大学食品科学与技术国家重点实验室,化学与材料工程学院,江苏 无锡 214122;2.江苏省原子医学研究所卫生部核医学重点实验室,江苏 无锡 2140631
异甜菊醇对骨肉瘤细胞U-2OS生长的影响
王小侠1,张 珏2,李 建2,夏咏梅1,潘 红1
1.江南大学食品科学与技术国家重点实验室,化学与材料工程学院,江苏 无锡 214122;2.江苏省原子医学研究所卫生部核医学重点实验室,江苏 无锡 2140631
[摘要]背景与目的:骨肉瘤恶性程度高、发展迅速、易转移且致残致死率高;其常用化疗药物的长期应用不良反应较大,存在着一定的局限性。异甜菊醇具有四环二萜结构,是很多抗癌药的合成起始剂,但其自身的抗癌活性鲜有报道。该研究旨在考察异甜菊醇对骨肉瘤细胞U-2OS生长的影响,并初步探讨其作用机制。方法:通过MTT实验检测异甜菊醇对U-2OS细胞生长的影响;分别通过Hoechst 33342和PI染色分析细胞状态,检测细胞活性氧和细胞膜电位;用流式细胞术分析异甜菊醇处理细胞后细胞周期;通过蛋白[质]印迹法(Western blot)检测凋亡相关蛋白Bcl-2、Bax的差异表达。结果:异甜菊醇对骨肉瘤细胞U-2OS的抑制呈现出时间和剂量依赖性;染色和流式细胞术实验显示,异甜菊醇对骨肉瘤细胞U-2OS作用24 h观察到细胞S期周期阻滞,48 h时观察到细胞凋亡;随着药物浓度升高活性氧显著增多,细胞膜电位逐渐降低,促凋亡相关蛋白Bax的表达上调,抗凋亡相关蛋白Bcl-2的表达下调。结论:异甜菊醇对人骨肉瘤U-2OS细胞有抑制生长作用,其作用机制可能与上调Bax及下调 Bcl-2等凋亡相关蛋白的表达有关。
[关键词]异甜菊醇;U-2OS;生长抑制;凋亡
Correspondence to: XIA Yongmei E-mail: ymxia@jiangnan.edu.cn
骨肉瘤是一种起源于间叶组织的恶性肿瘤,好发于儿童和青少年的股骨远端、胫骨近端,其恶性程度高、发展迅速、易转移至肺、脑等组织,预后较差,致残、致死率高[1-3]。骨肉瘤的发生、发展是多途径、多因素共同作用的复杂过程[4-5]。常用化疗药物如氟尿嘧啶(5-fluorouracil,5-FU)、甲氨蝶呤(methotrexate,MTX)、顺铂(cisplatin,DDP)等长期应用不良反应较大,存在着一定的局限性[6-7]。
异甜菊醇具有四环二萜结构,有保护心肌[8]、抗高血压[9]、降低血糖生成[10]以及细胞毒作用[11]和抗肿瘤[12-13]等生物活性。异甜菊醇是很多抗癌药的合成起始剂,但其自身的抗癌活性鲜有报道。本研究就异甜菊醇对人骨肉瘤细胞系U-2OS增殖、凋亡的影响及可能的作用机制进行初步探讨,为异甜菊醇应用于人骨肉瘤治疗提供理论依据。
1 材料和方法
1.1主要试剂及仪器
5-FU购自美国Sigma公司,DMEM培养基购自美国Gibco公司,胎牛血清购自杭州四季青生物工程材料有限公司,青霉素、链霉素、胰蛋白酶、Hoechst 33342、PI、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、细胞裂解液、苯甲基磺酰氟(PMSF)、BCA蛋白检测试剂盒、抗体稀释液、ECL化学发光试剂盒、活性氧检测试剂盒(DCFH-DA分子探针)和线粒体膜电位检测试剂盒(JC-1)均购自上海碧云天生物技术有限公司,Bcl-2、Bax和β-actin兔抗单克隆抗体购自美国CST公司,辣根过氧化物酶标记的二抗购自美国Santa Cruz公司,异甜菊醇(isosteviol)由实验室制备(HPLC检测纯度为99%)。所有化学试剂都是分析纯。
超净工作台(SW-CJ-2FD型双人单面净化工作台)购自苏州净化设备有限公司,μQuant酶标仪购自美国 Bio-Tek公司,XDS-1A倒置相差显微镜、BX51TRF荧光显微镜购自日本Olympus公司,3111生化培养箱购自美国Thermo公司,FACSAria流式细胞仪购自美国Becton Dickinson公司,ChemiDoc MP凝胶成像仪购自美国Bio-Rad公司。
1.2细胞培养
人骨肉瘤细胞株U-2OS购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。细胞置于含10%胎牛血清的DMEM高糖培养基中,于37℃、CO2体积分数为5%的饱和湿度下培养,取对数生长期细胞试验。
1.3MTT法检测[14]
将对数生长期的细胞用0.25%胰蛋白酶消化后以4×104个/mL的浓度接种于96孔板中,每孔100 μL,置于培养箱中培养过夜。吸出孔内培养基,然后每孔加200 μL含有一定浓度5-FU、异甜菊醇药物的培养基,温育后每孔分别加入20 μL MTT溶液(用PBS溶解,5 mg/mL),于培养箱温育4 h后,吸弃上清液,每孔加入150 μL DMSO溶解结晶,在微量振荡器上振荡10 min,用酶标仪在570 nm下测定吸光度。细胞生长抑制率=(1- D实验组570 nm/D对照组570 nm)×100%。用倒置显微镜观察不同药物浓度作用24、48 h后96孔板内细胞形态及生长情况,并显微拍照。
1.4Hoechst 33342和PI双染荧光法[15]
将对数期细胞消化,吹打均匀,调整细胞浓度为5×104个/mL铺板,各孔100 μL,设置对照组,放于培养箱过夜,细胞贴壁后吸出上清液,测试组分别加入200 μL不同终浓度的药物,作用24、48 h 后,小心吸除上层培养液,用PBS洗涤细胞,先加入Hoechst 33342染液37℃避光温育15 min,吸出染液。再加入PI染液(终浓度均为10 μg/mL,以PBS溶解)进行双标记染色,37℃避光温育15 min,于倒置荧光显微镜下观察细胞核形态。
1.5PI单染流式细胞术检测细胞周期[16]
将对数生长期细胞消化,铺6孔板,细胞悬液20×104个/mL每孔加1 mL。放入培养箱中过夜。待6孔板内细胞贴壁后,吸取上清液,每孔加入不含血清的培养基1 mL饥饿处理过夜使细胞周期同步。将相应浓度的药物加入6孔板内,设置对照组。作用24、48 h后将孔内上清液吸出,每孔加入消化液1 mL,将消化下来的细胞和上清液一起放于离心管离心 (200×g,离心3 min),倒掉上清液,加1 mL PBS吹打重悬,再离心3 min。倒掉上清液,加入70%乙醇2 mL吹打成悬浮液放于4℃冰箱中固定4 h以上。固定好后取出细胞,200×g,离心3 min,分两次用PBS清洗去除乙醇,离心去除PBS,加入PI染液 (50 μg/mL RNase,0.1% TritonX-100,0.1 mmol/L EDTA,50 μg/mL PI),4℃冰箱温育30 min。用流式细胞仪检测,数据分析使用软件Modifit LT 3.2.1。
1.6异甜菊醇对U-2OS细胞活性氧的影响
原位装载DCFH-DA分子探针,用荧光共聚焦显微镜直接观察[17]。由于细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF,以细胞中DCF的荧光强度表征细胞内活性氧的水平。按1∶1 000用无血清培养液稀释DCFH-DA,终浓度为10 μmol/L。异甜菊醇作用24 h后去除细胞培养液,6孔板每孔加入稀释好的DCFH-DA 1 mL,37℃细胞培养箱内温育20 min,用PBS轻轻洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。
1.7原位装载JC-1荧光探针检测线粒体膜电位[16,18-19]
药物作用24 h后用PBS轻轻洗涤细胞2次,吸取500 μL 缓冲液,加入1 μL JC-1,涡旋混匀配成JC-1工作液;每孔加入取50 μL JC-1工作液,于37℃、CO2体积分数为5%的培养箱中温育15~20 min,吸弃工作液,用缓冲液洗2次;再每孔加入50 μL缓冲液,用荧光显微镜观察橙红色和绿色荧光的变化,通过荧光颜色的转变来检测线粒体膜电位的变化,从橙红色荧光到绿色荧光的转变标示着细胞膜电位的下降。
1.8蛋白[质]印迹法(Western blot)检测凋亡相关基因蛋白水平表达[19]
将处于对数生长期的细胞接种于6孔板,培养过夜后加入含有异甜菊醇的培养基,温育24 h后收集细胞,加入细胞裂解液并在冰上裂解5 min,然后置于-80℃和37℃反复冻融3次使细胞充分裂解,于高速离心机(4℃ 2 400×g)离心15 min后取上清液,即为细胞蛋白液。以BCA蛋白浓度测定试剂盒测定蛋白浓度,按照每孔50 μg的总蛋白量上样,经12% SDS-PAGE电泳后再转移至聚偏氟乙烯(PVDF)膜上,用质量浓度为5%的脱脂奶粉室温封闭条带1 h后,再用1∶1 000比率稀释的一抗在4℃下温育过夜。TBST溶液漂洗条带3次后再用辣根过氧化物酶(HRP)标记的二抗(1∶1 000)室温温育1 h,最后加入等体积混合的ECL化学发光试剂A液和B液后进行检测,用Image Lab 4.0软件(Bio-Rad,USA)分析条带。
1.9统计学处理
采用SPSS 18.0统计软件对数据进行分析,组间比较采用方差分析进行比较。P<0.05为差异有统计学意义。
2 结 果
2.1异甜菊醇对 U-2OS细胞生长的作用
以5-FU为对照,异甜菊醇对U-2OS细胞生长的作用如图1,作用前后细胞形态变化见图2。MTT实验结果显示,异甜菊醇作用24、48 h后的IC50值分别为148.75和86.69 μg/mL。在所观察剂量(25~500 μg/mL)下,异甜菊醇对U-2OS细胞增殖的抑制作用呈明显的时间依赖性和剂量依赖性。异甜菊醇对骨肉瘤细胞作用后,细胞密度下降,通透性变差,失去原有的形状,变圆,细胞质固缩,碎片增多,且随药物浓度增大和作用时间延长致死现象越明显,与MTT实验结果对应(图2)。
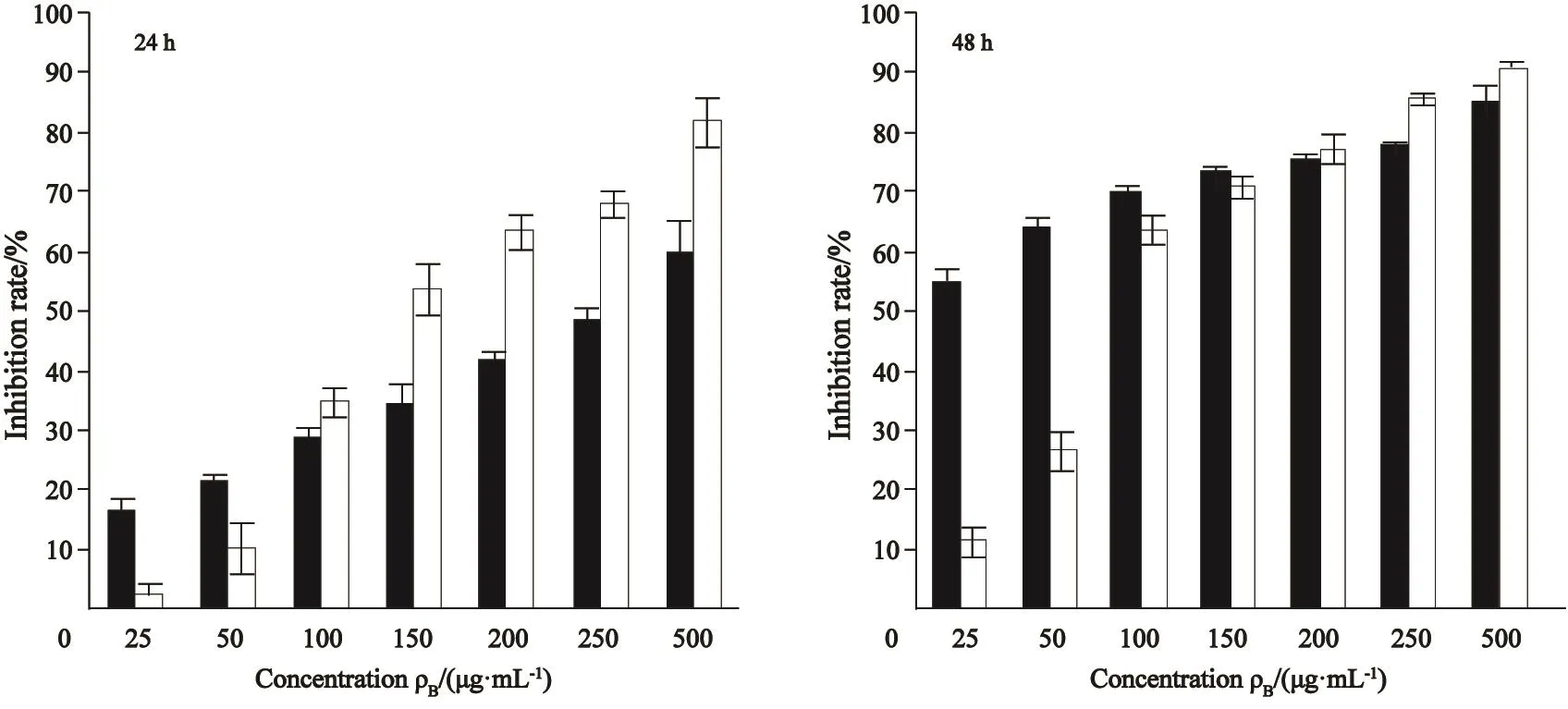
图 1 5-FU和异甜菊醇对U-2OS细胞生长的作用Fig. 1 U-2OS cells’ growth in the presence of 5-FU and isosteviol
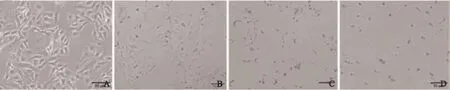
图 2 异甜菊醇作用48 h后细胞形态Fig. 2 Cell morphology after the treatment of isosteviol for 48 h
2.2异甜菊醇对U-2OS细胞凋亡形态的影响
Hoechst 33342和PI染色显示,异甜菊醇处理组的细胞密度明显下降,出现亮蓝色,细胞体积减小,核染色质浓集。在浓度高于150 μg/mL时,异甜菊醇作用后的U-2OS细胞呈现出较多的月形甚至碎裂,染色体碎裂、浓集细胞被染成亮蓝色或者淡红色,有的出现凋亡小体(图3)。
2.3异甜菊醇对U-2OS细胞周期的影响
异甜菊醇作用后,随其浓度升高U-2OS细胞凋亡比例增加,24 h出现Sub-G1凋亡状态峰;作用48 h后凋亡比例大幅上升,这与图3染色实验的相应凋亡形态对应一致(图4)。S期细胞比例随异甜菊醇浓度升高而逐渐减少。与对照组相比,作用组S期细胞比例降低了27.62%,说明在异甜菊醇作用24 h后呈现S期阻滞现象(图5)。
2.4异甜菊醇对U-2OS细胞活性氧的影响
异甜菊醇对U-2OS作用24 h后,活性氧含量与异甜菊醇浓度呈正相关,提示异甜菊醇能增加其活性氧的产生(图6)。
2.5异甜菊醇对对线粒体膜电位的影响
异甜菊醇对U-2OS作用24 h后,随异甜菊醇浓度升高绿色荧光显著增多,橙色荧光显著降低[19],且有明显的剂量依赖性,表明细胞膜电位逐渐降低(图7)。
2.6异甜菊醇对凋亡相关蛋白表达的影响
与对照组相比,异甜菊醇作用后在高剂量(200 μg/mL)时明显下调U-2OS细胞抗凋亡蛋白Bcl-2[14]的表达(P<0.01)。50、100和200 μg/mL浓度的异甜菊醇都使U-2OS细胞促凋亡蛋白Bax[14]的表达水平显著升高(P<0.01),且呈现出浓度梯度效应(图8)。
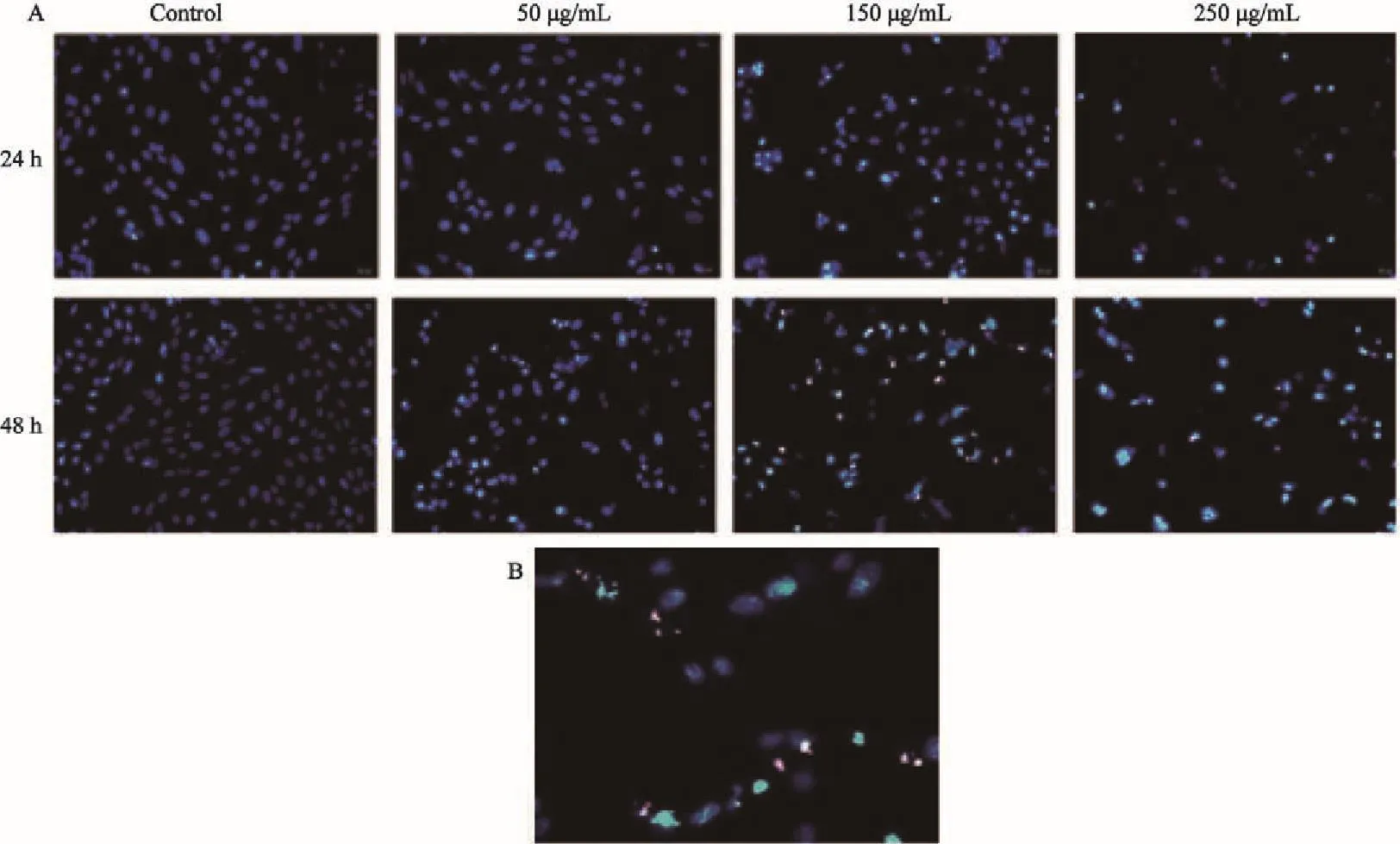
图 3 异甜菊醇作用骨肉瘤细胞U-2OS后的形态观察Fig. 3 Hoechst 33342 and PI staining of isosteviol-treated U-2OS cells
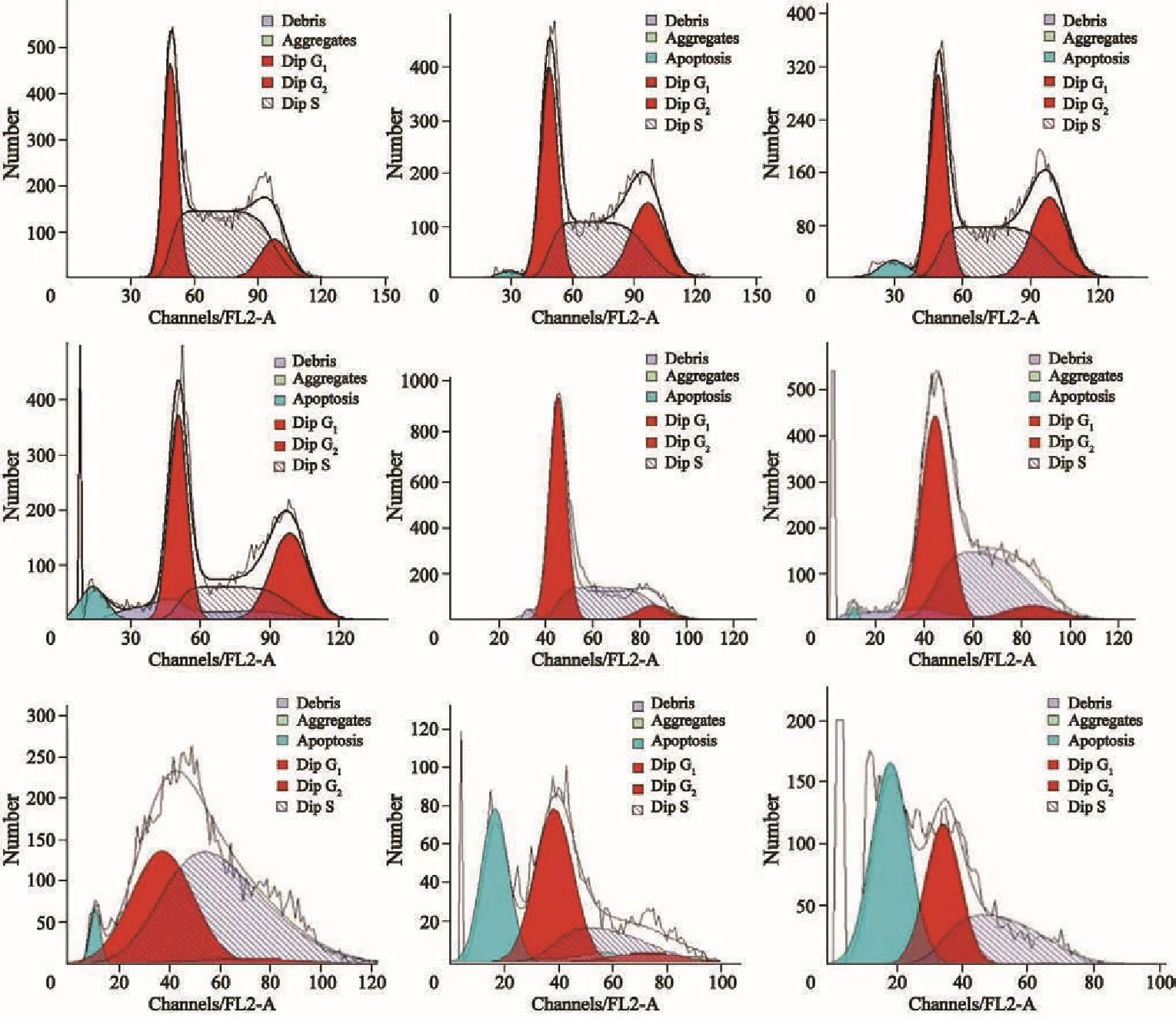
图 4 流式细胞术检测异甜菊醇对U-2OS细胞作用后细胞周期Fig. 4 The cell cycle analysis of U-2OS cells treated with isosteviol by flow cytometry
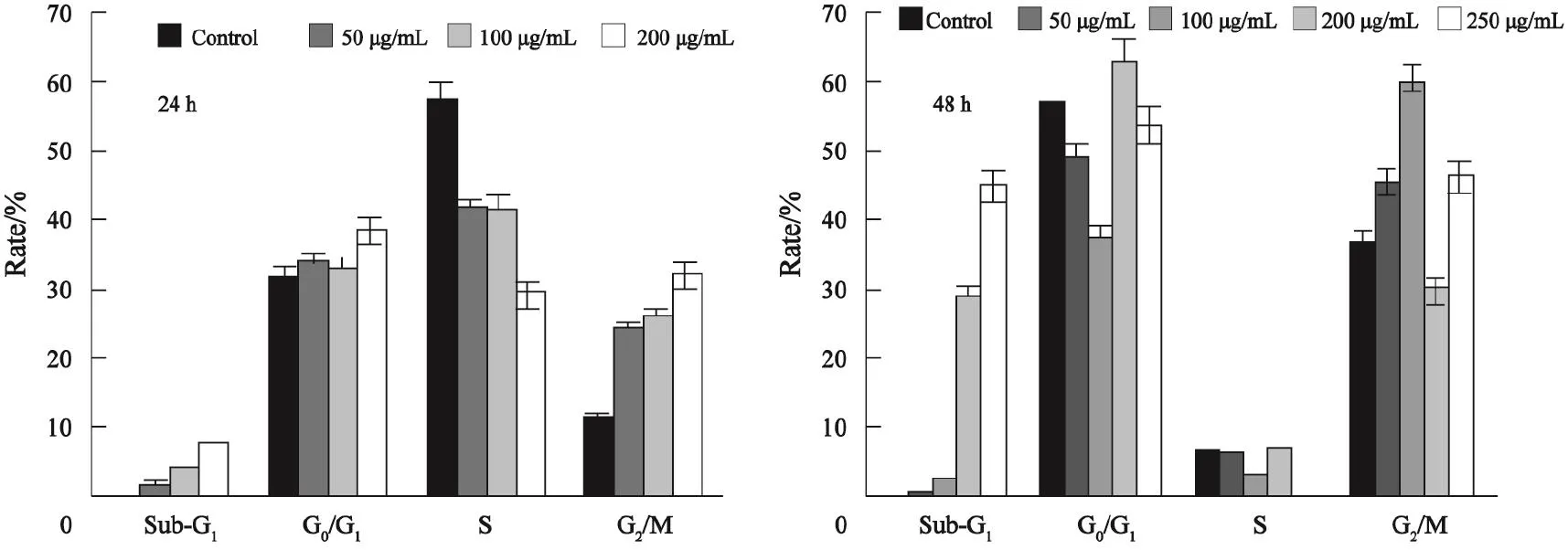
图 5 异甜菊醇作用后细胞各周期比例Fig. 5 The proportion of each cell cycle after isosteviol treatment
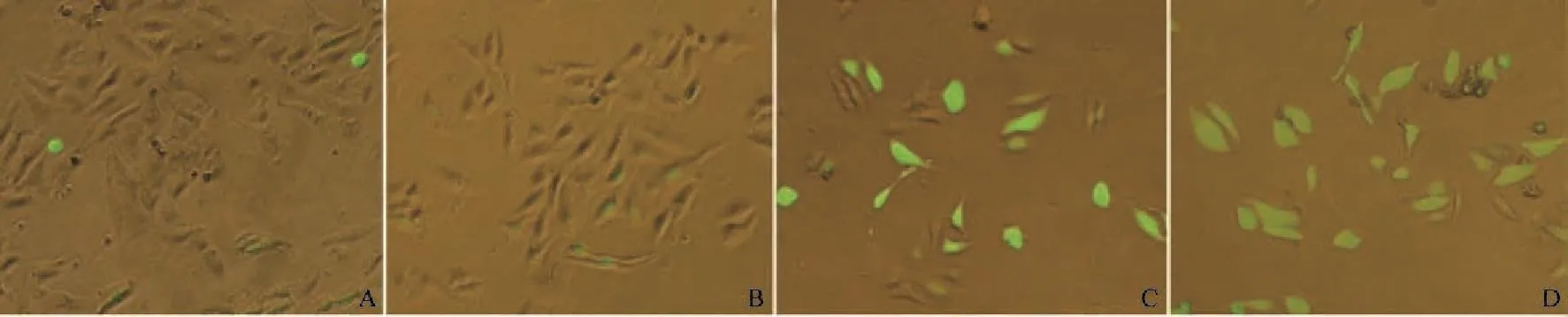
图 6 异甜菊醇对U-2OS作用24 h后活性氧状况Fig. 6 Reactive oxygen species generation affected by different concentrations of isosteviol (×400)
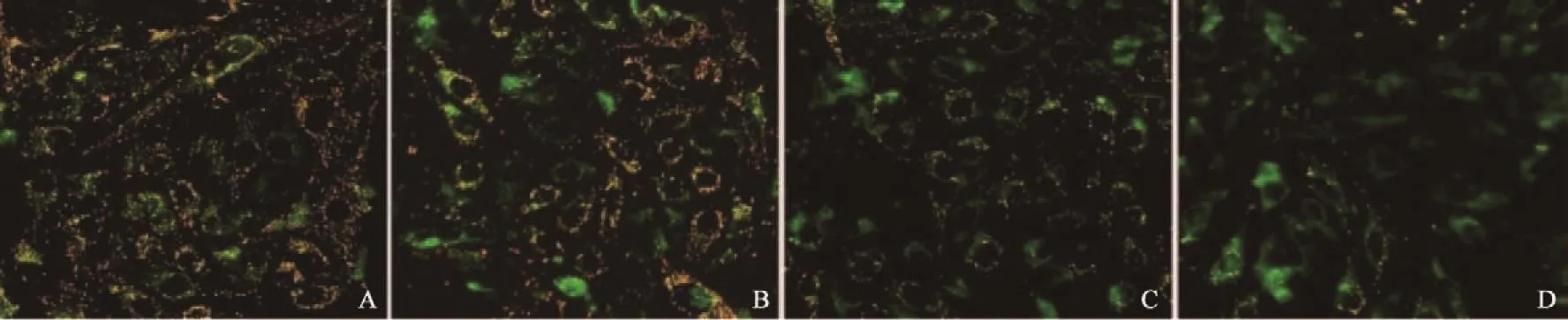
图 7 异甜菊醇对U-2OS细胞膜电位影响Fig. 7 U-2OS cell membrane potential affected by isosteviol (×400)

图 8 Western blot检测异甜菊醇对U-2OS细胞凋亡相关蛋白表达的影响Fig. 8 Expression of U-2OS cells apoptosis-related proteins after treatment with isosteviol for 24 h
3 讨 论
在本实验中,MTT检测表明,异甜菊醇对U-2OS有明显的抑制增殖作用,而Hoechst 33342和PI双染荧光检测发现异甜菊醇作用24 h时有少量凋亡出现,48 h作用时出现大量凋亡状态细胞,且在一定浓度范围内呈现剂量依赖性。流式细胞术检测结果表明,24 h时出现S期细胞周期阻滞,细胞DNA直方图出现Sub-G1峰,在作用48 h后大量细胞出现凋亡,在一定范围内随异甜菊醇浓度升高凋亡比例逐渐升高,说明异甜菊醇促进U-2OS细胞凋亡的作用且有浓度依赖性。
较高的活性氧可作用于线粒体,促使线粒体膜通透性改变、线粒体膜电位下降、细胞色素C从线粒体内膜解离至膜间隙[20]。线粒体跨膜电位下降源于线粒体的膨胀;内膜的膨胀导致外膜的破裂,从而使与细胞凋亡有关的重要因子释放到细胞质中,致使细胞整体结构破坏、功能紊乱,发生凋亡。而实验发现作用24 h后U-2OS细胞内的活性氧明显增加且呈现浓度依赖性,且随异甜菊醇浓度升高线粒体膜电位明显降低。由此可以推测异甜菊醇作用24 h后可能刺激细胞产生过量活性氧,使膜脂质过氧化作用而破坏线粒体膜完整性[21],导致膜电位下降促进细胞凋亡[22-23]。而定位于细胞质的细胞色素C可以启动半胱天冬酶的级联活化,由半胱天冬酶3启动凋亡[24],其中活性氧的升高和线粒体膜电位的降低被视为凋亡的早期事件[25]。
再者,Bcl-2可阻止凋亡形成因子如细胞色素C等从线粒体释放,具有抗凋亡作用,而Bax可与线粒体上的电压依赖性离子通道相互作用,介导细胞色素C的释放促进细胞凋亡。而实验表明抗凋亡基因Bcl-2的蛋白表达不断降低,而促凋亡基因Bax的蛋白表达不断升高,且呈浓度依赖性。因此推测,异甜菊醇通过促进活性氧的产生,降低细胞膜电位,破坏细胞膜完整性,上调Bax的表达、下调Bcl-2的表达而促进U-2OS细胞的凋亡。综上所述,异甜菊醇可以改变骨肉瘤U-2OS细胞周期进程并发生凋亡,从而抑制U-2OS细胞生长。
[参 考 文 献]
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA-Cancer J Clin, 2011, 61(2): 69-90.
[2] MAVROGENIS A F, ROSSI G, PALMERINI E, et al. Palliative treatments for advanced osteosarcoma[J]. Eur J Orthop Surg Traumatol, 2014, 24(8): 1351-1356.
[3] MIRABELLO L, TROISI R J, SAVAGE S A. Osteosarcoma incidence and survival rates from 1973 to 2004 [J]. Cancer,2009, 115(7): 1531-1543.
[4] FUCHS B, ZHANG K, SCHABEL A, et al. Identification of twenty-two candidate markers for human osteogenic sarcoma [J]. Gene, 2001, 278(1): 245-252.
[5] BACCI G, LONGHI A, FAGIOLI F, et al. Adjuvant and neoadjuvant chemotherapy for osteosarcoma of the extremities:27 year experience at Rizzoli Institute, Italy [J]. Eur J Cancer, 2005, 41(18): 2836-2845.
[6] 牛晓辉, 徐海荣. 骨肉瘤的化疗进展[J]. 中国癌症杂志,2012, 22(9): 663-668.
[7] LONGHI A, FERRARI S, BACCI G, et al. Long-term followup of patients with doxorubicin-induced cardiac toxicity after chemotherapy for osteosarcoma [J]. Anticancer Drugs,2007, 18(6): 737-744.
[8] CHOU B H, YANG L M, CHANG S F, et al. Microbial transformation of isosteviol lactone and evaluation of the transformation products on androgen response element [J]. J Nat Prod, 2008, 71(4): 602-607.
[9] CHEN S C, CHENG J J, Hsieh M H, et al. Molecular mechanism of the inhibitory effect of trilinolein on endothelin-1-induced hypertrophy of cultured neonatal rat cardiomyocytes. [J]. Int J Cardiol, 2005, 71(6): 525-529.
[10] ISHII E L, SCHWAB A J, BRACHT A. Inhibition of monosaccharide transport in the intact rat liver by stevioside [J]. Biochem Pharmacol, 1987, 36(9): 1417-1433.
[11] LIN L H, LEE L W, SHEU S Y, et al. Study on the stevioside analogues of steviolbioside, steviol, and isosteviol 19-alkyl amide dimers: synthesis and cytotoxic and antibacterial activity [J]. Chem Pharm Bull, 2004, 52(9): 1117-1122.
[12] WU Y, DAI G F, YANG J H, et al. Stereoselective synthesis of 15-and 16-substituted isosteviol derivatives and their cytotoxic activities[J]. Bioorg Med Chem Lett, 2009, 19(6):1818-1821.
[13] ZHU S L, WU Y, LIU C J, et al. Design and stereoselective synthesis of novel isosteviol-fused pyrazolines and pyrazoles as potential anticancer agents [J]. Eur J Med Chem, 2013,65: 70-82.
[14] CHENG Z L, ZHANG J K, SHI Z L, et al.Matrine induces caspase-dependent apoptosis in human osteosarcoma cellsin vitro and in vivo through the upregulation of Bax and Fas/ FasL and downregulation of Bcl-2 [J]. Cancer Chemother Pharmacol, 2012, 69(2): 317-331.
[15] WANG B, YU T, DONG X, et al. Edwardsiella tarda invasion of fish cell lines and the activation of divergent cell death pathways [J]. Vet Microbiol, 2013, 163 (3-4): 282-289.
[16] SONG J, SHU L, ZHANG Z H, et al. Reactive oxygen speciesmediated mitochondrial pathway is involved in Baohuoside I-induced apoptosis in human non-small cell lung cancer [J] Chem Biol Interact, 2012, 199(1): 9-17.
[17] WANG Y, WANG L, ZHA F X, et al. Inhibition of PARP prevents angiotensin II-induced aortic fibrosis in rats [J]. Int J Cardiol, 2013, 167(5): 2285-2293.
[18] LIU L, GU L, MA Q, et al. Resveratrol attenuates hydrogen peroxide-induced apoptosis in human umbilical vein endothelial cells [J]. Eur Rev Med Pharmacol Sci, 2013,17(1): 88-94.
[19] YANG F, SUN X, SHEN J, et al. A recombined protein (rSj16)derived from Schistosoma japonicum induces cell cycle arrest and apoptosis of murine myeloid leukemia cells [J]. Parasitol Res, 2013, 112(3): 1261-1272.
[20] DJAVAHERI-MERGNY M, WIETZERBIN J. 2-Methoxyestradiol induces apoptosis in Ewing sarcoma cells through mitochondrial hydrogen peroxide production [J]. Oncogene, 2003, 22(17): 2558-2567.
[21] PA DE FARIA, BETTANIN F, CUNHA R L, et al. Cytotoxicity of phenothiazine derivatives associated with mitochondrial dysfunction: A structure-activity investigation [J]. Toxicology, 2015, 330: 44-54. doi: 10.1016/ j.tox.2015.02.004.
[22] KROEMER G, GALLUZZI L, BRENNER C. Mitochondrial membrane permeabilization in cell death [J]. Physiol Rev,2007, 87(1): 99-163.
[23] LI Y Y, ZHANG Z, WANG Z H, et al. rBTI induces apoptosis in human solid tumor cell lines by loss in mitochondrial transmembrane potential and caspase activation [J]. Toxicol Lett, 2009, 189(2): 166-175.
[24] MARZO I, BRENNER C, ZAMZAMI N, et al. Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis [J]. Science, 1998, 281(5385): 2027-2031.
[25] KARBOWSKI M, KURONO C, WOZNIAK M, et al. Free radical-induced megamitochondria formation and apoptosis [J]. Free Radic Biol Med, 1999, 26(3): 396-409.
The effect of isosteviol on growth of human osteosarcoma cell lines U-2OS
WANG Xiaoxia1, ZHANG Jue2, LI Jian2, XIA Yongmei1, PAN Hong1(1.State Key Laboratory of Food Science and Technology, School of College of Chemical and Material Engineering, Jiangnan University, Wuxi 214122, Jiangsu Province, China; 2. Key Laboratory of Nuclear Medicine of Ministry of Health, Jiangsu Institute of Nuclear Medicine, Wuxi 214063, Jiangsu Province, China)
[Key words]Isosteviol; U-2OS; Growth inhibition; Apoptosis
[Abstract]Background and purpose: Osteosarcoma, a highly malignant bone tumor, develops rapidly. The current medicines for osteosarcoma present some limitations with serious side effects of long-term use. Isosteviol has the structure of tetracyclic diterpene which is the starting material of many anti-cancer drugs. However, its anti-tumor activity has been rarely reported. This study investigated the effect of isosteviol on proliferation of human osteosarcoma cell line U-2OS. Methods: The effect of isosteviol on U-2OS cell proliferation was assayed by MTT method. Cellular morphologic changes were observed under an inverted phase contrast microscope. The cell condition was observed with Hoechst 33342 and PI staining. Generation of reactive oxygen species and cell membrane potential were detected as well. The cell cycles were analyzed with flow cytometry. The expressions of apoptosis-related proteins Bcl-2 and Bax were measured by Western blot assay. Results: The result indicates that isosteviol suppressed the growth of U-2OS cells in time- and concentration-dependent manner. Isosteviol could cause S phase cell cycle arrest at 24 h and apoptosis at 48 h. With the increased drug concentration, reactive oxygen species increased significantly, and the membrane potential gradually reduced. In addition, isosteviol treatment enhanced the expression of Bax but reduced that of Bcl-2. Conclusion: The inhibition of isosteviol on cell growth of U-2OS cells was possibly caused by promoting apoptosis through regulating the apoptosis-related protein expressions, such as the enhancement of Bax and reduction of Bcl-2expression.
DOI:10.3969/j.issn.1007-3969.2016.03.005
中图分类号:R738.1
文献标志码:A
文章编号:1007-3639(2016)03-0230-08
基金项目:国家自然科学基金(31171752,31371837)。
通信作者:夏咏梅 E-mail:ymxia@jiangnan.edu.cn
收稿日期:(2015-09-10 修回日期:2015-12-20)

