卵巢癌血清相关miRNAs的筛选及其临床意义
朱 滔,张 平,郑 伟
1.浙江大学医学院附属第二医院妇产科,浙江 杭州 310009;2.浙江省肿瘤医院妇瘤科,浙江 杭州 310022
卵巢癌血清相关miRNAs的筛选及其临床意义
朱 滔1,张 平2,郑 伟1
1.浙江大学医学院附属第二医院妇产科,浙江 杭州 310009;2.浙江省肿瘤医院妇瘤科,浙江 杭州 310022
[摘要]背景与目的:卵巢癌预后较差,发现时通常是晚期,需找寻与卵巢癌发生、发展相关的诊治方法。该研究检测miRNA在上皮性卵巢癌患者术前外周血清及良性卵巢肿瘤患者外周血清中表达情况的差异,筛选差异有统计学意义的miRNA并分析其与上皮性卵巢癌患者临床病理特征、预后等的关系。方法:定制研究相关的48种miRNA表达谱芯片,通过TaqMan低密度微阵列芯片,筛选出有统计学意义的miRNA。采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)法验证筛选的miRNA在卵巢良、恶性肿瘤患者血清中的表达情况,选择具有统计学意义的miRNA行大样本验证并分析其与肿瘤分期、组织病理及预后等的关系。结果:通过TaqMan低密度微阵列芯片筛选和RTFQ-PCR验证,发现miR-125b在上皮性卵巢癌患者血清中的表达高于良性肿瘤患者(P=0.039),miR-125b在早期患者中的表达量高于晚期患者(P=0.003),术后无残余肿瘤患者表达量高于术后有残余肿瘤患者(P=0.013)。血清miR-125b高表达有利于卵巢癌患者无进展生存期(progression-free survival,PFS)延长(P=0.003),但对总生存期(overall survival,OS)无明显影响(P=0.069)。结论:miR-125b在上皮性卵巢癌的发生、发展中起着关键作用,与患者预后相关,是预测卵巢癌复发的潜在基因,但在肿瘤不同期别的表达情况发生变化,在早期作用比较明显,在晚期或肿瘤残余较多的患者表达较不明显,其作用机制有待进一步研究。
[关键词]上皮性卵巢癌;miRNA表达谱芯片;miR-125b;预后
Correspondence to: ZHENG Wei E-mail: zhengwei@zju.edu.cn
卵巢癌是女性生殖系统三大恶性肿瘤之一,死亡率居妇科肿瘤之首。我国妇女的发病率呈逐年上升的趋势,近20年来其占女性全部恶性肿瘤死亡的构成比上升92.92%[1]。调查显示,早期(Ⅰ期)上皮性卵巢癌患者的5年生存率高于85%[2]。然而,75%以上的卵巢癌患者在晚期确诊,Ⅲ期卵巢癌患者的5年生存率小于40%,Ⅳ期卵巢癌患者的5年生存率小于20%[2-3]。卵巢癌预后较差,主要与卵巢癌诊断均为较晚期及现有的治疗方法对不能手术者疗效欠佳有关。因此,找寻与卵巢癌发生、发展相关的诊治方法迫在眉睫。
非编码单链RNA分子(microRNA,简称miRNA)是长度为19~24 nt的非编码小分子RNA,它在转录后水平通过作用于信使RNA(mRNA)3’端的非转录区,从而使mRNA降解或抑制蛋白质的翻译来调节基因的表达,进而影响细胞变化过程中的关键步骤,如细胞周期、分化及凋亡[4]。近年miRNA是肿瘤领域的研究热点之一。研究显示,在血液肿瘤及实体肿瘤中miRNA的表达发生了变化[5]。miRNA在不同类型肿瘤中的表达是独特的,由于作用靶点及作用机制的不同,同一种miRNA在不同的细胞中发挥着癌基因或抑癌基因的作用,同时,miRNA还参与肿瘤转移及其他特性[6]。研究发现,miRNA在组织和细胞中的表达表现为显著的肿瘤相关性、组织特异性和表达稳定性[7];而且miRNA在外周血中的表达同样具有肿瘤相关性和组织特异性,其表达稳定性更为显著[8-9 ],能够稳定地被检测并且提示肿瘤状态。
miRNA在卵巢癌组织及血清中的相关研究显示,miRNA在包括卵巢癌在内的肿瘤中的异常表达与肿瘤的组织类型及预后相关[10-11],miRNA在卵巢癌患者与健康人中有不同的表达谱,且在组织、细胞和血清中的表达水平相当,基于血清检测具有创伤小、稳定性好等优点,本研究通过检测卵巢良、恶性肿瘤患者血清中miRNA表达差异,分析其差异和临床病理特征之间的关系,为进一步研究血清中miRNA在卵巢癌中的作用机制提供依据。
1 资料和方法
1.1一般资料
病例组血清样本取自2009年2月—2012年1月在浙江省肿瘤医院收治行手术治疗的上皮性卵巢癌患者共135例,年龄37~78岁,平均中位年龄54岁。参照国际妇产科联合会(Internationa Federation of Gynecology and Obstetrics,FIGO分类标准和WHO分级标准:早期(Ⅰ期和Ⅱ期33例,晚期(Ⅲ期和Ⅳ期)102例;浆液性腺癌93例,非浆液性卵巢癌患者为42例;病理分级G1、G2级分化者18例,G3级 106例,缺失1例;术后有残余肿瘤62例,无残余肿瘤71例,缺失2例。同时收集60例卵巢良性上皮性肿瘤患者临床血清样本为对照组。血清样本取自患者入院后术前空腹时肘静脉全血10 mL,置于未加抗凝试剂的试管中,标本采集后在室温下静置1 h,离心后(1 680 ×g)去上清液,置于EP管中,保存于-80 ℃冰箱中。
1.2主要材料和试剂
血清miRNA提取试剂盒购自德国Qiagen公司,miRNA逆转录试剂盒、定制miRNA预扩增逆转录引物池、TaqMan低密度微阵列芯片和实时荧光定量聚合酶链反应(real-time fluorescen quantitative polymerase chain reaction,RTFQ PCR)试剂购自美国Applied Biosystems公司,RTFQ-PCR反应miR-125b基因标准品购自上海吉玛制药技术有限公司。
1.3研究方法
前期数据挖掘,定制研究相关的48种miRNA表达谱芯片。定制研究相关miRNA表达谱芯片,通过TaqMan低密度微阵列芯片,检测挖掘的miRNA在部分上皮性卵巢癌患者血清、卵巢良性肿瘤血清样本中的表达差异情况,10 张TaqMan低密度微阵列芯片总共筛选了135例上皮性卵巢癌患者中的18例血清及60例良性血清中的16例血清,每个样本筛查48种miRNA。再利用RTFQ-PCR技术在20例上皮性卵巢癌患者血清及18例良性卵巢肿瘤患者血清中进一步验证miRNA的表达情况,经以上两次筛查验证,最终确定目的miRNA。在135例上皮性卵巢癌患者血清与38例卵巢良性肿瘤患者血清中进一步验证目的miRNA的表达水平并分析了其与卵巢癌患者的生存预后及相关临床病理学特征之间的关系。
1.4随访
所有卵巢癌患者经手术治疗后均进行电话随访,术后2年平均3个月随访1次,3年及以后每半年随访1次,本次随访时间为2015年6 月10日。患者的无进展生存期(progression-free survival,PFS)为3~69个月,中位PFS为28个月。总生存期(overall survival,OS)为4~75个月,平均中位生存期为40个月。卵巢癌复发人数为58例,死亡人数为44例。
1.5统计学处理
2 结 果
2.1卵巢癌血清相关miRNAs的筛选结果
通过TaqMan低密度微阵列芯片,检测挖掘的miRNA在部分上皮性卵巢癌患者血清、卵巢良性肿瘤血清样本中的表达差异情况,10张TaqMan低密度微阵列芯片总共筛选了135例上皮性卵巢癌患者中的18例血清及60例良性血清中的16例血清,其中miR-20a (P=0.953)、miR 125b(P=0.044)、miR-126(P=0.209)在卵巢良、恶性肿瘤血清中表达有差异(P<0.05)。采用RTFQ PCR在135例上皮性卵巢癌患者血清与38例卵巢良性肿瘤患者血清中进一步验证miR-125b的表达水平。结果显示,miR-125b在上皮性卵巢癌患者血清中的表达量高于卵巢良性肿瘤患者(P=0.039,图1)。
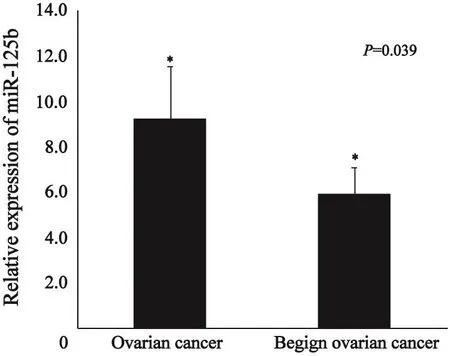
图 1 RTFQ-PCR检测上皮性卵巢癌患者血清miR-125b表达量与卵巢良性肿瘤患者血清中表达量的关系Fig. 1 Significant up-regulation of miR-125b in the serum of thmalignant ovarian cancer as compared with that in the benign ovarian tumor detected by RTFQ-PCR
2.2miR-125b表达水平与上皮性卵巢癌患者临床病理特征关系
将miR-125b在135例上皮性卵巢癌患者血清中的表达量与患者的临床病理特征进行相关性统计分析结果见表1。术后无残余肿瘤组血清miR-125b表达量高于术后有残余肿瘤组,差异有统计学意义(P=0.013);早期患者的血清miR 125b表达量高于晚期患者的血清表达量,差异有统计学意义(P=0.003);血清miR-125b表达量在不同病理类型(P=0.937)和分化程度(P=0.782)上差异均无统计学意义。
2.3miR-125b表达水平与预后的关系
将135例上皮性卵巢癌患者血清miR-125b表达量分为高表达组及低表达组。Kaplan-Meier曲线显示,miR-125b表达水平与患者PFS密切相关,高表达miR-125b的患者PFS更长(P=0.035),在OS方面无明显优势(P=0.069,图2、3)。
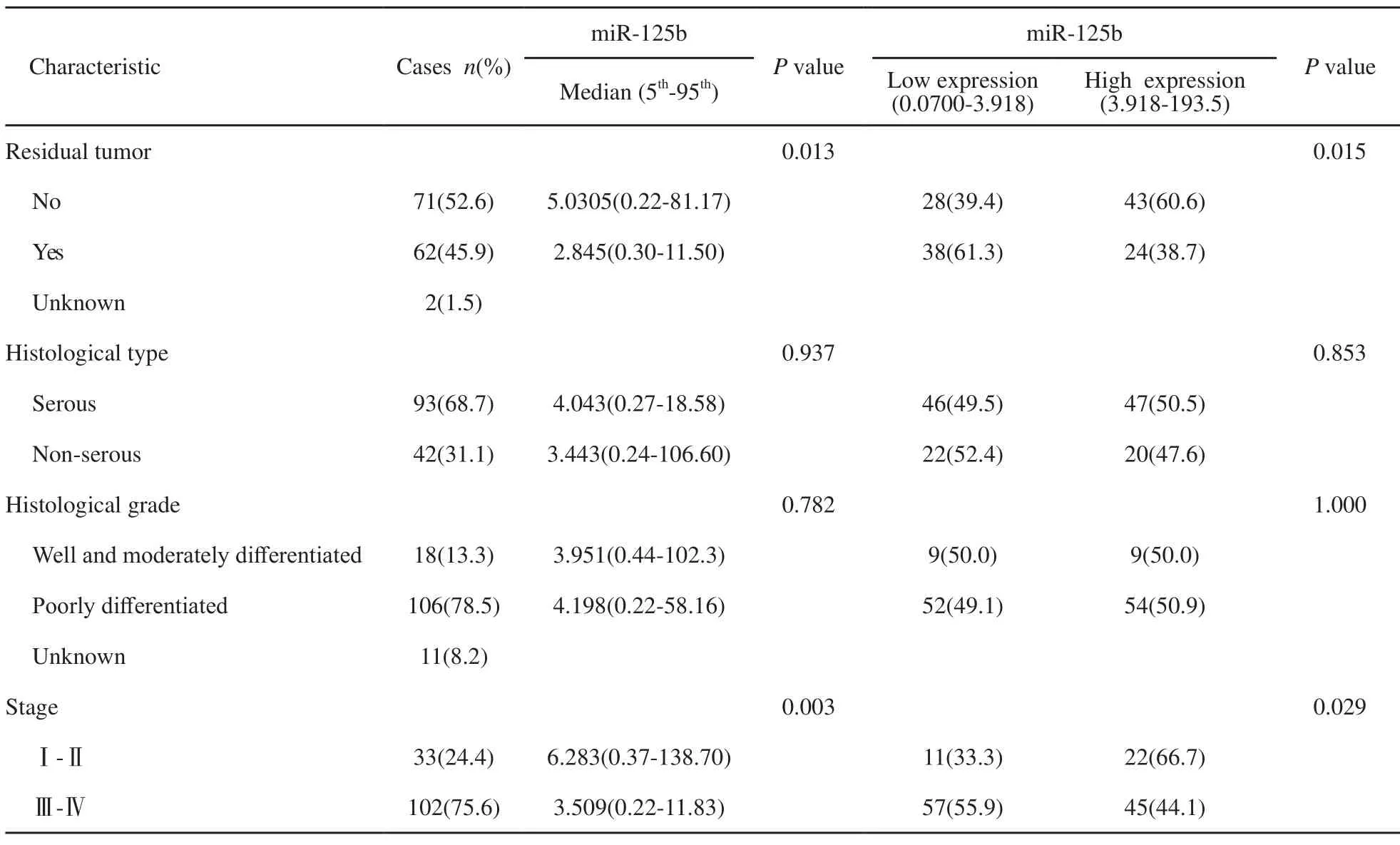
表 1 miR-125b表达水平与上皮性卵巢癌患者临床病理特征关系Tab. 1 The relationship between the expression level of serum miR-125b and clinical pathological features of epithelial ovarian cancer
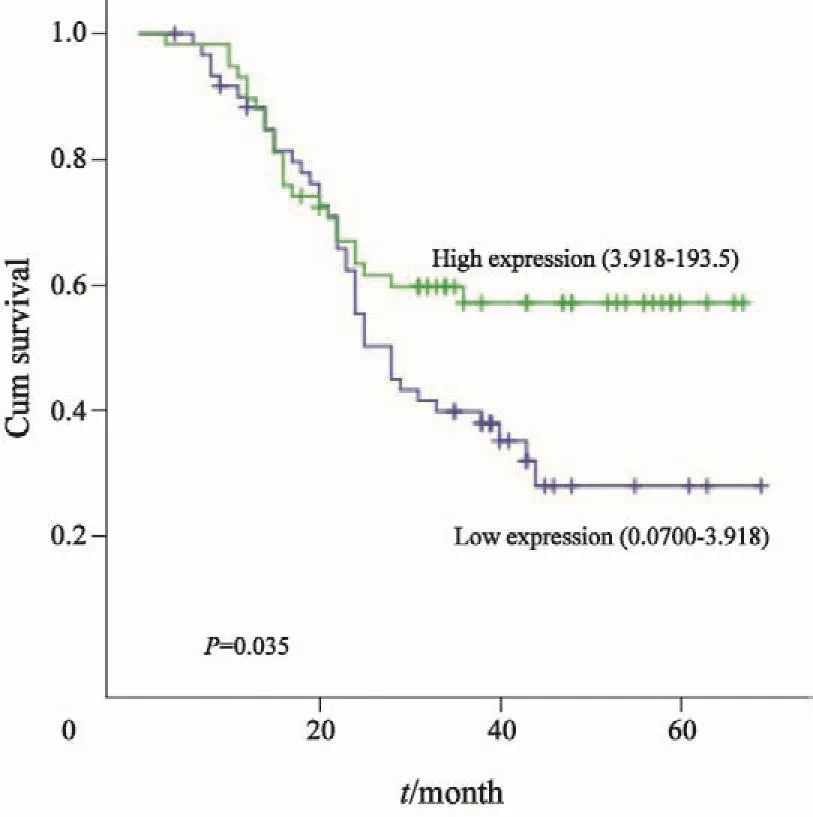
图 2 135例卵巢癌患者中miR-125b表达水平与患者PFS的关系Fig. 2 The relationship between miR-125b expression levels in serum of malignant ovarian cancer with PFS
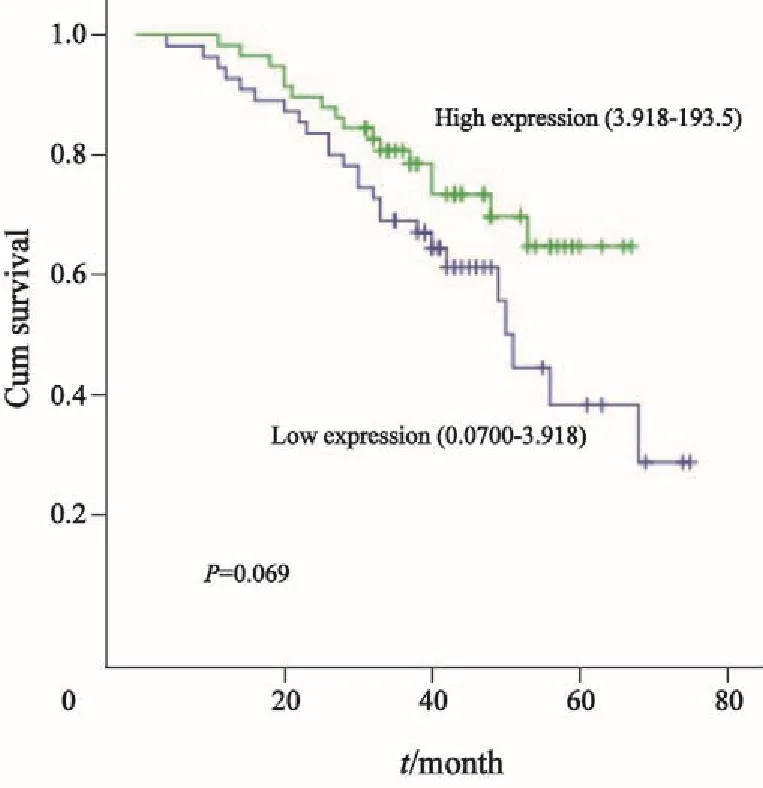
图 3 135例卵巢癌患者中miR-125b表达水平与患者OS的关系Fig. 3 The relationship between miR-125b expression levels in serum of malignant ovarian cancer with OS
3 讨 论
卵巢癌是女性最常见的恶性肿瘤之一,也是妇科肿瘤中致死率最高的肿瘤[12]。由于其临床症状隐匿,卵巢癌患者大部分在晚期确诊,其5年生存率为30%[13],预后不良。依据不同的起源,卵巢癌可分为上皮性肿瘤、性索间质肿瘤及恶性生殖细胞肿瘤。临床上以上皮性卵巢癌常见。上皮性卵巢癌进一步分为5种组织类型,即透明细胞型、子宫内膜型、黏液型、浆液型和未分化型[14]。
卵巢癌的发生与基因表达密切相关,近期miRNA与肿瘤研究是热点之一,为恶性肿瘤的发生、发展研究提供了一种新思路。Iorio等[15]首次在卵巢癌及卵巢正常组织中全基因组范围内比较了miRNA的表达情况,发现约30种miRNA表达有差异。随后其他研究也显示,卵巢癌组织中有表达失调的miRNA[16-17]。
研究表明,在各种组织中稳定表达的多种miRNA在外周血液中能够被检测到[18]。Chung等[19]发现,在卵巢癌患者血清、组织、腹水中,有88种miRNA表达升高,95种miRNA表达降低。Wei等[20]报道,miR-212在卵巢癌组织及血清中低表达。Shapira等[21]发现,卵巢癌患者与正常人血清中有22种表达不同的miRNA,良性及卵巢癌患者血清中有6种差异表达的miRNA。本研究应用TaqMan低密度微阵列芯片筛选了卵巢良、恶性肿瘤患者血清中48 种miRNA的表达情况,并进一步以RTFQ-PCR技术验证筛选结果,发现仅miR-125b在上皮性卵巢癌患者血清中的表达高于卵巢良性肿瘤患者,且差异有统计学意义(P<0.05)。卵巢良、恶性肿瘤血清miRNA表达情况的差异有助诊断卵巢癌,为找寻新的肿瘤检测指标提供新思路。
miR-125b有两个前体:miR-125b-1和miR-125b-2,其编码基因分别在人类11号和21号染色体上,但是它们具有相同的成熟miR-125b碱基序列[22]。miR-125b在不同肿瘤中作用不一样,其表达情况不同可用于疾病预后的评估。Cui等[23]分析了260例晚期非小细胞肺癌患者血清的miR-125b表达量与临床特征、化疗反应及预后之间的关系。结果显示,miR 125b在Ⅳ期患者、肿瘤病理分化差的患者及对铂类化疗治疗无反应的患者血清中表达均高于对照组(P<0.05),同时相关性分析结果显示,miR-125b的高表达与患者较差的生存显著相关(P<0.05),miR-125b是判断患者预后的独立危险因子。这提示miR-125b或许是非小细胞肺癌患者血清有意义的标志物,可用于预测疾病进展,监测治疗反应及检测疾病复发。Zhang等[24]的研究结果显示,miR-125b在侵袭性乳腺癌组织中低表达,miR-125b表达越低,患者淋巴结转移率越高(P<0.05),5年生存率也明显低于miR-125b高表达患者(53.8% v 81.8%,P=0.002)。多因素及单因素分析显示,低表达的miR-125b是乳腺癌患者不利的独立因素。
miR-125b在各种肿瘤组织中报道较多,但是在肿瘤血清中的作用还未有广泛的研究。本研究经TaqMan低密度微阵列芯片筛选出miR 125b,进一步通过RTFQ-PCR技术在135例上皮性卵巢癌患者血清中分析其表达水平与肿瘤分期、肿瘤分化程度、病理类型、患者术后残余肿瘤状况及生存预后之间的相关性。结果显示,在135例上皮性卵巢癌患者血清中,早期患者血清miR-125b的表达量高于晚期患者血清的表达量。芯片筛选及RTFQ-PCR检测结果显示,上皮性卵巢癌患者血清的miR-125的表达量高于卵巢良性肿瘤患者血清的表达量(P<0.05);然而,miR-125b在无残余肿瘤患者血清的表达量高于有残余肿瘤患者血清的表达量(P<0.05),原因在于早期患者术后几乎无肉眼残余肿瘤,而在晚期卵巢癌患者中,有残余肿瘤的患者较多,而miR-125b在上皮性卵巢癌的发生、发展中起着关键作用,所以在上皮性卵巢癌早期的作用比较明显,在晚期或肿瘤残余较多的患者表达较不明显。miR-125b表达量高的患者在PFS上有优势(P<0.05),在OS方面无明显优势(P>0.05),这提示miR-125b是一个潜在的预测卵巢癌复发的基因。因卵巢癌预后是多因素参与,因此可能还有其他影响OS的因素。
由于作用靶点及作用机制的不同及多样性,同一种miRNA在不同的细胞中发挥着癌基因或抑癌基因的作用。本研究结果提示,miRNA正是因为通过mRNA在转录后起作用,因此它在肿瘤的发生、发展中可能会作用于癌基因或者抑癌基因表达的mRNA,从而在肿瘤的不同期别的表达情况发生变化。本研究结果提示,在卵巢癌的发生、发展过程中也可能有其他基因参与调控,从而在不同期别引起miR-125b表达不同,因此miR-125b在无残余肿瘤患者血清的表达量高于有残余肿瘤患者血清的表达,早期术后无肉眼残余肿瘤高于晚期术后有残余肿瘤的患者表达。
本研究以TaqMan低密度微阵列芯片筛选上皮性卵巢癌与卵巢良性肿瘤外周血清中有差异表达的miRNA,并进一步以RTFQ-PCR技术验证筛选的miRNA及分析临床意义,结果显示miR-125b在上皮性卵巢癌中的表达量高于卵巢良性肿瘤。miR-125b在早期上皮性卵巢癌患者中的表达高于晚期患者,在术后无残余肿瘤患者中的表达高于术后有残余肿瘤的患者,故本研究显示miR-125b在上皮性卵巢癌的发生、发展中起着关键作用,而且在肿瘤不同期别的表达情况发生变化,所以在上皮性卵巢癌早期的作用比较明显,在晚期或肿瘤残余较多的患者表达较不明显。研究还显示,miR-125b高表达有利于患者的PFS,但在OS方面无明显优势。MiR-125b在肿瘤早期诊断、侵袭转移、预后等方面均有一定的意义,但是找寻miR-125b作用的靶基因及其作用的相关机制等问题尚未解决。MiR-125b可作为上皮性卵巢癌一类新的生物标志物及作用靶点,但是还需要更多的研究来探明其作用机制。
[参 考 文 献]
[1] 张思维, 陈万青, 魏文强, 等. 中国第三次死因抽样调查(2004—2005)卵巢癌死亡情况分析[J]. 中华预防医学杂志, 2010, 44(5): 418-422.
[2] KIM P S, DJAZAYERI S, ZEINELDIN R. Novel nanotechnology approaches to diagnosis and therapy of ovaria cancer[J]. Gynecol Oncol, 2011, 120(3): 393-403.
[3] VAN JAARSVED M T, HELLEMAN J, BERNS E M, et a MicroRNAs in ovarian cancer biology and therapy resistanc [J]. Int J Biochem Cell Biol, 2010, 42(8): 1282-1290.
[4] IORIO M V, CROCE C M. MicroRNAs in cancer: smal molecules with a huge impact[J]. J Clin Oncol, 2009 27(34): 5848-5856.
[5] ZHANG Y, LI M, WANG H, et al. Profiling of 95 microRNA in pancreatic cancer cell lines and surgical specimens by real time PCR analysis[J]. World J Surg, 2009, 33(4): 698-709 [6] ESQUELA-KERSCHER A, SLACK F J. Oncomirs microRNAs with a role in cancer [J]. Nat Rev Cancer 2006, 6(4): 259-269.
[7] 许 建, 武治印, 于典科. 血清microRNA在肿瘤诊断和预后评估中的应用[J]. 中国科学, 2010, 55(1): 2-6.
[8] MITCHELL P S, PARKIN R K, KROH E M, et al. Circulatin microRNAs as stable blood-based markers for cance detection[J]. Proc Natl Acad Sci U S A, 2008, 105(30)10513-10518.
[9] CHEN X, BA Y, MA L, et al. Characterization of microRNA in serum: A novel class of biomarkers for diagnosis of cance and other diseases[J]. Cell Res, 2008, 18(10): 997-1006.
[10] RESNIKE K E, ALDER H, HAGAN J P, et al. The detectio of differentially expressed microRNAs from the serum o ovarian cancer patients using a novel real-time PCR platfor [J]. Gynecol Oncol, 2009, 112(1): 55-59.
[11] 李智敏, 罗喜平, 曾俐琴, 等. hsa-miRNA27a和hsa miRNA451通过调控MDRl/P-gp的表达和功能参与卵巢癌和乳腺癌细胞耐药[J]. 中国癌症杂志, 2015, 25(3): 190 198.
[12] HUANG Y W, KUO C T, STONER K, et al. An overview o epigenetics and chemo-prevention[J]. FEBS Lett, 2011 582(13): 2129-2136.
[13] YURKOVETSKY Z, SKATES S, LOMAKIN A, et al Development of a multimarker assay for early detection o ovarian cancer[J]. J Clin Oncol, 2010, 28(13): 2159-2166
[14] SOSLOW R A. Histologic subtypes of ovarian carcinoma: a overview[J]. Int J Gynecol Pathol, 2008, 27(2): 161-174.
[15] IORIO M V, VISONE R, DI LEVA G, et al. MicroRN signatures in human ovarian cancer[J]. Cancer Res, 2007 67(18): 8699-8707.
[16] JEMAL A, SIEGEL R, XU J, et al. Cancer statistics, 201 [J]. CA Cancer J Clin, 2010, 60(5): 277-300.
[17] U.S. PREVENTIVE SERVICES TASK FORCE. Screening fo ovarian cancer: reaffirmation recommendation statement[J]Am Fam Physician, 2013, 87(10): 900-904.
[18] ZHANG C, WANG C, CHEN X, et al. Expression profile o microRNAs in serum: a fingerprint for esophageal squamou cell carcinoma[J]. Clin Chem, 2010, 56(12): 1871-1879.
[19] CHUNG Y W, BAE H S, SONG J Y, et al. Detection o microRNA as novel biomarkers of epithelial ovarian cancefrom the serum of ovarian cancer patients[J]. Int J Gynecol Cancer, 2013, 23(4): 673-679.
[20] WEI L Q, LIANG H T, QIN D C, et al. MiR-212 exerts suppressive effect on SKOV3 ovarian cancer cells through targeting HBEGF[J]. Tumor Biol, 2014, 35(12): 12427-12434.
[21] SHAPIRA I, OSWALD M, LOVECCHIO J, et al. Circulating biomarkers for detection of ovarian cancer and predicting cancer outcomes[J]. Br J Cancer, 2014, 110(4): 976-983.
[22] POGUE A I, CUI J G, LI Y Y, et al. MicroRNA-125b (miRNA-125b) function in astrogliosis and glial cell proliferation[J]. Neurosci Lett, 2010, 476(1): 18-22.
[23] CUI E H, LI H J, HUA F, et al. Serum microRNA 125b a a diagnostic or prognostic biomarker for advanced NSCL patients receiving cisplatin-based chemotherapy[J]. Act Pharmacol Sin, 2012, 34(2): 309-313.
[24] ZHANG Y, YAN L X, WU Q N, et al. miR-125b is methylate and functions as a tumor suppressor by regulating the ETS proto-oncogene in human invasive breast cancer[J]Cancer Res, 2011, 71(10): 3552-3562.
Screening of miRNAs in ovarian cancer patients and its correlation with clinicopathological features
ZHU Tao1, ZHANG Ping2, ZHENG Wei1(1. Department of Obstetrics and Gynecology, Medical College, Zhejiang University, Hangzhou 310009, Zhejiang Province, China; 2. Department of Gynecologic Oncology, Zhejiang Cancer Hospital, Hangzhou 310022, Zhejiang Province, China)
[Key words]Ovarian cancer; MiRNA expression cards; MiR-125b; Prognosis
[Abstract]Background and purpose: The prognosis of ovarian cancer is poor and the diagnosis is relatively late. It is needed to search for early diagnosis and treatment for ovarian cancer. This study investigated the expression of serum miRNAs in patients with malignancy or benign ovarian tumor preoperativey and analyzed its correlation with clinicopathological progress and prognostic features of epithelial ovarian cancer. Methods: Forty-eight miRNAs which have been reported to be related to ovarian cancer were ordered. The differential expression of 48 miRNAs in the serum of patients with malignant or benign epithelial ovarian tumors was detected by TaqMan low density array. The differentially expressed miRNAs were further confirmed by real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR). The relationship between the expression level of selected miRNA and clinical clinicopathological factors, progress and prognosis were analyzed. Results: TaqMan low density array and further RTFQ-PCR showed that only miR-125b was significantly increased in 135 ovarian cancer patients as compared with 38 individuals with benign tumor. The expression of miR-125b was higher in early stage patients than that in advanced stage patients (P=0.039). The patients without residual tumor expressed more miR-125b than patients with residual tumor (P=0.013). The high level of miR-125b was signifi-cantly correlated with longer progress free survival (PFS) (P=0.003), but not correlated with overall survival (OS) (P=0.069). Conclusion: MiR-125b may play an important role in the pathogenesis of epithelial ovarian cancer and prognosis. It may be a potential gene to predict the recurrence of epithelial ovarian cancer, but the change of gene expression at different stages and its underlying mechanism need further research.
DOI:10.3969/j.issn.1007-3969.2016.03.001
中图分类号:R737.31
文献标志码:A
文章编号:1007-3639(2016)03-0201-07
基金项目:浙江省自然科学基金资助项目(Y2111317;LY14H160010)。
通信作者:郑 伟 E-mail:zhengwei@zju.edu.cn
收稿日期:(2015-10-01 修回日期:2016-01-24)

