新疆维吾尔族妇女子宫颈癌DBC1基因启动子甲基化分析
武 丹,杨 昕,朱君玲,王红英,李洪涛,潘 欢,何鸿昌,任显显,潘泽民
1.石河子大学新疆地方与民族高发病教育部重点实验室,石河子大学医学院生物化学教研室,新疆 石河子 832002;2.新疆医科大学自治区中医医院病理科,新疆 乌鲁木齐 830000;3.喀什地区第一人民医院病理科,新疆 喀什 844000;4.新疆医科大学基础医学院微生物学教研室,新疆 乌鲁木齐 830011
新疆维吾尔族妇女子宫颈癌DBC1基因启动子甲基化分析
武 丹1,杨 昕2,朱君玲3,王红英4,李洪涛1,潘 欢1,何鸿昌1,任显显1,潘泽民1
1.石河子大学新疆地方与民族高发病教育部重点实验室,石河子大学医学院生物化学教研室,新疆 石河子 832002;2.新疆医科大学自治区中医医院病理科,新疆 乌鲁木齐 830000;3.喀什地区第一人民医院病理科,新疆 喀什 844000;4.新疆医科大学基础医学院微生物学教研室,新疆 乌鲁木齐 830011
[摘要]背景与目的:近年来,表观遗传学研究已经成为癌症研究的一个新方向。大量研究结果显示,表观遗传修饰的异常改变与癌症有着十分密切的联系,全基因组范围内的表观遗传修饰改变已经成为癌症的新标志。该研究旨在探讨膀胱癌缺失基因1(deleted in bladder cancer 1,DBC1)启动子甲基化与新疆维吾尔族妇女子宫颈癌的关系及与人类乳头瘤病毒(human papillomavirus,HPV)感染的相关性,分析其能否作为高敏感性及特异性的工具用于子宫颈癌筛选。方法:用聚合酶链反应(polymerase chain reaction,PCR)方法对43例正常子宫颈组织、35例子宫颈上皮内瘤样变(cervical intraepithelial neoplasia,CIN)组织以及54例子宫颈癌组织进行HPV16、HPV18感染的检测;运用甲基化特异性PCR方法检测上述组织DBC1基因启动子甲基化状况;采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)方法检测10例甲基化阴性的正常子宫颈组织和10例甲基化阳性的子宫颈癌组织中DBC1基因mRNA表达情况。结果:正常子宫颈组织、CIN组织及子宫颈癌组织中HPV16的感染率分别为18.6%、34.3%和68.5%;HPV18的感染率分别为2.3%、8.6% 和16.7%;DBC1基因发生甲基化率分别为23.3%、40.0%和87.0%;在79例高级别宫颈损伤及子宫颈癌样本中,其中50例HPV16/18感染阳性,29例HPV16/18感染阴性;阳性组中DBC1基因发生甲基化率88.0%,阴性组甲基化率为55.2%(P<0.05);10例甲基化阳性子宫颈癌组织中DBC1基因mRNA表达水平明显低于10例甲基化阴性正常子宫颈组织(P<0.05)。结论:DBC1基因甲基化可能作为新疆维吾尔族妇女子宫颈癌的分子标志物,结合HPV16/18感染检测有助于子宫颈癌的诊断。
[关键词]子宫颈癌;DBC1基因甲基化;HPV16/18;基因表达
Correspondence to: PAN Zemin E-mail: panteacher89@sina.com
子宫颈癌是妇科常见的恶性肿瘤之一,全球每年新发病例50万人左右,80%在发展中国家[1]。我国的子宫颈癌患病率和病死率均约占世界的1/3[2]。新疆是我国子宫颈癌高发区,尤其在南疆,子宫颈癌是当地维吾尔族妇女死亡的主要原因之一。新疆维吾尔族妇女子宫颈癌患病率高达(459~590)/10万,病死率为15.78/ 10万,明显高于生活在同一个环境下的其他民族[3]。人类乳头瘤病毒(human papillomavirus,HPV)感染是子宫颈癌发生的最重要的因素[4],但是子宫颈癌的病因与多种因素有关。研究表明,表观基因变化可以引起子宫颈癌的发生[5]。DNA甲基化可以有效用于子宫颈癌的早期筛查。
膀胱癌缺失基因1(deleted in bladder cancer 1,DBC1)在许多癌症中都表现杂合性缺失,是目前发现的恶性肿瘤组织中的甲基化新基因,研究发现该基因可以作为甲基化标志物用于筛查子宫颈癌[4]。本研究旨在分析DBC1基因在新疆维吾尔族妇女子宫颈癌中的甲基化状况,探讨基因甲基化与子宫颈癌发生及与HPV16/18感染的相关性。
1 资料和方法
1.1研究对象
所有标本来自于2010年5月—2014年12月石河子大学医学院第一和第三附属医院、喀什地区第一人民医院、新疆维吾尔自治区人民医院未经化疗或放疗维吾尔族妇女子宫颈病变患者的手术切除或活检新鲜组织标本,均经过病理确诊且获得患者知情同意。其中正常对照组4例,子宫颈上皮内瘤样变(cervical intraepithelia neoplasia,CIN)组35例,子宫颈癌组54例。患者年龄23~73岁,平均年龄47岁。
1.2研究方法
1.2.1基因组DNA提取
取约30 mg组织,使用TIANamp FFPE DNA Kit DP331-02试剂盒[天根生化科技(北京)有限公司]提取基因组DNA,0.7%琼脂糖凝胶电泳检测DNA的质量,置于-20 ℃冰箱的保存。
1.2.2 HPV感染检测
H P V 1 6 / 1 8病毒采用聚合酶链反应(polymerase chain reaction,PCR)扩增检测,反应体系(25 μL)为PCR Mix 12.5 μL,正向引物0.5 μL,反向引物0.5 μL,DNA模板1 μL,灭菌水10.5 μL。反应条件:95 ℃预变性10 min,95 ℃ 30 s,57 ℃ 40 s,72 ℃ 40 s,共35个循环,最后72 ℃延伸5 min。扩增片段大小为268 bp,反应产物用2%琼脂糖凝胶电泳,并在凝胶成像系统内照相鉴定。引物设计见表1。
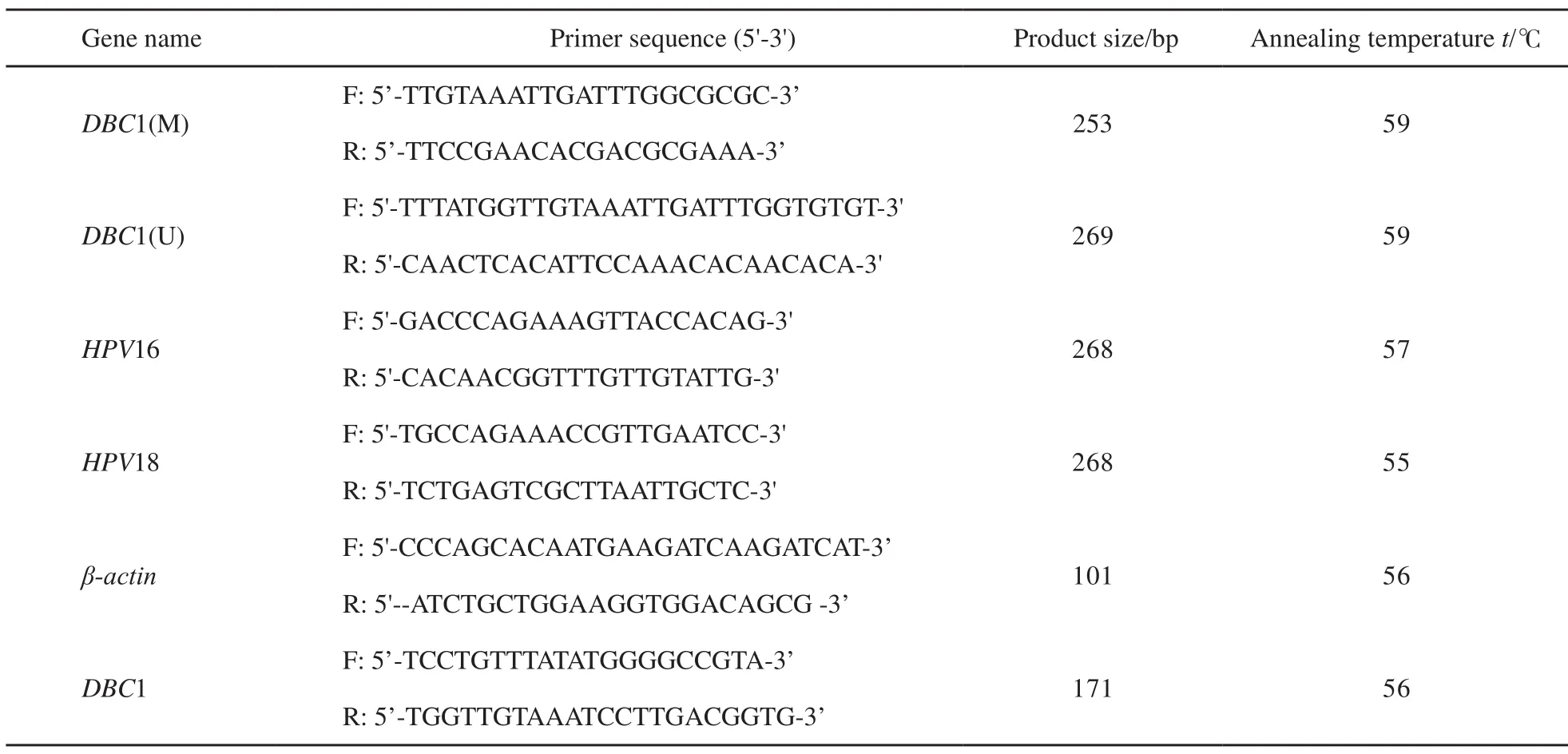
表 1 引物信息Tab. 1 Primer information
1.2.3DNA亚硫酸盐修饰
取约1 μg DNA,使用CpGenomeTMDNA Modification Kit S7820试剂盒(美国Chemicon公司),经过修饰、初步脱盐、二次脱盐对DNA进行亚硫酸盐修饰并纯化,将修饰后的DNA置于-20 ℃冰箱保存。
1.2.4甲基化特异性PCR检测
对所有标本进行甲基化与非甲基化检测,反应体系与反应条件均一致。引物参照文献[6],使用Bio-Rad梯度PCR仪进行扩增。反应体系(25 μL)为 Mix 12.5 μL(北京康为世纪生物科技有限公司,2×PCR goldstar Best Mastermix),正向引物0.5 μL,反向引物0.5 μL,DNA模板2 μL,灭菌水9.5 μL。反应条件:95 ℃预变性10 min,95 ℃ 1 min,59 ℃1 min,72 ℃ 1 min,共35个循环,最后72 ℃延伸7 min。甲基化产物片段大小为253 bp,非甲基化产物片段大小为269 bp,用2%琼脂糖凝胶电泳分析结果。
1.2.5RNA提取
挑选甲基化阴性的正常子宫颈组织和甲基化阳性的子宫颈癌组织各10例,取约30 mg组织,使用TRIzol法(美国Invitrogen公司)提取总RNA,采用1.0%琼脂糖凝胶电泳检测RNA的质量。
1.2.6实时荧光定量聚合酶链反应(real-tim fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测
取约1 μgRNA,使用RevertAid First Stran cDNA Synthesis Kit、K1622试剂盒(美国Thermo公司)进行逆转录,步骤按说明书操作。β-acti作为内部参照,DBC1基因引物序列参照美国哈佛大学ParaBioSys数据库中的数据。20 μ反应体系包括:2×SYBR Green 10.0 μL(美国QIAGEN公司),正向引物0.5 μL,反向引物0.5 μL,cDNA模板1.5 μL,灭菌水7.5 μL。反应条件:95 ℃预变性5 min,95 ℃ 10 s,56 ℃ 30 s,72 ℃ 30 s,共40个循环,最后95 ℃1 min,56 ℃ 30 s,95 ℃ 30 s。每个样本重复3次实验。
1.3统计学处理
采用SPSS 17.0统计软件处理分析,计数资料及相关性分析均采用χ2检验;RTFQ-PCR检测结果的数据为计量资料,采用两独立样本t检验分析。P<0.05为差异有统计学意义。
2 结 果
2.1HPV病毒感染情况
正常子宫颈组织、CIN组织及子宫颈癌组织中HPV16的感染率分别为18.6%、34.3%和68.5%;HPV18的感染率分别为2.3%、8.6%和16.7%。HPV16感染率两两比较发现:正常组与CIN组比较,差异有统计学意义(P<0.05);CIN组与子宫颈癌组比较,差异有统计学意义(P<0.05);正常组与子宫颈癌组比较,差异有统计学意义(P<0.05)。HPV18感染率两两比较,正常组与子宫颈癌组比较,差异有统计学意义(P<0.05)。HPV16/18感染率两两比较,CIN组与子宫颈癌组比较,差异有统计学意义(P<0.05);正常组与子宫颈癌组比较,差异有统计学意义(P<0.05,表2)。
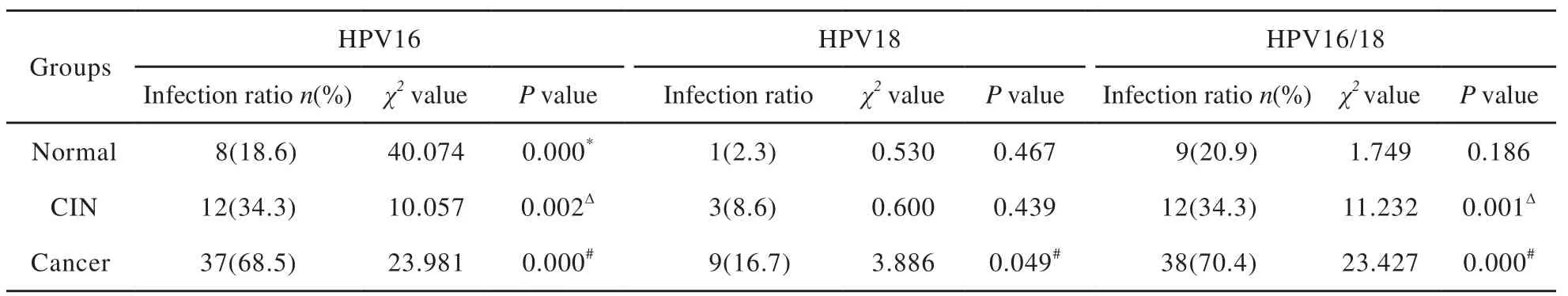
表 2 HPV16/18病毒感染情况Tab. 2 The infection status of HPV16 and 18

表 3 DBC1基因甲基化状况Tab. 3 The frequency of DBC1 gene promoter methylation
2.2甲基化特异性PCR电泳及测序结果
43例子宫颈正常组织中10例(23.3%)发生DBC1基因甲基化,35例CIN组织中14例(40.0%)发生甲基化,而54例子宫颈癌组织47例(87.0%)发生甲基化。正常组与CIN组比较,DBC1基因甲基化率差异无统计学意义(P>0.05);CIN组与子宫颈癌组比较,DBC1基因甲基化率差异有统计学意义(P<0.05);正常组与子宫颈癌组比较,DBC1基因甲基化率差异有统计学意义(P<0.05)。随着疾病的发展,甲基化的概率呈现出增加的趋势(表3)。
通过甲基化特异性PCR方法检测发现,甲基化扩增条带为253 bp,非甲基化扩增条带为269 bp(图1)。
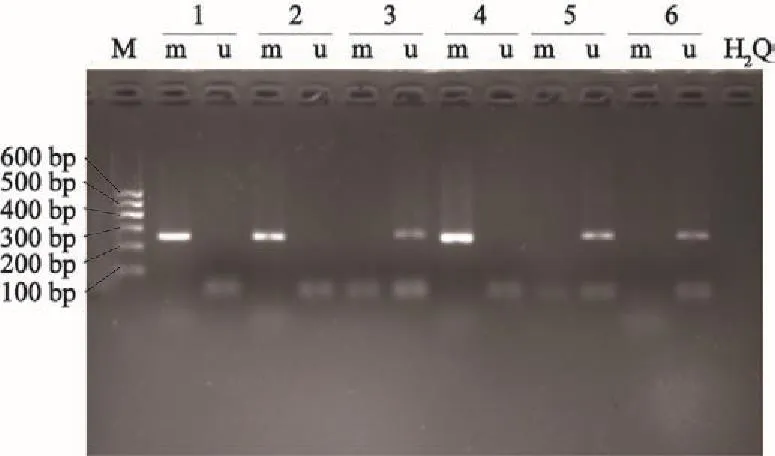
图 1 DBC1基因甲基化特异性PCR结果Fig. 1 The result of methylation-specific PCR of DBC1 gene M: Marker (100-600 bp); m: Methylation-specific PCR products; U: Unmethylation-specific PCR products; 1, 2: Cervical cancer tissues;3, 4: Cervical intraepithelial neoplasia tissues; 5, 6: Normal cervical tissues
DBC1基因甲基化特异性PCR产物测序后发现,甲基化产物CpG位点的C均不变,其余C变成了T;而非甲基化产物中所有C都变成了T,包括CpG位点(部分未修饰完全未变成T,图2)。
2.3DBC1基因甲基化与临床病理因素之间的相关性
研究发现,在54例子宫颈癌组织中,患者年龄、FIGO分期与DBC1基因甲基化之间无相关性(P>0.05,表4)。
2.4DBC1基因甲基化与HPV感染的关系
在25例高级别子宫颈损伤(CINⅡ、CINⅢ)和54例子宫颈癌组织样本中,50例HPV16/18阳性,29例HPV16/18阴性。阳性组中44例(88.0%)发生甲基化,阴性组中16例(55.2%)发生甲基化,两组之间甲基化率差异有统计学意义(χ2=10.828,P<0.05)。结果显示,DBC1基因甲基化与HPV16/18感染之间可能相关(表5)。
2.5DBC1基因表达量分析
10例甲基化阳性的子宫颈癌组织中DBC1基因mRNA表达量为0.642±0.272,10例甲基化阴性的正常子宫颈组织mRNA表达量为1.052±0.187,甲基化阳性组中DBC1基因mRNA表达水平明显低于甲基化阴性组(P<0.05,图3)。
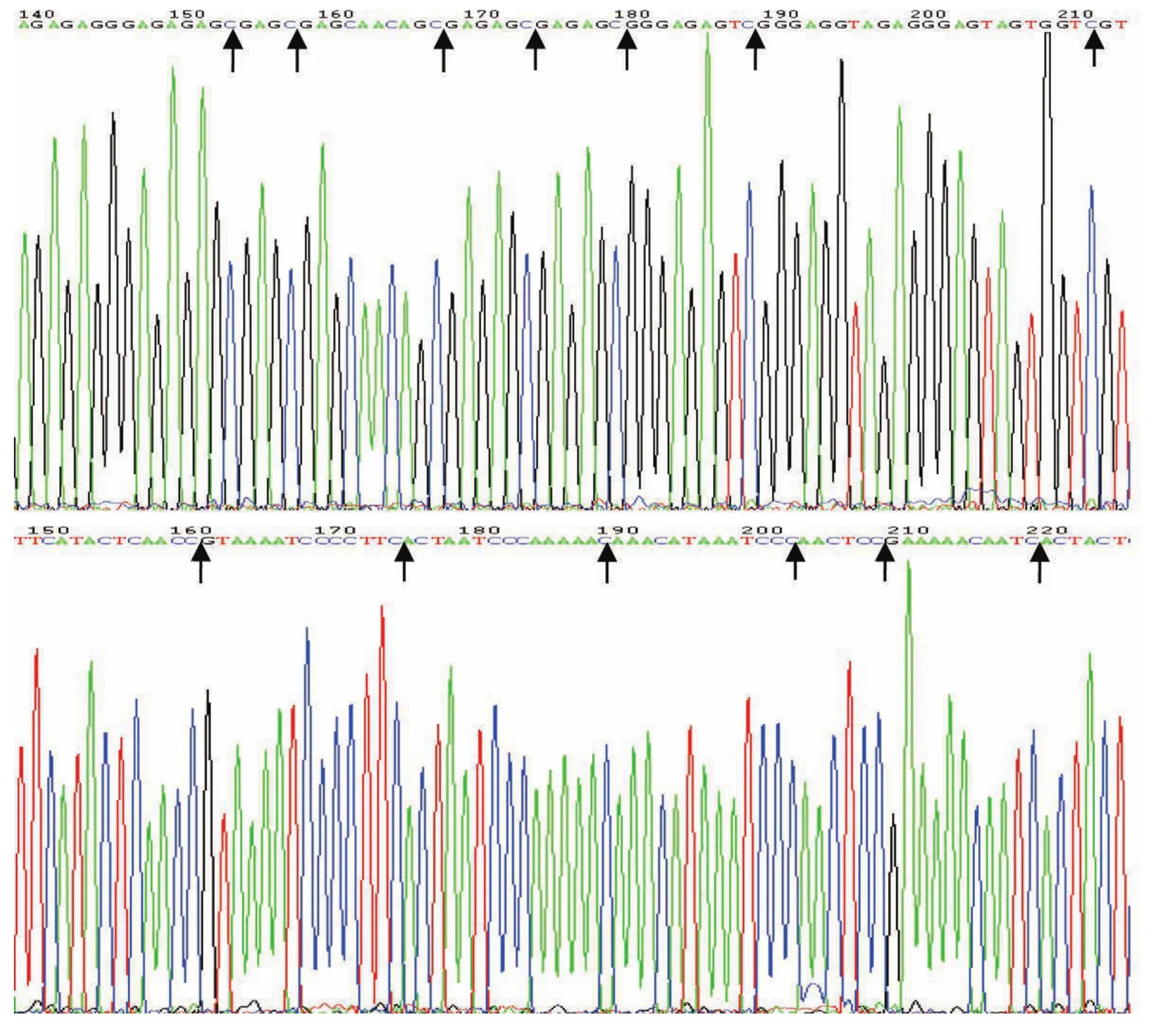
图 2 DBC1基因MSP产物测序结果Fig. 2 The sequencing results of MSP products of DBC1 gene Above: Methylation-specific PCR products; Below: Unmethylation-specific PCR products (the reverse sequencing results); Arrows for the CpG loci

表 4 DBC1基因甲基化与临床病理因素之间的相关性Tab. 4 The correlation of methylation of DBC1 gene promoter with clinical factors in cervical cancer patients (chi-square test)
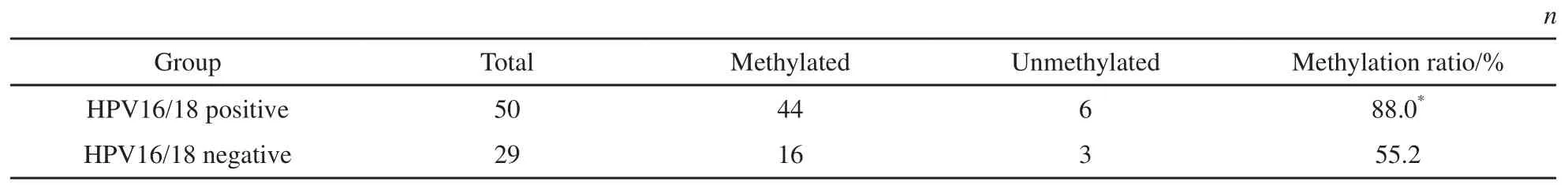
表 5 DBC1基因甲基化与HPV16/18在子宫颈癌组织中的分布情况Tab. 5 The distribution of methylation of DBC1 gene promoter and infection of HPV16/18 in cervical cancer tissues
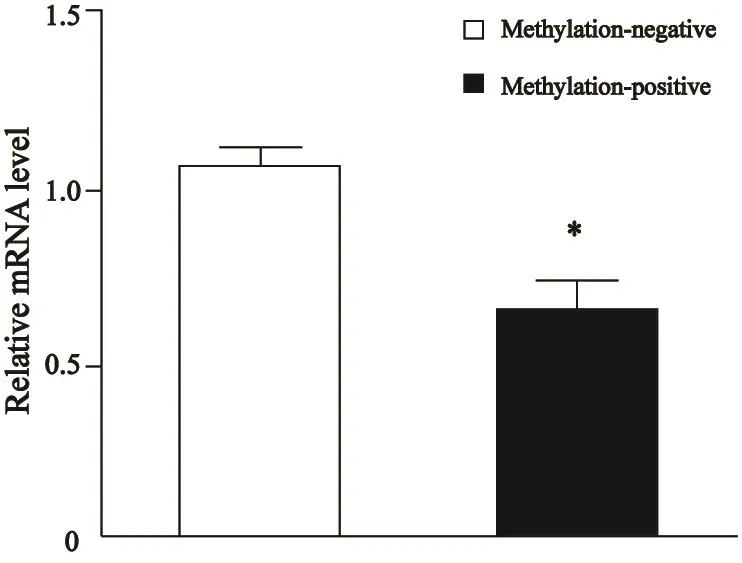
图 3 DBC1基因mRNA表达水平Fig. 3 The expression of DBC1 gene at mRNA level
3 讨 论
肿瘤发生、发展的主要机制是各种物理、化学、生物致癌因素造成DNA序列变异,从而导致细胞生长、分化失控,最终导致肿瘤的形成。近年来,随着研究的深入,人们发现DNA序列以外的调控机制异常在肿瘤的发生、发展过程中更为普遍[7],这种不依赖于DNA序列变化的可遗传的调控机制称为表观遗传学机制,DNA甲基化作为表观遗传修饰的重要组成部分,不改变基因序列而引起基因表达的失活,并且可以引起肿瘤的发生[8]。陈蔚等[9]通过对LMX1A基因的6个位点和PAX1基因的9个位点的甲基化定量分析,发现子宫颈癌组甲基化水平明显高于CIN组。前期课题组也同样发现,在子宫颈癌组织中经常出现抑癌基因高甲基化而失活,如IFITM1、NKX6-1等基因[10-11]。
感染高危型HPV是子宫颈癌发生的重要因素[12]。虽然HPV感染是子宫颈癌的发生原因,但HPV病毒感染不是导致子宫颈癌发生的唯一因素,有研究表明少于1%的感染HPV的女性可以发展为子宫颈癌[13]。研究报道,经过早期发现与及时治疗后,患者的子宫颈癌病死率出现显著下降,幅度为20%~60%[14]。因此通过早诊早治,可以降低子宫颈癌的发病率及病死率。基因甲基化分析结合HPV感染检测用于子宫颈癌的诊断,将对新疆维吾尔族妇女这一严峻的健康问题产生重大而深远的影响。
DBC1基因定位在染色体9q32-33[15]。有研究发现,DBC1基因的低表达与膀胱癌预后差有关[16],DBC1基因可抑制非小细胞肺癌细胞系的生长[17]。前期有研究发现,在台湾省妇女子宫颈癌组织中DBC1基因发生甲基化率为93%,存在高甲基化的状态[4]。本研究中正常子宫颈组织DBC1基因发生甲基化率为23.3%,CIN组织甲基化率为40.0%,子宫颈癌组织DBC1发生甲基化率为87.0%,随着病变的发展,甲基化率呈现出逐渐增加的趋势。其中,子宫颈癌组明显高于正常组,差异有统计学意义;高级别的子宫颈损伤DBC1基因发生甲基化率显著高于低级别子宫颈损伤。提示DBC1基因发生甲基化导致基因失活可能与子宫颈癌的发生、发展相关。同时发现,在54例子宫颈癌组织中,患者年龄、FIGO分期与DBC1基因甲基化率之间无显著相关性(P>0.05)。
本研究中正常组、CIN组及子宫颈癌组的HPV16感染率两两比较,差异均有统计学意义;HPV18感染率两两比较,只有正常组与子宫颈癌组差异有统计学意义。感染以HPV16为主,这与文献报道一致[18]。本研究对79例高级别子宫颈损伤及子宫颈癌样本进行了统计,其中50例HPV16/18感染阳性,29例HPV16/18感染阴性;阳性组中DBC1基因甲基化发生率为88.0%,阴性组甲基化率为55.2%(P<0.05),两者之间差异有统计学意义。提示HPV16/18感染与DBC1基因甲基化之间可能相关,在子宫颈癌的发生、发展过程中发挥一定的作用。
根据上述分析,DBC1基因甲基化可能与新疆维吾尔族妇女子宫颈癌的发生、发展相关,并与HPV感染有一定的相关性。随着DNA甲基化研究的逐渐深入,甲基化检测在肿瘤早期诊断的作用进一步明确,为去甲基化药物在肿瘤的治疗方面提供了希望。
[参 考 文 献]
[1] FERLAY J, SOERJOMATARAM I, ERVIK M, et al. International Agency for Research on Cancer. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No. 11. globocan.iarc.fr. Accessed December 12,2013.
[2] 高 琼, 韦创建, 刘筱娴. 宫颈癌的筛查及早期诊断[J].医学与社会, 2007, 20(1): 41-42.
[3] 李清阳, 玛依努尔·尼亚孜, 阿不力孜. 新疆南部维吾尔族妇女HPV16 E6、E7基因突变与宫颈癌及癌前病变的相关性研究[J]. 新疆医学, 2009, 39(5): 1-4.
[4] HUANG R L, CHANG C C, SU P H, et al. Methylomic analysis identifies frequent DNA methylation of zinc finger protein 582 (ZNF582) in cervical neoplasms[J]. PLoS One,2012, 7(7): e41060.
[5] GUERRERO-SETAS D, PÉREZ-JANICES N, BLANCOFERNANDEZ L, et al. RASSF2 hypermethylation is present and related to shorter survival in squamous cervical cancer [J]. Mod Pathol, 2013, 26(8): 1111-1122.
[6] GAO S, WORM J, GULDBERG P, et al. Loss of heterozygosity at 9q33 and hypermethylation of the DBCCR1 gene in oral squamous cell carcinoma[J]. Br J Cancer, 2004, 91(4):760-764.
[7] BUYSSCHAERT I, SCHMIDT T, RONCAL C, et al. Genetics,epigenetics and pharmaco-(epi) genomics in angiogenesis [J]. J Cell Mol Med, 2008, 12(6B): 2533-2551.
[8] ROMANI M, PISTILLO M P, BANELLI B. Environmental epigenetics: crossroad between public health, lifestyle, and cancer prevention[J]. Biomed Res Int, 2015: 587983. doi:10.1155/2015/587983. Epub 2015 Aug 3.
[9] 陈 蔚, 杨慧娟, 徐 军, 等. 宫颈上皮内瘤变和宫颈癌中LMX1A和PAX1基因甲基化的定量分析[J]. 中国癌症杂志, 2015, 25(1): 19-24.
[10] 左强强, 郑威楠, 张金莉, 等. IFITM1基因启动子甲基化与新疆维吾尔族妇女子宫颈癌的相关性[J]. 基础医学与临床, 2014, 34(1): 58-61.
[11] 范佩文, 杨 昕, 王红英, 等. 新疆维吾尔族妇女宫颈癌NKX6-1基因甲基化检测[J]. 石河子大学学报(自然科学版), 2015, 33 (3): 310-314.
[12] RIBEIRO A A, COSTA M C, ALVES R R, et al. HPV infection and cervical neoplasia: associated risk factors[J]. Infect Agent Cancer, 2015, 10: 16. doi: 10.1186/s13027-015-0011-3. eCollection 2015.
[13] WOODMAN C B, COLLINS S I, YOUNG L S. The natural history of cervical HPV infection: unresolved issues[J]. Nat Rev Cancer, 2007, 7(1): 11-22.
[14] U.S. PREVENTIVE SERVICES TASK FORCE. Screening for cervical cancer: recommendations and rationale[J]. Am J Nurs, 2003, 103(11): 101-102, 105-106, 108-109.
[15] LOPEZ-BELTRAN A, ALVAREZ KINDELAN J, LUQUE R J, et al. Loss of heterozygosity at 9q32-33 (DBC1 locus) in primary non-invasive papillary urothelial neoplasm of low malignant potential and low-grade urothelial carcinoma of the bladder and their associated normal urothelium [J]. J Pathol, 2008, 215(3): 263-272.
[16] SHIM U J, LEE I S, KANG H W, et al. Decreased DBC1 expression is associated with poor prognosis in patients with non-muscle-invasive bladder cancer[J]. Korean J Urol,2013, 54(9): 631-637.
[17] WRIGHT K O, MESSING E M, REEDER J E. DBCCR1 mediates death in cultured bladder tumor cells[J]. Oncogene, 2004, 23(1): 82-90.
[18] 古扎丽努尔·阿不力孜, 程静新, 米克热木, 等. 新疆维吾尔族妇女宫颈癌的HPV谱研究[J]. 肿瘤, 2007, 27(5):379-382.
Analysis of DBC1 gene promoter methylation in cervical cancer tissues of Uyghur women in Xinjiang
WU Dan1, YANG Xin2, ZHU Junling3, WANG Hongying4, LI Hongtao1, PAN Huan1, HE Hongchang1, REN Xianxian1, PAN Zemin1(1.Key Laboratory of Xinjiang Endemic and Ethnic Diseases, Department of Biochemistry and Molecular Biology, School of Medicine, Shihezi University, Shihezi 832002, Xinjiang Uygur Autonomous Region, China; 2. Department of Pathology, Chinese Medicine Hospital of Autonomous Region, Xinjiang Medical University, Urumqi 830000, Xinjiang Uygur Autonomous Region, China; 3. Department of Pathology, the First People Hospital of Kashgar, Kashgar 844000, Xinjiang Uygur Autonomous Region, China; 4. Department of Microbiology, College of Basic Medicine, Xinjiang Medical University, Urumqi 830011, Xinjiang Uygur Autonomous Region, China)
[Key words]Cervical cancer; DBC1 gene methylation; HPV16/18; Gene expression
[Abstract]Background and purpose: In recent years, epigenetics research has become a new direction of cancer research. A large number of results have shown that the abnormal changes of epigenetic modifications have close connection with cancer. Genome-wide epigenetic modifications have become new markers for cancer. This study aimed to investigate the methylation of the promoter of DBC1 gene in cervical cancer tissues of Uyghur women in Xinjiang, to explore the correlation between the gene methylation and the infection of HPV, and to evaluate whether it can be used as a tool with high sensitivity and specificity for cervical cancer screening. Methods: This study detected the infection of HPV16, 18 in 43 normal cervical tissues, 35 cervical intraepithelial neoplasia tissues and 54 cervical cancer tissues using the polymerase chain reaction (PCR) method. The methylation of the promoter of DBC1 gene in above-mentioned tissues was detected by the methylation-specific PCR method. The expression of DBC1 at mRNA level was measured by real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) in 10 methylation-negative normal cervical tissues and 10 methylation-positive cervical cancer tissues. Results: In normal cervical tissues, CIN tissues and cervical cancer tissues,the infection ratios of HPV16 were 18.6%, 34.3% and 68.5%, respectively; the infection ratios of HPV18 were 2.3%, 8.6% and 16.7%, respectively; and the methylation ratios of DBC1 gene were 23.3%, 40.0%, 87.0%, respectively. In 79 highgrade squamous intraepithelial lesions (CINⅡ and Ⅲ) and cervical cancer tissues, 50 of 79 were infected with HPV16/18,while 29 of 79 were negative. The methylation ratio of DBC1 gene was 88.0% in HPV16/18 infection positive group while the methylation ratio was 55.2% in negative group (P<0.05). The expression of DBC1 gene at mRNA level in 10 methylation-positive cervical cancer tissues was significantly lower than that in the 10 methylation-negative normal cervical tissues (P<0.05). Conclusion: The methylation of DBC1 gene may become a molecular marker to detect cervical cancer of Uyghur women in Xinjiang. DBC1 gene methylation combined with HPV16/18 infection test can be used to aid diagnosis of cervical cancer.
DOI:10.3969/j.issn.1007-3969.2016.03.002
中图分类号:R737.33
文献标志码:A
文章编号:1007-3639(2016)03-0208-07
基金项目:兵团国际科技合作项目(2013BC003);国家科技支撑计划(“十二五”计划)(2013BAI05B0503);国家自然科学基金项目(30860302,30660193);石河子大学重大科技攻关计划项目(gxjs2013-zdgg05);高层次人才科研启动资金专项(RCZX201333)。
通信作者:潘泽民 E-mail:panteacher89@sina.com
收稿日期:(2015-09-22 修回日期:2015-12-14)

