外源一氧化氮对低温胁迫下苦瓜幼苗生长及部分抗逆指标的影响
杜卓涛,杨 衍,朱国鹏,田丽波,*,商 桑,*
(1.海南大学 园艺园林学院/热带作物种质资源保护与开发利用教育部重点实验室,海南 海口 570228; 2.中国热带农业科学院 热带作物品种资源研究所,海南 儋州 571737)
外源一氧化氮对低温胁迫下苦瓜幼苗生长及部分抗逆指标的影响
杜卓涛1,杨衍2,朱国鹏1,田丽波1,*,商桑1,*
(1.海南大学 园艺园林学院/热带作物种质资源保护与开发利用教育部重点实验室,海南 海口 570228; 2.中国热带农业科学院 热带作物品种资源研究所,海南 儋州 571737)
摘要:为探讨外源一氧化氮(NO)提高苦瓜抗冷性的内在机制,以碧绿苦瓜幼苗为试材,对其施加不同浓度(0,0.1,0.5,1.0,1.5和2.0 mmol·L-1)的外源NO供体(SNP)并进行低温(8 ℃)处理,研究外源NO对低温胁迫下苦瓜幼苗的生长、相对电导率、丙二醛(MDA)、脯氨酸含量以及过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性的影响。结果显示:SNP处理提高了茎粗/株高和叶面积/根体积的比值,降低了苦瓜幼苗叶片相对电导率和 MDA含量,提高了叶片脯氨酸含量和SOD,CAT,POD三种酶的活性,从而降低低温胁迫对苦瓜幼苗的伤害。低浓度的SNP处理的苦瓜幼苗抗冷效果好于高浓度的,尤其以0.5 mmol·L-1SNP处理效果最佳。结果表明:低温胁迫下,适宜浓度的外源NO通过提高抗氧化酶活性,促进渗透调节物质的合成,降低膜透性和膜脂过氧化水平,保护了细胞膜结构的稳定性,从而提高苦瓜幼苗抗低温胁迫的能力,促进了苦瓜幼苗的生长。
关键词:苦瓜;外源NO(SNP);低温胁迫;防御酶
一氧化氮(nitric oxide,NO)是一种广泛存在于植物体的信号分子,调节植物生长发育的诸多生理过程,是当前植物逆境生理和信号转导领域的研究热点[1]。已有研究表明,NO可增强植物抗逆性,在缓解植物盐胁迫、碱胁迫、温度胁迫、重金属胁迫、水分胁迫、紫外线辐射胁迫、渗透胁迫、光照胁迫等所引起的伤害中起着重要作用[2-3]。NO 可上调渗透胁迫及活性氧清除酶类基因的表达,提高水稻的耐盐性及耐热性[4],还可调控高温胁迫下拟南芥叶片的非光化学猝灭来维护 PSⅡ的正常生理功能[5]。近几年研究表明,外源 NO能增强姜[6]叶片的抗氧化酶活性,减轻膜脂过氧化程度,缓解高温胁迫对幼苗氧化损伤的影响。另外,NO可缓解低温对植物的伤害已经在多种作物上得到了证实。Lamattina等[2]研究报道外源 NO 能提高小麦、玉米种子和幼苗的抗低温能力。研究发现,外源 NO可缓解低温胁迫对玉米[7]、番茄[8]、黄瓜[9]幼苗生长的抑制作用,还可以通过提高棉花[10]、蝴蝶兰[11]幼苗的保护酶活性,增加渗透调节物质含量,来减轻低温胁迫对幼苗的伤害,提高其抗低温胁迫的能力。樊怀福等[9]报道外源NO能显著提高黄瓜幼苗叶片的净光合速率和叶绿素含量,显著降低低温对膜造成的伤害。
苦瓜(MomordicacharantiaL.)为葫芦科苦瓜属一年生草本植物。苦瓜不仅有丰富的营养价值,而且有降血糖、抗菌、抗肿瘤、抗病毒、抗艾滋病等很高的药用功效。近几年来,随着人们对苦瓜的营养价值及诸多食疗功效的深刻认识,苦瓜生产发展迅速,栽培面积逐年扩大,从而推动了苦瓜育种研究工作的深入开展[12]。苦瓜喜温、耐热、不耐寒,在反季节栽培时常常遭遇低温,造成冷害。孙奉良[13]开展了苦瓜耐低温指标鉴定的研究,提出冷害指数、电导率、脯氨酸含量、丙二醛含量等生理生化指标可作为鉴定苦瓜耐低温能力的指标。黄玉辉等[14]指出苦瓜幼苗叶片经低温胁迫后,丙二醛相对增加量与冷害指数呈显著正相关,POD活性、SOD活性、可溶性糖含量与冷害指数呈显著负相关。程世强等[15]指出低温胁迫降低了苦瓜发芽种子成苗率,还增加了苦瓜幼苗叶片质膜相对透性、游离脯氨酸含量、可溶性糖含量,提高SOD,POD 活性,还降低了CAT活性和根系活力。已有研究表明,应用油菜素内酯可缓解低温胁迫对苦瓜的伤害[16]。硝普钠(SNP)是现已广泛使用的外源 NO供体,每0.5 mmol·L-1SNP大约可释放2.0 μmol·L-1的NO[17]。外源NO供体SNP可缓解低温胁迫对作物的伤害,在番茄[8]、棉花[10]、黄瓜[18]上得到了证实。
鉴于低温对苦瓜幼苗的影响较大,需要采用简单而有效的措施缓解低温胁迫对幼苗而影响,而外源NO在缓解低温胁迫对苦瓜的影响方面的研究少见报道,因此本研究通过对苦瓜幼苗根际施加外源NO,初步探讨不同浓度的外源NO对低温胁迫下苦瓜幼苗生长和抗逆指标的影响,为制定苦瓜低温冷害有效的防御措施提供依据及技术支持,对提高苦瓜的抗逆能力具有重要的意义。
1材料与方法
1.1试材及处理
供试苦瓜品种为碧绿苦瓜,购于海南省农业科学院种子公司。试验所用外源NO供体硝普钠(SNP)由上海生工公司提供。
试验于2012年在海南大学农科实践教学基地大棚进行。种子经温汤浸种催芽后,1穴1粒播于育苗穴盘,基质采用V(田园土)∶V(椰糠)∶V(有机肥)=2∶1∶1配制而成,并用多菌灵灭菌。采用单因子随机区组设计,待2叶1心时选取整齐一致的幼苗放入光照培养箱中培养,控制昼夜温度为8 ℃(经过预实验,将低温胁迫温度设定在8 ℃),光照强度90 μmol·m-2·s-1,光照时间10 h,暗期14 h,对幼苗分别施用浓度为0(CK蒸馏水),0.1,0.5,1.0,1.5,2.0 mmol·L-1的SNP浇根,早晚各施1次,每次20 mL,每个处理20株,重复3次,低温胁迫8 d。
1.2测定方法
低温胁迫结束后,取完整植株用清水洗净,将根部附着的基质土壤等去除。茎高采取单个植株,用直尺直接测量(从生长点到根茎结合处);茎粗采用50分度格游标卡尺测量根茎结合处;叶面积用YMJ-C活体叶面积测定仪进行测定。根体积使用EPSON EXPERSSION 1680台式扫描仪及图像分析软件WinRHIZO测量。计算茎粗/株高和叶面积/根体积。采用氮蓝四唑NBT法[19]测定超氧化物歧化酶(SOD)活性。采用愈创木酚法[19]测定过氧化物酶(POD)活性。采用过氧化氢还原法,参考Bailly方法[20],测定过氧化氢酶(CAT)的活性。采用电导率仪法[21]进行测定相对电导率(RC)。采用酸性茚三酮比色法[22]测定脯氨酸(Pro)含量。采用硫代巴比妥酸(thiobarbituric acid,TBA)法[23]测定丙二醛(MDA)含量。
1.3数据统计及分析
数据采用Microsoft Excel 进行统计,处理后的结果用SPSS 17.0软件按照Duncan新复极差法分析差异显著性。
2结果与分析
2.1外源NO对低温胁迫下苦瓜幼苗生长的影响
由表1可知:不同浓度SNP处理的苦瓜幼苗茎粗/株高、叶面积/根体积均高于对照,在SNP处理浓度(0~0.5 mmol·L-1)较低时,随着SNP浓度的升高, 茎粗/株高、叶面积/根体积也逐渐增加。在SNP浓度为0.5 mmol·L-1时,两项比值均达到最大值,与对照相比均有显著差异。而SNP浓度为0.5~2.0 mmol·L-1时,2项比值均降低。
表1SNP对低温胁迫下苦瓜幼苗生长的影响
Table 1Effect of SNP on growth of bitter melon seedlings under low temperature stress

SNP浓度/(mmol·L-1)茎粗/株高叶面积/根体积0(CK)0.628±0.01bB5.31±0.21bA0.10.654±0.02abAB6.47±0.28abA0.50.706±0.03aA7.24±0.25aA1.00.700±0.03aA7.19±0.36aA1.50.657±0.02abAB6.15±0.23abA2.00.664±0.01abAB5.95±0.29abA
注:采用Duncan新复极差法进行差异显著性多重比较,数据=平均值±标准误,同列不同行数据后没有相同小写和大写字母分别表示处理间在0.05和0.01水平存在显著性差异。下同。
2.2外源NO对低温胁迫下苦瓜幼苗防御酶系的影响
由表2可知:经外源NO处理后,低温胁迫下苦瓜幼苗的SOD活性均比对照(CK)有所提高,分别高出对照1.05%,2.16%,1.42%,0.46%,0.35%。0.5,1.0 mmol·L-1的SNP处理效果和对照相比有显著差异,其中以0.5 mmol·L-1SNP处理效果最好,差异极显著。与对照相比,0.1,0.5,1.0,1.5 mmol·L-1SNP处理后,苦瓜幼苗的POD活性分别比对照提高6.01%,52.85%,69.18%,7.43%,而2.0 mmol·L-1SNP处理比对照低7.32%。不同浓度的SNP对POD活性的作用有明显的浓度效应,低浓度(0.1,0.5,1.0,1.5 mmol·L-1)促进,而高浓度(2.0 mmol·L-1)抑制,并且以1.0 mmol·L-1SNP处理提高POD的活性的效果最好,与对照相比有极显著性差异。0.1,0.5,1.0 mmol·L-1SNP处理后,苦瓜幼苗的CAT活性分别较对照高3.32%,47.57%,91.81%,1.5,2.0 mmol·L-1分别较对照低13.94%,26.33%。不同浓度的SNP对CAT的作用有明显的浓度效应,低浓度(0.1,0.5,1.0 mmol·L-1)促进,而高浓度(1.5,2.0 mmol·L-1)抑制,并且以1.0 mmol·L-1SNP处理提高CAT活性的效果最好,与对照相比有极显著性差异。
2.3外源NO对低温胁迫下苦瓜幼苗相对电导率的影响
由图1可知:经过SNP处理的苦瓜幼苗叶片相对电导率均低于对照,0.1,0.5,1.0,1.5,2.0 mmol·L-1SNP处理分别较比对照减少了6.2%,58.1%,42.4%,39.9%和37.6%。其中0.5 mmol·L-1SNP处理抑制电解质增多的效果最好,差异达显著水平。
表2SNP对低温胁迫下苦瓜幼苗SOD,POD和CAT活性的影响
Table 2Effect of SNP on the activities of SOD, POD and CAT of bitter melon seedlings under low temperature stress
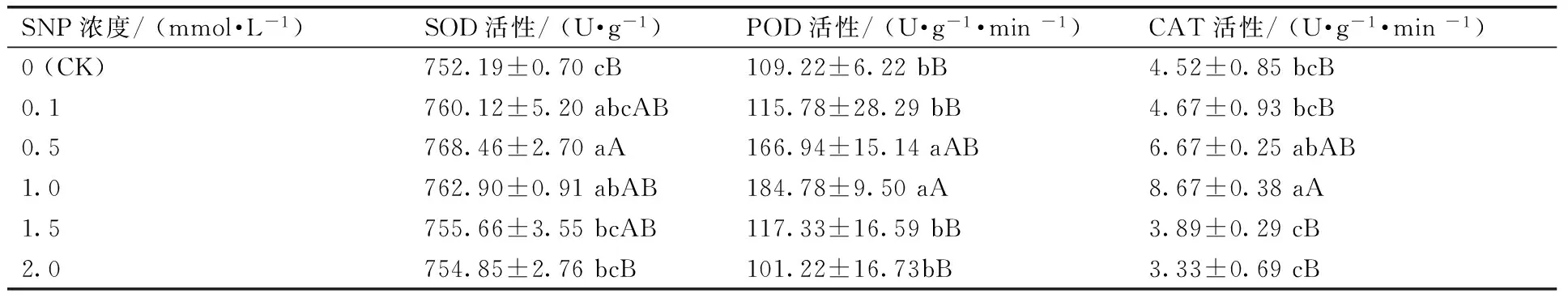
SNP浓度/(mmol·L-1)SOD活性/(U·g-1)POD活性/(U·g-1·min-1)CAT活性/(U·g-1·min-1)0(CK)752.19±0.70cB109.22±6.22bB4.52±0.85bcB0.1760.12±5.20abcAB115.78±28.29bB4.67±0.93bcB0.5768.46±2.70aA166.94±15.14aAB6.67±0.25abAB1.0762.90±0.91abAB184.78±9.50aA8.67±0.38aA1.5755.66±3.55bcAB117.33±16.59bB3.89±0.29cB2.0754.85±2.76bcB101.22±16.73bB3.33±0.69cB
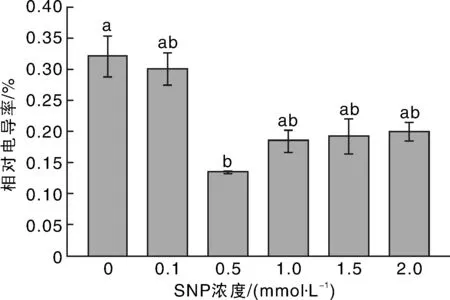
不同处理间没有相同小写字母表示差异显著(P<0.05),没有相同大写字母表示差异极显著(P<0.01)。下同。图1 SNP对低温胁迫下苦瓜幼苗相对电导率的影响Fig.1 Effect of SNP on relative conductivity of bitter melon seedlings under low temperature stress
2.4外源NO对低温胁迫下苦瓜幼苗脯氨酸含量的影响
由图2可知:与对照相比,0.5,1.0 mmol·L-1SNP处理比对照提高了135.6%,114.4%,差异达极显著水平,0.1,2.0 mmol·L-1SNP处理比对照仅提高了4.2%和69.9%,差异不显著。说明适宜浓度的SNP处理可以提高低温胁迫下苦瓜叶片的脯氨酸含量,其中以0.5 mmol·L-1SNP处理的效果最好。

图2 SNP对低温胁迫下苦瓜幼苗脯氨酸含量的影响Fig.2 Effect of SNP on proline content of bitter melon seedlings under low temperature stress
2.5外源NO对低温胁迫下苦瓜幼苗丙二醛含量的影响
由图3可见:由0.1,0.5,1.0,1.5和2.0 mmol·L-1SNP处理组比对照组分别降低了18.7%,55.5%,36.3%,37.2%和7.5%,其中0.5 mmol·L-1SNP处理时MDA含量最小,差异达显著水平。说明在低温胁迫下,适宜浓度SNP能有效降低膜脂过氧化的程度,保持膜稳定性,提高苦瓜幼苗的抗冷性。
3结论与讨论
育苗的核心问题是培育壮苗,除了使用与幼苗生长有关的一些数量性状,如茎粗、茎高、叶片数、叶面积、根体积、花芽数等来描述秧苗的质量外,也可以使用由它们构成的相对指标,如茎粗/茎高、叶面积/根体积、苗幅/苗高等进行描述,相对指标比单一指标更为稳定[24],通常相对指标数值越大,秧苗的质量越高。本试验发现,施用适宜浓度的外源NO后,低温胁迫下的秧苗茎粗/茎高和叶面积/根体积比值均显著超过了对照,从而说明外源NO对在低温逆境下培育壮苗具有重要的作用。

图3 SNP对低温胁迫下苦瓜幼苗丙二醛(MDA)含量的影响Fig.3 Effect of SNP on MDA content of bitter melon seedlings under low temperature stress
植物遭受冷害胁迫后产生大量自由基、活性氧,引起膜脂质过氧化,蛋白质活性降低甚至丧失,细胞膜受损,透性增大、电导率增大,导致植物代谢紊乱[25]。由SOD,POD和CAT组成的活性氧清除系统,三者协调作用,能有效清除植物体内的自由基和过氧化物[26]。脯氨酸除可作为渗透调节物质外,还在清除ROS、提高抗氧化能力、稳定大分子结构、降低细胞酸性和解除氨中毒等方面起重要作用[27]。丙二醛(MDA)是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度[28]。本试验表明:低温胁迫下,外源NO可提高SOD,POD,CAT的活性,降低相对电导率,降低膜透性,保护细胞膜免受或减少损伤,提高苦瓜幼苗抗低温胁迫的能力。本试验还发现,0.5 mmol·L-1SNP处理可有效缓解低温胁迫对苦瓜幼苗的影响,高浓度和低浓度的SNP对低温胁迫缓解作用较小,高浓度的SNP有时会产生相反的作用。由于外源NO的作用机制非常复杂,SNP的浓度效应是否是由NO对生物体的双重作用引起目前还有争议,还需进一步深入研究。
综上所述,在低温胁迫下,外源NO可以增加苦瓜幼苗叶片脯氨酸等渗透调节物质含量,提升SOD,CAT,POD等3种抗氧化酶活性,清除低温胁迫产生的多余自由基,降低相对电导率和 MDA含量保护膜的完整,防止膜质过氧化,从而增强了苦瓜幼苗对低温胁迫的适应性,促进了低温胁迫下苦瓜幼苗的生长。
参考文献:
[1]BELIGNI M V,LAMATTINA L. Nitric oxide: a non-traditional regulator of plant growth[J].TrendsinPlantScience, 2001,6(11):508-509.
[2]LAMATTINA L,BELIGNI M V,GARCIA-MATA C, et al. Method of enhancing the metabolic function and the growing conditions of plants and seeds: U.S. Patent No. 6242384[P]. 2001-06-05. Washington DC: U.S. Patent and Trademark Office.
[3]KOPYRA M,GWOZDZ E A. Nitric oxide stimulates seed germination and counteracts the inhibitory effect of heavy metals and salinity on root growth ofLupinusluteus[J].PlantPhysiology&Biochemistry, 2003, 41(11/12):1011-1017.
[4]UCHIDA A, JAGENDORF A T, HIBINO T, et al. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J].PlantScience, 2002, 163(3): 515-523.
[5]HOSSAIN K K,NAKAMURA T,YAMASAKI H. Effect of nitric oxide on leaf non-photochemical quenching of fluorescence under heat-stress conditions[J].RussianJournalofPlantPhysiology, 2011, 58(4): 629-633.
[6]李秀,巩彪,徐坤. 外源NO对高温胁迫下姜叶片活性氧代谢的影响[J].园艺学报,2014,41(2):277-284.
[7]陈银萍, 王晓梅, 杨宗娟,等.NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响[J].农业环境科学学报,2012,31(2):270-277.
[8]于秀针,张彩虹, 姜鲁艳,等.外源NO对低温胁迫下番茄种子萌发和幼苗生长的影响[J].北方园艺,2014(22):5-8.
[9]樊怀福,杜长霞,朱祝军.外源NO对低温胁迫下黄瓜幼苗生长、叶片膜脂过氧化和光合作用的影响[J].浙江农业学报,2011,23(3):538-542.
[10]杨美森,王雅芳, 干秀霞,等.外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响[J].中国农业科学,2012,45(15):3058-3067.
[11]牟雪姣,刘理想,孟鹏鹏,等.外源NO缓解蝴蝶兰低温胁迫伤害的生理机制研究[J].西北植物学报,2015,35(5):978-984.
[12]田丽波,谷幸幸,商桑,等.苦瓜基因组DNA的提取及ISSR扩增体系的优化[J].中国农学通报,2014,29(4):88-93.
[13]孙奉良.苦瓜耐低温性指标鉴定与筛选[D].武汉:华中农业大学,2003.
[14]黄玉辉,罗海玲,韦莉萍,等.苦瓜耐冷性生理指标研究[J].广西农业科学,2008(6):805-807.
[15]程世强,吴智明,曾晶,等.低温胁迫对苦瓜成苗及幼苗生理生化特性的影响[J].热带作物学报,2011,32(11):2099-2103.
[16]黄玉辉,黄如葵,陈小凤,等.油菜素内酯对苦瓜抗冷性生理指标的影响[J].南方农业学报,2012,43(5):592-596.
[17]DELLEDONNE M,XIA Y,DIXON R A,et al. Nitric oxide functions as a signal in plant disease resistance[J].Nature, 1998, 394(6693): 585-588.
[18]李洋,张芃,张晓茜,等.SNP复合抗冷剂对黄瓜幼苗耐冷性的影响[J]. 浙江农业学报,2015,27(2):200-205.
[19]BAILLY C,BENAMAR A,CORBINEAU F,et al. Changes in malondialdehyde content and in superoxide dismutace, catalase and glutathione reductase activities in sunflower seed as related to deteriotation during accelerated aging[J].PhysiologiaPlantarum,1996,97(1):104-110.
[20]FOYER C H,DESCOURVIERES P,KUNERT K J. Protection against oxygen radicals: an important defense mechanism studied in transgenic plants[J].PlantCell&Environment,1994,17(5):507-523.
[21]薛应龙.植物生理学实验手册[M].上海:上海科学技术出版社,1985.
[22]王学奎.植物生理生化实验原理和技术[M].2版.北京:高等教育出版社,2006.
[23]赵世杰,许长成,邹琦.植物组织水中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[24]别之龙,黄丹枫.工厂化育苗原理与技术[M].北京:中国农业出版社,2008.
[25]SHARMA P,SHARMA N,DESWAL R. The molecular biology of the low-temperature response in plants[J].Bioessays, 2005, 27(10): 1048-1059.
[26]尚庆茂,陈淑芳,张志刚.硒对高温胁迫下辣椒叶片抗氧化酶活性的调节作用[J].园艺学报,2005,32(1):35-38.
[27]刘兴旺.一氧化氮提高黄瓜低温耐受性的分子机制[D]. 北京:中国农业大学,2013.
[28]邹琦.植物生理学实验指导[M].北京:中国农业出版社, 2000.
(责任编辑张韵)
Abstract: The purpose of this work was to separateNINandSusgene from Ougan fruit and analyze expression patterns of both two genes in different tissues at different development stages of fruits, which will provide some basic information for sugar metabolism of Ougan fruit and enrichNINandSusstudy on citrus fruit. Two full length sequences encodingNINandSusgenes were isolated. They were 1 932 and 2 418 bp in length, respectively, encoding putative proteins of 643 and 805 amino acid. Sequence alignment results showed that bothNINandSuswere highly conserved, and shared more than 70% sequence homology with other plants from NCBI and almost 100% homology with citrus fruit. GenBank accession number forNINandSusfrom Ougan fruit was KF694988 and KF694989, respectively. Relative molecular mass of the putative NIN and Sus protein was 72.18 and 92.19 ku, respectively, and the isoelectric point (pI) was 6.882 and 6.051, respectively. Phylogenetic analysis showed that putative NIN protein belonged to Group α, which might localize in plastid, and putative Sus protein belongs to Sus Ⅰ. Results of real-time quantitative PCR showed that the mRNA level of both two genes accumulated highly in stem, then leaf, peel and flesh in descending order. The transcription level ofNINin peel was higher than that in flesh, while the transcription level ofSusin peel was relative to that in flesh. At different development stages of fruit, both genes expressed the highest at 120 after full bloom and then maintained at a low level until fruit maturation. The study showed that bothNINandSusgenes expressed with tissue-specificity, and both expressed at a higher level at the immature stage and decreased towards the ripening stage.
Key words: Ougan fruit; neutral invertase; sucrose synthase; gene clone; gene expression
CLC number: S666.1 Document: A
Article ID: 1004-1524(2016)05-0782-08
Effects of exogenous NO on plant growth and resistant characteristics of bitter melon seedlings under low-temperature stress
DU Zhuo-tao1, YANG Yan2, ZHU Guo-peng1, TIAN Li-bo1,*, SHANG Sang1,*
(1.CollegeofHorticultureandLandscape/KeyLaboratoryofProtectionandDevelopmentalUtilizationofTropicalCropGermplasmResources,HainanUniversity,Haikou570228,China; 2.TropicalPastureResearchCenter,ChineseAcdemyofTropicalAgriculturalSciences,Danzhou571737,China)
Abstract:For exploring the internal mechanism of exogenous NO in improving the cold resistance of bitter melon, in this experiment, the variety of Bilv was taken as test material, different concentrations of sodium nitroprusside (SNP) (0, 0.1, 0.5, 1.0, 1.5 and 2.0 mmol·L-1) was employed as exogenous nitric oxide (NO) donor to study the effects of different concentrations of exogenous nitric oxide (NO) on the plant growth, relative electrical conductivity, MDA content, proline content and the activities of POD, SOD, CAT of bitter melon seedlings under 8 ℃ low-temperature stress. The results showed that the treatment of SNP could improve plant height/stem diameter and leaf area/root volume; reduce the relative electrical conductivity and content of MDA; increase proline content and the activities of POD, SOD and CAT of the bitter melon seedlings under low-temperature stress to reduce the damage caused by low-temperature. It was also found that the cold resistance effect of treatment with low concentration of SNP was better than that with high concentration, especially the treatment with 0.5 mmol·L-1SNP was the best. It indicated that the exogenous NO with proper concentration could promote the plant growth and enhance the bitter melon seedlings’ adaptability for low temperature stress through improving the activities of defensive enzymes, increasing the osmotic adjustment substance contents, reducing membrane lipid peroxidation and protecting the stability of cell membrane structure.
Key words:bitter melon; exogenous NO (SNP); low temperature stress; defensive enzyme
Gene clone, sequence analysis and gene expression of NIN and Sus from Ougan fruit
JIN Wei-wei, CHEN Gong-kai*, ZHU Jian-jun, GAO Ai-ling
(InstituteofPomology,WenzhouAcademyofAgriculturalSciences,Wenzhou325006,China)
DOI:10.3969/j.issn.1004-1524.2016.05.11
收稿日期:2015-09-10
基金项目:国家自然科学基金项目(31460517);海南省自然科学基金项目(311029);海南省蔬菜生物学重点实验室开放课题(SCKF201502);国家科技支撑计划项目子课题(2014BAD05B04);海南大学中西部计划学科建设项目(ZXBJH-XK008)
作者简介:杜卓涛(1980—),女,河北石家庄人,硕士研究生,从事植物生物技术研究。E-mail: dutao200588@126.com
*通信作者,田丽波,E-mail:faiy7play@163.com;商桑,E-mail: fair.play@163.com
中图分类号:S642.5
文献标志码:A
文章编号:1004-1524(2016)05-0776-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2016,28(5): 776-781
http://www.zjnyxb.cn
杜卓涛,杨衍,朱国鹏,等.外源一氧化氮对低温胁迫下苦瓜幼苗生长及部分抗逆指标的影响[J].浙江农业学报,2016,28(5): 776-781.

