2013年新疆地区血培养分离细菌耐药监测分析
张 琼,郭忠帅,刘 涛,季 萍
(新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054)
2013年新疆地区血培养分离细菌耐药监测分析
张琼,郭忠帅,刘涛,季萍△
(新疆医科大学第一附属医院医学检验中心,乌鲁木齐 830054)
[摘要]目的了解新疆地区2013年血培养分离细菌的分布特征及耐药性。方法对分离菌株的鉴定采用法国梅里埃VITEK-Compact和ABI系列细菌鉴定仪,药物敏感性试验采用最小抑菌浓度(MIC)法和K-B法结合进行。结果临床血培养共分离出细菌3 962株,其中革兰阳性菌占50.8%,革兰阴性菌占49.2%。最常见的菌株为凝固酶阴性葡萄球菌(31.7%)、大肠埃希菌(23.2%)、金黄色葡萄球菌(9.5%)、肺炎克雷伯菌(8.7%)、鲍曼不动杆菌(3.6%)、阴沟肠杆菌(2.5%)、屎肠球菌(2.5%)、铜绿假单胞菌(2.2%)、粪肠球菌(2.0%)、肺炎链球菌(1.1%)。产超广谱β-内酰胺酶(ESBLs)大肠埃希菌、肺炎克雷伯菌和奇异变形杆菌检出率分别为69.8%、62.6%和66.7%。耐甲氧西林金黄色葡萄球菌(MRSA)和耐甲氧西林凝固酶阴性葡萄球菌(MRSCN)的检出率分别为36.2%和86.3%。鲍曼不动杆菌、铜绿假单胞菌和肺炎克雷伯菌的泛耐药菌株(XDR)检出率分别为14株(9.9%)、1株(1.2%)、2株(0.6%)。未发现对万古霉素、利奈唑胺耐药的葡萄球菌、粪肠球菌。结论新疆地区血培养分离菌株中,革兰阳性菌与革兰阴性菌所占比例相当,呈现菌种多样化,对常用抗菌药物耐药性严重,应及时了解血培养分离细菌的分布情况,加强细菌耐药性监测,控制院内感染,指导临床合理用药,控制耐药菌株的产生和传播。
[关键词]细菌;药物耐受性;抗菌药物;新疆
血培养是确定血流感染(BSI)最重要、最直接的手段。近年来,随着抗菌药物的大量滥用,患者的机体免疫防御功能下降,使得由条件致病菌感染所致的菌血症、败血症的发生率逐年上升,而且血流感染表现为致病菌种类广泛,耐药性存在地域性差异,常导致初期经验性治疗效果不佳。因此,定期检测血培养分离细菌的耐药性显得尤为重要[1-2]。现将新疆地区2013年血培养分离细菌的分布特征及耐药性进行总结,供临床参考。
1材料与方法
1.1材料血培养标本来源于2013年新疆17家三级医院,剔除患者相同部位重复株菌,且不收集除革兰阳性菌及革兰阴性菌以外的其他病原微生物。
1.2方法
1.2.1细菌鉴定及药敏试验细菌的培养、分离及鉴定严格按照《全国临床检验操作规程》进行。对金黄色葡萄球菌和凝固酶阴性葡萄球菌补充头孢西丁药敏纸片。对万古霉素药敏纸片呈中介或耐药的肠球菌属补充万古霉素E-test条测定其最小抑菌浓度(MIC),对苯唑西林纸片抑菌圈直径小于或等于19 mm 的肺炎链球菌必须做青霉素E-test条测定其MIC。
1.2.2质量控制及药敏试验判定质控菌株为大肠埃希菌 ATCC 25922和ATCC 35218、阴沟肠杆菌ATCC 700323、铜绿假单胞菌ATCC 27853、金黄色葡萄球菌 ATCC 25923和ATCC 29213、肺炎链球菌 ATCC 49619、粪肠球菌ATCC 29212、铅黄肠球菌ATCC 700323。药敏结果按照美国临床和实验室标准协会抗菌药物敏感性试验标准2014版进行判定。
1.3统计学处理所有数据按照WHONET5.6要求统一收集、录入、分析。
2结果
2.1细菌分布临床血培养共分离出细菌3 962株,其中革兰阳性菌占50.8%,革兰阴性菌占49.2%。革兰阳性菌(2 011株)中,最常见的为表皮葡萄球菌(12.3%)、金黄色葡萄球菌(9.5%)、人葡萄球菌(7.8%)、溶血葡萄球菌(3.8%)、缓慢葡萄球菌(3.2%);革兰阴性菌(1 951株)中,最常见的为大肠埃希菌(23.2%)、肺炎克雷伯菌(8.7%)、鲍曼不动杆菌(3.6%)、阴沟肠杆菌(2.5%)、铜绿假单胞菌(2.2%)。
2.2临床常见细菌的耐药率
2.2.1葡萄球菌属本文耐甲氧西林金黄色葡萄球菌(MRSA)和耐甲氧西林凝固酶阴性葡萄球菌(MRSCN)的检出率分别为64株(36.2%)和479株(86.3%),未检出对利奈唑胺和万古霉素耐药菌株。金黄色葡萄球菌对复方新诺明的耐药率为12.9 %,对其余抗菌药物的耐药率均超过20.0%。凝固酶阴性葡萄球菌对庆大霉素和利福平的耐药率分别为16.7%和15.0%,对其余抗菌药物的耐药率均超过20.0%。其中,MRSA和MRCNS对多数抗菌药物的耐药性明显高于MSSA和MSCNS,见表1。
2.2.2肠球菌属屎肠球菌对大部分抗菌药物的耐药率明显高于粪肠球菌。二者对万古霉素、替考拉宁和利奈唑胺有高度的敏感性,耐药率低于2.0%。未检出对万古霉素和替考拉宁耐药粪肠球菌(表1)。
2.2.3肺炎链球菌本文中共分离非脑膜炎肺炎链球菌43株,其中0~14岁儿童15株,15岁以上成人28株。未发现对青霉素、左氧氟沙星、莫西沙星、利奈唑胺、万古霉素的耐药菌株。其中,儿童对克林霉素(75.0%)、红霉素(80.0%)的耐药率低于成人(81.2%、86.4%),见表2。
2.2.4肠杆菌科产超广谱β-内酰胺酶(ESBLs)大肠埃希菌、肺炎克雷伯菌和奇异变形杆菌检出率分别为185株(69.8%)、67株(62.6%)和4株(66.7%)。产碳青霉烯酶(KPC)大肠埃希菌和肺炎克雷伯菌的检出率分别为3株(0.3%)和14株(4.1%)。多数肠杆菌科细菌对亚胺培南和美罗培南仍高度敏感,耐药率低于10.0%。哌拉西林/他唑巴坦和阿米卡星对肠杆菌科细菌有良好的抗菌活性,耐药率为0%~6.8%。
2.2.5革兰阴性非发酵菌鲍曼不动杆菌和铜绿假单胞菌泛耐药菌株分别检出14株(9.9%)和1株(1.2%)。鲍曼不动杆菌对大部分抗菌药物的耐药率明显高于铜绿假单胞菌。二者对多黏菌素B和米诺环素有高度的敏感性。洋葱伯克霍尔德菌对美罗培南的耐药率为19.0%,对其他抗菌药物的耐药率均低于5.0%。嗜麦芽窄食单胞菌对头孢哌酮/舒巴坦的耐药率为42.9%,对其他抗菌药物的耐药率均低于10.0%,见表2。

表1 革兰阳性球菌常见细菌药敏率(%)
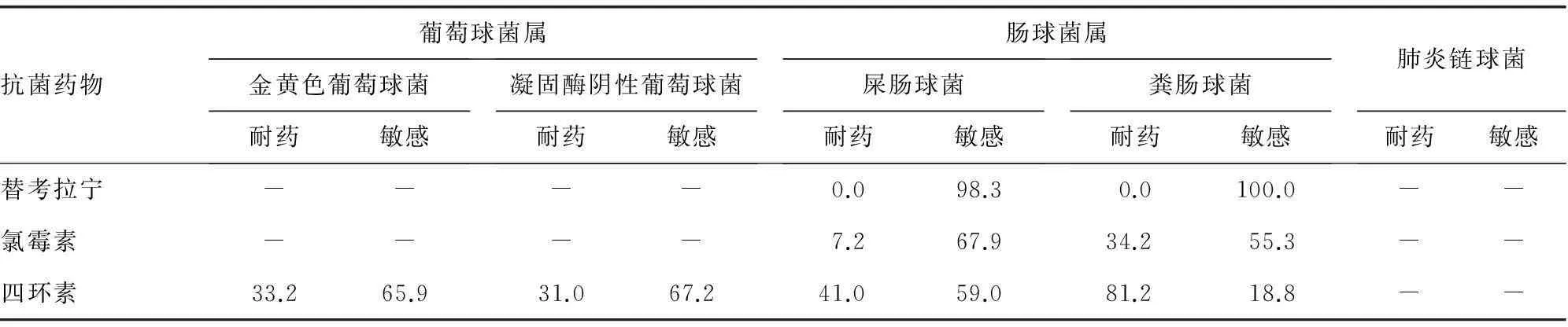
续表1 革兰阳性球菌常见细菌药敏率(%)
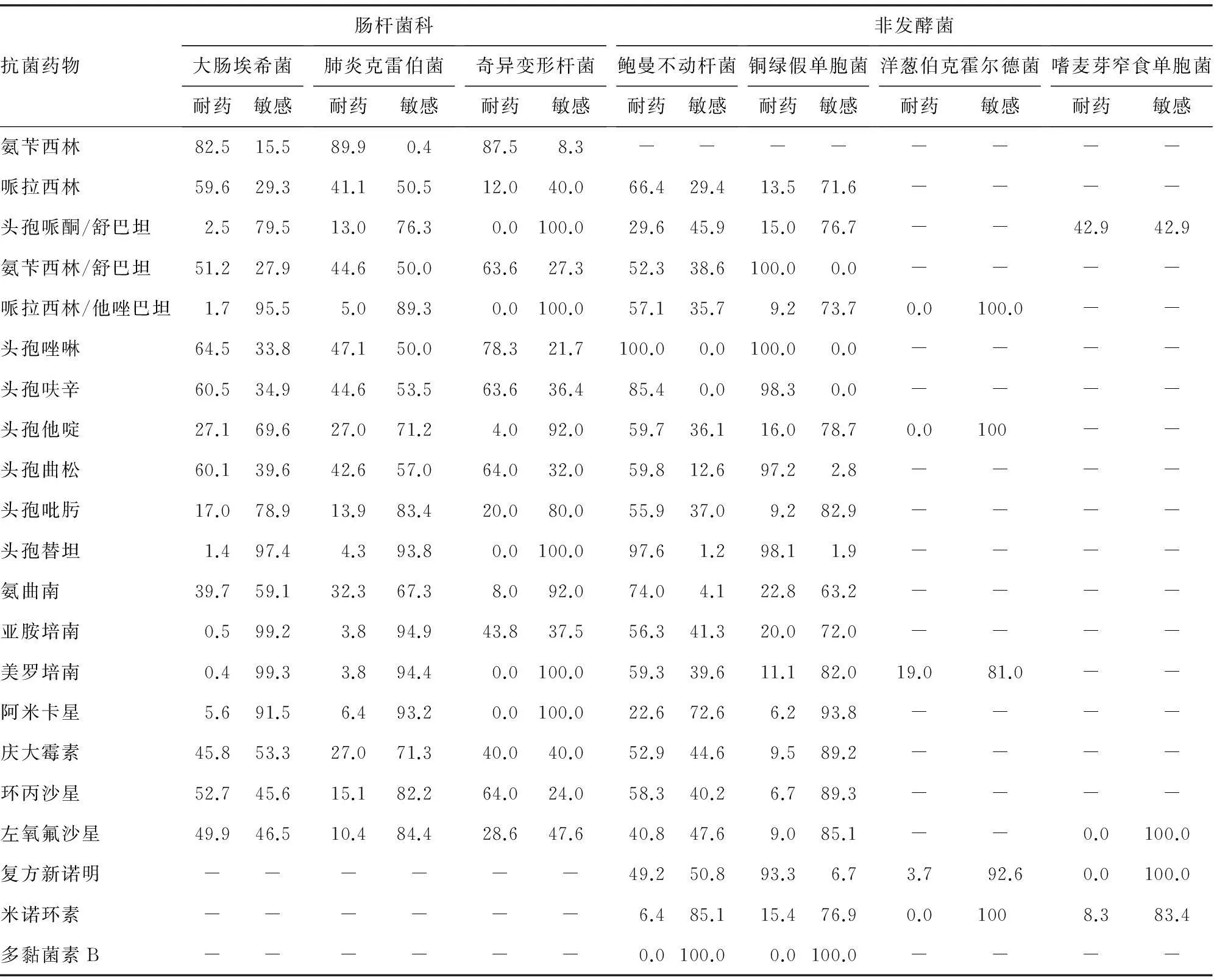
表2 革兰阴性杆菌常见细菌药敏率(%)
3讨论
本文中临床共分离出3 962株细菌,革兰阳性菌占50.8%,革兰阴性菌占49.2%,与陆国健[3]报道一致,与强雪芹等[4]报道相反,说明血流感染的细菌分布存在地域性差异,这与不同地区患者的疾病类型、发病情况、抗菌药物的选择等有关。MRSA检出率为36.2%,低于全国水平;MRCNS检出率为86.3%,远高于全国水平[5]。而科室中,重症监护室(ICU)是血流感染的最主要的病区(40.0%),可能与患者的基础病及免疫力低下等因素密切相关。
葡萄球菌是血流感染的主要病原菌,因其感染率和病死率高,给临床治疗带来了困难[6]。但有研究表明血培养中,葡萄球菌(CNS)有27.0%确定引起血流感染,37.0%可能引起感染,而36.0%为污染所致[7]。因此,为了确定葡萄球菌是否是致病菌,应连续做2~3套以上血培养,均检出该菌,则致病菌的可能性大,如只有1次阳性,则应结合患者是否有菌血症或败血症的症状,白细胞计数及降钙素原是否升高来判断[8]。另外,要加强血培养采集的规范化操作。本文中,葡萄球菌的感染率为41.2%,其中表皮葡萄球菌、人葡萄球菌等凝固酶阴性葡萄球菌占血培养分离菌株的31.7%,金黄色葡萄球菌占血培养分离菌株的9.5%。CNS对利福平和庆大霉素有较高的敏感性,金黄色葡萄球菌对复方新诺明有较高的敏感性,未发现对万古霉素、利奈唑胺耐药的葡萄球菌。
大肠埃希菌是新疆地区血流感染的最主要细菌,占所有分离菌株的23.2%,其他常见肠杆菌科细菌为肺炎克雷伯菌(8.7%)和阴沟肠杆菌(2.5%)。肠杆菌科细菌常产CRE,耐药程度较高[9]。随着对碳青霉烯类抗菌药物耐药菌株的增多,亚胺培南作为治疗产ESBLs菌株的最后防线,临床上应谨慎选择用药。本文中,产ESBLs大肠埃希菌、肺炎克雷伯菌和奇异变形杆菌分别检出185株(69.8%)、67株(62.6%)和4株(66.7%),产CRE的大肠埃希菌和肺炎克雷伯菌分别检出3株(0.3%)和14株(4.1%)。本文中奇异变形杆菌对亚胺培南的耐药率为43.8%,明显高于全国水平,可能是由于方法学问题造成的。因为VITEK-Compact药敏结果说明书特别注明,如果鉴定为奇异变形杆菌,亚胺培南MIC法药敏结果不可信,需补充亚胺培南K-B法药敏结果。
非发酵菌感染中,主要以鲍曼不动杆菌和铜绿假单胞菌为主,并且以ICU患者最为常见,分别占全部分离菌株的3.6%和2.2%。本文中,鲍曼不动杆菌对多数抗菌药物的耐药率较高,明显高于铜绿假单胞菌,但二者对多黏菌素B和米诺环素有很高的敏感性。而鲍曼不动杆菌和铜绿假单胞菌泛耐药菌株分别检出14株(9.9%)和1株(1.2%)。2012年的中国鲍曼不动杆菌感染诊治与防控专家共识[10]推荐以替加环素为基础联合用药治疗鲍曼不动杆菌感染。
血流感染是引起患者死亡的主要原因之一,而血培养是诊断血流感染的金标准。因此,快速、准确、规范化的操作,可准确地检测出病原菌,给出合理的药敏结果,为临床早期诊断及合理用药提供可靠的依据,并且能控制抗菌药物的滥用和耐药菌株的产生。
参考文献
[1]Prabhu K,Bhat S,Rao S.Bacteriologic profile and antibiogram of blood culture isolates in a pediatric care unit[J].J Lab Physicians,2010,2(2):85-88.
[2]Atul Garg,Anupurba S,Garg J,et al.Bacteriological profile and antimicrobial resistance of blood culture isolate from a university hospital[J].J Ind Acad Clin Med,2007,8(2):139-143.
[3]陆国健.血培养分离344株病原菌的耐药性分析[J].中华医院感染学杂志,2013,23(6):1439-1441.
[4]强雪芹,张爽,辛力华,等.2011~2012年血培养病原菌分布及耐药性变迁[J].中华医院感染学杂志,2014,24(1):36-38.
[5]李光辉,朱德妹,汪复,等.2011年中国CHINET血培养临床分离菌的分布及耐药性[J].中国感染与化疗杂志,2013,13(4):241-247.
[6]Rodriguez-Bano J,De Cueto M,Retamar PA.Current management of bloodstream infections[J].Expert Rev Anti Infect Ther,2010,8(7):815-829.
[7]Healy CM,Baker CJ,Palazzi DL,et al.Distinguishing true coagulase-negative staphylococcus infections from contaminants in the neonatal intensive care unit[J].J Perinatol,2013,33(1):52-58.
[8]Beckmann SE,Dickema DJ,Doern GV.Determining the clinical significance of coagulase negative staphylococci isolated from blood cultures infect control[J].Hosp Epidemiol,2005,26(6):559-566.
[9]Schwaber MJ,Carmeli Y.Carbapenem-resistant enterobacteriaeeae:a potential threat[J].JAMA,2008,300(24):2911-2913.
[10]陈佰义,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊治与防控专家共识[J].中国医药科学,2012,2(8):3-8.
Antimicrobial resistance monitoring of bacteria isolated from blood culture in Xinjiang area during 2013*
Zhang Qiong,Guo Zhongshuai,Liu Tao,Ji Ping△
(Medical Laboratory Center,First Affiliated Hospital of Xinjiang Medical University,Urumqi,Xinjiang 830054,China)
[Abstract]ObjectiveTo understand the distribution characteristics and drug resistance of bacteria isolated from blood culture in Xinjiang area during 2013.MethodsThe identification of isolated bacteria were performed by adopting the France VITEK-Compact and the ABI series bacterial identification instruments.The antimicrobial susceptibility test was carried out by using the minimum inhibitory concentration (MIC) and Kirby-Bauer (K-B) methods.ResultsA total of 3 962 strains of bacteria were isolated from clinical blood culture,in which Gram-positive bacteria and Gram-negative bacteria accounted for 50.8% and 49.2% respectively.The most frequent strains were coagulase-negative staphylococci (31.7%),Escherichia coli (23.2%),Staphylococcus aureus (9.5%),Klebsiella pneumoniae (8.7%),Acinetobacter baumannii (3.6%),Enterobacter cloacae (2.5%),Enterococcus faecium (2.5%),Pseudomonas aeruginosa (2.2%),Enterococcus faecalis (2.0%) and Streptococcus pneumoniae (1.1%).The detection rate of extended-spectrum beta-lactamase (ESBLs) producing Escherichia coli,Klebsiella pneumoniae and Proteus mirabilis were 69.8%,62.6% and 66.7% respectively.The detection rates of methicillin-resistant Staphylococcus aureus(MRSA) and methicillin-resistant coagulase-negative Staphylococcus (MRCNS) was 36.2% and 86.3% respectively.The pan-drug resistant (XDR) strains of Acinetobacter baumannii,Pseudomonas aeruginosa,Klebsiella pneumonia were 14 strains(9.9%),1(1.2%),2 strains(0.1%),16 strains(0.6%).No strains resistant to vancomycin or linezolid were found in Staphylococcus and Enterococcus faecalis.ConclusionAmong blood culture isolated bacteria in Xinjiang area,the proportion of Gram-positive bacteria and Gram-negative bacteria have little difference.The diversity of bacterial species exist.The resistance to commonly used antibiotics is serious.The distribution situation of blood culture isolated bacteria should be timely understood.The bacterial drug resistance monitoring should be strengthened to control the nosocomial infections,guide rational drug use in clinic and control the generation and spread of drug resistant bacterial strains.
[Key words]bacteria;drug tolerance;antibiotics;Xinjiang
doi:·调查报告·10.3969/j.issn.1671-8348.2016.09.029
作者简介:张琼(1969-),学士,副教授,主要从事免疫、微生物方面的研究。△通讯作者,E-mail:439090316@163.com。
[中图分类号]R446.5
[文献标识码]A
[文章编号]1671-8348(2016)09-1251-04
(收稿日期:2015-08-18修回日期:2015-12-13)

