HIFU术后子宫肌瘤消融区内残余灶MRI增强与超声造影比较及临床价值
王昭波,丁汇清,杨 杰,李长城,李春阳,杨静秀
(1.连云港市东方医院HIFU治疗中心,江苏连云港 222042;2.连云港市第二人民医院影像科,江苏连云港 222023)
HIFU术后子宫肌瘤消融区内残余灶MRI增强与超声造影比较及临床价值
王昭波1,丁汇清1,杨杰2△,李长城1,李春阳1,杨静秀1
(1.连云港市东方医院HIFU治疗中心,江苏连云港 222042;2.连云港市第二人民医院影像科,江苏连云港 222023)
[摘要]目的探讨高强度聚焦超声(HIFU)术后早期子宫肌瘤消融区内残余灶磁共振成像(MRI)增强与超声造影的临床价值。方法对26例子宫肌瘤HIFU术后消融区内残余灶(共32个)采用MRI增强和超声造影,并进行比较。结果26例子宫肿瘤患者HIFU术后32个残余灶中,超声造影显示有7个残余灶(21.88%),MRI增强显示有30个残余灶(93.75%),两种影像学检查显示残余灶比较,差异有统计学意义(χ2=16.94,P<0.01)。结论超声造影可用于肌瘤HIFU术后早期疗效粗略评价,MRI多期增强显示HIFU术后早期肌瘤消融区内残余灶较超声造影更准确。
[关键词]子宫肌瘤;高强度聚焦超声;残余灶;磁共振成像;超声造影
目前,高强度聚焦超声(high intensity focused ultrasound,HIFU) 已成为治疗子宫肌瘤的主要方法[1-4]。超声检查和磁共振成像(MRI)不仅是HIFU术中导引、监测的主要方法,而且也是术后随访和疗效评价的两种主要方法。有研究认为,HIFU术后的MRI增强或超声造影时,肌瘤消融区内有强化或血流灌注是残余灶存在的重要征象,也是评价HIFU术后各期疗效的主要指标[2-5]。本文旨在分析HIUF术后早期残余灶的MRI和超声造影表现,以探讨MRI多期增强(简称MRI增强)与超声造影在HIUF术后早期残余灶的临床意义。
1资料与方法
1.1一般资料2011年6月至2015年6月连云港市东方医院HIFU治疗中心共收治因子宫肌瘤作HIFU治疗的患者362例。选择HIFU术后早期及随访大于或等于6个月的子宫肌瘤消融区内有残余灶的患者26例(32个残余灶),年龄23~56岁,平均(30.11±3.65)岁。本组患者均由临床、超声造影及MRI检查证实, HIFU术前和术后超声检查包括二维、彩色多普勒显像(CDFI)和造影等,术前及术后1~2周MRI检查包括常规、弥散加权成像(DWI)、表观弥散系数(ADC)和多期动态增强等。临床随访和影像学检查需避开月经期,患者对本研究均有知情权并签字。影像学资料由两名长期从事影像学诊断高级职称医师分析。
1.2方法
1.2.1患者选择术前选择MRI增强或(和)超声造影显示有不同程度血供和直径大于或等于3.20 cm的肌瘤,瘤体直径为3.20~9.83 cm,平均(4.61±1.30)cm。剔除浆膜下肌瘤基底部宽度/瘤体直径小于或等于1/2和其他盆腔肿瘤,以及有重要脏器严重病变的患者。
1.2.2HIFU治疗和超声监测方法设备为重庆海扶技术有限公司JC-200型HIFU肿瘤治疗系统。使用参数:治疗频率0.50~2.00 MHz,焦点为1.10 mm×1.10 mm×3.30 mm;焦域最大声强为20 000 W/cm2;运动控制精度为0.10 mm。本组HIFU治疗功率为340~400 W,平均384 W;辐照时间为901~2 910 s,平均1 610 s,治疗总剂量为348.62~1 221.26 KJ,平均846.55 KJ;治疗时间为0.98h~4.26h,平均(2.40±0.50)h。用机载超声做HIFU术前术后检查,每次检查均先以常规超声观察肌瘤一般情况,然后使用彩色Doppler超声观察,最后做超声造影重点肌瘤消融区及有无残余灶。超声造影剂为声诺维(Bracco,Italy),用5 mL生理盐水稀释、摇匀,抽取2.5 mL从肘静脉快速团注,随即5 mL生理盐水快速冲管,连续观察120~180 s。参照肌瘤实质性部分的二维超声回声强度,定义残余灶的回声强度为高、稍高、等和低回声。
1.2.3MRI检测方法所用设备为Phillip Achieva Pulsar HP 1.5 T全身MRI扫描仪。梯度场强66 mT/m,切换率180 mT·m-1·ms-1。体线圈为8通道通用相控阵SENSE线圈,加速因子1.5~2.0,上、下游及体前置饱和带,采用脂肪抑制技术。以快速自旋回波序列T1WI、T2WI平扫为基础进行横断位扫描,完成T1W I (24幅图像)、T2WI (24幅)成像分别需120~150 s。视野(FOV)为340 mm,层厚5 mm,层间距1 mm。采集矩阵各为256×256,翻转角80°,回波链15~20。增强扫描采用T1高分辨率等体素容积采集(THRIVE)序列,横断位采用SENSE技术,SENSE因子R=1.8,层厚1 mm;重复1次。造影剂为国产钆喷酸葡胺注射液(Gd-DTPA)15 mL,用高压注射器以2 mL/s速率从肘静脉注入、再注入等量生理盐水。设定启动增强各期的扫描时间分别为:动脉期35 s,静脉期60 s和平衡期120 s,增强各期可得120幅×3图像。以臀肌MRI信号强度作为参照,定义肌瘤常规和多期增强MRI信号强度分别为高、稍高、等和低信号。
1.2.4MRI增强和超声造影检查判断有无残余灶的标准参照文献[3-8]的方法,将本组资料中MRI增强时肌瘤消融区内有强化呈高信号改变区域视为残余灶;反之,则视为无残余灶。将超声造影时肌瘤消融区内有造影剂充填呈较高或高回声区域视为残余灶;反之,则视为无残余灶。
1.3统计学处理使用SPSS13.0软件进行统计分析,计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1残余灶及子宫肌瘤消融区的MRI增强结果本组32个残余灶中,于术后1~2周MRI检查时发现30个(93.75%)残余灶,2个残余灶未显示(于术后1~6个月MRI检查显示)。残余灶大小为30~500 mm3,平均(250±20.4)mm3,均位于消融区外围部分。观察残余灶与子宫肌层关系,26个(26/32) 残余灶与子宫肌层有低信号带相隔的;6个(6/32) 残余灶自子宫肌层呈“半岛状”突入消融区内。在MRI增强动脉期,消融区内残余灶均表现为短条、带状或斑片状强化呈高信号改变;在静脉期和平衡期病灶仍持续强化。从MRI增强动脉期到平衡期,32个肌瘤消融区(除残余灶外)均无强化呈低信号表现,其范围也无变化;从MRI增强动脉期到平衡期,子宫肌层逐渐强化和信号增高。
2.2HIFU术后肌瘤残余灶及消融区超声造影结果26例患者术后随访超声造影时,共发现7个残余灶(21.88%),其大小为3~12 mm,均位于消融区内外围。超声造影表现残余灶均有造影剂充填,呈条带或斑片状较高和高回声表现,残余灶部分区域也可呈稍低或等于子宫肌层回声。7个残余灶中,有3个病灶自子宫肌层也呈“半岛状”突入消融区内。32个消融区(除残余灶外)均无造影剂充填,表现为低回声。超声造影显示近腹壁侧(超声探头侧)的消融区回声可较高,并从浅层到深层回声渐次降低,消融区边缘与子宫肌层界面较模糊。
2.3HIFU术后6个月残余灶超声和MRI表现超声造影示7个(21.88%)残余灶仍有造影剂充填,其中3个残余灶体积增大。MRI增强示32个(100.00%)残余灶均有强化,其中14个残余灶体积增大。
2.4MRI增强与超声造影二者对子宫肌瘤消融区及残余灶检测比较MRI增强和超声造影显示消融区比较,差异无统计学意义(χ2=0.00,P>0.05);HIFU术后早期MRI增强对残余灶检出优于超声造影,差异有统计学意义(χ2=16.94,P<0.01),见表1。

表1 二者对肌瘤消融区及残余灶检测情况比较
+:HIFU术后1~2周MRI增强示有强化,术后超声造影示有造影剂充填;-:无强化或无充填。
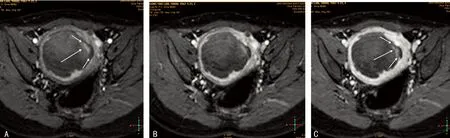
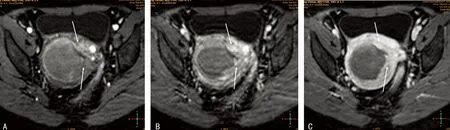
2.5典型病例患者1,49岁,子宫肌瘤HIFU术后24 h,MRI多期增强示消融区内残余灶。从动脉期到平衡期,肌瘤消融区残余灶呈“半岛”状持续强化影,大小约一3 mm×6 mm,该影以一蒂(细箭)与子宫肌层(粗箭)相连接,并突向消融区内(箭头)。MRI增强各期消融区均无强化,子宫肌层逐渐强化。在各期图像上,消融区边缘均较规则,与子宫肌层间界面清晰可辨,见图1。患者2,48岁,子宫肌瘤行HIFU治疗,术后第3天MRI多期增强检查。动脉期增强示肌瘤消融区有一2.5 mm×12 mm强化灶(长箭),呈高信号表现,增强后两期病灶仍强化,考虑为残余灶。该灶与子宫肌层间无明显联系,隔以宽约1~3 mm低信号带(短箭)。从动脉期到平衡期,肌瘤消融区均无强化呈大片状低信号影,子宫肌层逐渐强化(图2);HIFU术后6个月MRI多期增强检查,与图1比较,残余灶仍然有强化,范围增大(箭),明显强化血管处尤为显著(图3);HIFU术后即刻超声造影示子宫左侧壁见一米粒大小强回声影突入宫腔内(箭),术后6个月超声造影检查残余灶突入宫腔内,仍有造影剂充填,体积有所增大及局部形态增厚(箭),见图4。

A:动脉期;B:静脉期;C:平衡期。
图1典型子宫肌瘤HIFU术后24 h的MRI多期增强图像
A:动脉期;B:静脉期;C:平衡期。
图2典型子宫肌瘤HIFU术后第3天MRI多期增强检查
A:动脉期;B:静脉期;C:平衡期。
图3典型子宫肌瘤HIFU术后6个月MRI多期增强检查

A:术后即刻;B:术后6个月。
图4HIFU术后即刻和术后6个月超声造影检查
3讨论
HIFU术后,肌瘤消融区的体积变化和有无供血(即有无残余灶),是评价其疗效的主要指标[1-7]。但是,术后早期肌瘤消融区体积无明显缩小,需要长期随访才可见其明显缩小,有时即使其体积缩小也不能作为评价HIFU治疗有效的指标[2,8]。而在术后早期,做超声造影和MRI增强,根据消融区内有无供血情况,即可判断有无残余灶[6,9-10]。目前国内监测HIFU治疗肌瘤的影像学设备多用机载超声方法,极少用MRI监测。鉴于在HIFU术后早期,对MRI增强显示残余灶情况较少探讨,及对MRI增强和超声造影显示残留灶的准确性方面存在争议[3,5,7]。
3.1HIFU术后早期MRI增强和超声造影显示残余灶情况及临床意义有研究认为,HIFU各种治疗效应均可使肌瘤组织血供中断、血流灌注停止和凝固性坏死,而形成无残余灶的消融区(或非血流灌注区)[1,4,6-9]。上述病理学改变,是MRI和超声判断有无残余灶的重要征象,也是判断其疗效的指证[3,6,10]。在HIFU术后早期MRI增强时,消融区无增强呈低信号,残余灶强化方式与肌瘤强化方式相似而呈高或较高信号,在消融区与残余灶间可形成信号差对比。因此,MRI增强多能(本组30/32个)明确显示大于或等于3 mm残余灶。但是,在HIFU术后早期,MRI也可将残余灶漏检(2/32个)。究其因可能与残余灶较小、或与其血供不丰富(如肌瘤变性)而导致MRI增强时强化程度较差等有关。本组资料显示,MRI和超声随访过程中,尽管有些残余灶体积增大不明显,但是只要消融区内持续有供血病灶存在,仍可认为是残余灶。因此,在HIFU术后早期,MRI和超声检查时未显示残余灶的病例仍需密切随访,随访间隔以3~6个月并持续时间不短于12个月。此外,本组残余灶多位于肌瘤消融区的外围部分,及少部分病灶与子宫肌层呈“半岛状” 相连。总之,在HIUF术后早期,根据消融区内病灶有血供及多位于消融区外围征象,对于及时发现残余灶具有一定价值。但是,目前尚缺乏相关MRI和病理学大样本比较研究。在HIFU术后早期超声造影中,残余灶检出较低(7/32个)。首先操作者在超声造影时,必须仔细观察肌瘤消融区有无造影剂充填,在近超声探头侧及附近的消融区可呈稍高到较高回声,及伴有相当范围的声影;这种表现使得近探头侧消融区与子宫肌层界面模糊,有时会干扰较小残余灶的检出。但是,超声造影多切面、实时动态观察残余灶造影剂充填及与子宫肌层间的关系较好。
3.2MRI增强和超声造影显示残余灶的差异及临床意义表中资料显示,术后早期超声造影与MRI增强对残余灶检出率比较,差异有统计学意义(P<0.01)。导致差异的原因可能为:(1)与消融区内凝固性坏死等声学特性密切有关[3,5,9]。(2)与造影剂微泡是一种高声阻抗物质和散射剂,到达消融区后所产生的声学特性有关[11-12];在HIFU术后即刻超声造影时,由于病灶发生凝固性坏死和空化效应等,可产生较强回声伪影干扰[13]。(3)与MRI增强比较,在HIUF术后早期的超声造影时,显示子宫肌瘤边缘与子宫肌层界面均较模糊,同时造影剂充填子宫肌层也会产生较高声阻抗(较高回声)和声影,导致声影内消融区中残余灶的遗漏。与超声造影对比,在HIFU术后早期,MRI增强各期均能更细致地显示造影剂在血管内外和病灶组织中的分布过程,更准确地显示残余灶及消融区细节情况。充分认识在HIFU术后早期,MRI增强与超声造影显示残余灶的差异有一定临床意义:(1)对HIFU术后早期,与MRI增强对比,超声造影对残余灶的检出存在明显不足;(2)在HIFU术后即使超声造影未发现残余灶,患者仍需定期做MRI增强随访。两种检查对消融区检出差异无统计学意义(P>0.05),在HIFU术后随访中,超声可作为常规检查方法。
总之,在HIFU术后早期,MRI增强显示残余灶强化细节情况明显优于超声造影。因此,MRI增强可以对HIFU治疗子宫肌瘤早期疗效做出更准确评价。在HIFU术后随访中,超声造影与MRI增强联合使用,效果更好。
参考文献
[1]Kim YS,BaeDS,Park MJ,et al.Techniques to Expand Patient Selection for MRI-Guided High-Intensity Focused Ultrasound Ablation of Uterine Fibroids[J].AJR,2014,202(2):443-451.
[2]Leblang SD,Hoctor K,Steinberg FL.Leiomyoma shrinkage after MRI-guided focused ultrasound treatment:report of 80 patients[J].AJR Am J Roentgenol,2010,194(1):274-280.
[3]王磊,周晓东,任小龙,等.超声造影评价高强度聚焦超声治疗子宫肌瘤早期疗效的临床研究[J].中华超声影像学杂志,2006,16(9):698-700.
[4]熊小娟,欧阳光,张萤,等.超声造影评价聚焦超声在治疗子宫肌瘤及腺肌病补充治疗中的应用[J].重庆医学,2013,42(35):4286-4288.
[5]张晓君,胡兵.影像学在高强度聚焦超声治疗子宫肌瘤中的应用进展[J].中国医学影像学技术,2007,23(9):1417-1419.
[6]卢瑞沾,张俊成,杨振华,等.DCE-MRI对评价高强度聚焦超声刀治疗子宫肌瘤早期疗效的价值[J].磁共振成像,2013,4(4):271-275.
[7]刘艳林,吴光平,张焰.超声消融治疗子宫肌瘤后早期疗效观察[J].临床超声医学杂志,2012,14(8):562-564.
[8]Lénárd ZM,Mcdannold NJ,Fennessy FM,et al.Uterine leiomyomas:Mr imaging-guided focused ultrasound surgery--imaging predictors of success[J].Radiology,2008,249(1):187-194.
[9]李国权,刘国庆,周子和,等.高场强MRI对高强度聚焦超声治疗子宫肌瘤的疗效速评[J/CD].中华临床医师杂志:电子版,2012,6(10):2809-2810.
[10]邱冬,费兴波,龙劲松,等.高强度聚焦超声治疗子宫肌瘤的疗效观察[J/CD].中华医学超声杂志:电子版,2008,5(3):423-429.
[11]Clare MC,Nathan JM,Kullervo H,et al.Focused ultrasound surgery in oncology:overview and principles[J].Radiology,2011,276(2):39-56.
[12]唐晓旭,邹建中.微泡造影剂在高强度聚焦超声治疗子宫肌瘤中的应用进展[J].微创医学,2014,9(6):751-754.
[13]胡森阳,彭松.影像学在高强度聚焦超声消融子宫肌瘤术后疗效评价中的研究进展[J].现代医药卫生,2015,31(1):51-53.
作者简介:王昭波(1976-),副主任医师,大学本科,主要从事影像学诊疗工作。△通讯作者,Tel:13851222388;E-mail:13851222388@163.com。
doi:·经验交流·10.3969/j.issn.1671-8348.2016.06.032
[中图分类号]R445.1
[文献标识码]B
[文章编号]1671-8348(2016)06-0815-04
(收稿日期:2015-09-02修回日期:2015-11-10)

