变异链球菌磷酸转移酶系统ptxA、ptxB基因对细菌生长能力的影响
吴昕彧 陈晓丹 赵望泓 侯晋 陈璇南方医科大学南方医院·南方医科大学口腔医学院,广州 510515
变异链球菌磷酸转移酶系统ptxA、ptxB基因对细菌生长能力的影响
吴昕彧陈晓丹赵望泓侯晋陈璇
南方医科大学南方医院·南方医科大学口腔医学院,广州 510515
[摘要]目的研究变异链球菌(S.mutans)磷酸转移酶系统(PTS)中抗坏血酸家族ptxA、ptxB基因对细菌生长能力的影响。方法构建ptxA、ptxB和ptxAB双重基因缺陷菌株以及ptxAB功能补偿菌株。在仅以抗坏血酸作为唯一碳源时,使用实时荧光定量聚合酶链反应检测野生株中ptxA、ptxB基因的表达情况。连续监测野生株、缺陷株和补偿株的菌液OD600值,比较其生长能力。结果经过聚合酶链反应和测序鉴定,结果证明缺陷株和补偿株构建成功。在以抗坏血酸作为唯一碳源的培养基中,野生株ptxA、ptxB基因的表达量均明显增高(P<0.01)。缺陷株的生长能力较野生株有所下降,但是在补偿株中可以得到补偿。结论ptxA、ptxB基因与S.mutans对抗坏血酸的吸收利用密切相关,缺陷株和补偿株的构建为进一步研究目的基因在S.mutans抗坏血酸代谢中的作用机制提供了理论基础。
[关键词]变异链球菌;磷酸转移酶系统;ptxA基因;ptxB基因;抗坏血酸
Supported by:The National Natural Science Foundation of China(81050035);Project of Talent Introduction in Universities of Guangdong Province (C1030636);President Foundation of Nanfang Hospital, Southern Medical University(2013B003).Correspondence: Zhao Wanghong, E-mail: zhaowh@smu.edu.com.
龋病是人类发病率最高的口腔疾病。目前较为公认的致龋菌之一是变异链球菌(Streptococcus mutans,S.mutans)。S.mutans可代谢碳水化合物,从而发挥产酸、黏附、生物膜形成等与致龋相关的生物学特性。2002年,S.mutans血清c型UA159菌株的全基因组测序工作全部完成。通过对基因组的分析表明,S.mutans与碳水化合物代谢相关的基因占了15%,与现有其他已测序的革兰阳性菌基因组相比,其呈现出更强的碳水化合物代谢能力[1]。而S.mutans对碳水化合物的转运,主要是通过磷酸转移酶系统(phosphotransferase system,PTS)完成的[2]。鉴于PTS对S.mutans代谢碳水化合物的重要作用,研究PTS相关基因对理解S.mutans的致龋作用有重要意义。
ptxA基因(NCBI GeneID:1027857)与ptxB基因(NCBI GeneID:1027854)分别编码S.mutans UA159 PTS中抗坏血酸家族酶Ⅱ复合体中的酶ⅡA和酶ⅡB。有学者[3]曾对这两个蛋白的三维晶体结构进行解析,并通过体外酶活性实验证明它们对抗坏血酸的磷酸化具有特异性。抗坏血酸在自然界中分布广泛,尤其在水果及蔬菜中含量丰富。目前已知大肠杆菌(Escherichia coli,E.coli)[4]、乳酸杆菌[5]等可在无氧条件下发酵抗坏血酸,以获得维持生命活动的碳源,但未见关于S.mutans通过PTS吸收利用抗坏血酸以获得碳源的报道。本研究拟构建ptxA、ptxB和ptxAB双重基因缺陷菌株,以及ptxAB功能补偿菌株,研究其在抗坏血酸特异性培养基中的生长情况,以揭示ptxA、ptxB基因在S.mutans利用代谢抗坏血酸中发挥的作用,并为进一步研究其作用机制提供基础。
1 材料和方法
1.1菌株及培养条件
本实验所用菌株S.mutans UA159(北京大学口腔医学院中心实验室惠赠)采用脑心浸液(brain heart infusion,BHI)培养基(青岛海博生物技术有限公司)培养,或采用添加不同浓度葡萄糖(Sigma公司,美国)或抗坏血酸(Sigma公司,美国)的TV培养基(含3.5%胰蛋白胨、0.04 μg·mL-1对氨基苯甲酸、0.2 μg·mL-1盐酸硫胺酸、1 μg·mL-1烟酰胺和0.2 μg·mL-1核黄素)(上海阿拉丁生化科技股份有限公司)进行培养。选择性BHI培养基采用壮观霉素(spectinomycin,spe)(Sigma公司,美国)抗性,spe的浓度为1 mg·mL-1。S.mutans的培养条件为37 ℃,厌氧培养(10%CO2、10%H2、80%N2)。E.coli DH5α[天根生化科技(北京)有限公司]采用Luria-Bertani(LB)培养基(青岛海博生物技术有限公司)培养,选择性LB培养基采用spe抗性,spe的浓度为0.1 mg·mL-1。E.coli的培养条件为37 ℃,200 r·min-1振荡培养。
1.2ptxA、ptxB、ptxAB缺陷菌株及ptxAB功能补偿菌株的构建
根据NCBI提供的S.mutans UA159全基因组序列,利用Primer Premier 5.0软件针对ptxA、ptxB及ptxAB设计引物,具体见表1。

表1 引物序列Tab 1 Sequences of primers
聚合酶链反应(polymerase chain reaction,PCR)扩增各基因相应的上、下游片段,经双酶切后与pFW5质粒(第四军医大学口腔医学院余擎教授惠赠)进行连接,使用E.coli DH5α感受态细胞进行转化。利用选择性LB培养基筛选阳性克隆,提取阳性克隆的质粒进行测序鉴定。将构建成功的ptxA、ptxB 及ptxAB双基因缺陷重组质粒转化入S.mutans。使用1 μg·mL-1的感受态刺激肽(competence stimulating peptide,CSP)对野生型S.mutans UA159进行刺激,两者混合后进行自然转化[6]。利用选择性BHI培养基筛选阳性克隆,提取阳性克隆的基因组DNA进行PCR及测序鉴定。利用类似方法,将启动子序列及ptxAB片段克隆至pDL278质粒(美国路易斯安那州立大学牙学院Zezhang T.Wen教授惠赠),转化入ptxAB双重基因缺陷菌株,构建ptxAB功能补偿菌株。
1.3抗坏血酸作为S.mutans生长唯一碳源时的最适浓度探究
分别检测含有5、10、15、20、30 mmol·L-1抗坏血酸的TV培养基的pH值。将培养24 h后的野生型S.mutans UA159使用无菌PBS溶液洗涤2次,TV培养基重悬,调节菌液OD600≈0.8,按1︰100分别加入到含有上述浓度抗坏血酸的TV培养基中,37 ℃厌氧培养48 h,每隔2 h测量各组菌液OD600值,重复3次,绘制细菌在含不同浓度抗坏血酸的培养基中的生长曲线。
1.4检测ptxA、ptxB基因在两种不同碳源特异性培养基中的表达情况
将培养24 h后的野生型S.mutans UA159用无菌PBS溶液洗涤2次,TV培养基重悬,调节菌液OD600≈ 0.8,按1︰100分别加入到含有15 mmol·L-1抗坏血酸或葡萄糖的TV培养基中,37 ℃厌氧培养至对数生长后期。使用RNAiso试剂盒(Takara公司,日本)提取细菌总RNA,使用逆转录试剂盒(Takara公司,日本)进行逆转录。利用Primer Premier 5.0软件设计ptxA、ptxB基因的引物,16S rRNA作为内参(表1),进行qPCR,检测ptxA、ptxB基因的表达情况,重复3次。使用SPSS 13.0软件进行两独立样本t检验,检验水准为α=0.05。
1.5各菌株在以抗坏血酸为唯一碳源时的生长能力比较
将培养24 h后的野生型S.mutans UA159、ptxA基因缺陷菌株、ptxB基因缺陷菌株、ptxAB双重基因缺陷菌株及ptxAB功能补偿菌株使用无菌PBS溶液洗涤菌体2次,TV培养基重悬,调节菌液OD600≈0.6,按1︰100比例分别加入至含有15 mmol·L-1抗坏血酸的TV培养基中,37 ℃厌氧培养72 h,每隔2 h测量各菌液OD600值,重复3次,绘制各基因缺陷菌株和补偿菌株在以抗坏血酸作为唯一碳源时的生长曲线。
2 结果
2.1ptxA、ptxB及ptxAB双重基因缺陷菌株的鉴定
ptxA、ptxB及ptxAB双重基因缺陷菌株的PCR鉴定结果见图1。由图1可见,各缺陷菌株PCR扩增的片段大小与使用相应重组质粒作为模版所扩增的片段大小一致,大小与预计相符。将片段测序结果在NCBI上进行BLAST对比,结果显示99%相符。

图1 ptxA、ptxB及ptxAB双重基因缺陷菌株的PCR鉴定Fig 1 Identification of ptxA-, ptxB- and ptxAB-deficient mutant by PCR
2.2抗坏血酸作为S.mutans生长唯一碳源时的最适浓度
含5、10、15、20、30 mmol·L-1抗坏血酸的TV培养基的pH值分别为6.26、5.90、5.53、5.17、4.79。随着抗坏血酸浓度的上升,培养基的pH值随之下降。野生型S.mutans UA159在以不同浓度的抗坏血酸作为唯一碳源时,其生长情况有所不同(图2)。随着抗坏血酸浓度的增加,迟缓期逐渐延长。5 mmol·L-1组与10 mmol·L-1组的迟缓期较短,约为6 h,其达到稳定期所需的时间亦较短,约为16 h,但5 mmol·L-1组与10 mmol·L-1组的终末菌密度均较低。15 mmol·L-1组的迟缓期约为12 h,其达到稳定期所需的时间约为34 h,菌液终末OD600值约为0.6。20 mmol·L-1组的迟缓期约为24 h,但在监测的48 h内,未进入稳定期。而30 mmol·L-1组在监测的48 h内,细菌未见明显增长。综合考虑含不同浓度抗坏血酸的培养基的pH值、细菌生长的迟缓期、达到稳定期所需的时间及终末菌密度,选择15 mmol·L-1作为S.mutans生长的最适抗坏血酸浓度,用于后续实验。
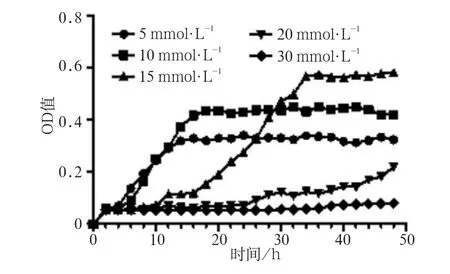
图2 野生型S.mutans UA159在以不同浓度抗坏血酸作为唯一碳源时的生长情况Fig 2 Growth study of wild-type S.mutans UA159 using L-ascor-bate as the only carbon source at various concentrations
2.3ptxA、ptxB基因在两种不同碳源特异性培养基中的表达情况
在以15 mmol·L-1抗坏血酸作为唯一碳源的TV培养基中,ptxA、ptxB基因的mRNA相对表达量显著高于15 mmol·L-1葡萄糖组(图3)。抗坏血酸组ptxA基因的表达量约为葡萄糖组的2倍,ptxB基因的表达量约为葡萄糖组的5倍,差异均具有统计学意义(P<0.01)。
2.4野生株与缺陷株在抗坏血酸特异性培养基中的生长能力
在以15 mmol·L-1抗坏血酸作为唯一碳源的TV培养基中,缺陷株的生长能力与野生株相比,受到明显影响(图4)。ptxA缺陷菌株的迟缓期延长,终末菌密度降低。而ptxB缺陷菌株与ptxAB缺陷菌株在监测的72 h内,未见明显增长。ptxAB功能补偿菌株能在一定程度上补偿缺陷菌株的生长能力,但仍未达到野生型的水平。
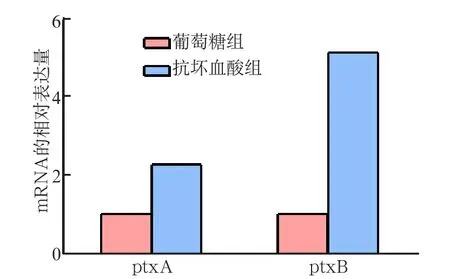
图3 ptxA、ptxB基因在含15 mmol·L-1抗坏血酸或葡萄糖特异性培养基中mRNA的表达情况Fig 3 The mRNA expression of ptxA and ptxB gene in the medium with 15 mmol·L-1L-ascorbate or glucose

图4 野生型S.mutans UA159与ptxA、ptxB、ptxAB基因缺陷菌株及ptxAB功能补偿菌株在含15 mmol·L-1抗坏血酸特异性培养基中的生长能力Fig 4 Growth of wild-type S.mutans UA159, ptxA-, ptxB-, ptxAB-deficient mutant and ptxAB-complemented strain in the me-dium with 15 mmol·L-1L-ascorbate
3 讨论
目前在S.mutans UA159中已发现超过14种PTS,包括葡萄糖、果糖、蔗糖、半乳糖、甘露糖等[7-10]。PTS一般由酶Ⅰ、含组氨酸的磷酸载体蛋白(histidinecontaining phosphocarrier protein,HPr)和酶Ⅱ复合体3部分组成。其中酶Ⅱ复合体具有糖特异性,负责对特定底物的跨膜转运及磷酸化,一般由3个蛋白组成:ⅡA、ⅡB 和ⅡC[11]。关于PTS磷酸转移的过程目前已较为清楚:首先酶Ⅰ通过自身磷酸化,从磷酸烯醇式丙酮酸中获得磷酸,然后把磷酸依次传递给HPr、ⅡA、ⅡB,最后ⅡB把磷酸传递给通过ⅡC转运进来的糖类[12]。ptxA、ptxB基因编码S.mutans UA159 PTS中抗坏血酸家族酶Ⅱ复合体中的酶ⅡA和酶ⅡB。有学者[3]曾对ptxA、ptxB基因编码的蛋白的作用底物进行体外实验研究,发现在抗坏血酸、甘露醇、蔗糖、木糖、木糖醇和果糖6种底物中,这两种蛋白仅对抗坏血酸有活性。
本研究通过“双次交换”同源重组的方法,将目的基因的上、下游片段插入至pFW5载体的两个多克隆位点中,使目的基因被壮观霉素抗性基因aad9替换,从而构建ptxA、ptxB及ptxAB双重基因缺陷菌株。“双次交换”同源重组能使所得的转化株传代稳定,有效避免了极性效应[13]。关于抗坏血酸作为S.mutans生长唯一碳源时的最适浓度的研究表明,随着抗坏血酸浓度的升高,野生株的迟缓期随之延长,这可能与抗坏血酸浓度越高时,培养基的pH值越低,细菌需要更长的时间来适应这种酸性环境有关,亦可能是在高浓度时细菌胞内氧化还原反应改变的结果[4],也可能是高浓度提高了氧化应激水平,对细菌胞体造成了损伤所致[14]。qPCR检测ptxA、ptxB基因在两种不同碳源特异性培养基中mRNA的表达差异,结果显示野生株目的基因在抗坏血酸特异性培养基中的表达水平明显增高,表明抗坏血酸对ptxA、ptxB基因的表达有诱导作用。当培养基中仅存在抗坏血酸作为唯一碳源时,细菌为维持自身生长,上调ptxA、ptxB基因的表达量,以保证对抗坏血酸的充分利用。该实验结果进一步证实了ptxA、ptxB基因与S.mutans抗坏血酸代谢相关。ptxA基因缺陷菌株在抗坏血酸特异性培养基中的生长能力明显低于野生株,ptxB及ptxAB双重基因缺陷菌株甚至无法生长,原因为细菌体内抗坏血酸特异性PTS过程的完整性和连续性受到破坏,细菌对抗坏血酸的吸收利用受到影响,从而影响生长,而功能补偿菌株则能在一定程度上减少这种影响。但ptxA、ptxB基因在S.mutans抗坏血酸代谢中的具体调控机制及在细菌内是否存在其他代偿机制仍有待进一步研究。
[参考文献]
[1] Ajdić D, McShan WM, McLaughlin RE, et al.Genome sequence of Streptococcus mutans UA159, a cariogenic dental pathogen[J].Proc Natl Acad Sci USA, 2002, 99(22): 14434-14439.
[2]Ajdic D, Chen Z.A novel phosphotransferase system of Streptococcus mutans is responsible for transport of carbohydrates with α-1,3 linkage[J].Mol Oral Microbiol, 2013,28(2):114-128.
[3]Lei J, Li LF, Su XD.Crystal structures of phosphotransferase system enzymes PtxB (ⅡB(Asc)) and PtxA (ⅡA(Asc))from Streptococcus mutans[J].J Mol Biol, 2009, 386(2): 465-475.
[4]Zhang Z, Aboulwafa M, Smith MH, et al.The ascorbate transporter of Escherichia coli[J].J Bacteriol, 2003, 185(7): 2243-2250.
[5]Linares D, Michaud P, Delort AM, et al.Catabolism of L-ascorbate by Lactobacillus rhamnosus GG[J].J Agric Food Chem, 2011, 59(8):4140-4147.
[6]Li YH, Lau PC, Lee JH, et al.Natural genetic transformation of Streptococcus mutans growing in biofilms[J].J Bacteriol, 2001, 183(3):897-908.
[7] Ajdić D, Pham VT.Global transcriptional analysis of Streptococcus mutans sugar transporters using microarrays[J].J Bacteriol, 2007, 189(14):5049-5059.
[8]Zeng L, Burne RA.Comprehensive mutational analysis of sucrose-metabolizing pathways in Streptococcus mutans reveals novel roles for the sucrose phosphotransferase system permease[J].J Bacteriol, 2013, 195(4):833-843.
[9]Sato Y, Okamoto-Shibayama K, Azuma T.Glucose-PTS involvement in maltose metabolism by Streptococcus mutans[J].Bull Tokyo Dent Coll, 2015, 56(2):93-103.
[10]Zeng L, Xue P, Stanhope MJ, et al.A galactose-specific sugar: phosphotransferase permease is prevalent in the noncore genome of Streptococcus mutans[J].Mol Oral Microbiol, 2013, 28(4):292-301.
[11]Saier MH Jr, Reizer J.Proposed uniform nomenclature for the proteins and protein domains of the bacterial phosphoenolpyruvate: sugar phosphotransferase system[J].J Bacteriol, 1992, 174(5):1433-1438.
[12]van Montfort RL, Pijning T, Kalk KH, et al.The structure of an energy-coupling protein from bacteria, ⅡBcellobiose, reveals similarity to eukaryotic protein tyrosine phosphatases [J].Structure, 1997, 5(2):217-225.
[13]段劲, 刘筱娣, 郭丽宏.变形链球菌UA159磷酸蔗糖变位酶基因功能丧失菌株的构建[J].实用口腔医学杂志, 2008, 24(1):69-73.Duan J, Liu XD, Guo LH.Construction of psm-negative mutans of S.mutans UA159[J].J Pract Stomatol, 2008, 24 (1):69-73.
[14]Campos E, Montella C, Garces F, et al.Aerobic L-ascorbate metabolism and associated oxidative stress in Escherichia coli[J].Microbiology, 2007, 153(Pt 10):3399-3408.
(本文编辑杜冰)
Effect of ptxA and ptxB genes of phosphotransferase system on growth of Streptococcus mutans
Wu Xinyu, Chen Xiaodan, Zhao Wanghong, Hou Jin, Chen Xuan.(Nanfang Hospital, School of Stomatology, Southern Medical University, Guangzhou 510515, China)
[Key words]Streptococcus mutans;phosphotransferase system;ptxA gene;ptxB gene;L-ascorbate
[Abstract]Objective This study aims to evaluate the effect of ptxA and ptxB genes, which are important genes in the L-ascorbate phosphotransferase system (PTS) of Streptococcus mutans (S.mutans).MethodsThe ptxA-, ptxB-, and ptxAB-double deficient mutant as well as ptxAB-complemented strain were constructed.Quantitative real-time polymerase chain reaction analysis was performed to evaluate the expression of the target genes of wild-type S.mutans when L-ascorbate was used as the sole carbohydrate source.The OD600values of the wild type, deficient, and complemented strains were continuously monitored, and their growth curves were constructed to compare growth capacity.ResultsPolymerase chain reaction and sequencing analyses suggested that deficient and complemented strains were successfully constructed.The expression levels of ptxA and ptxB significantly increased (P<0.01) when L-ascorbate was used as the sole carbohydrate source.The growth capacity of the deficient mutants decreased compared with that of the wild-type strain.However, the wild-type phenotype could be restored in the complemented strain.ConclusionptxA and ptxB genes are associated with L-ascorbate metabolism of S.mutans.The construction of deficient strains and complemented strain lay a foundation for further mechanism study on L-ascorbate metabolism in S.mutans.
[中图分类号]Q 786
[文献标志码]A [doi]10.7518/hxkq.2016.03.017
[收稿日期]2015-08-11; [修回日期]2016-03-05
[基金项目]国家自然科学基金项目(81050035);广东省高校人才引进项目(C1030636);南方医科大学南方医院院长基金项目(20-13B003)
[作者简介]吴昕彧,硕士,E-mail:michely-wxywxy@163.com
[通信作者]赵望泓,教授,博士,E-mail:zhaowh@smu.edu.com

