大鼠正畸牙移动过程中牙周膜骨硬化蛋白的表达
陈一文 高尚 许彤彤 张佳慧 李金城 李金成张慧彦 卢金金 胡敏 刘志辉.吉林大学口腔医院正畸科;.修复科,长春 300
大鼠正畸牙移动过程中牙周膜骨硬化蛋白的表达
陈一文1高尚1许彤彤1张佳慧1李金城1李金成1张慧彦1卢金金1胡敏1刘志辉2
1.吉林大学口腔医院正畸科;2.修复科,长春 130012
[摘要]目的观察正畸牙移动过程中大鼠牙周组织中骨硬化蛋白(Sclerostin)的表达及分布,研究Sclerostin在正畸牙移动骨改建中的作用。方法选取24只Wistar大鼠,安装加力装置,加载50 g力近中移动左侧第一磨牙,分别于安装加力装置后的0、1、3、5、7、14 d处死大鼠,用苏木精-伊红(HE)染色观察第一磨牙牙周组织形态学变化,抗酒石酸酸性磷酸酶(TRAP)染色观察破骨细胞的数量变化,免疫组织化学染色方法探究第一磨牙牙周膜中Sclerostin的表达变化。结果HE染色显示随加力时间的延长压力侧骨组织破坏逐渐加重,免疫组织化学染色显示Sclerostin的表达逐渐增加,5 d时达到高峰,之后又逐渐降低,压力侧表达多于张力侧。结论Sclerostin可能通过Wnt信号通路或者直接或间接控制骨形态发生蛋白参与了正畸牙移动骨改建过程。
[关键词]骨硬化蛋白;牙周膜;正畸牙移动
Supported by: The National Natural Science Foundation of China(81470764);Vital Science and Technology Project Supported by Jilin Provincial Science and Technology Department(20140204066SF);Undergraduate Training Programs for Innovation and Entrepreneurship(2013B78356).Correspondence: Hu Min, E-mail: humin@jlu.edu.cn.
正畸牙移动是机械力作用下牙周组织发生改建来完成的,其中牙周膜的生物力学作用起着至关重要的调控作用。牙周膜中包含具有分化潜能的成纤维细胞群体,它们对机械刺激高度敏感。机械刺激可以作为一种信号转换成生物反应和不同细胞的行为变化,比如细胞增殖和蛋白质表达,最终导致牙周组织的改造和适应性变化。已有研究证实,体外培养的牙周膜细胞具有向成骨样细胞分化的能力,表达成骨基因标识及形成钙结节[1],也可表达骨硬化蛋白(Sclerostin)[2]。Sclerostin是近些年来发现的一种对成骨细胞具有抑制作用的糖蛋白,激素水平、机械刺激以及低氧等外部条件的改变能影响Sclerostin的表达。本实验通过苏木精-伊红(hematoxylineosin,HE)染色、免疫组织化学染色和抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色,观察加力不同时间段Sclerostin在牙周膜内的分布和表达趋势,探讨Sclerostin在正畸牙移动颌骨改建中的作用。
1 材料和方法
1.1实验动物
选取由吉林大学实验动物中心提供的8周龄雄性Wistar大鼠24只,实验动物体重为180~220 g,本实验中所有的实验流程都遵循吉林大学动物实验的指导方针。
1.2大鼠正畸牙移动颌骨改建模型的建立
以Wistar大鼠的上颌切牙作为支抗,使用镍钛拉簧提供持续牵引力(50 g)近中移动左侧第一磨牙,右侧第一磨牙作为对照侧,不安装加力装置。每8 h分别检查加力装置脱落情况,如有损坏和脱落立即重新结扎。
1.3标本制备
所有动物分别于加力后的0、1、3、5、7、14 d心脏灌注法处死:腹腔注射4%水合氯醛(0.01 mL·g-1)麻醉,剪开右心耳,从左心室心尖向心脏内缓慢推入生理盐水,待流出的液体清亮后用同样的方法推入4%多聚甲醛溶液,至大鼠肌肉僵硬。取大鼠左侧上颌磨牙及周围组织,将标本固定于4%多聚甲醛溶液中。24 h后取出,常温下浸泡10%中性乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)溶液中脱钙2个月,依次进行脱水、透明、浸渍、包埋,按平行于第一磨牙近远中向连续切片,切片厚度为3 μm。选取第一磨牙牙根及牙周组织完整的切片经过脱蜡透明后进行HE染色、TRAP染色和免疫组织化学染色。
1.4染色
1.4.1HE染色将制好的切片按照常规步骤进行HE染色。
1.4.2免疫组织化学染色染色前,组织切片需用PBS缓冲液冲洗3次,每次3 min。然后用过氧化氢酶阻断剂在室温下孵育10 min以抑制过氧化氢酶活性。接着用PBS缓冲液冲洗,滴加血清以减少背景染色。之后去除血清后滴加1︰100比例稀释后的第一抗体,在4 ℃下湿盒中过夜孵育。然后用PBS冲洗,加入第二抗体,室温下孵育10 min。最后滴加DAB显色液使免疫反应可见。
1.4.3TRAP染色按照试剂盒上的说明严格进行操作。
1.5图像分析
在每张切片张力侧与压力侧牙周组织分别随机选取3个不重叠视野进行图像采集,采用Image Pro Plus图像分析软件测量图像的平均光密度(optical density,OD)和破骨细胞计数。破骨细胞计数选取200×视野,针对阳性染色且位于Howship陷窝同时细胞核数量不小于3者予以计数;光密度选取牙周膜区域的400×视野进行测量。二者均由同一有经验的实验者重复3次后取平均值。
1.6统计方法
采用SPSS 19.0统计学软件对多组样本进行多组样本均数的LSD检验。
2 结果
2.1大鼠牙周组织形态学变化
实验组未加力时牙周组织形态完整良好,牙槽骨边缘平整。加力1 d时,压力侧牙周膜厚度逐渐减小,张力侧逐渐增宽;至加力3 d时,压力侧牙槽骨边缘开始出现较为明显的骨吸收陷窝,其内可见破骨细胞。随着加力时间的延长,压力侧骨吸收范围逐渐扩大,骨组织的破坏明显,至加力14 d时仍未见吸收陷窝修复的表现,剩余牙槽骨面积缩小(图1)。
2.2免疫组织化学染色结果
实验组未加力时拉力侧与压力侧均未发现有Sclerostin阳性表达。随着加力时间的延长,Sclerostin表达逐渐增加(图2),在5 d时Sclerostin表达达到高峰,随之表达逐渐降低,5 d和7 d时压力侧Sclerostin表达多于张力侧,且差异具有统计学意义(P<0.01)(图3)。
2.3TRAP染色结果
破骨细胞数量随时间的变化趋势与免疫组织化学结果相似,实验组未加力时少见破骨细胞,随加力时间的增加,压力侧牙槽骨边缘可见多核、胞浆红染的破骨细胞(图4),5 d时数量达到高峰,随之逐渐降低,3、5和7 d组破骨细胞数量压力侧多于张力侧(P<0.01)(图5)。

图2 加力不同时间牙周膜中Sclerostin的观察结果 免疫组织化学染色 × 400Fig 2 Results of Sclerostin expression in periodontal ligament after applied orthodontic force for different days immunohistochemical staining × 400
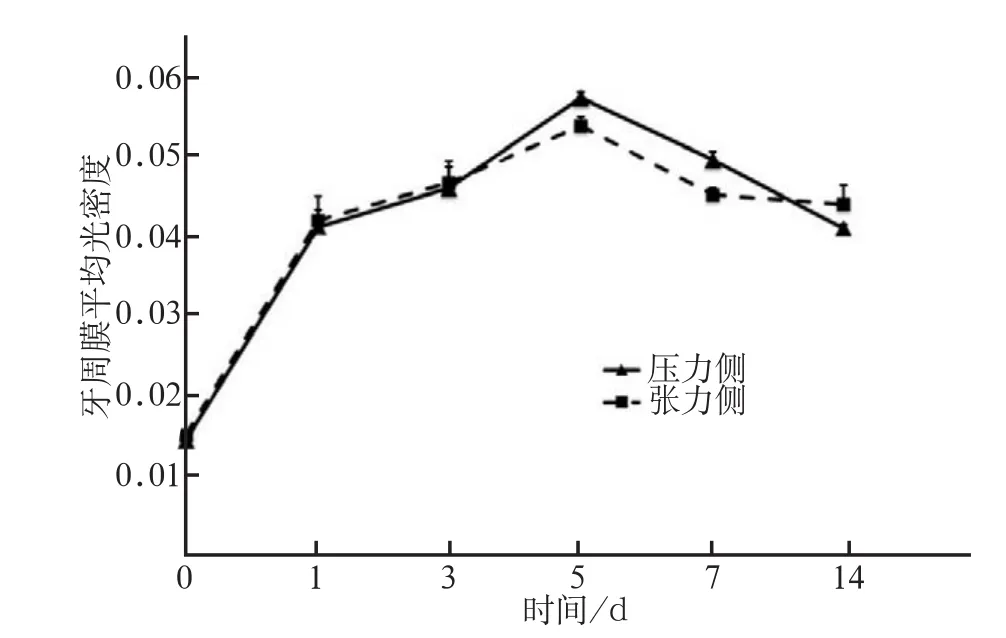
图3 加力不同时间牙周膜中Sclerostin免疫组织化学染色平均OD值Fig 3 The mean OD of Sclerostin immunohistochemical staining in periodontal ligament after applied orthodontic force for different days
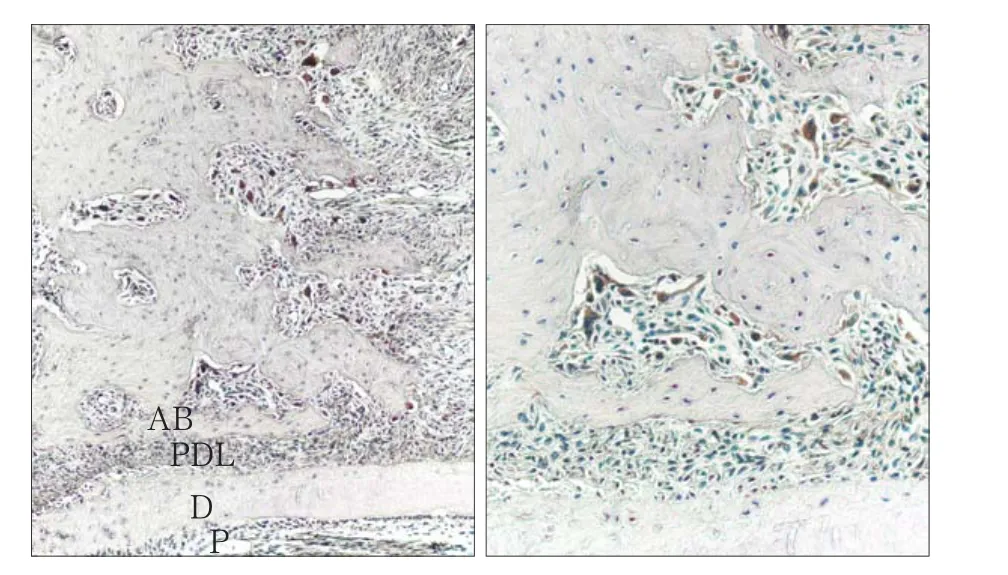
图4 加力5 d时骨吸收陷窝内可见阳性表达的破骨细胞 TRAP 染色Fig 4 TARP-positive osteoclasts in Howship’s lacuna after applied orthodontic force for 5 days TRAP staining
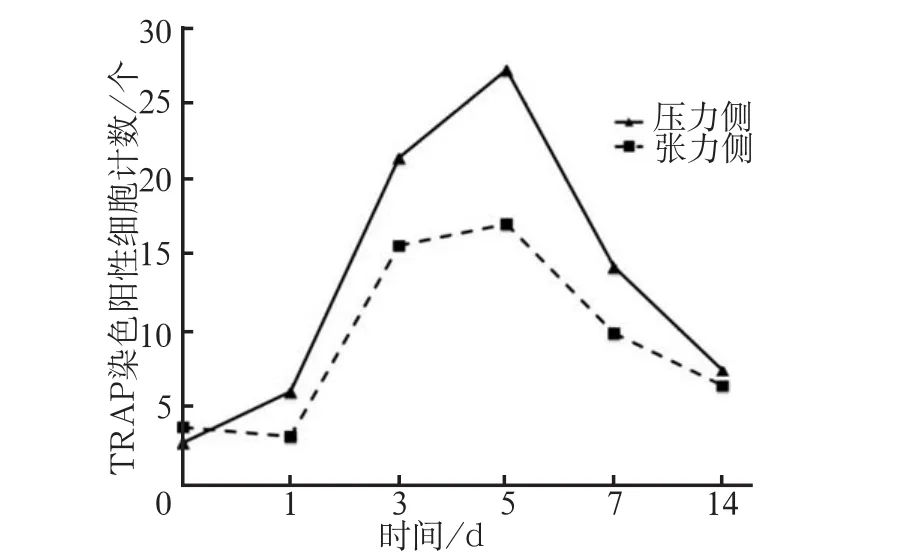
图5 不同加力时间TRAP染色阳性细胞计数Fig 5 Count of the TRAP-positive cells after applied orthodontic force for different days
3 讨论
3.1Sclerostin在正畸牙移动颌骨改建中的作用
Sclerostin是由骨细胞等骨源性细胞分泌的一种,可以通过Wnt通道抑制骨形成的糖蛋白[3],在破骨细胞生成、成骨细胞分化中起到较为重要的作用。
牙周膜细胞中包含具有多分化潜能的细胞群体,能分化为成骨细胞、成牙骨质细胞等,能维持牙周组织代谢和平衡,并参与其改建的作用,是正畸过程中骨改建的关键[4]。国内学者[2]在人牙周膜细胞矿化诱导过程中证实Sclerostin参与人牙周膜细胞向成骨样细胞的分化过程。本研究通过建立大鼠正畸牙移动模型,拟探究正畸力作用下Sclerostin的表达机制。
3.2实验结果分析
本研究实验组牙周膜中Sclerostin的表达在压力侧与张力侧较对照组相比均增加,同时,5 d组和7 d组中Sclerostin的表达压力侧多于张力侧(P<0.01)。提示在机械力的作用下,牙周膜细胞可能通过某种通路导致Sclerostin的表达增加。国外学者给予小鼠的尺骨持续施加机械力时,导致骨组织中Sclerostin的表达水平明显降低[5];尾部垂钓使小鼠后肢不受负荷,表现为骨组织中Sclerostin表达增多,Wnt/βcatenin信号活性降低[6]。国外学者[7]又证实在运动后血清中Sclerostin的含量下降。这些研究均表明Sclerostin的表达与机械刺激有关。然而,在正畸牙移动过程中,压力侧的牙周膜处于失去应力的状态,而张力侧牙周膜则受到张力的作用[8]。有学者[9]在加力1周后拆去第一磨牙的加力装置,然后持续1周,结果发现其压力侧与张力侧的Sclerostin表达均有增加,且含量高于持续加力组。所以可以合理地推断,由于大鼠切牙生长的特殊性,加力装置的固位易于因切牙的磨耗而脱落,尽管实验过程中每天检查3次修补脱落的加力装置以尽量减少误差,但是仍不可避免由于装置的脱落,而导致的拉力侧表达增加。
本研究结果还显示,牙周膜中Sclerostin的表达和牙周组织中的破骨细胞均先逐渐增加,至5 d达到峰值,随后逐渐地减少,14 d时Sclerostin的表达减少到接近3 d水平,推测原因可能有以下两种:一是由于Sclerostin和Noggin可竞争性与骨形态发生蛋白(bone morphogenetic protein,BMP)结合并抑制其作用[10]。骨改建过程是骨吸收与骨形成的动态平衡,二者同时进行。BMP促进骨形成的作用已经广泛得到证实,而Noggin作为其最具亲和力的一种细胞外拮抗剂,可特异性地被细胞表面的BMP受体结合来拮抗BMP的作用[11]。在正畸力的持续作用下,BMP的表达趋势逐渐增加至5 d出现峰值,随后逐渐下降,且张力侧多于压力侧[12],进而诱导其负反馈调节剂Noggin合成,但表达较BMP稍显延迟,7 d时达到峰值,以抑制其过度表达。因此推测Sclerostin同BMP的分泌接近同步,而被延迟分泌的Noggin抑制,三者共同参与骨改建的调节,综合表现为压力侧骨吸收,张力侧骨形成;二是Sclerostin通过抑制Wnt/ β-catenin信号通路抑制骨形成[6]。Sclerostin在胚胎发育早期时可以抑制Wnt,通过结合低密度脂蛋白受体相关蛋白(low density lipoprotein receptor-related protein,LRP)-5/6受体以及破坏由Wnt诱导的Frizzled-LRP复合体形成而抑制Wnt蛋白的形成[13],调节骨量[14]。对敲除SOST基因的小鼠进行尾部悬吊,发现Wnt/β-catenin信号通路活性未降低,也未产生骨丧失现象;缺乏LRP-4的成骨细胞系表现为Sclerostin表达增加,证实是由于解除了对Wnt/β-catenin信号通路的抑制和Sclerostin对核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)含量变化的感应,LRP-4在成骨细胞系中通过作为Sclerostin的受体反向调节Wnt/β-catenin信号通路和促进RANKL诱导的破骨细胞形成[15]。由此可见,Sclerostin可以通过直接或间接调控BMP和抑制Wnt/ β-catenin信号通路参与正畸牙移动颌骨改建过程。
3.3临床意义及展望
目前临床上对促进骨改建的疗法较少。由于Sclerostin具有抑制骨形成的作用,故推测其抗体可能具有促进骨形成的作用。有学者[16]将螺钉植入大鼠胫骨,注射Sclerostin抗体后进行拉力测试,发现骨小梁厚度和骨体积分数较对照组有所增加,证实Sclerostin抗体在骨改建时可以增加骨形成。Sclerostin抗体的临床应用正在进行探索,希望在调控骨改建、牙齿移动速度和提高骨量方面能有所应用,为正畸和种植等技术提供新的思路,为临床干预治疗奠定了一定的理论基础。
[参考文献]
[1]Seo BM, Miura M, Gronthos S, et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet, 2004, 364(9429):149-155.
[2]林婷婷, 陆尔奕.SOST基因在人牙周膜细胞矿化诱导过程中的表达[J].上海口腔医学, 2012, 21(2):139-144.Lin TT, Lu EY.Effect of induced-mineralization on the expression of SOST in human periodontal ligament cells[J].Shanghai J Stomatol, 2012, 21(2):139-144.
[3]Poole KE, van Bezooijen RL, Loveridge N, et al.Sclerostin is a delayed secreted product of osteocytes that inhibits bone formation[J].FASEB J, 2005, 19(13):1842-1844.
[4]King GJ, Keeling SD, McCoy EA, et al.Measuring dental drift and orthodontic tooth movement in response to various initial forces in adult rats[J].Am J Orthod Dentofacial Orthop, 1991, 99(5):456-465.
[5]Robling AG, Bellido T, Turner CH.Mechanical stimulation in vivo reduces osteocyte expression of sclerostin[J].J Musculoskelet Neuronal Interact, 2006, 6(4):354.
[6]Lin C, Jiang X, Dai Z, et al.Sclerostin mediates bone response to mechanical unloading through antagonizing Wnt/ beta-catenin signaling[J].J Bone Miner Res, 2009, 24(10): 1651-1661.
[7]Kerschan-Schindl K, Thalmann MM, Weiss E, et al.Changes in serum levels of myokines and Wnt-antagonists after an ultramarathon race[J].PLoS ONE, 2015, 10(7):e0132478.
[8]Nishiyama Y, Matsumoto T, Lee JW, et al.Changes in the spatial distribution of sclerostin in the osteocytic lacunocanalicular system in alveolar bone due to orthodontic forces, as detected on multimodal confocal fluorescence imaging analyses[J].Arch Oral Biol, 2015, 60(1):45-54.
[9]Yadav S, Assefnia A, Gupta H, et al.The effect of lowfrequency mechanical vibration on retention in an orthodontic relapse model[J].Eur J Orthod, 2016, 38(1):44-50.
[10]Winkler DG, Yu C, Geoghegan JC, et al.Noggin and sclerostin bone morphogenetic protein antagonists form a mutually inhibitory complex[J].J Biol Chem, 2004, 279(35): 36293-36298.
[11]Zimmerman LB, De Jesús-Escobar JM, Harland RM.The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4[J].Cell, 1996, 86(4):599-606.
[12]杨琳琳.正畸牙齿移动过程中BMP-2在牙周组织中表达的动物实验研究[D].大连: 大连医科大学, 2010.Yang LL.Expression of BMP-2 in periodontal tissues during orthodontic tooth movement in an animal experimental study [D].Dalian: Dalian Medical University, 2010.
[13]Collette NM, Genetos DC, Murugesh D, et al.Genetic evidence that SOST inhibits WNT signaling in the limb[J].Dev Biol, 2010, 342(2):169-179.
[14]Cui Y, Niziolek PJ, MacDonald BT, et al.Lrp5 functions in bone to regulate bone mass[J].Nat Med, 2011, 17(6):684-691.
[15]Xiong L, Jung JU, Wu H, et al.Lrp4 in osteoblasts suppresses bone formation and promotes osteoclastogenesis and bone resorption[J].Proc Natl Acad Sci USA, 2015, 112(11):3487-3492.
[16]Agholme F, Li X, Isaksson H, et al.Sclerostin antibody treatment enhances metaphyseal bone healing in rats[J].J Bone Miner Res, 2010, 25(11):2412-2418.
(本文编辑杜冰)
Sclerostin expression in periodontal ligaments during movement of orthodontic teeth in rats
Chen Yiwen1, Gao Shang1,
Xu Tongtong1, Zhang Jiahui1, Li Jincheng1, Li Jincheng1, Zhang Huiyan1, Lu Jinjin1, Hu Min1, Liu Zhihui2.(1.Dept.of Orthodontics, School of Stomatology, Jilin University, Changchun 130012, China;2.Dept.of Prosthodontics, School of Stomatology, Jilin University, Changchun 130012, China)
[Key words]Sclerostin;periodontal ligament;orthodontic tooth movement
[Abstract]ObjectiveThis study aims to observe the expression of Sclerostin during movement of orthodontic teeth and determine the effect of this protein on remodeling of periodontal tissues.Methods Twenty-four Wistar rats were chosen.Orthodontic forces were applied between the bilateral incisor and first molar to achieve mesial movement.Rats in each group were executed at different time points (0, 1, 3, 5, 7, 14 d).Morphology of periodontal tissue was observed by hematoxylineosin(HE) staining.The number of osteoclasts were observed by tartrate-resistant acid phosphatase (TRAP) staining.Sclerostin expression were observed by immunohistochemical staining.Results HE staining revealed that the resorption of alveolar bone intensified with prolonged movement.Results of immunohistochemical and TRAP staining revealed that Sclerostin expression and number of osteoclasts were related to duration of movement of orthodontic tooth.After staining for 5 days, the number of osteoclasts and Sclerostin expression reached their peak and then began to decline.The numbers of osteoclasts and the expression level of Sclerostin were higher at the compressive side than those at the tensive side.ConclusionSclerostin affected orthodontic tooth movement by inhibiting the Wnt signaling pathway and by indirectly or directly controlling bone morphogenetic protein.
[中图分类号]R 783.5
[文献标志码]A [doi]10.7518/hxkq.2016.03.005
[收稿日期]2015-12-01; [修回日期]2016-03-05
[基金项目]国家自然科学基金(81470764);吉林省科技厅重点科技攻关科技计划(20140204066SF);大学生创新创业训练计划(2-013B78356)
[作者简介]陈一文,学士,E-mail:397329354@qq.com
[通信作者]胡敏,教授,博士,E-mail:humin@jlu.edu.cn

