钛表面羟磷灰石/壳聚糖-转化生长因子-β1缓释微球复合涂层的制备及其对成骨细胞黏附与增殖的影响
苟诗然 张帆 李萌婷 黄婷 郑立舸.泸州医学院附属口腔医院口腔修复科,泸州 646000;2.口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 6004
钛表面羟磷灰石/壳聚糖-转化生长因子-β1缓释微球复合涂层的制备及其对成骨细胞黏附与增殖的影响
苟诗然1,2张帆1李萌婷1黄婷1郑立舸1,2
1.泸州医学院附属口腔医院口腔修复科,泸州 646000;2.口腔疾病研究国家重点实验室 华西口腔医院(四川大学),成都 610041
[摘要]目的探讨在钛表面制备羟磷灰石(HA)/壳聚糖(CS)-转化生长因子-β1(TGF-β1)缓释微球复合涂层及其对成骨细胞黏附与增殖的影响。方法通过物理-化学-生物改性联合方式制备HA/CS-TGF-β1 缓释微球复合涂层。运用扫描电镜(SEM)、X射线衍射仪(XRD)、傅里叶变换红外光谱(FTIR)等分析涂层的形貌和物相;使用CCK-8及免疫荧光检测其对成骨细胞的细胞毒性及细胞黏附和增殖的影响。结果成功制备HA/CS-TGF-β1缓释微球复合涂层,该涂层制备具有超亲水性,体外释药稳定且时间长,成骨细胞在此复合涂层的钛片上生长无抑制,且对细胞的黏附与增殖具有促进作用。结论HA/CS-TGF-β1缓释微球复合涂层在体外对于成骨细胞的黏附与早期增殖有明显的促进作用,具有良好的运用前景。
[关键词]钛;表面改性;细胞黏附;细胞增殖
Supported by: The Open Project Program of the State Key Laboratory of Oral Diessase (SKLOD2015OF09).Correspondence: Zheng Lige, E-mail: lzyxy-zlg@163.com.
种植体与骨之间形成良好骨整合是植入成功的关键,而骨整合取决于材料表面化学特征和形貌。利用表面改性对钛表面进行处理,以提高种植体骨结合率及成功率是目前的研究热点之一。羟磷灰石(hydroxyapatite,HA)是一种具有良好的生物相容性和骨引导作用,能促进早期骨整合的骨仿生材料[1]。壳聚糖(chitosan,CS)为可降解碱性多糖,具有六元环稳定结构,适于制备受力材料,具有良好的生物相容性和骨引导性[2]。转化生长因子-β1 (transforming growth factor-β1,TGF-β1)能促进成骨细胞的增殖,调节骨的成熟、改建,对骨整合的形成有重要的作用[3]。
本实验通过物理-化学-生物改性联合的方式,在钛表面得到HA/CS-TGF-β1缓释微球复合涂层,研究该复合涂层对成骨细胞黏附和增殖的影响,为进一步研究其在种植修复中的应用提供实验依据。
1 材料和方法
1.1材料和仪器
TA2纯钛钛片(宝鸡英耐特医用钛有限公司),1-乙基-3-(3-二甲基氨丙基)碳二亚胺[1-ethyl-3-(3-dimethyl aminopropyl)carbodiimide,EDC]/N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、明胶粉剂、HA、多巴胺(Sigam公司,美国),CS(浙江金壳生物化学有限公司),TGF-β1及酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)试剂盒(Cloud-clone公司,美国),CCK-8试剂盒(上海碧云天生物有限公司)。QUANTA 200扫描电子显微镜(scanning electron microscope,SEM)(FEI公司,荷兰),Magna 550型傅里叶变换红外光谱(Fourier transform-infrared spectroscopy,FTIR)(Nicolet公司,美国),p-Quant酶标仪(Bio-Tek公司,美国),X射线衍射仪(X-ray diffraction,XRD)(Panalytical公司,荷兰)。
1.2方法
1.2.1钛片表面处理将10 mm×10 mm×l mm纯钛钛片经240、400、800、1 000、1 500号砂纸逐级打磨,丙酮、乙醇清洗后,酸洗,去离子水超声清洗3遍,干燥备用。
1.2.2微弧氧化 使用Microarc-3.0微弧氧化机进行微弧氧化处理:钛片为阳极,石墨为阴极,电解液为200 mL去离子水与1 mL硫酸配置。经预实验,确定微弧氧化条件:电压200 V,电流密度6 mA·cm-2,氧化时间180 s。
1.2.3明胶缓释微球的制备将1.5 mL司盘80(Span-80)加入70 mL液体石蜡中预热至60 ℃,快速搅拌下滴入60 ℃的明胶溶液(1 g明胶+10 mL蒸馏水),搅拌30 min,直至溶液变成乳白色,冰浴冷却;待明胶溶液冷却至4 ℃加5%戊二醛4 mL,交联3 h;恢复至室温,加入30 mL丙酮,去除油相30 min;异丙醇、乙醇洗涤,抽滤,干燥,得淡黄色粉末,备用。
1.2.4HA/CS涂层的制备将经过微弧氧化处理的钛片放入1 g·L-1的多巴胺溶液浸泡18 h,干燥;将已溶解的HA(0.4 g HA+40 mL MES)缓慢滴入CS凝胶(1 g CS+50 mL H2O),搅拌1 h;在干燥钛片表面滴加该溶液,负压处理10 min,干燥24 h。
1.2.5EDC/NHS交联TGF-β1蛋白 将100片已制备HA/CS涂层的钛片分成A、B、C、D、E组,每组20片,为实验组。另备20片只经1.2.1步骤处理的钛片为对照组(F组)。备5只编号分别为A、B、C、D、E的装有20 mL 0.1g·mL-1CS凝胶的烧杯,各加入0.4 g明胶微球,搅拌20 min后放入对应的钛片各20片,冰浴下各加入0.08 g EDC,溶解后加入0.12 g NHS,随后立刻加TGF-β1蛋白,A、B、C、D、E组加入蛋白浓度分别为15、30、60、75、250 ng·mL-1,交联反应12 h,干燥。
1.2.6样品检测及体外释药 以SEM、XRD、FTIR等检测涂层表面形貌、成分及亲水性。从5个实验组中随机取钛片各5个,平铺于24孔细胞培养板,加入1 mLPBS缓冲液,于37 ℃恒温摇床上浸泡0.6 h,暂取出试样,吸取浸出液至EP管中,于-20 ℃的环境中保存,即为前0.6 h释放的待测浸出液。再将试样放回,加入PBS液1 mL,以同样方法取1、3、5、7、9、11、14 d的浸出液并保存。浸出液样品稀释为10%,据TGF-β1蛋白ELISA试剂盒操作说明,于波长450 nm时测定标准品及待测样品的光密度(optical density,OD)值并绘制标准曲线,根据曲线计算材料14 d内的释药量。
1.2.7成骨细胞增殖与毒性研究采用CCK-8法,取双抗灭菌后各组钛片各5片平铺于48孔培养板(钛片与孔直径相当)。分离大鼠成骨细胞并进行原代和传代培养,将P2代的细胞悬液按每孔100 μL接种于各组, 37 ℃、5%CO2培养箱中培养;于1、3、7 d分别取出培养板,每孔加CCK-8试剂溶液20 μL,37 ℃下孵育2.5 h后每孔取110 μL液体到96孔板内,酶标仪450 nm测定各孔OD值。
1.2.8成骨细胞的黏附与增殖 将成骨细胞按每孔1×103个细胞密度接种于各组材料表面,每孔100 μL细胞悬液,补足含10%胎牛血清的DMEM培养液,“8”字摇匀后放入37 ℃孵育箱。分别培养6 h及3 d后,吸出培养液,常温PBS反复冲洗3次,加入200 μL 2.5%的戊二醛4 ℃下固定15 min,吸出戊二醛,加入4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染料孵育20 min,PBS冲洗3次,置于倒置荧光显微镜下观察。
1.3统计学分析
采用SPSS 16.0统计学软件进行数据分析,定量资料采用描述,统计方法采用单因素方差分析,组间比较采用SNK(Student-Newman-Keuls test)法,检验效能α=0.05。
2 结果
2.1处理后钛片的表面形貌
钛表面微弧氧化后的SEM图像见图1。由图1可见,钛表面形成大小和间距基本一致的小微孔,较大微孔孔径约1 μm,较小微孔孔径约20 nm,孔洞占有率平均为13.022%。载TGF-β1蛋白的明胶微球表面形貌见图2。由图2可见,复合涂层载TGF-β1蛋白的明胶微球表面呈圆球型,粒径较均匀,未见微孔和裂纹。测得明胶微球粒径为8~30 μm,占表面的92.323%,平均粒径为(18.36±3.07) μm。

图1 微弧氧化后钛片的表面形貌 SEM × 10 000Fig 1 Surface morphology of titanium sheet after microarc oxida- tion SEM × 10 000
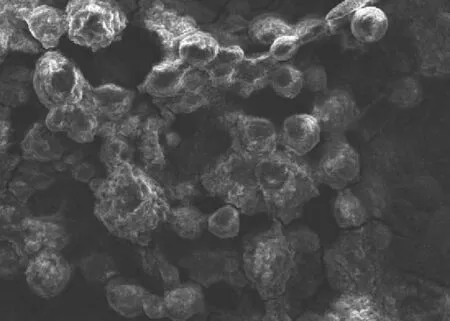
图2 载TGF-β1蛋白的明胶微球表面形貌 SEM × 500Fig 2 Surface morphology of gelatin microspheres with TGF-β1 SEM × 500
2.2XRD、FTIR检测结果
由XRD图谱可见,未经处理的钛片出现明显的钛基峰,仅存在很弱的锐钛矿型二氧化钛峰;而经微弧氧化后,样品表面锐钛矿型和金红石型的二氧化钛峰均相当明显,钛基峰明显减弱;当钛表面制备HA/CS-TGF-β1缓释微球复合涂层后,基体钛峰几乎被湮没,2θ=31.7°出现特征峰,这与HA标准粉末衍射数据谱峰的(211)晶面的特征峰位置吻和,且2θ 在15°~30°范围内出现CS的特征峰(图3)。FTIR图谱可在1 641~1 667 cm-1处对应酰胺基团,证明涂层表面存在大分子多肽。3 593 cm-1处对应非水羟基的振动吸收峰,可证实HA官能团在涂层中存在(图4)。
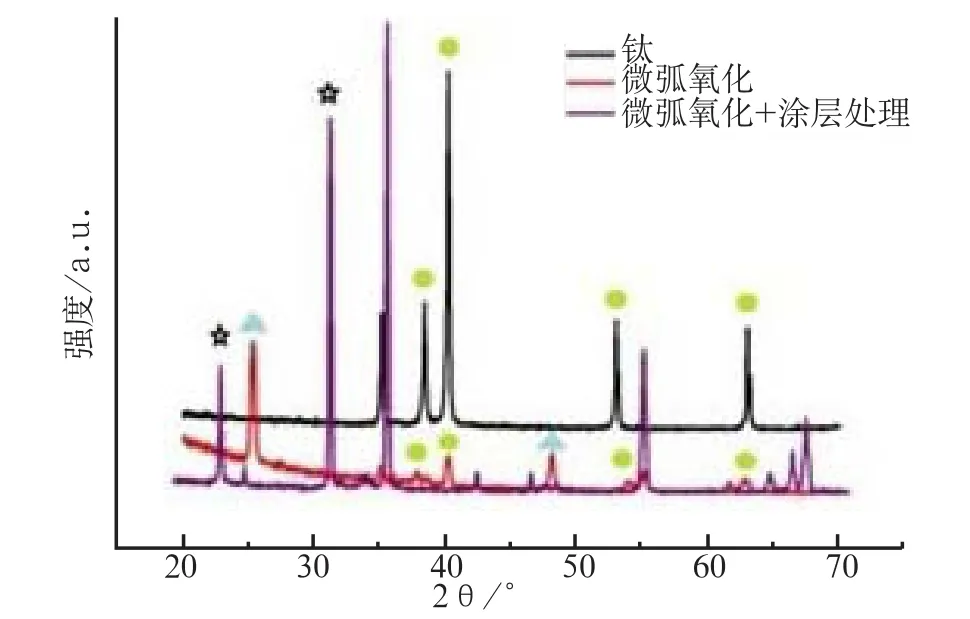
图3 XRD检测结果Fig 3 Result of XRD

图4 FTIR检测结果Fig 4 Result of FTIR
2.3接触角
未处理的钛表面接触角为68.2°±1.5°;经多巴胺和微弧氧化处理后接触角为26.8°±1.3°.。HA/CS-TGF-β1缓释微球复合涂层制备完成后接触角几乎为零,即具有超亲水性。
2.4体外释药
根据标准品TGF-β1蛋白浓度的OD值,得到标准品曲线y=3.885 5x+0.275 2,将样本OD值代入,可得A、B、C、D、E组平均释放浓度分别为(0.485± 0.022)、(0.976±0.021)、(1.992±0.023)、(2.493± 0.022)、(8.011±0.019) ng·mL-1。HA/CS-TGF-β1体外释药情况见图5。由图5可见,6 h、1 d、7 d、14 d时释放量分别达(25.3±1.8)%、(30.1±1.7)%、(58.4±1.8)%、(80.1±1.9)%。
2.5成骨细胞增殖测定
通过CCK-8检测大鼠成骨细胞于1、3、7 d后的相对增殖率(图6)。1 d时各组之间差异不明显(P>0.05);3 d时,各组细胞数量均有明显增长,且实验组细胞密度大于对照组的细胞密度(P<0.05),B、C组细胞增殖大于其他组;7 d时,实验组细胞增殖情况明显优于对照组(P<0.05), B、C组细胞增殖明显大于其他组(P<0.05),E组细胞密度小于其他实验组(P<0.05)。
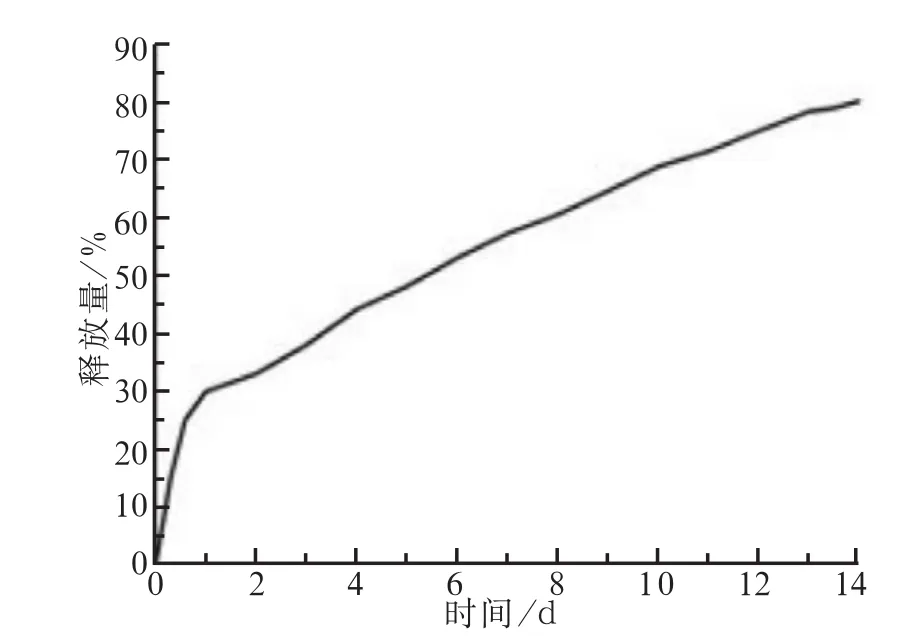
图5 药物体外累积释放曲线Fig 5 Drug accumulation release profile in vitro
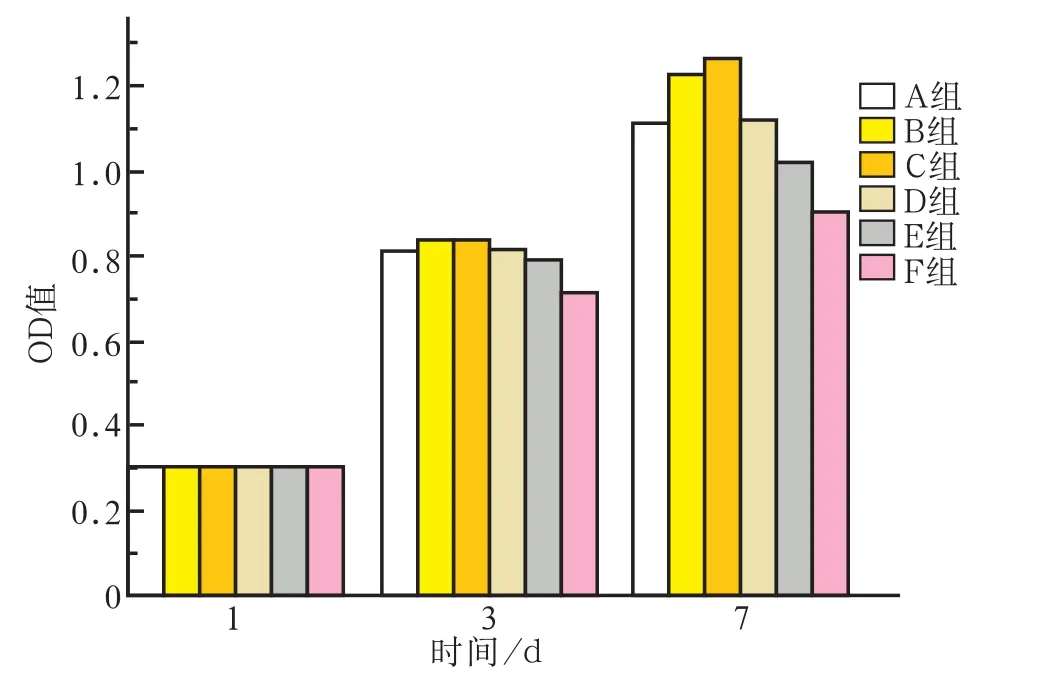
图6 成骨细胞增殖情况Fig 6 Osteoblast proliferation
2.6成骨细胞的黏附和增殖
DAPI染色发现:接种6 h时,实验组与对照组细胞数量无明显差距;在3 d时,各组均有明显增殖,B、C组尤其明显,E组细胞数量少于其他实验组,但所有的实验组细胞数量均高于对照组(图7)。

图7 各组成骨细胞细胞核不同时期的DAPI染色结果 DAPI × 100Fig 7 DAPI nuclear stain of different stages of osteoblasts in each group DAPI × 100
3 讨论
通过表面改性使种植体具有生物功能性,从而缩短种植周期,获得早期骨整合和更高的结合强度是口腔材料研究的热点。由于种植适应证的扩大,尤其是运用于全身性疾病如糖尿病、骨质疏松等的患者时,单一的钛种植体材料表面改性和简单的制备工艺已不能满足目前的临床要求,结合物理、化学、生物化学方法及材料优点的改性技术是今后提高种植体表面活性的必然趋势[4]。
目前,化学改性如离子喷涂HA涂层已广泛应用于种植领域,取得了一定的效果[5],但离子喷涂设备成本高且在骨-涂层-金属界面存在着涂层不均一、易剥脱等问题[6]。因此本实验对制备HA层进行了改进:通过微弧氧化在钛片形成的微孔,引入纳米级HA和CS形成胶体液涂在钛片表面,再通过加热,形成一层结合牢固的HA薄膜,并使用多巴胺将其紧黏附于钛片表面,通过负压处理使HA/CS复合涂层充分渗入钛内部,从而克服了传统涂层易于脱落的缺点。同时,Meirelles等[7]研究也证明了钛种植体表面纳米HA涂层的骨接触率明显高于普通HA涂层。
本实验使用明胶微球吸附TGF-β1,形成微球控制释放系统,又通过EDC/NHS直接交联TGF-β1蛋白,大幅度提高了载药量,再通过CS凝胶将整个复合涂层形成整体,将明胶微球包裹于内,形成缓释系统。涂层的蛋白释放速率主要取决于蛋白扩散速度和材料降解速度,而明胶微球在pH>7时完全降解约需2个月左右,且大分子肽类物质自微球向外部扩散速度较慢[8];EDC/NHS交联后涂层稳定性增强,抵抗酶解的能力显著增加;凝胶体系的降解速度较慢;这些因素都决定了此复合涂层具有良好的缓释性能。通过体外释药实验可见,除释药初期具有“突释”效应,以后蛋白释放逐渐平缓。有研究[9]报道可利用层-层自组装的方法,通过带相反电荷的聚电解质在材料表面交替沉积形成聚电解质多层膜来调节多层膜的厚度及多层膜中附载的物质及其释放速度,因此笔者也考虑在下一步的研究中利用CS和明胶在钛种植体表面制备聚电解质多层膜,在多层膜中附载蛋白,来解决“突释”问题。
良好亲水性的表面与细胞黏附有密切关系,亲水性的样品表面有利于从所处的周围环境中吸附蛋白质和具有极性或者离子性的营养物质,进而影响细胞的黏附与增殖和分化。本实验制备的复合涂层具有超亲水性,由细胞的黏附与增殖实验可以看出该涂层确实有利于细胞的增殖;同时由于钛片表面存在微孔、HA、明胶微球等,使复合涂层具有粗糙多孔的微观结构,更利于细胞的早期黏附。
HA/CS-TGF-β1缓释微球复合涂层能促进成骨细胞增殖生长,且TGF-β1蛋白释放浓度在一定范围内时,此作用尤为明显。证明TGF-β1蛋白释放浓度在低浓度时促进细胞的增殖,在高于10 ng·mL-1时,将抑制细胞增殖,却促进细胞的分化[10]。
综上所述,本实验对传统的表面改性进行改进,改性过程中基本未引入可能产生生物学危害的物质且改性后的表面具有多功能性,在体外对于成骨细胞的黏附与早期增殖具有明显的促进作用。但生物体体内环境复杂,因此复合涂层的体内释药及生物功能还需进一步动物实验验证。
[参考文献]
[1]Bacakova L, Filova E, Parizek M, et al.Modulation of cell adhesion, proliferation and differentiation on materials designed for body implants[J].Biotechnol Adv, 2011, 29(6): 739-767.
[2]Lu X, Wang Y, Yang X, et al.Spectroscopic analysis of titanium surface functional groups under various surface modification and their behaviors in vitro and in vivo[J].J Biomed Mater Res A, 2008, 84(2):523-534.
[3]Avila G, Misch K, Galindo-Moreno P, et al.Implant surface treatment using biomimetic agents[J].Implant Dent, 2009, 18(1):17-26.
[4]Meswania IM, Bousdras VA, Ahir SP, et al.A novel closedloop electromechanical stimulator to enhance osseointegration with immediate loading of dental implant restorations[J].Proc Inst Mech Eng H, 2010, 224(10):1221-1232.
[5]Roy M, Bandyopadhyay A, Bose S.Induction plasma sprayed nano hydroxyapatite coatings on titanium for orthopaedic and dental implants[J].Surf Coat Technol, 2011, 205(8/9): 2785-2792.
[6]Coelho PG, Cardaropoli G, Suzuki M, et al.Early healing of nanothickness bioceramic coatings on dental implants.An experimental study in dogs[J].J Biomed Mater Res Part B Appl Biomater, 2009, 88(2):387-393.
[7]Meirelles L, Arvidsson A, Andersson M, et al.Nano hydroxyapatite structures influence early bone formation[J].J Biomed Mater Res A, 2008, 87(2):299-307.
[8]Rautray TR, Narayanan R, Kwon TY, et al.Surface modification of titanium and titanium alloys by ion implantation [J].J Biomed Mater Res Part B Appl Biomater, 2010, 93(2): 581-591.
[9]Hu Y, Cai K, Luo Z, et al.Regulation of the differentiation of mesenchymal stem cells in vitro and osteogenesis in vivo by microenvironmental modification of titanium alloy surfaces[J].Biomaterials, 2012, 33(13):3515-3528.
[10]Guo CA, Liu XG, Huo JZ, et al.Novel gene-modified-tissue engineering of cartilage using stable transforming growth factor-beta1-transfected mesenchymal stem cells grown on chitosan scaffolds[J].J Biosci Bioeng, 2007, 103(6):547-556.
(本文编辑杜冰)
Preparation of hydroxyapatite/chitosan-transforming growth factor-β1 composite coatings on titanium surfaces andits effect on the attachment and proliferation of osteoblasts
Gou Shiran1,2, Zhang Fan1, Li Mengting1, Huang Ting1, Zheng Lige1,2.(1.Dept.of Prosthodontics, Hospital of Stomatology, Luzhou Medical College, Luzhou 646000, China;2.State Key Laboratory of Oral Diseases, West China Hospital of Stomatology, Sichuan University, Chengdu 610041, China)
[Key words]titanium;surface modification;cell adhesion;cell proliferation
[Abstract]Objective This study investigated the effects of hydroxyapatite (HA)/chitosan (CS)-transforming growth factor-β1 (TGF-β1) composite coatings on titanium surfaces, as well as on the attachment and proliferation of osteoblasts.Methods HA/CS-TGF-β1 composite coatings were prepared on titanium surfaces by physical, chemical, and biological modifications.Scanning electron microscopy (SEM), X-ray diffraction (XRD), Fourier transform-infrared spectroscopy (FTIR), and other methods were employed to analyze the chemical composition and surface topography of the composite coatings.CCK-8 and immunofluorescence assays were used to analyze the effects of the coatings on the attachment and proliferation of osteoblasts.ResultsHA/CS-TGF-β1 composite coatings were successfully prepared.Their contact angle was almost zero.These composite coatings were applied in vitro, with a drug released early and a burst release effect.The growth of osteoblasts was not inhibited on it and it had obvious promoting effect on the adhesion and early proliferation of osteoblasts.ConclusionThe composite coatings significantly promote the adhesion and early proliferation of osteoblasts in vitro.This finding shows that the proposed method demonstrates a good prospective application in surface modification of titanium.
[中图分类号]R 783.2
[文献标志码]A [doi]10.7518/hxkq.2016.03.003
[收稿日期]2015-09-25; [修回日期]2016-03-05
[基金项目]口腔疾病重点实验室开放课题(SKLOD2015OF09)
[作者简介]苟诗然,硕士,E-mail:dddddd0904@126.com
[通信作者]郑立舸,教授,学士,E-mail:lzyxy-zlg@163.com

