沉默二氢叶酸还原酶基因对卵巢癌细胞体外生物学行为的影响
李 状,张 玮,王 琪,阳志军,李 力广西医科大学附属肿瘤医院妇瘤科,广西 南宁 530021
沉默二氢叶酸还原酶基因对卵巢癌细胞体外生物学行为的影响
李 状,张 玮,王 琪,阳志军,李 力
广西医科大学附属肿瘤医院妇瘤科,广西 南宁 530021
[摘要]背景与目的:二氢叶酸还原酶(dihydrofolate reductase,DHFR)在卵巢上皮癌铂类耐药细胞中高表达。该研究旨在探讨DHFR基因沉默对卵巢癌细胞体外生物学行为的影响,为卵巢癌铂类耐药的治疗奠定基础。方法:设计DHFR基因靶向的发夹状siRNA,筛选出最佳siRNA沉默片段,构建携带有目的基因的慢病毒载体细胞即转染组(DHFR-pGCSIL-SKOV3细胞)及阴性对照组细胞(pGCSIL-SKOV3细胞)。采用流式细胞仪检测3组细胞在不同的顺铂质量浓度(2.5、5.0、10.0和20.0 μg/mL)下不同时间段(24、48及72 h)的凋亡情况以及IC50顺铂质量浓度(4.4 μg/mL)的周期变化;采用高效液相色谱法检测不同顺铂质量浓度(2.5、5.0和7.5 μg/mL)不同时间段(24和48 h)药物作用后3组细胞内的顺铂浓度。采用透射电镜观察IC50顺铂质量浓度(4.4 μg/mL)3种细胞的超微结构变化。结果:将退火后的双链寡核苷酸片段连接到pGCSIL/GFP载体,测序结果正确。转染SKOV3细胞后,蛋白[质]印迹法(Western blot)鉴定干扰效果。在给药24、48和72 h后,DHFR-pGCSIL-SKOV3、pGCSIL-SKOV3及SKOV3三组细胞的凋亡率随着顺铂质量浓度(2.5、5.0、10.0和20.0 μg/mL)的上升而升高,DHFR-pGCSIL-SKOV3细胞给药48和72 h后的凋亡率明显高于pGCSIL-SKOV3及SKOV3细胞,差异有统计学意义(P<0.05)。3组细胞在IC50顺铂质量浓度(4.4 μg/mL)给药24和48 h后,转染组G0/G1期细胞比例较阴性及空白对照组明显增多,G2/M、S期则反之;而给药72 h后,3组细胞以G2/M及S期为主,转染组低于阴性及空白对照组。采用高效液相法检测细胞内顺铂质量浓度时,转染组在2.5和5.0 μg/mL顺铂质量浓度给药24和48 h后,其细胞内顺铂浓度均明显高于对照组。转染组在7.5 μg/mL顺铂质量浓度给药24 h后,其细胞内顺铂浓度均明显低于对照组细胞,在48 h后却又高于对照组,差异有统计学意义(P=0.034,P=0.014)。未给药时,转染组细胞的微丝明显多于对照组,线粒体亦改变明显。IC50(4.4 μg/mL)给药24和48 h后3组细胞均未见微丝;而给药72 h后微丝明显增多,且排列紊乱。结论:成功构建携带DHFR基因的pGCSIL干扰慢病毒载体的卵巢癌细胞。通过对DHFR下调后耐药性能研究得知,DHFR的下调与经过铂类药物作用的体外卵巢癌细胞的药物耐药性有一定的联系,卵巢癌细胞中下调DHFR基因可以考虑作为多药耐药的逆转机制。
[关键词]pGCSIL/GFP载体;二氢叶酸还原酶;高效液相色谱法;凋亡;透射电子显微术
Correspondence to:LI LiE-mail:LiLi@gxmu.edu.cn
卵巢癌是女性生殖器官常见的肿瘤之一,发病率仅次于子宫颈癌和子宫体癌而列居第3位,但其却是妇科肿瘤中死亡率最高的恶性肿瘤。由于卵巢癌发病隐匿,大部分患者确诊时已为晚期(FIGO分期,Ⅲ期和Ⅳ期)[1]。目前卵巢癌的最佳治疗方案是外科手术和以铂类和紫杉醇为基础的化疗。但因化疗耐药,晚期患者的5年生存率仅为25%~30%。本课题组先前采用荧光标记差异显示PCR法筛选鉴定和验证铂类耐药和非耐药卵巢上皮癌细胞间差异表达基因时也发现,铂类耐药和非耐药卵巢上皮癌细胞间二氢叶酸还原酶(dihydrofolate reductase,DHFR)存在差异表达,且铂类敏感卵巢上皮癌细胞在体外被诱导成耐药细胞后其DHFR表达明显上调[2]。DHFR是一种利用还原型辅酶Ⅱ还原二氢叶酸产生四氢叶酸的氧化还原酶。其相对分子质量约为20 000,是催化叶酸还原成四氢叶酸的酶。四氢叶酸形成过程分2步进行,由同一个酶催化,四氢叶酸作为一碳单位载体,为嘌呤核苷酸从头合成和胸嘧啶核苷酸合成等提供一碳单位。叶酸缺乏可能导致DNA损伤、不稳定和DNA甲基化畸形状态,这在肿瘤发生过程中起重要作用。叶酸的代谢障碍也可能与卵巢癌的发生有关[3]。叶酸主要包括叶酸受体、DHFR和四氢叶酸还原酶。叶酸受体是一种糖基磷脂酰肌醇锚定膜蛋白,可介导细胞外叶酸进入细胞内[4],是目前抗肿瘤治疗研究的重要靶点[5],而DHFR是叶酸受体的下游。高海德等[6]观察到双突变DHFR基因(酶活性增高)对大剂量甲氨蝶呤化疗小鼠骨髓细胞具有保护作用。此外,有文献报道DHFR基因在白血病耐药细胞株、人骨肉瘤耐药细胞株及耐药乳腺癌细胞株等肿瘤耐药细胞株中高表达,并且在肿瘤多药耐药中发挥着一定的作用[7-9]。
本课题组在前期卵巢组织的荧光定量PCR的实验中,了解到DHFR基因可能在卵巢癌铂类耐药过程中起着重要的作用[2]。为进一步探讨其对卵巢癌细胞耐药性的影响,我们考虑选用稳定表达的载体来进行细胞功能性实验,而慢病毒载体目前是有效、可靠的转基因方法,且应用广泛,故选用pGCSIL/GFP慢病毒载体作为DHFR干扰载体,为今后进一步的基因功能研究和动物实验打下良好的基础。为进一步探讨DHFR与卵巢癌多药耐药之间的关系,我们构建了高拷贝DHFR-pGCSIL重组慢病毒干扰载体,并通过流式仪器检测不同时间段不同药物浓度的凋亡周期,采用透射电镜观察细胞超微结构,采用高效液相检测细胞内外铂类药物浓度的变化;同时也为后续研究卵巢癌细胞的多药耐药机制实验做了良好的铺垫。
1 材料和方法
1.1材料来源
细胞及质粒来源:SKOV3细胞为本实验室保存。pGCSIL慢病毒系统、包膜质粒pHelper1.0和包装质粒pHelper2.0均购自上海吉凯有限公司。
主要试剂:改良型1640培养液和胎牛血清均购自美国Gibco公司,LipofectamineTM2000购自美国Invitrogen公司,一抗(兔抗羊HPSE蛋白多克隆抗体)和二抗(辣根酶标记兔抗羊IgG)均购自美国Santa Cruz公司,GAPDH(甘油醛-3-磷酸脱氢酶)内参多抗购自上海康成生物公司,凋亡试剂盒BD PharmingenTMPE Annexin V Apoptosis Detection Kit Ⅰ及周期试剂盒BD CycletestTMPlus DNA Reagent Kit均购自美国BD公司,AgeI、EcoRI、T4 DNA ligase及buffer均购自美国NEB公司。
1.2方法
1.2.1重组质粒的构建
设计DHFR基因靶向的发夹状siRNA,筛选出最佳siRNA沉默片段,合成单链DNA寡核苷酸,引物退火形成双链DNA寡核苷酸即shRNA,将退火后的shRNA模板与酶切回收后的线性慢病毒载体pGCSIL相连接,经过DH-5a菌体的转化,提取阳性克隆进行测序。将测序结果进行BLAST比对,同源性为100%。重组质粒命名为DHFR-pGCSIL。
1.2.2质粒DNA细胞转染
DHFR-pGCSIL(pGCSIL)、pHelper1.0及pHelper2.0三种质粒质量比为4∶3∶2,将SKOV3细胞以每孔3×105接种于6孔培养板。第2天,细胞贴壁生长汇合至70%~80%时进行转染,具体操作按脂质体LipofectamineTM2000说明书进行。实验分为3组:实验组(携带有重组质粒DHFR-pGCSIL基因的SKOV3细胞组)、阴性对照组(携带有空载pGCSIL病毒的SKOV3细胞组)及空白对照组(亲本SKOV3细胞组)。采用流式细胞仪分选带有DHFR-pGCSIL基因的SKOV3细胞。
1.2.3蛋白[质]印迹法(Western blot)检测3组细胞中DHFR蛋白表达
用放射免疫沉淀试验裂解液裂解细胞,13 987.5×g离心5 min后取上清液抽提细胞总蛋白。用10%的十二烷基硫酸钠-聚苯烯酰胺凝胶电泳分离蛋白质,随后电转移至硝酸纤维膜,5%脱脂奶粉洗涤缓冲液封闭,抗体温育过夜,洗膜,然后用HRP标记的二抗常规温育1 h,摇床脱色10 min,进行化学发光反应。将胶片进行扫描或拍照,以β肌动蛋白(β-actin)为内参照,用凝胶图像处理系统分析目标带的相对表达水平。
1.2.4四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)比色法检测3组细胞生长曲线
将3组细胞培养至汇合度达80%左右,0.25%胰酶消化后,制成单个细胞悬液,按每孔8×103个细胞数接种于96孔板,每孔总体积为200 μL;在CO2体积分数为5%、37 ℃的环境中培养24 h;24 h后3组细胞以1.25、2.5、5.0、10.0、20.0和40.0 μg/mL质量浓度梯度加顺铂化疗药物,分别培养24、48和72 h。每孔加入MTT溶液20 μL,37 ℃温育4 h,吸弃上清液,每孔加入二甲基亚砜150 μL,吹打混匀使甲臜充分溶解,将所有溶液移至另一孔板;选择492 nm波长的酶联免疫检测仪测定各孔的吸光度(D)值,记录结果,绘制生长曲线。
1.2.5流式细胞仪检测不同药物浓度、不同时间段的凋亡变化
将3组细胞培养至汇合度达80%~90%左右,0.25%胰酶消化后,制成单个细胞悬液,按每孔5×105个细胞数接种于6孔板,每孔总体积为2 mL,24 h细胞贴壁后每种细胞按2.5、5.0、10.0和20.0 μg/mL质量浓度梯度加顺铂化疗药物,分别培养24、48和72 h后,按照凋亡试剂盒说明书进行操作,流式细胞仪进行检测。
1.2.6流式细胞仪检测IC50顺铂浓度作用不同时间段的周期变化
将3组细胞培养至汇合度达80%~90%左右,0.25%胰酶消化后,制成单个细胞悬液,按每孔1×106个细胞数接种于6孔板,每孔总体积为2 mL;24 h细胞贴壁后每种细胞按IC50质量浓度(4.4 μg/mL)加顺铂化疗药物,分别培养24、48和72 h。按照周期试剂盒说明书进行细胞处理,最后将样品放入流式仪器检测,每种细胞检测1×104个细胞,Multicycle软件分析细胞周期比例。
1.2.7高效液相检测顺铂作用不同浓度、不同时间段的细胞内外的铂类药物浓度变化
将预先培养的生长良好的3组细胞悬液(含细胞1×107个)加入25 cm2的培养瓶中培养24 h,加入2.5、5.0和7.5 μg/mL的顺铂质量浓度培养不同的时间(如0、24和48 h等),每个浓度及每个时间点培养3瓶。实验操作方法与李维凤等[10]的处理方法一致。按相应色谱条件测定峰面积,以峰面积对含量作线性回归,DDP质量浓度在0.1~1.0 μg/mL范围内r=0.99,回归方程Y=1.24×10-5X-6.41×10-3。
1.2.8电镜观察IC50浓度顺铂作用不同时间段的超微结构变化
将3组细胞培养至75 cm2的培养瓶,待细胞汇合度达90%~100%左右时分别将每种细胞加入筛选后的IC50顺铂质量浓度(4.4 μg/mL)药物刺激24、48和72 h后,0.25%胰酶消化细胞,将离心管内的细胞悬液离心(167.7×g,10 min)成团;3%戊二醛固定液固定过夜;1%锇酸固定液再固定1 h;丙酮∶醋酸异戊酯(1∶1)脱水10 min以及酒精逐层梯度脱水;环氧树脂618包埋制备成半超薄切片1 μm;在透射电镜下观察细胞超微结构,并拍照摄片,分析各组细胞超微结构的变化情况。
1.3统计学处理
2 结果
2.1重组质粒的构建
用pGCSIL/GFP载体的通用引物,以提取的质粒为模板进行PCR反应,扩增出目的基因全长823 bp。经BLAST比对,同源性达100%。序列为CCGGAAGTCTAGATGATGCCTTAAACT CGAGTTTAAGGCATCATCTAGACTTTTT TTG(图1)。
2.2流式细胞仪分选转然后的目的细胞及Western blot检测3组细胞中DHFR的含量
将携带有DHFR基因的病毒颗粒感染SKOV3细胞,大量培养后采用流式细胞仪进行荧光细胞的分选,分选率为65.8%。将成功分选的携带有DHFR基因的SKOV3细胞大量培养后进行验证并进行灰度值的检测。SKOV3灰度值/DHFR-pGCSIL-SKOV3灰度值=0.25/0.11=2.4倍,表明细胞转染成功(图2、3,表1)。

图1 DHFR-pGCSIL重组质粒载体的构建及测序图Fig. 1 The construction of DHFR-pGCSIL recombinant plasmid vector and sequence diagram

图2 流式细胞仪分选SKOV3目的细胞Fig. 2 Sorting of SKOV3 cells by fow cytometry
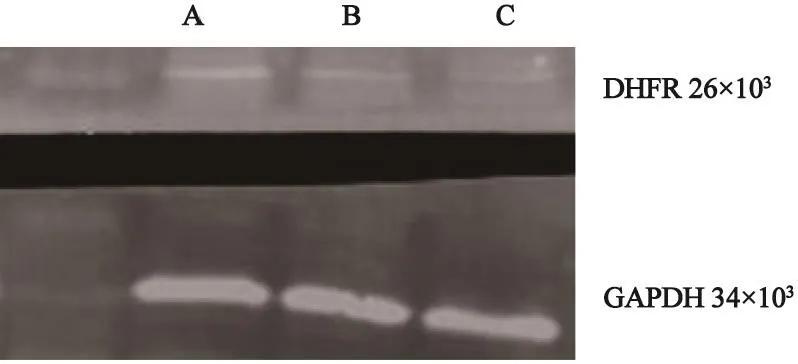
图3 Western blot检测3组不同SKOV3细胞DHFR表达量Fig. 3 Detection of DHFR expression in SKOV3 cells of three diferent groups by Western blot

表1 Western blot检测3组不同的SKOV3细胞中DHFR的灰度值Tab. 1 Detection of DHFR grey value in SKOV3 cells of three diferent groups by Western blot
2.3MTT比色法检测DHFR-pGC-SIL-SKOV3、pGCSIL-SKOV3及SKOV3三组细胞的生长曲线
MTT比色法检测,根据各个时间点所测得的D492 nm绘制出生长曲线,并计算出3组细胞的IC50顺铂质量浓度分别为4.4、5.5和4.9 μg/mL。
2.4流式细胞仪检测不同药物质量浓度、不同时间段的凋亡变化
在给药24、48和72 h后,DHFR-pGCSILSKOV3、pGCSIL-SKOV3及SKOV3细胞的凋亡率随着顺铂质量浓度(2.5、5.0、10.0和20.0 μg/mL)的增加而升高。pGCSIL-SKOV3 及SKOV3细胞的凋亡率差异无统计学意义(P=0.977)。在给药24 h后,不超过5.0 μg/mL时,3种细胞的凋亡率基本相同,差异无统计学意义;>5.0 μg/mL时,DHFR-pGCSILSKOV3细胞的凋亡率明显高于其他2组细胞(P=0.035,P=0.028)。pGCSIL-SKOV3及SKOV3细胞的凋亡率差异无统计学意义。在给药48 h后,3种细胞在顺铂质量浓度小于5.0 μg/mL时,DHFR-pGCSIL-SKOV3细胞的凋亡率明显低于其他2组细胞(P=0.003);在不小于5.0 μg/mL的顺铂质量浓度中,DHFR-pGCSILSKOV3细胞的凋亡率明显高于pGCSIL-SKOV3 及SKOV3细胞(P=0.036,P=0.009,P=0.047)。在给药72 h后,DHFR-pGCSIL-SKOV3细胞各个药物浓度的凋亡率明显高于其他2组细胞(P=0.023,P=0.034,P=0.012,P=0.000);pGCSIL-SKOV3及SKOV3细胞之间的凋亡率差异无统计学意义(P>0.05,表2)。
2.5流式细胞仪检测IC50顺铂质量浓度(4.4 μg/ mL)不同时间段的周期变化
3组细胞在IC50顺铂质量浓度(4.4 μg/mL)给药后24、48 h时,转染组G0/G1期细胞比例较阴性及空白对照组明显增多(P=0.044),G2/M、S期则相反(P=0.008,P=0.005);而给药后72 h时,3组细胞以G2/M及S期为主,转染组低于阴性及空白对照组(P=0.037,P=0.019,表3)。
2.6高效液相检测不同药物质量浓度、不同时间段的细胞内外的铂类药物浓度变化
未给药时,DHFR-pGCSIL-SKOV3、pGCSIL-SKOV3及SKOV3细胞内顺铂含量相同;3组不同顺铂质量浓度(2.5、5.0和7.5 μg/mL)时,转染组在药物作用24 h时,在2.5、5.0 μg/mL顺铂浓度给药后其细胞内顺铂浓度均明显高于对照组(P=0.006,P=0.034);在7.5 μg/mL顺铂浓度给药后其细胞内顺铂浓度却明显低于对照组(P=0.034);而在药物作用48 h时,其细胞内顺铂浓度均明显高于对照组(P=0.043,P=0.032,P=0.014)。转染组随着药物浓度的增加其细胞内顺铂药物浓度减少,对照组则与药物刺激浓度并不呈依赖性关系(图4,表4)。
表2 不同顺铂质量浓度作用不同时间后3组细胞的凋亡率比较Tab. 2 Comparison of apoptosis rates in 3 groups after diferent cisplatin concentrations at diferent time(%,±s)

表2 不同顺铂质量浓度作用不同时间后3组细胞的凋亡率比较Tab. 2 Comparison of apoptosis rates in 3 groups after diferent cisplatin concentrations at diferent time(%,±s)
Group DHFR-pGCSIL-SKOV3 SKOV3 pGCSIL-SKOV3 P24hvalue P48hvalue P72hvalue 24 h 48 h 72 h 24 h 48 h 72 h 24 h 48 h 72 h 2.5 μg/mL 5.32±0.24 15.30±1.32 46.11±0.68 5.06±0.22 20.20±1.46 29.00±1.23 7.16±0.49 23.27±1.3522.25±1.16 1.023 0.003 0.023 5.0 μg/mL 9.90±0.49 40.02±0.79 60.84±1.48 10.63±0.49 37.12±2.08 46.03±2.01 11.01±0.87 35.26±1.3844.16±1.87 0.098 0.036 0.034 10.0 μg/mL 22.83±0.44 57.09±0.89 80.26±1.32 12.83±0.85 47.16±1.45 66.40±1.68 12.07±1.22 49.55±2.0262.85±1.89 0.035 0.009 0.012 20.0 μg/mL 41.42±1.05 69.35±1.35 90.42±1.47 27.46±1.01 64.12±2.63 83.12±2.07 26.52±1.13 64.89±2.8182.97±2.28 0.028 0.047 0.000
表3 IC50顺铂质量浓度(4.4 μg/mL)作用不同时间后3组细胞的周期比较Tab. 3 Comparison of cell cycles in 3 groups induced by IC50cisplatin concentration (4.4 μg/mL) at diferent time(%,±s)

表3 IC50顺铂质量浓度(4.4 μg/mL)作用不同时间后3组细胞的周期比较Tab. 3 Comparison of cell cycles in 3 groups induced by IC50cisplatin concentration (4.4 μg/mL) at diferent time(%,±s)
Group G0/G1S G2/M 24 h 48 h 72 h 24 h 48 h 72 h 24 h 48 h 72 h DHFR-pGCSIL-SKOV3 62.60±0.44 55.48±1.43 2.34±0.24 30.49±0.89 44.30±1.12 60.94±0.78 4.91±0.88 0.22±0.11 36.72±1.03 SKOV3 57.03±0.99 37.29±1.01 0.96±0.21 31.11±1.31 62.67±0.59 36.14±0.81 11.86±0.64 0.04±0.31 62.90±1.24 pGCSIL-SKOV3 56.59±0.89 38.97±0.93 0.24±0.18 29.70±0.92 55.77±1.21 26.81±0.93 13.71±0.68 5.25±0.78 72.95±1.19 P value 0.044 0.022 0.004 0.057 0.005 0.019 0.008 0.001 0.037

图4 高效液相色谱法标准曲线色谱图的建立Fig. 4 The establishment of chromatogram standard curve by high performance liquid chromatography
表4 不同顺铂质量浓度作用不同时间3组细胞的细胞内顺铂浓度比较Tab. 4 Comparison of cisplatin concentrations in vivo in 3 groups at diferent cisplatin concentrations and at diferent time[ρB/(μg·mL-1),±s]
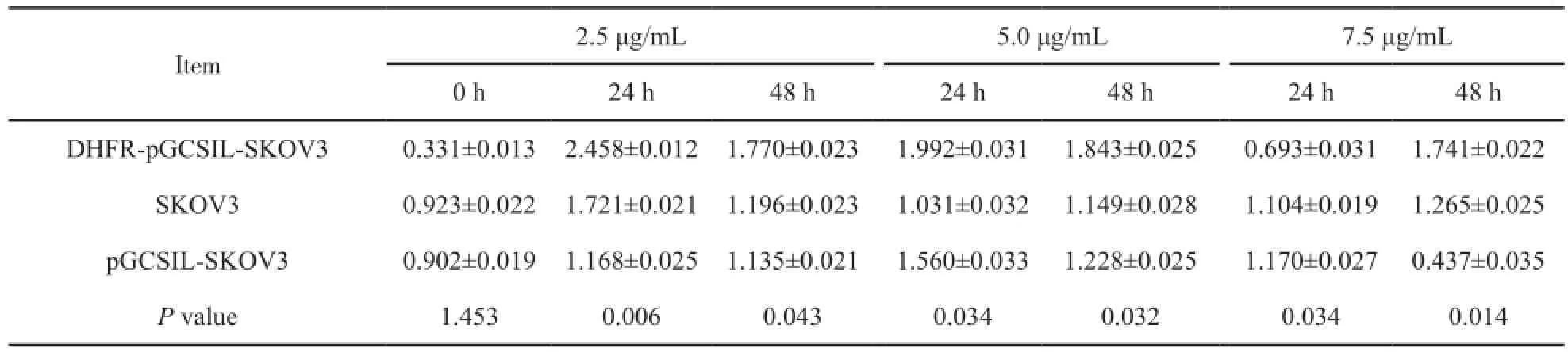
表4 不同顺铂质量浓度作用不同时间3组细胞的细胞内顺铂浓度比较Tab. 4 Comparison of cisplatin concentrations in vivo in 3 groups at diferent cisplatin concentrations and at diferent time[ρB/(μg·mL-1),±s]
Item 2.5 μg/mL 5.0 μg/mL 7.5 μg/mL 0 h 24 h 48 h 24 h 48 h 24 h 48 h DHFR-pGCSIL-SKOV3 0.331±0.013 2.458±0.012 1.770±0.023 1.992±0.031 1.843±0.025 0.693±0.031 1.741±0.022 SKOV3 0.923±0.022 1.721±0.021 1.196±0.023 1.031±0.032 1.149±0.028 1.104±0.019 1.265±0.025 pGCSIL-SKOV3 0.902±0.019 1.168±0.025 1.135±0.021 1.560±0.033 1.228±0.025 1.170±0.027 0.437±0.035 P value 1.453 0.006 0.043 0.034 0.032 0.034 0.014
2.7采用透射电镜检测不同时间段的IC50顺铂质量浓度的3组细胞超微结构变化
IC50(4.4 μg/mL)给药24和48 h后,3组细胞的微丝均少见,DHFR-pGCSIL-SKOV3细胞在24 h后可见线粒体肿胀、脊消失、空泡化、萎缩,内质网扩张明显,有聚集的核糖体,未见高尔基体,48 h时其有些线粒体溶解消失,且出现大量的白色囊泡;而pGCSIL-SKOV3及SKOV3细胞在24和48 h后内质网扩张少见,线粒体结构改变不明显,甚至有2~3个高尔基体存在。DHFR-pGCSIL-SKOV3细胞在72 h后,微丝明显聚集、增多,线粒体结构亦消失;而pGCSIL-SKOV3及SKOV3细胞微丝排列紊乱,线粒体形态多样化(图5,表5)。

图5 采用透射电镜检测不同时间段的IC50顺铂质量浓度(4.4 μg/mL)的细胞超微结构变化Fig. 5 A transmission electron microscope was used to observe cell ultrastructure changes in three groups at IC50cisplatin concentration (4.4 μg/mL) in diferent periods

表5 采用透射电镜检测不同时间段的IC50顺铂质量浓度(4.4 μg/mL)3组细胞的超微结构变化Tab. 5 Cell ultrastructure changes in 3 groups at IC50cisplatin concentration (4.4 μg/mL) in diferent periods detected by transmission electron microscope
3 讨论
近年来,多药耐药成为化疗失败的主要原因之一。如何逆转多药耐药已经成为当今肿瘤治疗的研究热点。临床研究证实,顺铂与紫杉醇的联合化疗是治疗卵巢癌的一线化疗药物。卵巢癌的治疗主要以肿瘤细胞减灭术及辅以化疗为主,基因治疗已逐步兴起。采用RNAi干扰相关的多药耐药基因已经成为多数学者的研究对象。直接转染合成的siRNA虽然能特异性抑制哺乳动物细胞内同源基因的表达,但细胞内siRNA很容易被降解。因此,这种方法不能实现稳定的RNA干扰。相比之下,质粒载体或病毒载体就能在细胞内长时间、稳定地生成siRNA。但质粒载体转染哺乳动物细胞的效率不如病毒载体,尤其无法转染非分裂相细胞。所以,本实验选择了一种更有效的干扰方法即慢病毒RNA干扰的表达载体。在此基础上进行一系列相关的耐药性功能实验。
DHFR是叶酸代谢过程中的关键酶,同时也是抗肿瘤、抗菌及抗炎的靶点药物。目前已经有大量研究关于DHFR基因在疟疾、乳腺癌及巨幼细胞性贫血症等疾病治疗中的相关作用。通过本课题组的前期研究发现卵巢癌顺铂耐药性增强时,其DHFR基因表达量增加。此结果与乳腺癌多药耐药的研究、骨肉瘤多药耐药的研究及急性淋巴细胞白血病的耐药性研究均一致。Malisa等[11]研究发现,DHFR基因的三重突变及DHPS的双重突变对磺胺嘧啶及乙嘧啶治疗疟疾的效果有着重要意义,DHFR突变可能是引起磺胺嘧啶及乙嘧啶耐药的主要原因之一。Cario等[12]研究发现,由DHFR纯合子突变引起的DHFR缺乏导致巨幼细胞贫血症及脑部叶酸缺乏导致严重的神经疾病,DHFR对于维持脑脊液及红细胞中叶酸水平是有必要的,即使血浆中已经有足够的叶酸以及叶酸供应。Zhu等[13]研究发现,DHFR表达增加的主要机制在于转录活化子激活所导致的。Banka等[14]研究分析表明,叶酸可以纠正由DHFR缺乏症导致的脑叶酸水平、贫血和血细胞改变的症状,同时为DHFR和脑四氢生物蝶呤的新陈代谢之间的联系提供了证据,进一步提示了叶酸在神经病学上的角色,包括抑郁症、阿本海姆症及帕金森病。Sun等[15]研究发现,敲除DHFR基因后对斑马鱼在心脏发展形成过程中其重要因子有消极影响,而过表达的DHFR对其则有积极作用,其主要是通过调节转录水平影响细胞增殖和凋亡。Klinghoffer等[16]研究通过慢病毒载体转染小干扰片段DHFR基因来调节β-连环素信号转导途径受体抑制剂GSK3,其机制可能为DHFR抑制剂引起的甲基化突变的协同作用,从而使DHFR及GSK3双重抑制剂来治疗慢性炎性反应。
在给药24、48和72 h后,DHFR-pGCSILSKOV3、pGCSIL-SKOV3和SKOV3细胞的凋亡率随着顺铂质量浓度(2.5、5.0、10.0和20.0 μg/ mL)的增加而升高,且DHFR-pGCSIL-SKOV3细胞给药48及72 h后的凋亡率明显高于pGCSILSKOV3及SKOV3细胞。凋亡是一个细胞的主动死亡过程,其有利于机体环境的稳定,而肿瘤细胞却可通过抑制凋亡来实现自我保护,以利于生存。细胞凋亡能力能够直接影响化疗药物的效应。因此,本实验的凋亡结果表明,DHFR基因下调后,细胞的凋亡率增加,药物的敏感性增加。DHFR可以通过诱导凋亡来抑制SKOV3细胞增殖,并能部分逆转细胞的多药耐药性。由于凋亡调控的复杂性,诱导其凋亡的机制可能与上调凋亡相关蛋白,上调Fas/Fasl、c-myc基因,下调survivin基因表达,以及线粒体膜电位下降等有关。3组细胞在IC50顺铂浓度(4.4 μg/mL)给药后24 h时,转染组G0/G1期细胞比例较阴性及空白对照组明显增多,表明细胞增殖减慢,说明沉默DHFR基因后,卵巢癌SKOV3细胞增殖明显受到抑制。给药后48 h,G2/M、S期细胞比例增加,细胞增殖加快,而给药72 h时,3组细胞以G2/M及S期为主,转染组低于阴性及空白对照组,表明卵巢癌SKOV3细胞在沉默DHFR基因后,对顺铂的敏感性增加。这表明敲除DHFR基因加强了顺铂对细胞周期的阻滞作用,尤其是G2/M期,细胞周期的正常运行被扰乱,其连续性中断,药物使细胞周期的运行停滞在S和G2/M期,使通过G2/M监测点进入下一个细胞周期的细胞减少,从而抑制了细胞的增殖。采用高效液相检测细胞内顺铂浓度时,当2.5和5.0 μg/mL顺铂质量浓度作用3种不同处理的卵巢癌细胞时,DHFR-pGCSIL-SKOV3细胞在给药24和48 h后,其细胞内顺铂浓度均明显高于pGCSIL-SKOV3及SKOV3细胞,表明敲除DHFR基因的细胞能够使顺铂更容易进入体内,明显提高了靶细胞内的药物浓度,并且药物进入的时间较快也较早,能迅速达到高峰浓度。而DHFR-pGCSIL-SKOV3细胞在7.5 μg/mL顺铂浓度给药24 h后,其细胞内顺铂浓度均明显低于pGCSIL-SKOV3及SKOV3细胞,而在48 h后却又高于pGCSIL-SKOV3及SKOV3细胞。这表明当药物浓度较大时,敲除DHFR基因使SKOV3细胞泵出顺铂减少,增强了对细胞的杀伤作用。而高浓度顺铂给药48 h时,由于药物浓度较大且作用时间较长,细胞内药物代谢能力增加,导致细胞内药物浓度降低。在顺铂刺激过程中,细胞中的线粒体及内质网改变亦比较明显,可能顺铂是通过内质网-线粒体机制杀伤细胞以治疗肿瘤,李培等[17]研究三氧化二砷主要通过线粒体途径诱导药物敏感的白血病K562细胞凋亡,而通过内质网一线粒体联合途径诱导耐药性白血病K562/ADM细胞凋亡。这与马艳云等[18]的研究结果相一致。李云春等[19]研究发现,顺铂通过恢复p53的功能,诱导肿瘤细胞凋亡,起到抑制肿瘤生长的作用。同时,柳友清等[20]研究顺铂诱导凋亡的机制结果与马艳云等[18]的研究一致。根据上述文献研究,本实验的凋亡机制可能亦与p53途径有关,但由于本实验并没有检测内质网、线粒体及p53信号转导途径中的相关蛋白和基因的表达,因此,DHFR基因干扰后在顺铂诱导后其对药物敏感性增加的具体机制尚不清楚。
通过对DHFR下调后耐药性功能研究得知,DHFR的下调与经过铂类药物作用的体外卵巢癌细胞的药物敏感性有一定的联系,一般DHFR下调后,其药物敏感性增加,在一定浓度范围内,顺铂的作用随药物浓度的增加而提高,达到一定浓度后,这种递增效应减弱或消失,说明顺铂作用浓度有饱和效应。其G2/M期阻滞作用随用药时间的延长而增强,以用药72 h最显著。在顺铂有效浓度范围内,适当延长药物的作用时间可能会减少耐药性的产生或可成为逆转耐药的方法之一。卵巢癌细胞中下调DHFR基因可以考虑作为多药耐药的逆转机制,细胞的凋亡周期均参与到多药耐药机制的研究中,其具体机制如何,需深入进一步研究。
[参 考 文 献]
[1] 王 倩, 程 堃. Gankyrin 基因沉默对人卵巢癌SKOV3/ CDDP细胞顺铂耐药性的逆转作用和机制[J]. 中国癌症杂志, 2014, 24(1):35-40.
[2] LI L, LUAN Y, LI X, et al. Demonstration of differential gene expression between sensitive and resistant ovarian tumor cells by fluorescence differential display-PCR analysis[J]. Oncol Rep, 2005, 13(5):793-799.
[3] GERSHONI-BARUCH R, DAGAN E, ISRAELI D, et al. Association of the C667T polymorphism in the MTHFR gene with breast and/or ovarian cancer risk in Jewish women [J]. Eur J Cancer, 2000, 36(18):2313-2316.
[4] SIERRA E E, GOLDMAN I D. Recent advances in the understanding of the mechanism of membrance transport of folates and antifolates[J]. Semin Oncol, 1999, 26(2):11-23.
[5] GALT J R, HALKAR R K, EVANS C O, et al. In vivo assay of folate receptors in nonfunctional pituitary adenomas with99mTc-folate SPECT/CT[J]. J Nucl Med, 2010, 51(11):1716-1723.
[6] 高海德, 路 平, 鲁 阳, 等. 双突变二氢叶酸还原酶基因对小鼠的化疗保护作用[J]. 中华肿瘤杂志, 2006, 28(8):583-585.
[7] SCHELLENS J H, MALIEPAARD M, SCHEPER R J, et al. Transport of topoisomerase Ⅰ inhibitors by the breast cancer resistance protein. Potential clinical implications[J]. Ann N Y Acad Sci, 2000, 922:188-194.
[8] 于明东, 李书忠. 实时荧光定量PCR法检测人骨肉瘤耐MTX细胞系中RFC、DHFR、GST-π的mRNA表达[J].中国矫形外科杂志, 2009, 17(11):858-861.
[9] 黄 瀚, 李 兵, 欧阳林旗, 等. 叶酸受体及二氢叶酸还原酶与人乳腺癌细胞MCF-7/(ADR)多药耐药关系[J]. 中国药理学通报, 2011, 27(1):99-103.
[10] 李维凤, 牛晓峰, 范 特, 等. 高效液相色谱法测定皮下植入顺铂的血浆及肾脏浓度[J]. 南方医科大学学报, 2010, 30(2):242-244.
[11] MALISA A, PEARCE R, ABDULLAH S, et al. Molecular monitoring of resistant dhfr and dhps allelic haplotypes in Morogoro and Mvomero districts in south eastern Tanzania [J]. Afr Health Sci, 2011, 11(2):142-150.
[12] CARIO H, SMITH D E, BLOM H, et al. Dihydrofolate reductase deficiency due to a homozygous DHFR mutation causes megaloblastic anemia and cerebral folate deficiency leading to severe neurologic disease[J]. Am J Hum Genet, 2011, 88(2):226-231.
[13] ZHU W Y, BUNNI M, PRIEST D G, et al. Severe folate restriction results in depletion of and alteration in the composition of the intracellular folate pool, moderate sensitization to methotrexate and trimetrexate, upregulation of endogenous DHFR activity, and overexpression of metallothionein Ⅱ and folate receptor alpha that, upon folate repletion, confer drug resistance to CHL cells[J]. J Exp Ther Oncol, 2002, 2(5):264-277.
[14] BANKA S, BLOM H J, WALTER J, et al. Identification and characterization of an inborn error of metabolism caused by dihydrofolate reductase deficiency[J]. Am J Hum Genet, 2011, 88(2):216-225.
[15] SUN S, GUI Y, JIANG Q, et al. Dihydrofolate reductase is required for the development of heart and outflow tract in zebrafish[J]. Acta Biochim Biophys Sin (Shanghai), 2011, 43(12):957-969.
[16] KLINGHOFFER R A, FRAZIER J, ANNIS J, et al. A lentivirus-mediated genetic screen identifies dihydrofolate reductase (DHFR) as a modulator of beta-catenin/GSK3 signaling[J]. PLoS One, 2009, 4(9):e6892.
[17] 李 培, 陈 彻, 席亚明, 等. 艰难梭菌毒素A诱导K562细胞凋亡及其机制研究[J]. 中国实验血液学杂志, 2011, 19(3):638-642.
[18] 马艳云, 陈 静, 易 娟, 等. 三氧化二砷经内质网应激反应诱导K562/ADM耐药细胞凋亡[J]. 基础医学与临床, 2009, 29(2):161-165.
[19] 李云春, 钟 利, 唐秀英, 等. 顺铂诱导直肠癌HCT116细胞凋亡及其作用机制的研究[J]. 中国综合临床, 2009, 25(10):1076-1079.
[20] 柳友清, 邢 辉, 韩晓兵, 等. 顺铂诱导宫颈癌HeLa细胞凋亡及其作用机制的研究[J]. 中国肿瘤临床, 2006, 33(1):1-4.
Efect of down-regulation of dihydrofolate reductase on biological function of ovarian cancer cells in vitro
LI Zhuang,ZHANG Wei,WANG Qi ,YANG Zhijun,LI Li (Department of Gynecology Oncology,Tumor Hospital of Guangxi Medical University,Nanning 530021,Guangxi Province,China)
[Key words]pGCSIL/GFP vector;Dihydrofolate reductase;High performance liquid chromatography;Apoptosis;Transmission electron microscopy
[Abstract]Background and purpose:Dihydrofolate reductase (DHFR) is expressed highly in platinum-resistant ovarian cancer. This study aimed to explore the relationship between the silence of DHFR gene and platinum drug resistance in ovarian cancer,and lay the foundation for the treatment of platinum-resistant ovarian cancer. Methods:To design targeting hairpin siRNA of DHFR gene,the optimal siRNA silent sequence was selected,and lentiviral vector carrying DHFR gene was constructed successfully,named DHFR-pGCSIL-SKOV3 cell. Flow cytometry was used to detect the cell apoptosis of DHFR-pGCSIL-SKOV3 cells,pGCSIL-SKOV3 cells and SKOV3 cells incubated in various concentrations of cisplatin (2.5,5.0,10.0 and 20.0 μg/mL) at different time points (24,48 and 72 h),and cell cyclechanges of these cells at IC50cisplatin concentration (4.4 μg/mL). High performance liquid chromatography was used to test intracellular concentration of cisplatin at different induction concentration of cisplatin (2.5,5.0 and 7.5 μg/mL) and various time points (24 and 48 h). Ultrastructural changes of these cells at concentration of cisplatin IC50(4.4 μg/mL)were observed by transmission electron microscope. Results:After annealing double-strand nucleotide was connected to pGCSIL/GFP vector,sequencing result was correct. SKOV3 cell were transfected with virus particles followed by Western blot detection of interference effect. Flow cytometry was used to detect apoptosis in three groups of cells,and increased apoptosis rate was found at the raised cisplatin concentration (2.5,5.0,10.0 and 20.0 μg/mL) at 24,48 and 72 h in DHFR-pGCSIL-SKOV3,pGCSIL-SKOV3 and SKOV3 cells. The apoptosis rate in DHFR-pGCSIL-SKOV3 was significantly higher than that in pGCSIL-SKOV3 and SKOV3 cells at 24 and 48 h (P<0.05). Flow cytometry was adopted to test cells cycle of 3 groups at different time period under IC50cisplatin concentration (4.4 μg/mL),the results indicated that G0/G1phase cell rate of DHFR-pGCSIL-SKOV3 was much more than the others,of which G2/M and S phase cell rates were on the contrary. While at 72 h,3 groups were mainly G2/M and S phase cell rates,DHFR-pGCSIL-SKOV3 was lower than the others. High performance liquid chromatography method was used to detect intracellular cisplatin concentration at 24 and 48 h after the cells were incubated at various concentrations of cisplatin (2.5 and 5.0 μg/mL). The results showed the intracellular cisplatin content of DHFR-pGCSIL-SKOV3 cell was significantly higher than that of pGCSIL-SKOV3 and SKOV3 cells. However,after incubation at cisplatin concentration of 7.5 μg/mL,the intracellular cisplatin content of DHFR-pGCSIL-SKOV3 cell was significantly lower than that of pGCSIL-SKOV3 and SKOV3 cells at 24 h,while higher than pGCSIL-SKOV3 and SKOV3 cells at 48 h (P=0.034,P=0.014). We observed ultrastructural changes of three different cell lines induced by IC50cisplatin concentration(4.4 μg/mL) at different time points by the electron microscope. We found that the microfilaments were increased and gathered together and mitochondrial structure was also changed obviously without the drug. However,there was rare microfilament in three groups of cells at 24 and 48 h,while at 72 h,obviously increased inordinate microfilaments were observed. Conclusion:We successfully constructed pGCSIL lentivirus interference carrier carrying DHFR gene. The research indicates that down-regulation of DHFR gene is related to cisplatin drug resistance in ovarian cancer. The results laid the foundation for us to investigate the molecular mechanisms of multidrug-resistance in tumor.
DOI:10.3969/j.issn.1007-3969.2016.04.004
中图分类号:R737.31
文献标志码:A
文章编号:1007-3639(2016)04-0303-10
基金项目:国家自然科学基金资助项目(30960404 );广西科学研究与技术开发计划课题(桂科攻14124004);广西自然科学基金(2014jjAA40673)。
通信作者:李 力 E-mail:LiLi@gxmu.edu.cn
收稿日期:(2015-07-09修回日期:2015-09-04)

