突变特异性免疫组织化学法检测非小细胞肺癌EGFR基因突变
张龙富,姚家美,蒋冬先,洪群英,李 春,赵婧雅,曾海英,侯英勇,张 新.复旦大学附属中山医院呼吸科,上海 0003;.复旦大学附属中山医院病理科,上海 0003
突变特异性免疫组织化学法检测非小细胞肺癌EGFR基因突变
张龙富1,姚家美2,蒋冬先2,洪群英1,李 春1,赵婧雅1,曾海英2,侯英勇2,张 新1
1.复旦大学附属中山医院呼吸科,上海 200032;2.复旦大学附属中山医院病理科,上海 200032
[摘要]背景与目的:表皮生长因子受体(epidermal growth factor receptor,EGFR)基因的突变状态是非小细胞肺癌(non-small cell lung cancer,NSCLC)患者使用EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)的重要疗效预测指标。该研究旨在探讨突变特异性免疫组织化学(immunohistochemistry,IHC)法检测NSCLC标本EGFR基因突变的临床实用价值。方法:同时采用突变特异性IHC法和扩增阻滞突变系统(amplification refractory mutation system,ARMS)法检测290例NSCLC患者的EGFR基因突变状态,计算突变特异性IHC法检测EGFR基因突变的灵敏度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV);比较ARMS法和突变特异性IHC法检测EGFR突变的一致性。结果:以ARMS法检测结果为金标准,当染色评分≥1+为阳性时,突变特异性IHC法诊断EGFR基因突变的灵敏度为72.92%,特异度为95.20%,PPV为93.75%,NPV为78.08%。突变特异性IHC法诊断不同类型EGFR基因突变的准确性相差明显:诊断19外显子缺失突变的灵敏度只有55.55%,但其特异度在99%以上;当染色评分为1+时,诊断L858R突变的灵敏度为90.27%,特异度为95.86%,当染色评分为2+或3+时,其特异度则为98.63%~100%。突变特异性IHC法与ARMS法检测结果有较好的一致性(P<0.001,Kappa值:0.612~0.864)。突变特异性IHC法能直观判断EGFR基因突变细胞丰度。结论:突变特异性IHC法是EGFR突变分子检测的有效补充。
[关键词]非小细胞肺癌;表皮生长因子受体;突变;免疫组织化学
Correspondence to:ZHANG XinE-mail:zhang.xin@zs-hospital.sh.cn
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤,且发病率和死亡率仍在上升[1]。临床上约70%的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者首诊时已处于中期或晚期,失去了根治的机会,多采用化疗、靶向治疗为主的综合治疗[2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)是现阶段治疗晚期NSCLC最重要的靶向药物,代表药物有吉非替尼、厄洛替尼和埃克替尼等。有研究表明,EGFR基因突变状态是决定EGFRTKIs疗效最重要的预测因子[3-4],EGFR基因突变主要位于18~21外显子,其中发生在19外显子上的E746_A750缺失突变和21外显子上的L858R点突变所占比例最多,可达85%~90%[5-7]。目前检测EGFR基因突变的方法很多,如直接测序法、扩增阻滞突变系统(amplification refractory mutation system,ARMS)法、数字PCR法和液相芯片法等,其中直接测序法和ARMS法应用较广,但这些方法各有优缺点。直接测序法可检测所有的突变分析的区域,但对样本要求高,灵敏度低,只能检测突变丰度即突变拷贝数百分比大于20%的基因,限制了其在临床中的应用[8]。ARMS法灵敏度可达1%,但仅能检测已知的EGFR基因突变,且试剂费用昂贵,设备和技术要求高。这限制了ARMS法的应用,尤其是在基层医院的推广。2009年,Yu等[9]首次合成抗EGFR 19外显子E746_A750缺失突变抗体和抗L858R点突变抗体,用其对NSCLC标本进行免疫组织化学(immunohistochemistry,IHC)法检测,所得结果与直接测序法有较好的一致性。但现阶段,EGFR基因突变特异性IHC法尚未得到广泛应用,作为经济、快速的EGFR基因突变检测手段,其诊断价值有待进一步验证。本研究旨在探讨突变特异性IHC法检测NSCLC标本EGFR基因突变的准确性及其临床应用价值。
1 材料和方法
1.1临床资料
收集复旦大学附属中山医院2014年6月—2014年12月确诊的NSCLC患者290例,同时用突变特异性IHC法和ARMS法检测EGFR基因突变。在290例患者中,手术切除肿瘤标本72例,纤维支气管镜、经皮肺穿刺和淋巴结穿刺等取得的小活检标本218例。病例构成特征见表1。
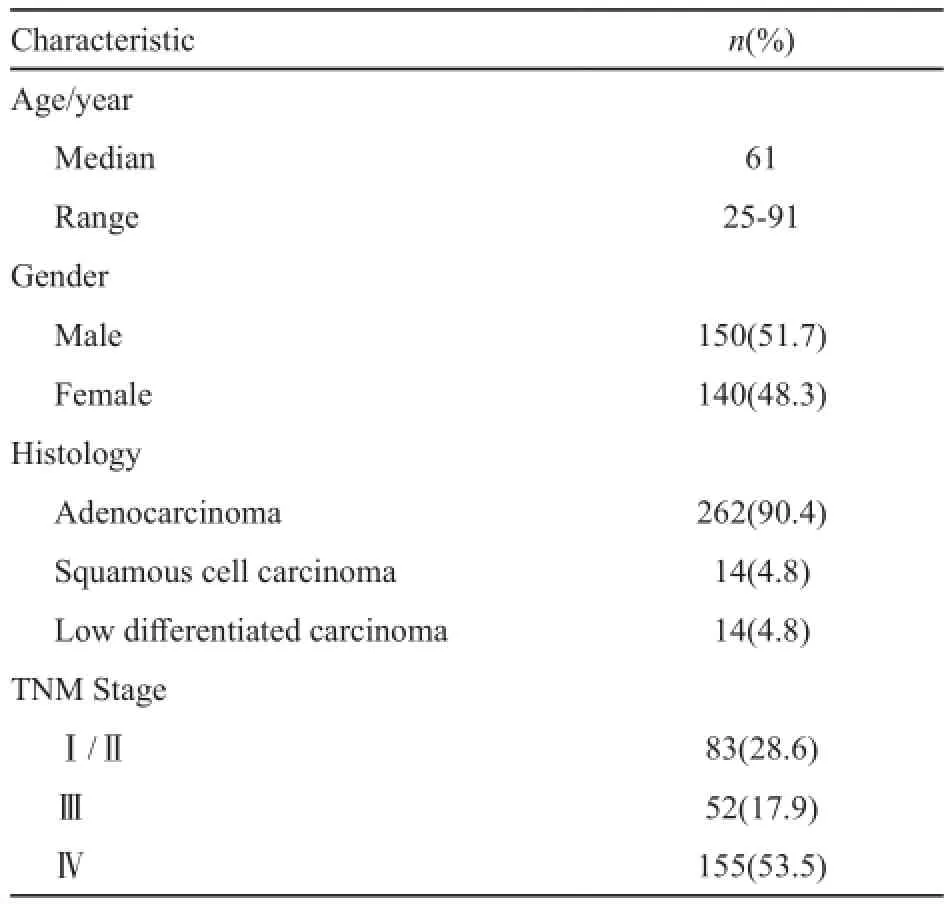
表1 入组患者临床资料Tab. 1 The clinical characteristics of patients
1.2DNA抽提
所有标本均为4%甲醛溶液固定、石蜡包埋组织;手术标本的石蜡组织切取4 μm厚切片3~5张,活检标本的石蜡组织切取切片10张,每个病例同时行常规H-E染色,并由病理科医师鉴定肿瘤细胞的存在。DNA抽提采用QIAamp DNA FFPE组织试剂盒(购自德国Agen公司),实验步骤依据说明书。从标本中提取并重悬后的DNA经NanoDrop 2000检测其总量及纯度。
1.3ARMS法检测
采用厦门艾德公司的EGFR基因突变检测试剂盒(ADx-EGFR基因突变检测试剂盒),该试剂盒覆盖了最常见的29种EGFR基因突变。参与反应的DNA总量及反应条件均根据该试剂盒说明书要求,最终检测结果以ADx-EGFR基因突变检测试剂盒提供的判读原则确定标本EGFR基因突变状态。
1.4突变特异性抗体IHC法及其结果判定
切片以二甲苯脱蜡,经各级浓度乙醇水化。加入EDTA(pH=9.0)加热至95 ℃左右,放入切片加热30 min抗原修复。放至室温,滴加5%的正常山羊血清(PBS稀释)封闭,室温温育15 min,甩去多余液体。根据组织大小,滴加50~150 μL稀释倍数为1∶50的第一抗体[抗E746_A750缺失突变单克隆兔抗体和抗L858R突变单克隆兔抗体,购自美国Cell Signaling Technology公司],4 ℃冰箱过夜。而后加生物素标记的第二抗体,室温下放置1 h,PBS冲洗后滴加辣根酶标记链霉素卵白素液室温温育1 h。每张切片加1滴新鲜配制的DAB液显色10~20 min,用淡苏木精复染细胞核30 s,脱水并待切片晾干后采用中性树脂封片,镜下观察。
以肿瘤细胞的细胞膜和(或)细胞质着色为基准,根据切片中阳性细胞染色强度及百分比将表达结果分为0、1+、2+和3+四个等级。0:无染色或≤10%肿瘤细胞浅染色;1+:>10%肿瘤细胞浅染色;2+:>10%肿瘤细胞中度强染色;3+:>10%肿瘤细胞强染色[9]。本结果由3位病理科医师各自单独评分,结果经汇总,对有差异的评分经复核商讨后得到最终一致结果。
1.5统计学处理
采用SPSS 19.0统计软件进行数据分析。以ARMS法为金标准,计算突变特异性IHC法的灵敏度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)。EGFR基因突变率的比较采用X2检验,突变特异性IHC法和ARMS法检测EGFR基因突变一致性的比较采用Kappa检验。P<0.05为差异有统计学意义。
2 结果
2.1突变特异性IHC法检测结果
在本组290例NSCLC标本中,EGFR特异性IHC法的阳性率为38.62%(112/290),其中染色评分1+为48例(16.55%,48/290),19外显子E746_ A750缺失突变17例,L858R突变31例;2+为34例(11.72%,34/290),其中19外显子E746_A750缺失突变10例,L858R突变24例;3+为30例(10.34%,30/290),其中19外显子E746_A750缺失突变14例,L858R突变16例。不同染色强度对应评分见图1。阳性病例主要表现为肿瘤细胞的细胞膜和细胞质染色,间质细胞极少染色,提示这两种抗体较特异性地与肿瘤细胞相关抗原结合。
2.2两种方法检测EGFR基因突变的阳性率比较
ARMS法检测EGFR基因突变阳性率为49.65%,优于突变特异性IHC法检测的阳性率(38.62%),差异有统计学意义(P=0.012)。而这一差异主要由19外显子缺失突变阳性率差异所致。ARMS法与突变特异性IHC法检测19外显子缺失突变的阳性率分别为24.82%和14.13%,前者显著高于后者(P=0.002)。而ARMS法和突变特异性IHC法检测L858R突变的阳性率差异无统计学意义(24.82% vs 24.48%,P=1,图2)。

图1 IHC染色结果Fig. 1 The staining results of IHC
(×400)

图2 两种检测方法检出EGFR基因突变率的比较Fig. 2 The comparison of EGFR gene mutation rates by ARMS and IHC
2.3突变特异性IHC法与ARMS法一致性分析
突变特异性IHC法和ARMS法的一致性分析提示,两者一致性较好(Kappa值=0.682,P<0.001,表2)。其中:对19外显子缺失突变检测的Kappa值为0.612(P<0.001,表3);对L858R突变检测的Kappa值为0.864(P<0.001,表4)。
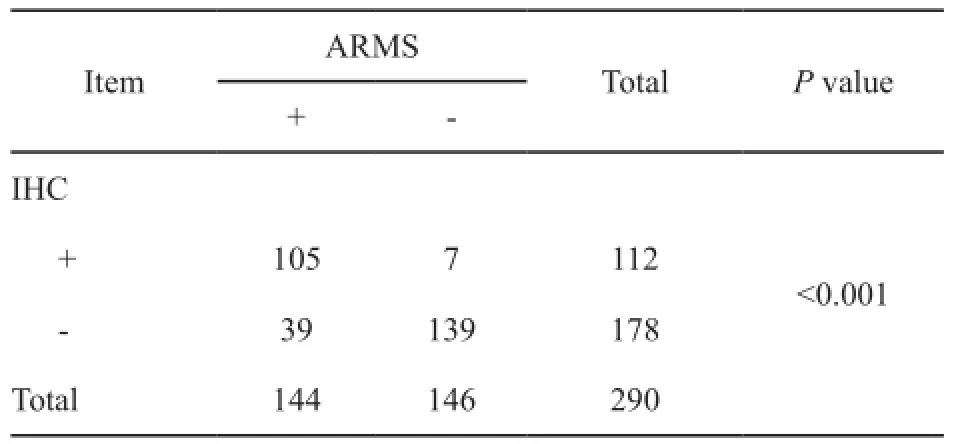
表2 ARMS法与突变特异性IHC法检测结果的一致性分析Tab. 2 Consistency analysis in detecting results between ARMS and mutation specifc IHC

表3 ARMS法与突变特异性IHC法检测19外显子缺失突变的一致性分析Tab. 3 Consistency analysis in detecting exon 19 deletion between ARMS and mutation specifc IHC

表4 ARMS法与突变特异性IHC法检测L858R突变的一致性分析Tab. 4 Consistency analysis in detecting L858R mutation between ARMS and mutation specifc IHC
2.4染色强度对突变特异性IHC法诊断准确性的影响
本文以ARMS法检测结果为金标准,当以IHC染色评分≥1为阳性时,IHC法诊断EGFR基因突变的灵敏度为72.92%,特异度为95.20%,PPV为93.75%,NPV为78.08%。
突变特异性IHC法对两种突变类型检测的准确性相差明显:诊断19外显子缺失突变的灵敏度只有55.55%,但其特异度在99%以上;当染色评分为1+时,诊断L858R突变的灵敏度为90.27%,特异度为95.86%,当染色评分为2+或3+时,其特异度则高达98.63%~100%(表5)。
2.5突变特异性IHC法对EGFR突变细胞丰度的判断
由于IHC法可以直观地显示EGFR突变型的肿瘤细胞,并进行计数,依据H-E染色也能判断和计数选定区域的所有肿瘤细胞,从而可以计算出EGFR某种突变型肿瘤细胞占总肿瘤细胞的比例,即细胞丰度。在本研究的290例标本中,包括EGFR 19外显子E746_A750缺失突变和L858R突变,EGFR基因突变细胞丰度都在15%~100%,均值约为84%,中位值为100%,只有10.71%(12/112)的病例EGFR基因突变细胞丰度低于50%。
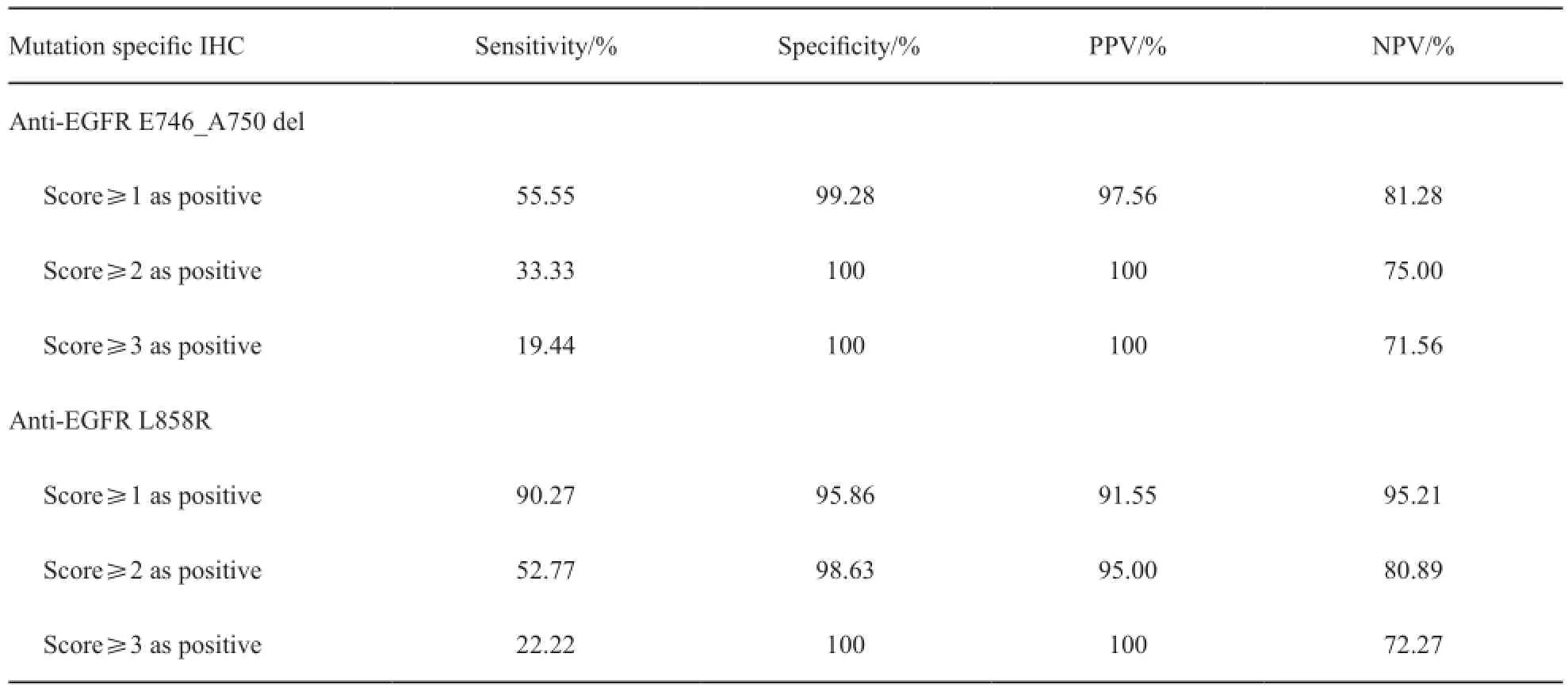
表5 ARMS法与突变特异性IHC法诊断价值的比较Tab. 5 Comparison of diagnostic value between mutation specifc IHC and ARMS
3 讨论
EGFR-TKIs在我国上市时间较长,包括IPASS、OPTIMAL和First-Signal等多项大型多中心临床实验证实,EGFR基因敏感突变的NSCLC患者使用EGFR-TKIs治疗的中位无进展生存期显著优于化疗,可达8~13个月,因此国内外多项指南推荐EGFR-TKIs作为EGFR基因敏感突变的晚期NSCLC的一线治疗,且推荐选用EGFR-TKIs作为一线治疗前,均应检测肿瘤EGFR基因突变状态[10-13]。然而,国内NSCLC病例EGFR基因突变的送检率只有20%,使很多患者丧失靶向治疗的机会[14],而不检测EGFR基因突变就盲目使用靶向药物,又会造成极大的浪费、贻误化疗时机。现阶段EGFR基因突变检测多采用直接测序法和ARMS法等分子水平检测,这类方法检测费用高,仪器设备及场地要求高,难以在基层医院开展,甚至不少三级医院也未开展EGFR基因突变检测,这是我国EGFR基因突变检测比例很低的重要原因。目前在各级医院病理科普遍开展总EGFR基因的IHC检测,野生型和突变型EGFR基因表达都为阳性,其表达水平不能预测EGFR-TKIs的疗效;而用突变特异性抗体,就能用IHC法识别EGFR基因突变的细胞。EGFR基因突变特异性IHC法较分子水平检测方法价格低廉,操作简便、迅速,可在几乎所有病理实验室开展。
近年来,国内外有数篇IHC法检测E746_ A750缺失突变和L858R突变的报道,但他们所报告的检测灵敏度波动范围(24%~100%)大,而且有些研究病例数偏少,有些研究作为金标准的方法欠妥[15-21]。本研究是国内外比较ARMS法和突变特异性IHC法检测EGFR基因突变病例数较多的一项研究,旨在探讨突变特异性IHC法检测EGFR基因突变在我国常规开展的价值,并指导临床医师合理解读IHC法检测结果,包括IHC法的灵敏度、特异度、可靠性及不同突变类型、不同染色强度的解读差异。
Yu等[9]于2009年最早报道了制备EGFR基因突变特异性抗体,并验证这两种抗体诊断EGFR基因突变的的灵敏度为92%,特异度为99%。实际上以后的类似研究基本上都是用此两种抗体。但其研究所依据的“金标准”是第一代直接测序法,现在已经明确,第一代测序法本身灵敏度不够高,特别是对活检小标本存在较多的假阴性,把该文的结论推广到以活检小标本为主的晚期肺癌检测显然欠妥。另外,该研究所使用的E746_A750缺失抗体也存在缺陷,它并不能涵盖所有的EGFR 19外显子缺失突变。根据癌症体细胞突变目录(catalogue of somatic mutations in cancer,COSMIC)的统计,EGFR 19外显子缺失突变包含如E746-A750、E746-T751、L747-T751、L747-A750和L747-S752缺失突变等19种,E746_A750缺失突变约占其中的68%[22]。从原理上就决定了用该抗体检测所有19外显子缺失突变的灵敏度不会太高。比较可信的是Brevet等[22]的报道,如果只对E746_A750缺失的病例,IHC法的灵敏度是100%;而对所有19外显子缺失突变的病例,灵敏度就下降到74.2%,特异度都为98.8%。Jiang等[20]报告按不同染色积分判断突变特异性IHC法检测结果,分值为1+、2+和3+时的阳性率分别为23.08% (24/104)、67.96% (70/103)和100% (48/48),特异度偏低。而王杰等[21]在2015年报道,在40例EGFR突变标本中,IHC法检出突变的灵敏度仅为40%,这两项国内的研究需考虑其实验条件和参数是否还需优化。
本研究以ARMS法为金标准,结果提示以染色评分≥1为阳性时,IHC法检测L858R突变的灵敏度为90.27%,特异度为95.86%;检测19外显子缺失突变的灵敏度为55.55%,特异度为99.28%。本研究比较IHC法和ARMS法,反映EGFR两种常见敏感突变检测一致性的Kappa值为0.682(P<0.01),这个数值主要是被19外显子缺失突变所拉低(Kappa值=0.612,P<0.001),对L858R突变而言,Kappa值高达0.864(P<0.001)。由上述结果可见,突变特异IHC法有较高的特异度,但对19外显子缺失突变的灵敏度则有不足,这与Brevet等[22]的报道比较吻合,而我们的病例数较多。本研究所使用E746_A750缺失抗体并不能涵盖所有的19外显子缺失突变,所以结果显示对19外显子缺失的灵敏度不足。针对这一问题,有研究表明,同时检测总EGFR表达水平可减少特异性突变假阴性结果的产生,提高19外显子缺失突变的灵敏度至82.56%以上[17,20]。随着研究的深入,相信会开发出更完善的抗体,从而提高IHC法的灵敏度。
IHC的染色强度也对突变检测结果的解读有重要影响。判断阳性的标准随IHC评分的升高,诊断的灵敏度就相应下降,特异度相应升高。对19外显子缺失突变而言,评分1+时诊断突变的特异度高达98.5%,这说明IHC的阳性结果基本上就是真阳性,临床可以使用EGFRTKIs;但如果是阴性,假阴性的机会较高,有条件时应该做核酸检测。对L858R而言,评分1+时诊断突变的灵敏度和特异度分别为90.27% 和95.86%,准确性较高,只有约10%的病例为假阴性;评分为2+和3+的标本,特异度分别高达98.63%和100%。由此可见,突变特异性IHC法检测EGFR基因突变具有较好的准确性,尤其当染色评分为强阳性时结果更加可靠。
另外,EGFR基因突变丰度是影响EGFRTKIs疗效的因素之一,Zhou等[23]和Zhao等[24]的研究显示,EGFR突变丰度的高低与EGFRTKIs疗效正相关。由于采用核酸检测方法,上述研究检测的突变丰度实际为肿瘤组织中突变型EGFR拷贝数占总EGFR拷贝数的比例,即EGFR基因突变分子丰度。然而,EGFR突变的细胞丰度,即突变型肿瘤细胞占所有肿瘤细胞的比例,暂不能通过简便的分子检测得到。突变特异性IHC法可直观地显示EGFR突变型的肿瘤细胞并进行计数,较简便地计算出EGFR突变细胞丰度,利于临床医生制定个体化的治疗方案,研究EGFR基因突变的变化规律。
综上所述,突变特异性IHC法具有快速、简便、经济和易于推广等优势,与ARMS法有较高的一致性,是ARMS法等核酸水平检测的有效补充,针对我国核酸检测广泛开展存在困难的现状,值得在基层医院推广;对突变特异性IHC检测结果,临床上要合理解读;突变特异IHC法对EGFR基因突变细胞丰度的观察有独特价值,值得进一步研究。
[参 考 文 献]
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012 [J]. CA Cancer J Clin, 2012, 62(1):10-29.
[2] ABERLE D R,BROWN K. Lung cancer screening with CT [J].Clin Chest Med, 2008, 29(1):1-14.
[3] LYNCH T J, BELL D W, SORDELLA R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib [J]. N Engl J Med, 2004, 350(21):2129-2139.
[4] PAEZ J G, JANNE P A, LEE J C, et al. EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy [J]. Science, 2004, 304(5676):1497-1500.
[5] ONO M, KUWANO M. Molecular mechanisms of epidermal growth factor receptor (EGFR) activation and response to gefitinib and other EGFR-targeting drugs [J]. Clin Cancer Res, 2006, 12(24):7242-7251.
[6] GATELY K, O’FLAHERTY J, CAPPUZZO F, et al. The role of the molecular footprint of EGFR in tailoring treatment decisions in NSCLC [J]. J Clin Pathol, 2012, 65(1):1-7.
[7] CHIRIEAC L R, DACIC S. Targeted therapies in lung cancer [J]. Surg Pathol Clin, 2010, 3(1):71-82.
[8] QIN L, ZHONG W, ZHANG L, et al. Comparison of three methods for detecting epidermal growth factor receptor mutations in plasma DNA samples of Chinese patients with advanced non-small cell lung cancer [J]. Chin Med J (Engl), 2011, 124(6):887-891.
[9] YU J, KANE S, WU J, et al. Mutation-specific antibodies for the detection of EGFR mutations in non-small-cell lung cancer [J]. Clin Cancer Res, 2009, 15(9):3023-3028.
[10] MOK T S, WU Y L, THONGPRASERT S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma [J]. N Engl J Med, 2009, 361(10):947-957.
[11] HAN J Y, PARK K, KIM S W, et al. First-SIGNAL:first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung [J]. J Clin Oncol, 2012, 30(10):1122-1128.
[12] ZHOU C C, WU Y L, CHEN G Y, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cel lung cancer (OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study [J]. Lancet Oncol, 2011, 12(8):735-742.
[13] ROSELL R, CARCERENY E, GERVAIS R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC):a multicentre, openlabel, randomised phase 3 trial [J]. Lancet Oncol, 2012, 13(3):239-246.
[14] XUE C, HU Z, JIANG W, et al. National survey of the medical treatment status for non-small cell lung cancer (NSCLC) in China [J]. Lung Cancer, 2012, 77(2):371-375.
[15] KATO Y, PELED N, WYNES M W, et al. Novel epidermal growth factor receptor mutation-specific antibodies for nonsmall cell lung cancer:immunohistochemistry as a possible screening method for epidermal growth factor mutations [J]. J Thorac Oncol, 2010, 5(10):1551-1558.
[16] WANG X Q, WANG G Q, HAO Y Y, et al. A comparison of ARMS and mutation specific IHC for common activating EGFR mutations analysis in small biopsy and cytology specimens of advanced non-small cell lung cancer [J]. Int J Clin Exp Pathol, 2014, 7(7):4310-4316.
[17] WU S G, CHANG Y L, LIN J W, et al. Including total EGFR staining in scoring improves EGFR mutations detection by mutation-specific antibodies and EGFR TKIs response prediction [J]. PLoS One, 2011, 6(8):e23303.
[18] KOZU Y, TSUTA K, KOHNO T, et al. The usefulness of mutation-specific antibodies in detecting epidermal growth factor receptor mutations and in predicting response to tyrosine kinase inhibitor therapy in lung adenocarcinoma [J]. Lung Cancer, 2011, 73(1):45-50.
[19] H O F M A N P , I L I E M , H O F M A N V , e t a l . Immunohistochemistry to identify EGFR mutations or ALK rearrangements in patients with lung adenocarcinoma [J]. Ann Oncol, 2012, 23(7):1738-1743.
[20] JIANG G Y, FAN C F, ZHANG X P, et al. Ascertaining an appropriate diagnostic algorithm using EGFR mutationspecific antibodies to detect EGFR status in non-small-cell lung cancer [J]. PLoS One, 2013, 8(3):e59183.
[21] 王 杰, 刘 畅, 钟殿胜, 等. 免疫组化法检测NSCLC患者EGFR突变[J]. 中国肺癌杂志, 2015, 18(4):212-218.
[22] BREVET M, ARCILLA M, LADANYI M. Assessment of EGFR mutation status in lung adenocarcinoma by immunohistochemistry using antibodies specific to the two major forms of mutant EGFR [J]. J Mol Diagn, 2010, 12(2):169-176.
[23] ZHOU Q, ZHANG X C, CHEN Z H, et al. Relative abundance of EGFR mutations predicts benefit from gefitinib treatment for advanced non-small-cell lung cancer [J]. J Clin Oncol, 2011, 29(24):3316-3321.
[24] ZHAO Z R, WANG J F, LONG H, et al. Mutation abundance affects the efficacy of EGFR tyrosine kinase inhibitor readministration in non-small-cell lung cancer with acquired resistance [J]. Med Oncol, 2014, 31(1):810.
Detection of EGFR gene mutations with mutation-specifc immunohistochemistry in non-small cell lung cancer
ZHANG Longfu1,YAO Jiamei2,JIANG Dongxian2,HONG Qunying1,LI Chun1,ZHAO Jingya1,ZENG Haiying2,HOU Yingyong2,ZHANG Xin1(1.Department of Pulmonary Medicine,Zhongshan Hospital,Fudan University,Shanghai 200032,China;2.Department of Pathology,Zhongshan Hospital,Fudan University,Shanghai 200032,China)
[Key words]Non-small cell lung cancer;Epidermal growth factor receptor;Mutations;Immunohistochemistry
[Abstract]Background and purpose:Epidermal growth factor receptor (EGFR) gene mutation is the most important predictive factor for determining the effectiveness of EGFR tyrosine kinase inhibitors (TKIs) for non-small cell lung cancer (NSCLC). This study aimed to determine the clinical application value of mutation-specific immunohistochemistry for EGFR mutation detection in NSCLC. Methods:Mutation-specific immunohistochemistry and amplification refractory mutation system (ARMS) were used simultaneously to detect EGFR gene mutation status in 290 lung cancer specimens. The sensitivity,specificity,positive predictive value (PPV) and negative predictive value (NPV) of mutation-specific immunohistochemistry for detecting EGFR gene mutations were evaluated. The consistency was analyzed between mutation-specific immunohistochemistry results and ARMS results. Results:With ARMS testing as the gold standard,when a cutoff value of score 1+ was used as positive by immunohistochemistry,the sensitivity of mutation-specific immunohistochemistry for EGFR gene mutation was 72.92%,specificity 95.20%,positive predictivevalue 93.75% and negative predictive value 78.08%. The accuracy of immunohistochemistry was obviously different when various EGFR gene mutations were detected. The sensitivity of immunohistochemistry for exon 19 deletion was only 55.55%,but specificity was above 99%. When immunohistochemistry score was 1+,the sensitivity for L858R mutation was 90.27%,whereas specificity was 95.86%. When immunohistochemistry score was 2+ or 3+,the specificity for L858R mutation was 98.63%-100%. The results of mutation-specific immunohistochemistry were finely correlated with mutation status determined by ARMS assay (P<0.001,Kappa value:0.612-0.864). Mutation-specific immunohistochemistry can directly determine EGFR gene mutation abundance at the cellular level. Conclusion:Mutation-specific immunohistochemistry could be an effective supplemental method to EGFR molecular tests.
DOI:10.3969/j.issn.1007-3969.2016.04.007
中图分类号:R734.2
文献标志码:A
文章编号:1007-3639(2016)04-0326-07
通信作者:张 新 E-mail:zhang.xin@zs-hospital.sh.cn
收稿日期:(2015-12-15修回日期:2016-02-20)

