肿瘤并发静脉血栓形成196例临床分析
申丽华,张忠伟,朱 彪复旦大学附属肿瘤医院麻醉科重症监护室,复旦大学上海医学院肿瘤学系,上海200032
肿瘤并发静脉血栓形成196例临床分析
申丽华,张忠伟,朱 彪
复旦大学附属肿瘤医院麻醉科重症监护室,复旦大学上海医学院肿瘤学系,上海200032
[摘要]背景与目的:静脉血栓形成(venous thromboembolism,VTE)是恶性肿瘤患者的第二常见死亡原因。通过了解复旦大学附属肿瘤医院5年间收治的患者VTE的发病情况,分析VTE的相关特点,以提高肿瘤合并VTE的诊断和防治意识,改善患者预后。方法:对复旦大学附属肿瘤医院2009年7月—2014年6月收治的196例肿瘤并发VTE的患者的临床资料进行回顾性分析。分析肿瘤并发VTE的临床特点及发病情况,了解相关因素对VTE发病的影响,了解VTE首发情况。结果:复旦大学附属肿瘤医院5年间共收治肿瘤患者207 514例,其中VTE患者196例,肿瘤并发VTE发生率为0.94‰。腺癌在妇科肿瘤(56.5%)、胃肠道肿瘤(91.7%)、肺癌(71.4%)和胰腺癌(80%)中所占比例较高。单变量Logistic回归分析显示,腺癌为肿瘤患者并发肺栓塞(pulmonary embolism,PE)的高危险因素(OR=0.36,95%CI:0.146~0.885,P=0.026)。化疗大于2次者明显比化疗小于等于2次者VTE的发生率更高(X2=10.976,P=0.001)。手术组VTE发生率高于非手术组。妇科肿瘤中有大量腹水者的非手术患者并发VTE者(>2 000 mL)更多(34.1% vs 10.7%,P=0.015)。术后和放化疗期间78%~88%的患者因出现深静脉血栓(deep vein thrombosis,DVT)症状发现VTE,而术前检查期间主要是在下肢静脉加压超声(compression venous ultrasonography,CUS)检查发现(59.1%)。复旦大学附属肿瘤医院术后进行物理性预防血栓措施者为15例(13.9%)。结论:复旦大学附属肿瘤医院的肿瘤相关性VTE发生率较其他流行病学调查发生率低。肿瘤患者术后并发VTE的风险明显高于非手术者。腺癌更易并发PE。对于临床无VTE症状的肿瘤患者和大量腹水的妇科肿瘤患者应积极进行VTE的相关检查,术后应更积极采取物理抗栓措施。
[关键词]静脉血栓形成;肺栓塞;深静脉血栓;肿瘤;危险因素;预防
Correspondence to:ZHU BiaoE-mail:zhubiaozs@sohu.com
静脉血栓形成(venous thromboembolism,VTE)是一种血栓栓塞性疾病,包括深静脉血栓(deep vein thrombosis,DVT)和肺栓塞(pulmonary embolism,PE)。近年来,VTE已成为恶性肿瘤患者的第二常见死亡原因[1-2]。肿瘤患者比非肿瘤患者具有更高的VTE风险,VTE对肿瘤患者的生存具有一定的不利影响。临床上防治VTE是恶性肿瘤治疗的一个重要组成部分。有研究表明,纠正恶性肿瘤患者的高凝状态,及时有效治疗血栓栓塞可以改善预后[3]。为了提高对恶性肿瘤血栓形成风险的认识,探讨肿瘤血栓防治措施,本研究回顾性分析了近5年在复旦大学附属肿瘤医院收治的196例肿瘤合并静脉血栓病例的临床特征,以便对肿瘤相关性VTE的防治工作起到一定的指导作用。
1 资料和方法
1.1研究对象
回顾性分析复旦大学附属肿瘤医院2009年7月—2014年6月收治的207 514例肿瘤患者,发生VTE的共有196例,包括入院后发生和入院时既已存在的,依据临床表现及相关辅助检查确诊。DVT的诊断依据为下肢疼痛或酸痛,行走后加重,伴肿胀,双侧下肢周径相差大于1 cm,下肢静脉加压超声(compression venous ultrasonography,CUS)提示下肢深静脉(胫前静脉、胫后静脉、小腿肌间静脉、腓静脉、腘静脉、股浅静脉、股深静脉、髂内静脉和髂外静脉)内有血栓形成,经积极抗凝溶栓治疗好转。PE诊断依据:有胸闷、晕厥等症状,螺旋CT肺动脉造影(CT pulmonary angiography,CTPA)提示有充盈缺损,经积极抗凝溶栓治疗好转。筛选病例时剔除2例入院前由外伤骨折导致下肢DVT的病例(有当地医院诊断证明,并已进行积极的抗栓治疗)。
1.2资料采集
纳入患者登记姓名、性别、年龄、身高和体质量,分类记录既往病史(尤其注意有无DVT病史及脑梗病史)、肿瘤部位(原发肿瘤的位置,妇科肿瘤包括卵巢癌、宫颈癌、子宫内膜癌、外阴癌和子宫肌瘤,胃肠道肿瘤包括胃癌和各段肠癌,泌尿系统肿瘤包括肾癌、膀胱癌、肾上腺肿瘤、阴茎癌和睾丸癌,肝胆系统肿瘤包括肝癌、胆管癌和胆囊癌)、相关组织病理类型、侵犯情况、肿瘤转移情况、患者血型、DVT发生部位及相关实验室检查。随访生存情况时间截至2015年1月30日。PE临床预测评分Wells评分依据2014年欧洲心脏病学学会急性PE诊断和管理指南原始版Wells评分标准进行评定[4]。
1.3统计学处理
2 结果
2.1一般资料
2009年7月—2014年6月共收治207 514例患者,其中VTE患者为196例,VTE总体发生率为0.94‰。手术患者为52 010例,并发VTE者108例,手术组并发VTE发生率为2.08‰;非手术患者155 504例,并发VTE为88例,非手术组并发VTE发生率为0.57‰。一般资料见表1。
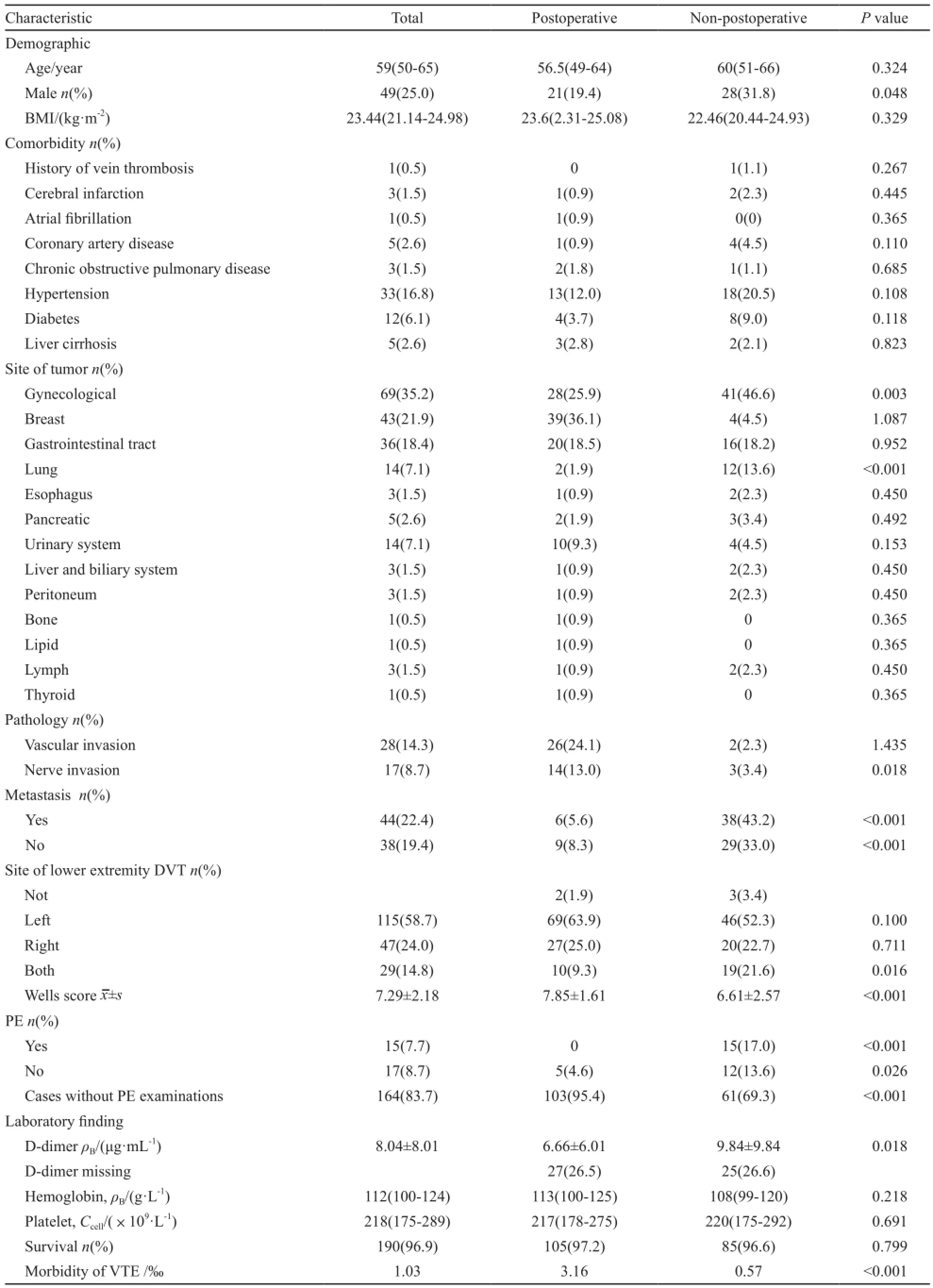
表1 肿瘤并发VTE患者的一般资料情况Tab. 1 Baseline characteristics of tumor-related VTE
在并发VTE的肿瘤构成比中,妇科肿瘤最多,其次为乳腺癌、胃肠道肿瘤,再次为泌尿系肿瘤、肺癌,而胰腺癌、肝胆肿瘤、腹膜肿瘤、淋巴瘤、食道癌、甲状腺癌、骨肉瘤和脂肪肉瘤这8类肿瘤最少,差异有统计学意义(P<0.05)。本研究患者肿瘤相关DVT均发生于下肢,左下肢发生率(58.7%)明显高于右下肢(24.0%),差异有统计学意义(X2=48.648,P<0.001)。手术组与非手术组差异均有统计学意义(P均<0.001)。非手术患者的双侧DVT明显高于手术患者(X2=5.849,P=0.016)。血型分布显示,A型最多,AB型最少。因缺少总收治患者的血型资料,未做整体对应肿瘤群体血型分布统计的比较。首发VTE症状而发现肿瘤的患者共6例(3%)。
手术组与非手术组相比,手术组女性患者更多,妇科肿瘤及肺癌偏少,A型、B型和O型患者更多,Wells评分、D-二聚体水平及VTE发生率更高。非手术组肿瘤远处转移率(X2=39.43,P<0.001)及淋巴转移率(X2=18.08,P<0.001)更高,差异均有统计学意义。
2.2组织病理类型与VTE发生的相关性
在196例肿瘤并发VTE的病例中,腺癌最多(49.5%),其次为浸润导管癌(19.4%),其他依次为鳞癌(10.2%)、肉瘤(3.6%)、尿路上皮癌(2.6%)、淋巴瘤(1.5%)和黏液腺癌(1%),最少者为神经鞘瘤、神经内分泌肿瘤、髓样细胞癌、胆管细胞癌、小细胞癌、精原细胞癌、透明细胞癌和印戒细胞癌(均为0.5%)。腺癌在妇科肿瘤(56.5%)、胃肠道肿瘤(91.7%)、肺癌(71.4%)和胰腺癌(80%)中比例最高,泌尿系统肿瘤则是腺癌、尿路上皮癌(均为35.7%)居多,乳腺癌最多见的是浸润性导管癌(83.7%)。
肿瘤并发PE患者共15例,其中妇科10例,乳腺癌1例,胃肠道肿瘤1例,肺癌1例,胰腺癌1例,泌尿系肿瘤1例,其原发肿瘤位置分布差异均无统计学意义(P均>0.05)。在并发PE的15例患者中,腺癌多达12例(X2=10.80,P=0.001),浸润性导管癌、鳞癌和不明类型各1例。以肿瘤患者是否并发PE作为因变量,对性别、年龄、肿瘤部位、并存疾病、转移情况、DVT发生部位和实验室检查等诸多因素进行多因素Logistic回归分析显示,腺癌为肿瘤患者并发PE的高危险因素(OR=0.36,95%CI:0.146~0.885,P=0.026),其他因素均无相关性。
2.3化疗次数与并发VTE的相关性
在196例肿瘤并发VTE的病例中,在化疗期间发生的VTE共41例,化疗大于2次者的发生率(28例,68.3%)明显比化疗小于等于2次者(13例,31.7%)更高,差异有统计学意义(X2=10.976,P=0.001)。
2.4手术相关VTE发病情况
2009年7月—2014年6月复旦大学附属肿瘤医院收治的手术患者各个部位肿瘤术后并发VTE发生率见表2。VTE发病率比较结果显示,妇科肿瘤、胰腺肿瘤、泌尿系统肿瘤和肝胆肿瘤并发VTE高于乳腺肿瘤、胃肠道肿瘤、肺部肿瘤、食道肿瘤和甲状腺肿瘤,差异有统计学意义(P<0.05)。妇科肿瘤并发VTE的发生率明显高于手术后并发VTE的总体发病率,差异有统计学意义(X2=31.368,P<0.001)。

表2 手术相关VTE发病率Tab. 2 Incidence of surgery-related VTE
妇科肿瘤、乳腺肿瘤、胃肠道肿瘤和泌尿系统肿瘤术后并发VTE的时间分别为5(4~9.75) d、3(2~6) d、5.5(4~16) d和8(6~12) d;不同肿瘤术后发生VTE时间差异无统计学意义(P均>0.05)。术后并发VTE的平均时间为(6.25± 4.67) d,发生时间跨度为1~22 d。术后进行物理性预防血栓措施者为15例(13.9%)。
2.5妇科肿瘤患者VTE发病情况
2009年7月—2014年6月复旦大学附属肿瘤医院收治妇科肿瘤患者共21 705例,手术患者3 375例,非手术患者18 330例。对妇科肿瘤的手术患者和非手术患者并发VTE情况分析见表3。非手术组与手术组相比,年龄更大,大量腹水(>2 000 mL)者更多,双侧DVT更多,左侧DVT偏少,发病率偏低。
2.6VTE患者首发情况
本研究VTE患者共196例,包括20例入院前既已发现VTE的患者和176例在院诊治期间发生VTE的患者。首发情况包括出现DVT症状(下肢疼痛或酸痛,行走后加重,伴肿胀,双侧下肢周径差异相差大于1 cm),D-二聚体高于正常值而发现DVT或PE症状,下肢CUS发现DVT或PE症状(胸闷、晕厥、咯血和呼吸困难等)。

表3 妇科肿瘤患者并发VTE情况分析Tab. 3 Analysis of gynecological tumor-related VTE
无VTE症状在术前检查中发现的患者列为术前检查发现组(n=22),该组在进行下肢CUS检查(n=13,59.1%)时发现DVT的最多,因D-二聚体升高(n=2,9%)而发现DVT最少(X2=12.239,P<0.001)。手术后发生VTE的患者列为手术相关组(n=108),该组因出现DVT症状而被检查出DVT者(n=95,88%)最多,因D-二聚体升高(n=7,6.5%)和进行下肢CUS检查而发现者(n=6,5.6%)明显少于DVT症状者(X2=1.439,P<0.001;X2=1.47,P<0.001)。在化疗进行中或化疗间期发生的患者列为化疗期间发生组(n=41),该组因出现DVT症状而被检查出DVT者(n=32,78%)最多,因PE症状而发现者(n=1,2.4%)最少(X2=48.733,P<0.001)。在放疗中或放疗后化疗前发生VTE的患者列为放疗期间发生组(n=5),该组因出现DVT症状而发现者共4例(80%),CUS发现者只有1例(20%),但差异无统计学意义(X2=3.6,P=0.058)。术前176例肿瘤患者并发VTE首发情况见图1。

图1 176例肿瘤并发VTE首发情况分布图Fig. 1 Distribution of frst discovery of VTE in 176 patients with tumor-related VTE
3 讨论
肿瘤患者的VTE发病风险是一般人群的4倍[5]。VTE是导致肿瘤患者死亡的第二原因,约9%的肿瘤患者死亡与VTE有关。其中,进展期的脑癌、肺癌、子宫癌、膀胱癌、胰腺癌、胃癌和肾癌1年内并发VTE的发生率最高。肿瘤转移的患者较未转移的患者,VTE发病风险增加3~14倍[6]。但目前国际上对于肿瘤血栓的防治,尤其是在预防血栓形成、改善高凝状态方面尚未达成一致,而国内对恶性肿瘤VTE的重视度不够,尚缺少对肿瘤相关VTE发病情况的相关报道。
本研究对象为复旦大学附属肿瘤医院收治的患者,受肿瘤学科限制,无脑肿瘤、血液肿瘤患者(淋巴瘤除外),骨肿瘤患者收治例数偏少(因骨肿瘤学科在2012年开始收治患者)。复旦大学附属肿瘤医院肿瘤相关VTE发病率为0.94‰,远低于其他相关流行病学调查结果中的肿瘤相关VTE发病率。其他相关研究结果显示,肿瘤患者2年的VTE累积发病率在0.8%~8%[6],另有研究提示,首次肿瘤相关VTE事件发生率可达20%~30%[7]。
肿瘤本身即为发生VTE的重要危险因素。此外,还有多种危险因素参与其中,化疗相关的Khorana风险预测模型中将BMI≥35 kg/m2作为肿瘤相关VTE发生的风险预测因素[8],在本研究中,肿瘤并发VTE患者的BMI尚未达到此水平。在本研究中,VTE发病率比较结果显示,妇科肿瘤、胰腺肿瘤、泌尿系统肿瘤和肝胆肿瘤高于乳腺肿瘤、胃肠道肿瘤、肺部肿瘤、食道肿瘤和甲状腺肿瘤。Horsted等[9]进行的Meta分析结果显示,肿瘤相关VTE的发生率按肿瘤部位依次为胰腺癌、脑癌、肺癌、血液肿瘤、结直肠肿瘤、骨肿瘤、前列腺癌和乳腺癌。其他大型多中心研究结果类似[10-11],血液系统肿瘤、肺癌、消化道肿瘤,脑癌和妇科肿瘤患者发生VTE的风险明显增加;恶性程度高的患者发生VTE的风险增加,如胰腺癌,而生长缓慢的肿瘤如乳腺癌和前列腺癌发生VTE的风险较低。复旦大学附属肿瘤医院的不同部位肿瘤的VTE发病率统计结果与众多研究不同之处在于,肺癌VTE发病率偏低,乳腺癌VTE发病率偏高。究其原因可能与术后是否积极实施抗栓措施有关。肿瘤患者进行外科手术、留置中心静脉导管均可引起血管内皮损伤,这些因素也协同肿瘤本身因素促进VTE的发生,尤其在腹部及盆腔的手术[12]。术前禁食导泻血液浓缩,术中血流缓慢、麻醉药激活凝血系统及肌松药镇静药物的使用均可促进血栓形成[13],术后卧床补液不足等诸多因素均可导致术后DVT的发生,如合并高血压、高血脂、糖尿病和冠心病,发病风险会提高[14]。本研究对比手术和非手术的肿瘤并发VTE的患者,手术相关VTE发病率明显高于非手术相关VTE。相应地反映VTE的高危因素D-二聚体水平,手术组也明显高于非手术组。对比用以评估PE发病风险的Wells评分,手术组也明显高于非手术组,说明肿瘤患者术后并发PE的风险明显高于非手术的肿瘤患者。但复旦大学附属肿瘤医院的临床医师在患者发生下肢DVT后并未进一步进行相关PE的检查,有83.7%的VTE患者无相关PE的检查(CTPA),尤其在术后未检查率更高(95.4%)。PE 和DVT是VTE病程中的两个不同阶段,确诊DVT后应积极完善PE相关检查以早期排除PE,早期预防突发致死性的PE,以提高肿瘤相关VTE患者的生存率。
有研究结果显示,肿瘤的组织病理类型与VTE的发病明显相关,肺癌中的腺癌最易发生VTE[15]。在本研究的肺癌病例中也是以腺癌发生率最高(71.4%),此外腺癌在妇科肿瘤、胃肠道肿瘤和胰腺癌中所占比例也是最高的。在肿瘤并发PE中,腺癌所占比例最高(80%),单变量Logistic回归结果显示,在复旦大学附属肿瘤医院的肿瘤相关PE中,腺癌是高危因素。此结果与Jonas等[16]的研究结果类似。腺癌易并发VTE的原因可能是腺癌细胞产生的组织蛋白酶激活凝血系统,并分泌黏蛋白,引起机体变态反应,使血管内膜及周围组织发生退行性病变、纤维素样变性和上皮细胞脱落,造成局部血栓形成。
化疗是导致VTE的重要危险因素,关于化疗相关的Khorana风险预测模型己建立[8,17]。本研究结果显示,化疗大于2次者明显比化疗小于等于2次者的VTE发生率更高,即化疗次数增加,VTE发生风险也随之增加。化疗药物增加的VTE风险包括血管壁急性损伤、内皮非急性损伤、自然凝血抑制物的减少(如蛋白S、蛋白C和抗凝血酶Ⅲ)和血小板活化四种机制[18]。
妇科肿瘤是复旦大学附属肿瘤医院VTE患者中发生率最高的肿瘤类型(8.3‰)。通过对比手术患者及非手术患者发现,非手术患者中出现大量腹水(大于2 000 mL)的患者更多。对于不能进行手术的妇科肿瘤患者,我们更应该积极进行VTE相关检查以便早期发现VTE,早期干预并治疗。
本研究对复旦大学附属肿瘤医院并发VTE的肿瘤患者首次发现VTE的原因进行分析,术后和放化疗期间发现VTE,大部分是因为出现DVT症状(78%~88%)。而术前检查期间发现VTE主要是依靠下肢CUS检查(59.1%),出现DVT症状者仅为31.8%。肿瘤患者因为其他原因进行肺部增强扫描,如对肿瘤进行分期评价或治疗后疗效评价时可能会发现,称为偶然发现的VTE。因为许多肿瘤患者其实是有症状的(如呼吸困难和疲劳),只是未被临床医师识别出来,或仅认为是肿瘤的症状所致。因此,不能仅仅依靠VTE症状来识别,因肿瘤患者是VTE的高危人群,对于无症状者也应积极进行VTE相关检查,早期发现并干预VTE,术后更需要积极抗栓以防止术后VTE的发生。在本研究中,复旦大学附属肿瘤医院术后采取物理性抗栓措施的仅为13.9%,各手术科室应引起积极重视。
还需注意的是,VTE是某些肿瘤患者的最早临床表现[19]。10%的VTE患者在确诊1年内被诊断为肿瘤。本研究因VTE症状而诊断为肿瘤的患者为6例(3%),提示临床医师一旦发现不明原因的VTE要积极进行肿瘤性疾病的排查。
本研究对复旦大学附属肿瘤医院肿瘤相关VTE病例进行深入分析后发现,肿瘤相关性VTE发生率较其他流行病学调查发生率低。肺癌相关VTE发病率偏低,乳腺癌相关VTE发病率偏高。究其原因可能与术后抗栓措施是否积极实施有关。肿瘤患者术后并发VTE的风险明显高于非手术患者。腺癌更易并发PE。对于无VTE症状的肿瘤患者和大量腹水的妇科肿瘤患者,应积极进行VTE的相关检查。术后应积极采取物理抗栓措施。在发现DVT后应进一步明确相关PE的检查。关爱肿瘤患者,重视VTE并发症,提高肿瘤患者的生存率和生存质量,是每个临床肿瘤医师的责任。本研究未进行复旦大学附属肿瘤医院同期收治病例的大样本的资料采集,对同期肿瘤患者的整体特征与并发VTE者未能进行大样本对比,有望在后续工作中改进。
[参 考 文 献]
[1] JOHNSON M J, SHYARD L, MARAVEYAS A, et al. Diagnosis and management of people with venous thromboembolism and advanced cancer:how do doctors decide? A qualitative study [J]. BMC Med Inform Decis Mak, 2012, 12(1):75-88.
[2] BEN DHAOU B, DERBALI F, BOUSSAMA F, et al. Thrombosis and cancer:retrospective study of 17 cases [J]. Tunis Med, 2012, 90(7):548-551.
[3] KUDERER N M, ORTEL T L, FRANCIS C W. Impact of venous thromboembolism and anticoagulation on cancer and cancer survival [J]. J Clin Oncol, 2009, 27(29):4902-4911.
[4] KONSTANTINIDES S V, TORBICKI A, AGNELLI G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism [J]. Eur Heart J, 2014, 35(43):3033-3069.
[5] HEIT J A, SILVERSTEIN M D, MOHR D N, et al. Risk factors for deep vein thrombosis and pulmonary embolism:a population based case-control study [J]. Arch Intern Med, 2000, 160(6):809-815.
[6] CHEW H K, WUN T, HARVEY D, et al. Incidence of venous thromboembolism and its effect on survival among patients with common cancers[J]. Arch Intern Med, 2006, 166(4):458-464.
[7] TIMP J F, BRAEKKAN S K, VERSTEEG H H, et al. Epidemiology of cancer-associated venous thrombosis [J]. Blood, 2013, 122(10):1712-1723.
[8] SHEA-BUDGELL M A, WU C M, EASAW J C. Evidencebased guidance on venous thromboembolism in patients with solid tumours [J]. Curr Oncol, 2014, 21(3):e504-e514.
[9] HORSTED F, WEST J, GRAINGE M J. Risk of venous thromboembolism in patients with cancer:a systematic review and meta-analysis [J]. PLoS Med, 2012, 9(7):e1001275.
[10] CRONIN-FENTON D P, SONDERGAARD F, PEDERSEN L A, et al. Hospitalisation for venous thromboembolism in cancer patients and the general population:a population-based cohort study in Denmark, 1997-2006 [J]. Br J Cancer, 2010, 103(7):947-953.
[11] WALKER A J, CARD T R, WEST J, et al. Incidence of venous thromboembolism in patients with cancer - a cohort study using linked United Kingdom databases [J]. Eur J Cancer, 2013, 49(6):1404-1413.
[12] ANTIEL R M, HASHIM Y, MOIR C R, et al. Intra-abdominal venous thrombosis after colectomy in pediatric patients with chronic ulcerative colitis:incidence, treatment, and outcomes [J]. J Pediatr Surg, 2014, 49(4):614-617.
[13] 高 莉, 陈 涛, 郭 稳, 等. 腹部外科手术患者并发下肢深静脉血栓形成的临床分析 [J]. 现代预防医学, 2011, 38(19):4085-4086.
[14] 吕迎秋. 普外科大手术后深静脉血栓的预防措施 [J].中国保健营养, 2013, 23(2):629-630.
[15] LEE J W, CHA S I, JUNG C Y, et al. Clinical course of pulmonary embolism in lung cancer patients [J]. Respiration, 2009, 78(1):42-48.
[16] JONAS A, BORIS D, CIHAN A Y, et al. Tumor grade is associated with venous thromboembolism in patients with canter:results from the Vienna Cancer and Thrombosis Study [J]. J Clin Oncol, 2012, 30(31):3870-3875.
[17] KHORANA A A, KUDERER N M, CULAKOVA E, et al. Development and validation of a predictive model for chemotherapy-associated thrombosis [J]. Blood, 2008, 15:4902-4907.
[18] FALANGA A, ZACHARSKI L. Deep vein thrombosis in cancer:the scale of the problem and approaches to management [J]. Ann Oncol, 2005, 16(5):696-701.
[19] RIESS H. Thrombosis reveals a neoplasm.”This cancer is especially aggressive” (interview by Dr. Beate Schumacher)[J]. MMW Fortschr Med, 2012, 154(11):33.
Clinical analysis of tumor related venous thromboembolism:196 cases
SHEN Lihua,ZHANG Zhongwei,ZHU Biao (Department of Anaesthesia,Critical Care and Pain Medicine,Fudan University Shanghai Cancer Center;Department of Oncology,Shanghai Medical College,Fudan University,Shanghai 200032,China)
[Key words]Venous thromboembolism;Pulmonary embolism;Deep vein thrombosis;Tumor;Risk factors;Prevention
[Abstract]Background and purpose:Venous thromboembolism (VTE) is the second common cause of death in cancer patients. The clinical data from VTE patients in Fudan University Shanghai Cancer Center were collected and analyzed during the last 5 years in this study to increase awareness for diagnosis and prevention of VTE in cancer patients and to improve their prognosis. Methods:The clinical data from 196 VTE patients among the 207 514 cancer patients were analyzed during the period from Jul. 2009 to Jun. 2014,and the clinical characteristics of cancer patients with VTE were investigated to understand the influence of risk factors and symptoms in VTE patients. Results:The incidence of VTE in cancer patients was 0.94‰. Adenocarcinoma was the most common type of gynecological cancer (56.5%),gastrointestinal tract cancer (91.7%),lung cancer (71.4) and pancreatic cancer (80%). Logistic regression analysis showed adenocarcinoma was the high risk factor in cancer patients with pulmonary embolism (PE,OR=0.36,95%CI:0.146-0.885,P=0.026). Compared with patients who received 2 cycles of chemotherapy,patients who received 3 cycles of chemotherapy had higher incidence of VTE (X2=10.976,P=0.001). The incidence of VTE in operative group was higher than that in non-operative group. The patients bearing gynecological cancer with ascites (>2 000 mL)had higher VTE incidence compared with the patients with less ascites. Besides,78%-88% of the VTE patients were diagnosed because of the deep vein thrombosis (DVT) symptom during postoperative recovery and chemoradiotherapy.However,59.1% of the preoperative VTE patients were diagnosed by the compression venous ultrasonography (CUS)in lower extremity. Physical therapy was adopted to prevent thrombus in 15 postoperative patients. Conclusion:The incidence of cancer-associated VTE in Fudan University Shanghai Cancer Center is lower compared with those reported in other epidemiologic investigations. The VTE incidence in postoperative patients is higher than that in preoperative patients. The patients with adenocarcinoma were inclined to be accompanied by PE. The examination should be taken in asymptomatic cancer patients and gynecological cancer patients with massive ascites. The physical measurement should be adopted actively to prevent thrombus in our hospital.
DOI:10.3969/j.issn.1007-3969.2016.04.009
中图分类号:R730.6
文献标志码:A
文章编号:1007-3639(2016)04-0338-08
通信作者:朱彪 E-mail:zhubiaozs@sohu.com
收稿日期:(2015-11-24修回日期:2016-01-24)

