IGF-1R基因通过调控BMP2表达影响SMMC7721细胞的增殖和凋亡
傅敬忠,黄龙璋,于 强,储节胜,匡美波,徐冠军.江西省九江市第三人民医院肿瘤科,江西 九江 33000;.江西省修水县第一人民医院肿瘤科,江西 修水 33400
IGF-1R基因通过调控BMP2表达影响SMMC7721细胞的增殖和凋亡
傅敬忠1,黄龙璋1,于强1,储节胜1,匡美波2,徐冠军1
1.江西省九江市第三人民医院肿瘤科,江西 九江 332000;2.江西省修水县第一人民医院肿瘤科,江西 修水 332400
[摘要]背景与目的:胰岛素生长因子-1(insulin-like growth factor-1,IGF-1)是一种重要的肽类激素,通过与其受体(IGF-1 receptor,IGF-1R)和胰岛素受体(insulin receptor,IR)结合并激活下游信号通路发挥生物学作用,骨形态发生蛋白(bone morphogenetic proteins,BMPs)因可促进多种肿瘤细胞的增殖和侵袭而日益成为肿瘤分子研究领域的热点。该研究通过RNA干扰(RNAi)技术沉默IGF-1R基因,探讨其对肝癌SMMC7721细胞中BMP2表达的影响以及对细胞增殖和凋亡的影响。方法:构建靶向IGF-1R基因的RNAi真核表达质粒,转染至肝癌SMMC7721细胞,用反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)和蛋白[质]印迹法(Western blot)检测IGF-1R和BMP2基因表达抑制效应,MTT实验检测IGF-1R基因沉默后细胞生长曲线,流式细胞术检测IGF-1R基因沉默后细胞凋亡情况。结果:成功构建靶向IGF-1R基因的真核表达质粒,IGF-1R-siRNA-1和IGF-1R-siRNA-2转染至肝癌SMMC7721细胞后,对IGF-1R基因的mRNA抑制效率分别达到68.9%和80.7%(P<0.05),对BMP2基因的mRNA抑制效率分别达到79.5%和83.3%(P<0.05),对IGF-1R蛋白表达抑制率分别为46.1%和62.1%,对BMP2蛋白表达抑制率分别为42.5%和60.9%(P<0.05)。根据MTT实验结果,绘制的生长曲线显示,IGF-1R基因沉默后SMMC7721细胞增殖速率明显低于对照组(P<0.05),细胞凋亡比例高于对照组(P<0.05)。结论:IGF-1R基因沉默表达能介导BMP2基因不同水平下调表达,抑制SMMC7721细胞增殖,并促进细胞发生凋亡。
[关键词]IGF-1R基因;BMP2基因;肝癌SMMC7721细胞;细胞增殖;细胞 凋亡
Correspondence to:XU GuanjunE-mail:xgjxiu80@163.com
胰岛素生长因子-1 (insulin-like growth factor-1,IGF-1)是一种重要的肽类激素,存在于人体乳腺、结肠和前列腺等多种组织中,与胚胎组织分化、器官发育、物质代谢等密切相关,并且在正常生理活动中发挥着极其重要的作用[1-2]。在许多恶性肿瘤中发现IGF-1信号相关配体、受体和调节性结合蛋白存在不同表达水平的改变,从而激活IGF信号通路,体内外实验也证实IGF-1信号通路在恶性肿瘤的起始和发展过程中有着重要的作用[3-4]。
IGF-1主要通过与其受体(IGF-1 receptor,IGF-1R)和胰岛素受体(insulin receptor,IR)结合并激活IGF-1R和IR下游信号通路发挥生物学作用。但是现在多数靶向IGF-1信号通路治疗策略都是通过特异性抑制IGF-1R并同时避开对IR信号转导的抑制,那是因为IR在正常的生理代谢过程中有着重要作用,同时抑制IR信号转导将会对机体产生不良反应[5]。在正常组织中,机体通过多种机制对IGF-1R信号通路活化进行严格调控,其中包括配体表达转录抑制、配体与结合蛋白(IGFBPs)和非信号受体(IGF-2R)结合。但是在人类恶性肿瘤中,这些调控系统出现紊乱,从而导致IGF-1R信号通路过度活化[3]。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)因可促进多种肿瘤细胞的增殖和侵袭而日益成为肿瘤分子研究领域的热点。有研究表明,IGF-1与BMPs两者在细胞增殖、分化及组织修复等方面起重要作用[6-7]。我们前期研究已证实IGF-1能促进肝癌SMMC7721细胞增殖,可增强肝癌细胞中BMP2基因及其蛋白的表达[8],但IGF-1R与BMP2之间的作用机制目前尚未明确。因此本试验将设计并构建靶向IGF-1R基因的siRNA表达质粒,转染至SMMC7721细胞后检测相关基因和蛋白的表达,并分析其对细胞增殖和凋亡的影响,初步研究IGF-1R与BMP2之间的作用机制。
1 材料和方法
1.1材料与试剂
肝癌细胞株SMMC7721购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。细胞培养瓶、冻存管和6孔板均由美国Corning公司生产,新生牛血清购自浙江天杭生物科技公司,胰酶和1640培养基购自美国Gibco公司,siRNA表达载体由上海吉凯公司合成构建,LipofectamineTM2000转染试剂购自Invitrogen公司,RNA提取试剂盒、cDNA合成试剂盒、PCR mix和ECL化学发光试剂盒均购自北京康为世纪生物科技有限公司,MTT购自美国Sigma公司,兔抗人IGF-1R和兔抗人BMP2单克隆抗体购自美国Anbo公司,羊抗兔IgG抗体购自北京中杉金桥公司,细胞凋亡检测试剂盒购自美国BD公司。
1.2实验方法
1.2.1设计靶向IGF-1R基因的siRNA并构建表达质粒
从NCBI数据库中查询人类IGF-1R基因的GENBANK序列号,并应用生物信息学软件siDRM(http://sidrm.biolead.org/index.php)对靶向IGF-1R基因的siRNA进行预测,根据预测的siRNA靶点设计带有酶切位点的寡核苷酸链。寡核苷酸序列和表达质粒由吉凯生物公司合成并构建,分别命名为IGF-1R-siRNA-1和IGF-1R-siRNA-2。
1 . 2 . 2 反转录聚合酶链式反应(r e v e r s e transcription-polymerase chain reaction,RTPCR)和蛋白[质]印迹法(Western blot)检测转染细胞IGF-1R和BMP2基因和蛋白表达
将构建的IGF-1R-siRNA-1和IGF-1R-siRNA-2表达载体分别转至染SMMC7721细胞,以未转染质粒和转染GV248空载体质粒转染至SMMC7721细胞组为对照组。转染后48 h收集细胞,加入1 mL TRIzol试剂混匀,按照说明书步骤提取细胞总RNA,用无RNase水进行溶解,用核酸蛋白测定仪检测RNA的纯度和浓度,取2 μg RNA溶液并按照北京康为世纪生物科技有限公司生产的SuperQuickRT cDNA第一链合成试剂盒说明书进行反转录反应。反转录反应完成后按照2×Es Taq MasterMix产品说明书进行PCR反应,反应条件为95 ℃预变性10 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,扩增28个循环。PCR扩增引物序列如下,IGF-1R-F:5'-CAACGGCAACCTGAGTTAC-3'和IGF-1R-R:5'-GCACGAAGATGGAGTTGTG-3',产物大小为286 bp;BMP2-F:5'-AACTACCAGAAACGAGTGGG-3'和BMP2-R:5'-GCTGTGTTCATCTTGGTGC-3',产物大小为409 bp;β-actin-F:5'-GCACTCTTCCAGCCTTCCTT-3'和β-actin-R:5'-AGGTCTTTGCGGATGTCCA-3',产物大小为101 bp,扩增完成后72 ℃温育10 min,4 ℃保存。扩增产物用2%浓度的琼脂糖凝胶电泳后用Quantity Qne软件进行拍照,Image J分析软件对电泳条带进行半定量分析。同样按照上述方法进行转染,48 h后收集细胞,加入RIPA裂解液(含有蛋白酶抑制剂PMSF)后冰上裂解细胞1 h,4 ℃,10 000×g离心10 min,并取上清液进行BCA法蛋白定量,取相同蛋白量的上清液并加入1/5倍体积的5×Loading缓冲液,煮沸10 min后,4 ℃,10 000×g离心10 min,取6 μL上样进行SDS-PAGE,半干电转移法将凝胶上蛋白转至硝酸纤维素膜上,取出膜于封闭液(5%脱脂牛奶溶于PBST中)中室温封闭1 h,分别加入1∶500稀释的兔抗人IGF-1R和BMP2抗体,4 ℃温育过夜,用PBST漂洗3次,每次10 min,再加入1∶5 000的HRP标记的羊抗兔二抗,37 ℃温育1 h,用PBST漂洗3次,每次10 min,取出膜,用ECL显色,压片并保存结果。
1.2.3MTT检测IGF-1R-siRNA表达质粒转染后细胞增殖
将IGF-1R-siRNA-1、IGF-1R-siRNA-2表达质粒和对照质粒分别转染至SMMC7721细胞,48 h后用胰酶消化并分别铺种至96孔板,铺种细胞密度为2 000个/孔,每组重复4个孔。在铺种0、12、24、36、48和60 h后向相应的细胞中加入20 μL MTT溶液(5 mg/mL);继续培养4 h后去掉培养基,加入150 μL DMSO,充分振荡后测定吸光度(D490 nm)值并绘制生长曲线。
1.2.4流式细胞术检测IGF-1R基因稳定表达细胞株的细胞凋亡
铺种SMMC7721细胞至6孔板,细胞转染方法按照LipofectamineTM2000说明书中步骤进行,转染48 h后用无EDTA的胰酶消化细胞,收集并清洗细胞后按照BD凋亡检测试剂盒操作进行抗体温育以及PI染色,避光15 min后加入Binding缓冲液后混匀,上机检测。
1.3统计学处理
采用SPSS 19.0软件对数据进行分析,两组样本均数比较采用独立样本t检验,多个样本均数两两比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1质粒构建结果鉴定
根据siRNA生物信息学软件给出的结果筛选出2对靶向IGF-1R基因的发卡结构siRNA并设计带有酶切位点寡核苷酸引物(表1)。用GV248表达质粒的上游测序引物H1-F对构建的siRNA表达载体进行测序,用测序结果所示序列(图1)与合成引物序列进行比对,比对结果一致,表明重组质粒IGF-1R-siRNA-1和IGF-1R-siRNA-2表达载体构建成功。

表1 靶向IGF-1R基因的siRNA靶点和寡核苷酸引物序列Tab. 1 Primer sequence of siRNA target spot and oligonucleotides
2.2RT-PCR和Western blot分析IGF-1R-siRNA对IGF-1R和BMP2基因及其蛋白表达的影响
RT-PCR结果显示,SMMC-7721细胞转染IGF-1R-siRNA-1和IGF-1R-siRNA-2表达载体后,IGF-1R和BMP2基因mRNA水平都出现明显下调表达,其中IGF-1R-siRNA-1转染组IGF-1R 和BMP2基因的表达相对于正常对照组分别下调68.9%和79.5%,IGF-1R-siRNA-2转染组IGF-1R和BMP2基因的表达分别下调80.7%和83.3%(图2),差异有统计学意义(P<0.05)。Western blot实验结果也显示,IGF-1R-siRNA-1和IGF-1R-siRNA-2质粒转染组IGF-1R和BMP2蛋白明显出现不同水平的下调,对IGF-1R蛋白表达抑制率分别为46.1%和62.1%,对BMP2蛋白表达抑制率分别为42.5%和60.9%,差异有统计学意义(P<0.05,图3)。
2.3IGF-1R-siRNA-1和IGF-1R-siRNA-2转染后对SMMC-7721细胞增殖的影响
SMMC-7721细胞转染IGF-1R-siRNA-2表达质粒和转染空质粒后,不同时间段加入MTT后并测D490nm值后绘制生长曲线(图4),发现IGF-1R-siRNA-1和IGF-1R-siRNA-2表达质粒转染组的细胞增殖速度明显要低于转染空质粒对照组,差异有统计学意义(P<0.05),而且IGF-1R-siRNA-2表达质粒转染组的细胞增殖速度稍高于IGF-1R-siRNA-1转染组,也就表明IGF-1R基因表达下调会抑制细胞的增殖。

图1 IGF-1R-siRNA质粒测序结果Fig. 1 Plasmid sequencing of IGF-1R small interfering RNA
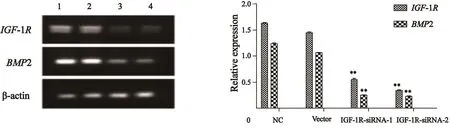
图2 RT-PCR检测质粒转染SMMC-7721细胞后IGF-1R和BMP2基因表达差异Fig. 2 Detection of the diference of IGF-1R and BMP2 gene expression after plasmid transfection into SMMC-7721 cells by RT-PCR

图3 Western blot检测质粒转染SMMC-7721细胞后IGF-1R和BMP2蛋白的表达Fig. 3 Detection of expression of IGF-1R and BMP2 proteins after plasmid transfection into SMMC-7721 cells by Western blot
2.4IGF-1R-siRNA-1和IGF-1R-siRNA-2质粒转染后对SMMC-7721细胞凋亡的影响
SMMC-7721细胞转染IGF-1R-siRNA-1 和IGF-1R-siRNA-2表达质粒和转染空质粒后,48 h后用流式细胞仪检测细胞凋亡情况(图5),结果显示,IGF-1R-siRNA-1和IGF-1R-siRNA-2表达质粒转染组的晚期细胞凋亡比例(17.3%和23.1%)明显高于转染空质粒对照组(2.5%),差异 有统计学意义(P<0.05),IGF-1R-siRNA-2质粒转染组凋亡比例稍高于IGF-1R-siRNA-1组,也就表明IGF-1R基因表达下调会促进细胞的凋亡。

图4 MTT检测质粒转染后细胞增殖情况Fig. 4 Detection of cell proliferation among the 3 groups at 0,12,24,36,48 and 60 h after transfection by MTT assay

图5 流式细胞仪检测转染后细胞凋亡Fig. 5 Detection of apoptosis rates of the cells after transfection by fow cytometry
3 讨论
近年来,IGF-1R作为肿瘤治疗靶点,已经成为抗肿瘤药物研发的热点,并已开发出相关的靶向药物。Linsitinib是一种靶向IGF-1R和IR的双重酪氨酸激酶抑制剂,现已进入ⅠB期临床研究,联合依维莫斯治疗难治性转移性结直肠癌[9-10]。靶向IGF-1R的单克隆抗体Ganitumab也已进入临床Ⅲ期的随机双盲多中心研究,与吉西他滨联用并成为治疗转移性胰腺癌的一线药物[11]。尽管现已研发出相关靶向药物,但是对于IGF-1R参与的信号通路和分子机制至今仍未阐明。
前期研究发现,在肝癌SMMC7721细胞中,IGF-1可以上调BMP2基因的表达,并通过阻断p38/MAPK信号通路抑制BMP2基因的表达[8]。IGF-1与其受体IGF-1R结合,并激活下游的MAPK和PI3K信号通路,BMP2基因的上调表达是由IGF-1R/MAPK信号通路活化所介导的。但是IGF-1R是否也会通过激活PI3K/Akt信号通路介导BMP2基因的上调表达至今仍未见报道,Graham等[12]对前列腺癌的研究发现,PI3K/Akt-NF-κB信号轴通过对BMP2基因进行转录调控从而促进BMP-Smad信号通路活化,ChIP实验还发现NF-κB可能通过与BMP2基因启动子结合从而参与对BMP2基因的转录调控。
本研究通过RT-PCR和Western blot实验研究发现,转染靶向IGF-1R基因的siRNA表达质粒后,肝癌SMMC7721细胞中IGF-1R和BMP2基因的转录和翻译水平都有明显下调,MTT细胞生长曲线和细胞凋亡实验研究发现,转染组SMMC7721细胞增殖速率明显低于对照组,转染组细胞凋亡比例也高于对照组。本研究结果也说明通过RNA干扰IGF-1R基因表达阻滞IGF-1R参与的信号通路的活化,明显抑制BMP2基因的转录表达,抑制细胞增殖,并且促进细胞发生凋亡。至于IGF-1R是通过MAPK还是PI3K相关信号通路调节BMP2基因的表达至今尚未见报道,也可能是通过IGF1R/PI3K/Akt-NF-κB信号通路发挥对BMP2基因的转录调控作用,但是本课题尚未对此假说进行验证。
[参 考 文 献]
[1] HULBERT A J, CLANCY D J, MAIR W, et al. Metabolic rate is not reduced by dietary-restriction or by lowered insulin/ IGF-1 signalling and is not correlated with individual lifespan in Drosophila melanogaster [J]. Exp Gerontol, 2004, 39(8):1137-1143.
[2] BAKER J, LIU J P, ROBERTSON E J, et al. Role of insulinlike growth factors in embryonic and postnatal growth[J]. Cell, 1993, 75(1):73-82.
[3] POLLAK M N, SCHERNHAMMER E S, HANKINSON S E. Insulin-like growth factors and neoplasia[J]. Nat Rev Cancer, 2004, 4(7):505-518.
[4] SAMANI A A, YAKAR S, LEROITH D, et al. The role of the IGF system in cancer growth and metastasis:overview and recent insights[J]. Endocr Rev, 2007, 28(1):20-47.
[5] LANET D B, LUDWIG D L, KAHN C R, et al. Insulin receptor functionally enhances multistage tumor progression and conveys intrinsic resistance to IGF-1R targeted therapy [J]. Proc Natl Acad Sci U S A, 2010, 107(24):10791-10798.
[6] TEN DIJKE P, FU J, SCHAAP P, et al. Signal transduction of bone morphogenetic proteins in osteoblast differentiation[J]. J Bone Joint Surg, 2003, 85(Suppl 3):34-38.
[7] KIM S, KANG Y, KRUEGER C A, et al. Sequential delivery of BMP-2 and IGF-1 using a chitosan gel with gelatin microspheres enhances early osteoblastic differentiation[J]. Acta Biomater, 2012, 8(5):1768-1777.
[8] XU G J, CAI S, WU J B. Effect of insulin-like growth factor-1 on bone morphogenetic protein-2 expression in hepatic carcinoma SMMC7721 cells through the p38 MAPK signaling pathway[J]. Asian Pac J Cancer Prev, 2012, 13(4):1183-1186.
[9] PUZANOV I, LINDSAY C R, GOFF L, et al. A phase Ⅰstudy of continuous oral dosing of osi-906, a dual inhibitor of insulin-like growth factor-1 and insulin receptors in patients with advanced solid tumors[J]. Clin Cancer Res, 2015, 21(4):701-711.
[10] BENDELL J C, JONES S F, HART L, et al. A phase Ⅰb study of linsitinib (OSI-906), a dual inhibitor of IGF-1R and IR tyrosine kinase, in combination with everolimus as treatment for patients with refractory metastatic colorectal cancer[J]. Invest New Drugs, 2015, 33(1):187-193.
[11] FUCHS C S, AZEVEDO S, OKUSAKA T, et al. A phase 3 randomized, double-blind, placebo-controlled trial of ganitumab or placebo in combination with gemcitabine as first-line therapy for metastatic adenocarcinoma of the pancreas:the GAMMA trial[J]. Annal Oncol, 2015, 26(5):921-927.
[12] GRAHAM T R, ODERO-MARAH V A, CHUNG L W, et al. PI3K/Akt-dependent transcriptional regulation and activation of BMP-2-Smad signaling by NF-κB in metastatic prostate cancer cells[J]. Prostate, 2009, 69(2):168-180.
Silencing IGF-1R gene inhibits proliferation of human SMMC7721 cell and promotes its apoptosis through down-regulating BMP2 expression
FU Jingzhong1,HUANG Longzhang1,YU Qiang1,CHU Jiesheng1,KUANG Meibo2,XU Guanjun1(1.Department of Oncology,the Third People's Hospital of Jiujiang,Jiujiang 332000 Jiangxi Province,China;2.Department of Oncology,the First People's Hospital of Xiushui,Xiushui 332400,Jiangxi Province,China)
[Key words]IGF-1R gene;BMP-2 gene;Hepatocellular carcinoma SMMC7721 cell;Cell proliferation;Cell apoptosis
[Abstract]Background and purpose:Insulin-like growth factor-1 (IGF-1) is a peptide that participates in many biological processes by stimulating the downstream signaling pathways through their interaction with IGF-1 receptor (IGF-1R) and insulin receptor (IR). Bone morphogenetic proteins (BMPs) are a group of functional proteins which participate in the biological processes of proliferation and migration in many kinds of cancers and have become a hot area of cancer research. The study aimed to investigate the effects of silencing IGF-1R gene on the expression level of BMP2 gene, and the cell proliferation and apoptosis of SMMC7721 cells. Methods:The RNAi plasmid targeting IGF-1R gene was constructed and transfected into SMMC7721 cells. Then the inhibition effect on the expression level of IGF-1R and BMP2 gene was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot. The SMMC7721 growth curve and cell apoptosis were detected by MTT assay and flow cytometry after they were transfected with RNAi plasmid. Results:The RNAi plasmid targeting IGF-1R gene was constructed successfully. The inhibition efficiencies at mRNA expression levels were 68.9% and 80.7% (IGF-1R gene), 79.5% and 83.3% (BMP2 gene), respectively, aftertransfection with IGF-1R-siRNA-1 and IGF-1R-siRNA-2 plasmid (P<0.05). The inhibition efficiencies at protein levels were 46.1% and 62.1% (IGF-1R gene, P<0.05), 42.5% and 60.9% (BMP2 gene, P<0.05), respectively. The results of MTT growth curve showed that the proliferation rate in the transfected SMMC7721 cells was significantly slower than that in the control group (P<0.05). The proportion of apoptotic cells in transfected groups was significantly higher than that in the control group (P<0.05). Conclusion:Silencing IGF-1R gene can downregulate the expression of BMP2 gene at different levels that results in inhibition of cell proliferation and promotion of apoptosis in SMMC7721 cells.
DOI:10.3969/j.issn.1007-3969.2016.04.003
中图分类号:R735.7
文献标志码:A
文章编号:1007-3639(2016)04-0297-06
通信作者:徐冠军 E-mail:xgjxiu80@163.com
收稿日期:(2015-06-28修回日期:2015-08-25)

