黄酒储存期间4-乙烯基愈疮木酚和香草醛的变化及影响因素
莫新良 ,徐岩,范文来
1(浙江工业 职业技术学院 黄酒学院,浙江 绍兴,312000) 2(江南大学 酿酒科学与酶技术中心,酿造微生物与应用酶学实验室,江苏 无锡,214122)
黄酒储存期间4-乙烯基愈疮木酚和香草醛的变化及影响因素
莫新良1*,徐岩2,范文来2
1(浙江工业 职业技术学院 黄酒学院,浙江 绍兴,312000)2(江南大学 酿酒科学与酶技术中心,酿造微生物与应用酶学实验室,江苏 无锡,214122)
摘要对黄酒储存过程中4-乙烯基愈疮木酚和香草醛的变化及其影响因素进行了分析,同时对模拟黄酒储存过程中添加纯物质4-乙烯基愈疮木酚后的产物进行了检测。结果表明:随着储存时间的延长,4-乙烯基愈创木酚的含量总体变化趋势在逐渐减少,而香草醛的含量始终在不断增加,氧气和温度对这两种物质的变化影响较大;黄酒中香草醛是通过4-乙烯基愈疮木酚的氧化而形成;香草醛是模拟黄酒贮存过程中4-乙烯基愈创木酚减少的主要产物,有超过 80 % 的4-乙烯基愈创木酚转化成了香草醛,其中有极小部分的愈创木酚和香草酸产生。结论是:黄酒储存期间4-乙烯基愈疮木酚的减少和香草醛的增加变化较显著,香草醛是4-乙烯基愈创木酚降解的主要产物,氧气和温度有利于香草醛这种甜香物质的形成。
关键词黄酒;储存;4-乙烯基愈疮木酚; 香草醛;阿魏酸;香草酸;愈疮木酚
黄酒是我国最古老的传统发酵酒,其特点是越陈酿香气越浓郁。黄酒通过一定时间的储存,其风味特征发生显著变化,由新酒的口感粗糙爆辣,香气单薄,转化为陈酒的醇厚柔和、醇香浓郁,从而形成黄酒所特有的“陈香”[1-2]。因此,黄酒又称“老酒”,意味着新酿制的黄酒往往需要经过一定时间的陈酿才能得到最终的成品。正是这种独特的酿造工艺才造就了黄酒独具特色的、复杂的风味特征。
黄酒由于其营养丰富且风味独特而深受人们喜爱,而香气是决定黄酒风味和典型性的重要因素。国内对于黄酒中的香气成分及风味特征已经研究得较为全面深入[3-5]。已有的感官分析发现,我国黄酒主要具有曲香、醇香、甜香、药香、烟气香、焦糖香及蜂蜜香等典型香气特征[5]。理化分析结果显示,黄酒中的主要成分是水、乙醇和糖分,三者约占总量的 96%~97%,其他微量组分仅占 3%~4%,而决定黄酒的风味特征及品质的差异却是这 3%~4%的微量组分[4]。
酚类化合物一直以来被认为是饮料酒中有重要贡献的香气物质。研究发现,酚类香气化合物是对黄酒整体香气贡献最大的一类化合物,其中,4-乙烯基愈疮木酚具有典型的烟气香、草药香及丁香的气味,在黄酒中具有较高的香气强度(香气强度OSME > 3)[3-4],是构成黄酒“药香、烟气香”的重要风味物质。香草醛又名香兰素,具有令人愉悦的香荚兰豆香气及甜香气[6],在黄酒中具有最大的香气强度(OSME >4)[3-4],是使黄酒具有令人优雅的甜香特征的重要风味物质。
饮料酒中,4-乙烯基愈疮木酚主要来源于阿魏酸的脱羧反应[7,9],香草醛的形成比较复杂,目前报道其途经主要是在储存过程由阿魏酸产生的4-乙烯基愈疮木酚氧化而来[8-10]。已有研究发现,黄酒中的4-乙烯基愈疮木酚来源于黄酒的麦曲,主要在发酵中由阿魏酸脱羧而得到[11],香草醛主要在黄酒储存中产生[12]。但有关黄酒储存过程中这两种物质如何变化,且影响因素有哪些,文献中未见其报道。本工作拟分析黄酒中4-乙烯基愈疮木酚和香草醛在储存过程中含量变化情况及其影响因素,并对模拟黄酒储存过程中4-乙烯基愈疮木酚的主要降解产物进行分析,为丰富黄酒风格特点及高品质黄酒的开发和生产提供科学依据。
1材料与方法
1.1实验材料和仪器
分析样品为:由浙江地区机制生麦曲、脚踏生麦曲和上海地区机制生麦曲新酿制而成的原酒,分别命名为ZJJZ、ZJJT和SHJZ。
定量所需的标准品均为色谱纯,4-乙烯基愈创木酚 (98%),愈创木酚(98%),4-(4-甲氧苯基)-2-丁酮(98%),香草醛(99%),阿魏酸和香草酸,购自Sigma-Aldrich(中国)公司。无水乙醇为色谱纯,美国TEDIA试剂公司。乙醚和氯化钠为分析纯,购自中国医药(集团)上海化学试剂公司。超纯水自制(Milli-Q 系统,Millipore, Badford, MA, USA)。
高速冷冻离心机 J-E,美国 Beckman公司;水浴恒温摇床振荡器(SHA-2 型,瑞华仪器);MPS2 自动进样器,德国 Gerstel 公司;安捷伦气-质联用仪,Agilent 6890 GC-5973 mass selective detector (MSD );GC-MS色谱分离柱为DB-FFAP (60 m × 0.25 mm i.d. × 0.25 m,J&W Scientific);戴安高效液相色谱仪P 680,美国戴安有限公司;HPLC色谱柱 C18柱(Zorbax SB-Aq,2.5 m,250 mm×4.6 mm)。
1.2实验方法
1.2.1标准溶液的配制
准确称取一定量的4-乙烯基愈创木酚、愈创木酚和香草醛标样分别用无水乙醇精确配制,再取一定量加入到模拟黄酒中配制成系列浓度梯度的标准溶液;用无水乙醇溶解4-(4-甲氧苯基)-2-丁酮作为内标溶液。模拟黄酒由超纯水和12.5% (vol) 乙醇配制得到,并用乳酸将其pH值调为4.0。
精确称取一定量的阿魏酸和香草酸标准品,分别用甲醇配制得到 10 g/L的标准贮备液,再由贮备液配制一系列不同浓度标样混合溶液,用高效液相色谱(HPLC)进行分析。
1.2.2样品香气物质的萃取分析
样品香气物质的萃取分析参照文献[12]的方法。即用液-液微萃取结合气相色谱-质谱联用(GC-MS)方法萃取分析样品中的香气物质。
1.2.2.1香气物质的萃取
取15 mL黄酒样品,加4.5 g NaCl 和内标4-(4-甲氧苯基)-2-丁酮(终质量浓度为98.61 μg/L),用 1 mL 重蒸过的乙醚萃取离心后,取上清液进行GC-MS分析。
1.2.2.2香气物质的分析
GC条件:自动进样器直接进样,进样量1 μL,不分流模式;He载气流速为2 mL/min;进样口和检测器温度均为温度250 ℃;程序升温方式:100℃ 保持2 min,10 ℃/min升温至230 ℃,恒温10 min;MS条件:电子能量70 eV,EI电离源,离子源温度230 ℃,质量扫描范围30~550 amu。
1.2.2.3香气物质的定性与定量
物质的定性采用将未知物的谱图和NIST 05a.L 质谱库 (Agilent Technologies Inc.)中标准谱图进行比对,结合其相应标准品的保留时间进行对比来确定。
定量结果通过内标标准曲线计算,内标化合物为 4-(4-甲氧苯基)-2-丁酮。每种待测物分别对应于该内标做标准曲线,每种化合物峰面积采用选择特征离子法 (SIM)积分,利用待测物质和内标的相对峰面积比代入相对应的标准曲线方程计算出待测物质在黄酒中的含量。
1.2.3样品中不挥发性物质阿魏酸和香草酸的萃取分析
样品预处理按照文献[13]的方法。20 mL 样品用 5 mL 的乙酸乙酯提取 3 次,真空干燥器吹干。残留物再用一定量的50% 的甲醇液溶解,用 0.45 μm 微孔滤膜过滤,滤液用于 HPLC 分析。
色谱条件:进样量 10 μL,柱温 30 ℃,检测波长320 nm,流动相流速1 mL/min,流动相为 0.01% 的醋酸溶液 (A)∶甲醇 (B)=7∶3,时间:起始时A 溶液 80%,保持 4 min,24 min 时 A 溶液降至 60%, 27 min 时 A 溶液降至 0% 持续 2 min,30 min 时又增至 80%,并保持5 min 使柱子平衡。
1.2.4黄酒煎酒及储存
ZJJZ和ZJJT(分别含:乙醇12.1%和12.5% (vol) ,阿魏酸4.30 mg/L和5.98 mg/L, 4-乙烯基愈疮木酚4.23 mg/L和5.74 mg/L,香草醛0.06 mg/L和0.08 mg/L),90 ℃ 煎酒 30 min后,30 ℃储存 9 个月,15 天检测1次。
SHJZ(乙醇12.0% ,阿魏酸0.75 mg/L,4-乙烯基愈创木酚 2.40 mg/L,香草醛0.08 mg/L),添加 2.41 mg/L 4-乙烯基愈创木酚,煎酒后,分别在常压(atmosphere,简写为atm)、充满O2(瓶中总的溶氧为 20.0 ~ 21.0 mg/L)、充满 CO2和在 60 ℃ 的条件下储存 15 d。
1.2.5 黄酒模拟酒煎酒及贮存
配制好的模拟酒添加纯4-乙烯基愈创木酚(5.0 mg/L),煎酒后,在 30 ℃下储存一段时间,检测分析其中的物质。
1.2.6黄酒酒精度的测定
参照 GB/T 13662—200,将样品经过蒸馏,用酒精计测定馏出液中酒精的含量。
2结果与分析
2.1香气物质分析方法验证
为消除其他杂质峰的干扰,采用SIM方法对每个香气化合物进行定量分析,化合物的定量离子见表1。
配制一系列浓度的4-乙烯基愈创木酚、香草醛及愈创木酚混合标准溶液,每个不同浓度水平的混合标准溶液重复测定6次,求得相应化合物的平均值。由内标标准曲线法进行线性回归分析,并验证了该方法的有效性,包括线性相关性系数、线性范围、相对标准偏差、回收率、检测限和定量限等,结果见表 1。
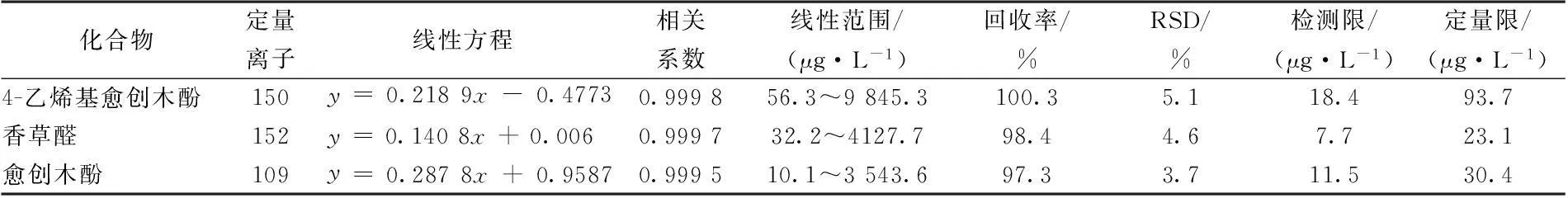
表 1 香气物质的定量离子、标准曲线、线性范围、相关系数、回收率、相对标准偏差、检出限及定量限
由表 1 可知,方法所定量的化合物的线性关系较好,相关系数 在 0.999 5~ 0.999 8 之间。方法的准确度和精密度较好,回收率在 97.3% ~ 100.3% 之间,相对标准偏差均在 10% 以内,适于微量成分的准确分析。检测限和定量限的变化范围分别在 7.7~ 18.4 μg/L和 23.1~ 93.7 μg/L,均满足相应香气化合物的检测要求。
2.2黄酒储存过程中4-乙烯基愈创木酚和香草醛的变化
已有研究发现,黄酒中的4-乙烯基愈创木酚主要是在发酵过程由阿魏酸脱羧而得到,阿魏酸来自黄酒酿造过程中使用的特殊原料——麦曲,因小麦中含有高浓度的阿魏酸[11,14]。那么在储存过程中,阿魏酸是否继续转化为4-乙烯基愈创木酚呢?研究也发现,香草醛在黄酒中主要是在储存过程中产生[12]。为考察储存过程中这两种物质含量变化情况及时间的影响,用ZJJZ和ZJJT煎酒后,在 30 ℃的条件下储存 9 个月,分析结果见图 1 和图 2。
由图 1 和图 2得知,在前45天的储存过程中,4-乙烯基愈创木酚含量有所增加,说明这个阶段阿魏酸经过非酶脱羧反应形成了4-乙烯基愈疮木酚(因这两种酒中还含有一定浓度的阿魏酸,分别为4.30 mg/L和5.98 mg/L)。但随着储存时间的延长,4-乙烯基愈创木酚的含量在逐渐减少(图 1),而香草醛始终在不断增加(图 2)。
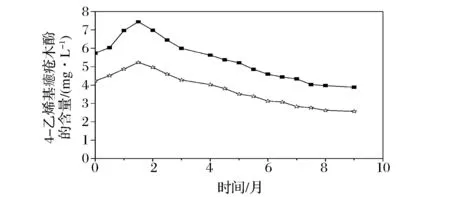
—■—脚踏麦曲酿制的原酒(ZJJT);—☆—机制麦曲酿制的原酒(ZJJZ)图1 浙江地区生麦曲酿制的原酒储存在30 ℃ 条件下4-乙烯基愈创木酚含量的变化Fig. 1 Change of 4-vinylguaiacol during aging of fresh rice wine brewed with wheat Qu from Zhejiang area at 30℃

—■—脚踏麦曲酿制的原酒(ZJJT);—☆—机制麦曲酿制的原酒(ZJJZ)图2 浙江地区生麦曲酿制的原酒储存在30 ℃ 的条件下香草醛的变化Fig. 2 Change of vanillin during aging of fresh rice wine brewed with wheat Qu from Zhejiang area at 30 ℃
香草醛可能来自阿魏酸的降解,而阿魏酸通过生化作用转化为香兰素的途径已得到广泛证实[8, 9]文献报道,由阿魏酸降解产生香草醛的途径复杂,主要有四条:非氧化脱羧反应、依赖于辅酶A的去乙酰反应、不依赖于辅酶A的去乙酰反应和侧链还原[6]。其中在非氧化脱羧反应中,阿魏酸首先脱羧形成4-乙烯基愈创木酚,然后香草醛再由4-乙烯基愈疮木酚氧化形成[6]。香草醛的这种形成途径在其它饮料酒中也普遍存在[8-10]。由上述分析可以推测,黄酒中香草醛是通过4-乙烯基愈疮木酚的氧化而形成的。
2.3黄酒储存过程中重要香气物质变化的影响因素
文献报道,香草醛若通过4-乙烯基愈疮木酚的氧化形成,则氧气等催化剂及环境温度对其产生有较大的影响[9],因此本研究也从氧气、温度等方面来分析两种物质在黄酒贮存过程中的变化。

表2 新酒SHJZ添加2.41 mg/L 4-乙烯基愈创木酚后,在常压、O2 或 CO2和
注:同行字母不同表示差异显著(P<0.05)。
2.3.1黄酒储存过程中氧气对4-乙烯基愈创木酚和香草醛变化的影响
表2列出了SHJZ添加 2.41 mg/L 4-乙烯基愈创木酚后,在常压、O2或 CO2和60℃的储存条件下,4-乙烯基愈创木酚和香草醛的变化情况。
由表2可知,随着储存时间的延长,3种情况下的黄酒中4-乙烯基愈创木酚的含量均减少,同时香草醛的含量均已增加,含量变化极显著(P<0.05)。在充氧的条件下,4-乙烯基愈创木酚含量的减少和香草醛含量的增加比常压和充 CO2条件下变化的幅度更大。这种现象和文献报道在啤酒的储存过程中 4-乙烯基愈创木酚的减少和香草醛的增加情况相一致[9]。说明氧气有助于这种化学反应过程的变化,原因是氧气有利于 4-乙烯基愈创木酚双键的氧化,因而有利于这种化学反应的转变,因为黄酒经过 90℃ 以上的温度煎酒后,基本上处于无菌状态,微生物的生物反应几乎不存在。
从表2中也发现,通过90 ℃的高温煎酒后,黄酒中的4-乙烯基愈创木酚和香草醛的含量都有少量的增加,这主要是其中的少量阿魏酸(0.75 mg/L),在较高温度的热效应作用下,发生快速脱羧反应形成了4-乙烯基愈创木酚后,又有部分氧化成了香草醛[14]。这种现象同日本烧酒的蒸馏过程和啤酒的麦汁煮沸过程中阿魏酸转化成4-乙烯基愈创木酚,而后又形成香草醛的情况相似[8-9]。
2.3.2黄酒储存过程中温度对4-乙烯基愈创木酚和香草醛变化的影响
SHJZ添加 2.41 mg/L 4-乙烯基愈创木酚,充满 O2后,在不同温度下储存,研究4-乙烯基愈创木酚和香草醛的变化情况,结果见表3。
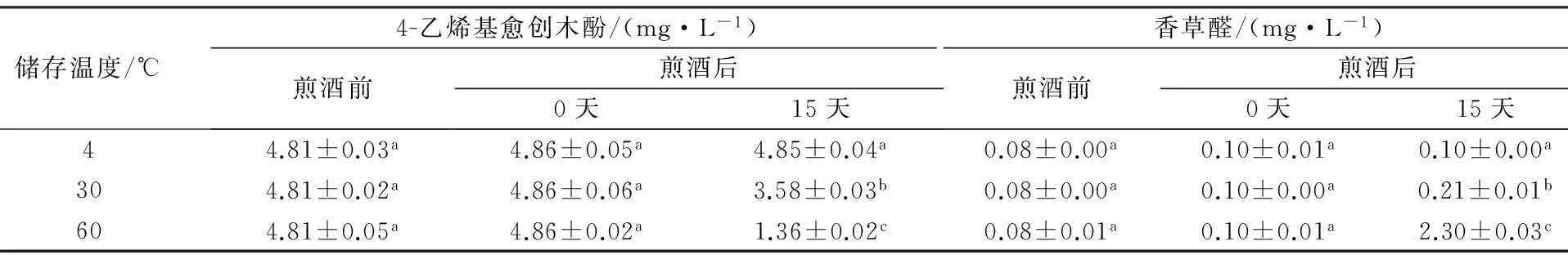
表3 新酒SHJZ添加2.41 mg/L4-乙烯基愈创木酚后,充满 O2 后储存在4℃、30℃、60℃的条件下
注:同行字母不同表示差异显著(P<0.05)。
由表3可知,随着储存温度的升高,二者的含量变化都极显著(P<0.05),4-乙烯基愈创木酚减少和香草醛增加的幅度均在提高,说明温度对两种物质的变化影响较大。这种现象和文献报道的啤酒的储存过程中4-乙烯基愈创木酚的减少和香草醛的增加情况相一致[9]。
2.4模拟黄酒储存过程中添加4-乙烯基愈创木酚后物质的变化
为方便黄酒储存过程中,其它物质的检测和鉴定,用模拟黄酒来研究添加纯的4-乙烯基愈创木酚后物质的变化情况,同时用不添加该物质的模拟酒做对照,在30℃ 条件下储存一段时间,结果见表4。

表4 模拟黄酒添加5.00 mg/L 4-乙烯基愈创木酚后,
注:ND, 未检测到;同列字母不同表示差异显著(P﹤0.05)。
由表4可知,随着储存时间的延长,在模拟酒中能检测到 3 种挥发性物质,即愈创木酚、4-乙烯基愈创木酚和香草醛,同时还能检测到 1 种不挥发性物质即香草酸(HPLC检测)。并且随着储存时间的延长,4-乙烯基愈创木酚和香草醛含量变化显著(P﹤0.05),4-乙烯基愈创木酚从第1天的4.85 mg/L减少到第90天的2.94 mg/L,香草醛从第1天的0.04 mg/L增加到第90天的1.63 mg/L。综合研究发现,有超过 80% 的4-乙烯基愈创木酚转化成了香草醛,其中有极小部分的愈创木酚和香草酸产生,而且随着储存时间的延长,这两种物质的含量变化不明显。因此,在储存过程中,香草醛是 4-乙烯基愈创木酚氧化的主要产物,其他两种物质即愈创木酚和香草酸,只是其少量的副产物。而不添加 4-乙烯基愈疮木酚的模拟酒中检测不到任何物质。
3结论
黄酒储存过程中,4-乙烯基愈疮木酚和香草醛的含量发生明显的变化,4-乙烯基愈创木酚在大量减少,香草醛在不断增加,氧气和温度对这两种物质的变化影响较大,香草醛主要是由4-乙烯基愈创木酚转化而来。通过在模拟黄酒中添加4-乙烯基愈疮木酚后,进一步证实香草醛是4-乙烯基愈疮木酚的主要降解产物。
参考文献
[1]周家骐.黄酒生产工艺[M].北京:中国轻工业出版社,1996:4-236.
[2]谢广发.黄酒酿造技术[M].北京:中国轻工业出版社,2010:1-17.
[3]罗涛.清爽型黄酒香气特征及麦曲对其香气的影响[D].无锡:江南大学生物工程学院,2008.
[4]陈双.中国黄酒挥发性组分及香气特征研究[D].无锡:江南大学生物工程学院,2013.
[5]王栋,经斌,徐岩,等.中国黄酒风味感官特征及其风味轮的构建研究[J].食品科学,2013,34(5):90-95.
[6]PRIEFERT H,RABENHORST J,STEINBUCHEL A.Biote chnological production of vanillin[J].Applied Biochemistry and Biotechnology,2001,56(3-4):296-314.
[7]ROSAZZA J P N,HUANG Z,DOSTAL L,et al.Review:Biocatalytic transformations of ferulic acid:an abundant aromatic natural product[J].Journal of Industrial Microbiology,1995,15(6):457-471.
[8]KOSEKI T,ITO Y,FURUSE S,et al.Conversion of ferulic acid into 4-vinylguaiacol,vanillin and vanillic acid in model solutions ofshochu [J].Journal of Fermentation and Bioengineering,1996,82(1):46-50.
[9]VANBENEDEN N,SAISON D,DELVAUX F,et al.Decrease of 4-vinylguaiacol during beer aging and formation of apocynol and vanillin in beer [J].Journal of Agricultural and Food Chemistry,2008,56(24): 11 983-11 988.
[10]SPILLMAN P J,POLLNITZ A P,LIACOPOULOS D,et al.Accumulation of vanillin during barrel-aging of white,red, and model wines [J].Journal of Agricultural and Food Chemistry,1997,45(7):2 584-2 589.
[11]MO Xin-liang XU Yan.Ferulic acid release and 4-vinylguaiacol formation during Chinese rice wine brewing and fermentation[J].Journal of the Institute of Brewing,2010,116(3):304-311.
[12]莫新良,徐岩,范文来.中国黄酒中香草醛的定性定量分析[J].食品与发酵工业,2012,38(12):133-137.
[13]李永红,郑志强,孙志浩.反相高效液相色谱法同时测定发酵液中的阿魏酸、香草酸和香草醛[J].分析化学,2004,32(3):409.
[14]FIDDLER W,PARKER W E,WASSERMANN A E,et al.Thermal decomposition of ferulic acid[J].Journal of Agricultural and Food Chemistry,1967,15(5):757-761.
Evolution of 4-vinylguaiacol and vanillin as well as factors affected its change during the storage of Chinese rice wines
MO Xin-liang1*, XU Yan2, FAN Wen-lai2
1(College of Chinese Rice Wine, Zhejiang Industry Polytechnic College, Shaoxing 31200, China)2Centre for Brewing Science and Enzyme Technology, Laboratory of Brewing Microbiology and Applied Enzymology, Jiangnan University, Wuxi 214122, China)
ABSTRACTIn this paper, the change of 4-vinylguaiacol and vanillin as well as factors affected its change during the storage of Chinese rice wines were investigated. The products resulted from supplement of 4-vinylguaiacol in model solutions of Chinese rice wines were identified. Results showed that the contents of 4-vinylguaiacol were gradually decreased and the levels of vanillin were on the steady increase with prolongation of storage, and factors affecting its change were highly dependent on oxygen and temperature. Vanillin was shifted from 4-vinylguaiacol. Three compounds including vanillin, guaiacol and vanillic acid, were identified in model solutions after forced aging. Vanillin was found to be the main degradation product of 4-vinylguaiacol, and its formation was shown to account for up to 80% of the decrease of 4-vinylguaiacol.It could be concluded that the decrease of 4-vinylguaiacol and the increase of vanillin were obvious during the storage of Chinese rice wines, and vanillin was the main degradation product of 4-vinylguaiacol. Furthermore, oxygen and temperature contributed to the formation of a sweet compound named as vanillin.
Key wordsChinese rice wine; storage; 4-vinylguaiacol; vanillin; ferulic acid; guaiacol; vanillic acid
收稿日期:2015-10-09,改回日期:2015-10-30
基金项目:浙江省专业带头人专业领军项目(Ij2013134)
DOI:10.13995/j.cnki.11-1802/ts.201602006
第一作者:博士,讲师(本文通讯作者,E-mail:xinliangmo@163.com)。

