绍兴黄酒混浊蛋白的分离鉴定及其氨基酸组成、二级结构分析
孙军勇,樊世英,谢广发,陆健,5
1(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122) 4(中国绍兴黄酒集团有限公司 国家黄酒工程技术研究中心,浙江 绍兴,312000) 5(宿迁市江南大学产业技术研究院,江苏 宿迁,223800)
绍兴黄酒混浊蛋白的分离鉴定及其氨基酸组成、二级结构分析
孙军勇1,2,3,樊世英1,2,3,谢广发3,4,陆健1,2,3,5
1(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)3(江南大学 生物工程学院,江苏 无锡,214122)4(中国绍兴黄酒集团有限公司 国家黄酒工程技术研究中心,浙江 绍兴,312000)5(宿迁市江南大学产业技术研究院,江苏 宿迁,223800)
摘要采用双向电泳及基质辅助激光解析电离飞行时间串联质谱法分析了绍兴黄酒混浊蛋白的主要组成及来源,结果表明:绍兴黄酒混浊中的蛋白质主要包括来源于小麦类燕麦蛋白b1、类燕麦蛋白、二聚-α淀粉酶抑制剂、病程相关蛋白、病程相关蛋白-4、几丁质酶II,以及来源于水稻的类燕麦蛋白和β-淀粉酶。高效液相色谱与傅里叶变换红外线光谱分析法分析绍兴黄酒上清蛋白质和混浊蛋白质的氨基酸组成与二级结构发现,绍兴黄酒混浊蛋白中谷氨酸含量最高,占总氨基酸含量的20.48%,疏水性的氨基酸含量比酒体蛋白高24.2%。高α-螺旋含量、低β-折叠和无规则卷曲是黄酒混浊中蛋白质的主要结构特征。
关键词黄酒;混浊蛋白;基质辅助激光解吸电离飞行时间质谱(MALDI-TOF/TOF MS);氨基酸组成;二级结构
黄酒是一种成分复杂、营养丰富的胶体溶液,含有蛋白质、氨基酸、多酚、糖、金属离子等物质。在存储的过程中,黄酒受到光照、震动、氧气的影响,胶体平衡被打破而出现失光、絮凝和混浊[1]。
近年来,很多研究者[2-5]对黄酒混浊的成分进行了分析。丁关海[6]对坛装和瓶装酒的混浊成分进行了研究,发现坛装酒混浊中粗蛋白占34.66%,瓶装酒混浊中粗蛋白占了50.56%。谢广发等[5]对瓶装酒的混浊成分的分析表明,其粗蛋白含量达到50.6%,其中高分子蛋白占总蛋白含量72.62%。以上研究均说明蛋白是黄酒混浊的主要成分。然而,研究人员发现[7-8],尽管高分子蛋白质在混浊中所占的比例较大,但黄酒的稳定性并不随着黄酒中高分子蛋白质含量增高而降低,而可能与黄酒中某类容易形成混浊的特定蛋白质有关。本研究室谭新勇[9]研究发现,黄酒的混浊蛋白的分子量主要集中在14~16 kDa、21~23 kDa附近,混浊蛋白中富含谷氨酸,但其并未对混浊蛋白的氨基酸组成特征和二级结构特征进行深入分析。
本文通过双向电泳(2-DE)和基质辅助激光解析电离飞行时间串联质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF/TOF MS)技术追溯绍兴黄酒混浊蛋白质的种类和来源,并采用高效液相色谱(high performance liguid chromatography,HPLC)技术对绍兴黄酒混浊中的蛋白质的氨基酸组成进行分析,通过傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)技术分析混浊蛋白二级结构,目的是更深入认识绍兴黄酒混浊蛋白质,为绍兴黄酒的蛋白混浊问题的解决提供新的理论指导。
1材料与方法
1.1材料与仪器
黄酒样品:塔牌绍兴花雕酒,古越龙山陈年花雕酒,购于本地超市,酒精度均≥15.5%(vol),总糖均为15.1~40.0 g/L,产地均为浙江绍兴。
3-[(3-胆固醇氨丙基)二甲氨基]-1-丙磺酸(CHAPS)、碘乙酰胺(IAA)、二硫苏糖醇(DTT)、尿素、固相IPG胶条(7 cm,pI 3~10,非线性)、IPG缓冲液(pH 3~10,非线性)为GE公司产品。α-氰基-4-羟基肉桂酸(HCCA)、碳酸氢铵、三氟乙酸(TFA)、胰蛋白酶、乙腈等试剂等购于Sigma公司。30%丙烯酰胺单体储液、甲叉双丙烯酰胺、三羟甲基氨基甲烷(Tris)、十二烷基磺酸钠(SDS)、N,N,N’,N’-四甲基乙二胺(TEMED)、过硫酸铵(APS)、牛血清蛋白、考马斯亮蓝G-250、考马斯亮蓝R-250、三氯乙酸(TCA)、丙酮、尿素、β-巯基乙醇、蛋白标准品、透析袋、N-[三(羟甲基)]甘氨酸(Tricine buffer),均购于生工生物工程(上海)股份有限公司。
蛋白电泳系统(Mini-Protein 3 Cell),美国Bio-Rad公司;高速冷冻离心机,美国Sigma公司;Ultraflextreme串联飞行时间质谱仪,德国Bruker公司;UV-2100紫外可见分光光度计,尤尼克上海仪器公司;WGZ-2-PJ型浊度计,上海昕瑞仪器仪表有限公司;K2300凯氏定氮仪,丹麦Foss有限公司;Agilent 1100型氨基酸专用高效液相色谱仪,美国安捷伦公司;傅里叶变换红外光谱仪Nexus Nicolet 470,美国Thermo Nicolet公司。
1.2实验方法
1.2.1双向电泳
按照参考文献[10]方法制备样品。
1.2.2蛋白质鉴定
切取凝胶上可见的蛋白条带或蛋白点,用双蒸水冲洗胶粒2次,加入200 μL含有100 mmol/L NH4HCO3的30%乙腈溶液,振荡直至胶粒无色,去除脱色液,加入50 μL无水乙腈,脱水2次后得白色胶粒。每管加入5 μL胰蛋白酶液,置于4 ℃冰箱中30~60 min,使胶粒完全吸收酶液,然后去除多余酶液,加入20 μL 25 mmol/L NH4HCO3溶液,37 ℃水浴20 h。将酶解液转移到新离心管中,在原管中加入萃取液进行超声萃取,然后将酶解液和萃取液混合,进行旋转真空浓缩,浓缩至3 μL左右时停止,如果浓缩干燥,则加入TA60溶液3 μL振荡复溶。吸取0.7 μL样品点样,干燥后加0.7 μL基质,干燥后采用MALDI-TOF/TOF MS质谱仪对样品进行肽质量指纹图谱分析。一级质谱数据采集模式采用正离子反射模式与自动获取数据模式,扫描范围为700~3500 Da。选取5~10个信号强度较好的一级质谱峰进行二级质谱分析,使用BioTools软件进行整合,用Mascot软件(http://www.matrixscience.com)在NCBInr中对质谱数据进行搜索匹配。
1.2.3氨基酸分析
(1)游离氨基酸测定[11]:参照文献[11]。
(2)总氨基酸测定:取一定量的黄酒混浊蛋白或黄酒样品,加入浓盐酸,110 ℃水解22 h,转移到容量瓶中定容后过滤,经过蒸酸、离心,按照参考文献[11]的方法进行测定。
(3)氨基酸疏水性分析:根据Lozano等[12]的经验公式计算氨基酸的疏水性,并计算氨基酸平均疏水值Hφavg。
1.2.4黄酒混浊蛋白的二级结构分析
(1)样品预处理
混浊蛋白:购买市场上已经产生混浊的黄酒,静置5 d,采用虹吸法将上清酒液去除,留下底部约80 mL酒样,振荡混匀后,12 000 r/min下离心30 min,收集沉淀。将沉淀装入1 000 Da的透析袋在流动水中透析48 h,冷冻干燥后,进行傅里叶红外光谱分析。
黄酒上清液:向黄酒中添加硫酸铵至饱和度为80%,4 ℃冰箱过夜,离心收集沉淀,将沉淀物转入截留分子量1 000 Da的透析袋,透析48 h,冷冻干燥后,进行傅里叶红外光谱分析。
(2)傅里叶变换红外光谱分析(FTIR)
冷冻干燥后的蛋白质样品的傅里叶变换红外光谱分析按照参考文献[13]的方法进行。谱图处理按照参考文献[14]的方法进行。
2结果与分析
2.1黄酒混浊蛋白质的双向电泳分析
由于黄酒的混浊成分复杂,含有多酚、糊精、金属离子、蛋白质等多种成分[5,15],并且沉淀中的蛋白质可能与多酚结合形成大分子物质,传统的TCA-丙酮沉淀处理样品的方法难以得到高质量的混浊蛋白质样品用于双向电泳,因此,在对混浊蛋白的处理中,采用酚抽提结合TCA-丙酮沉淀的方法处理混浊样品,双向电泳结果见图1。

a-瓶装黄酒混浊蛋白双向电泳图谱;b-古越龙山未进行稳定性处理黄酒样品混浊蛋白图1 不同黄酒样品混浊蛋白质双向电泳图谱(7 cm,pH 3~10,NL)Fig.1 2-DE profiles of haze proteins in Chinese rice wine samples(7 cm, pH 3~10, NL)
从图1可以看出,在瓶装黄酒与未进行稳定性处理的黄酒自然存放产生的沉淀物质中,蛋白质的分布相似,主要为酸性蛋白区和低分子碱性端蛋白质。在酸性端与碱性端中间分布的蛋白质点较少且颜色浅,这说明混浊蛋白质中这类蛋白质的含量较少。低分子碱性端蛋白点颜色较深,蛋白质含量较大。
2.2黄酒混浊蛋白质的MALDI-TOF/TOF MS鉴定分析
挖取图1中的蛋白点进行质谱分析及全数据库蛋白质检索,共鉴定成功15个点,鉴定成功的蛋白质点标于图1中,各蛋白质点的鉴定结果见表1。
从表1中可以看出,鉴定成功的混浊蛋白共有9种。在这些蛋白中,来源于小麦的蛋白质有6种,分别为类燕麦蛋白b1、类燕麦蛋白、二聚α-淀粉酶抑制剂、病程相关蛋白、病程相关蛋白-4(wheatwin1)、病程相关蛋白-4、几丁质酶II等,它们的分子量分布在13 ~16 kDa和28~46 kDa之间,在混浊蛋白质中占较大比重,是混浊蛋白最主要的来源;来源于水稻的蛋白质有类燕麦蛋白和β-淀粉酶,分子质量分别为33.4 kDa和55.4 kDa。

表1 黄酒混浊蛋白质谱鉴定结果(7 cm,pH 3~10,NL)
由鉴定结果可知,混浊蛋白质主要来源于黄酒酿造原料麦曲和糯米。二聚α-淀粉酶抑制剂的蛋白点最多,均来源于小麦,病程相关类蛋白次之(PR、PR-4、几丁质酶II),其次为类燕麦蛋白、β-淀粉酶。经查阅文献发现,二聚α-淀粉酶抑制剂和类燕麦蛋白同样是啤酒混浊蛋白的组成部分[16],几丁质酶在葡萄酒混浊中也有发现[17]。
二聚α-淀粉酶抑制剂是α-淀粉酶抑制剂的二聚体。α-淀粉酶抑制剂最早发现于小麦种子中,是一种糖水解酶抑制剂,对不同来源的α淀粉酶都有强烈的抑制作用,在小麦种子中主要存在12、24、60 kDa三种形式,其中12kDa为单体的α-淀粉酶抑制剂,24、60 kDa分别为二聚体和四聚体[18-20]。α-淀粉酶抑制剂可以抑制内生性淀粉酶的活性,使摄入体内的淀粉不能水解,阻断能量的主要来源,从而可以防御昆虫的侵害[19, 21]。研究发现[20],α-淀粉酶抑制剂具有较好的酸碱耐受性,蛋白性质结构在pH 4~11范围内稳定,在70℃作用30 min后活性基本没有变化,80℃作用10 min活性仅降低10%左右。据此分析,在黄酒煎酒的过程中,其热稳定性好,只有少部分的α-淀粉酶抑制剂失活变性凝固析出,大部分还存在于酒液中,经过长时间的贮存,外界环境发生变化,导致其逐渐析出形成混浊。
病程相关蛋白是植物在病理环境下诱导产生的一类水溶性蛋白质总称,主要功能为参与植物的抗病反应,降解病原物毒素,抑制病毒外壳蛋白与植物分子结合,组成植物的防卫体系[22-24]。PRs根据氨基酸序列相似度可分为PR-1~14共14个家族,其中几丁质酶II属于PR-3家族,能够降解病原菌的细胞壁,提高植物的抗病能力。研究发现,PRs是一类相对分子质量为10~40 kDa的单体蛋白质,稳定性较强,大部分的PRs能够耐受低pH、重金属、蛋白酶和高温[25]。据此推测,在黄酒的酿造过程中,由于PRs稳定性较好,一直存在于酒液中,经过煎酒和过滤过程,不能将其去除,最终存在于成品酒中,成为黄酒的蛋白质混浊的一部分。
类燕麦蛋白是小麦中的储藏蛋白,其主要存在于小麦胚乳中,属于低分子量谷蛋白,因与大麦中的燕麦蛋白序列相似而得名[26],分为A亚型和B亚型两种蛋白质。A亚型蛋白质所含的168个氨基酸中谷氨酸有36个,占氨基酸总量的21%,B亚型蛋白质所含的284个氨基酸中谷氨酸有80个,占氨基酸总量的28%,这与混浊蛋白氨基酸分析中谷氨酸含量占有较高比例相符合。另外,类燕麦蛋白含有高冗余的半胱氨酸残基,分子内和分子间存在的二硫键可以形成高分子聚合体,对混浊形成有重要影响。
2.3黄酒混浊蛋白质的氨基酸分析
瓶装黄酒混浊和上清中的蛋白质的氨基酸分析结果见表2。酒体蛋白非游离氨基酸的定义为总氨基酸减去游离氨基酸[28]。疏水值表示的是氨基酸的疏水性,值越大表示疏水性越强。

表2 黄酒混浊蛋白和酒体蛋白中的氨基酸分析结果
在黄酒混浊蛋白中,谷氨酸含量最高,占总氨基酸含量的20.48%,其次为脯氨酸和天冬氨酸,分别占10.12%和8.54%。在酒体蛋白氨基酸中,含量最高的也为谷氨酸,占总氨基酸含量的31.98%,其次为天冬氨酸和丝氨酸,分别占8.67%和7.53%。谷氨酸和天冬氨酸的疏水值等于零,属于亲水性的氨基酸。丝氨酸疏水值为-0.3,是亲水性最强的氨基酸,在混浊蛋白中含量为4.73%,酒体蛋白中丝氨酸的含量为混浊蛋白的1.59倍。脯氨酸的疏水值为2.6,是氨基酸中疏水值较大的,在混浊蛋白中所占的比例是酒体蛋白中所占比例的1.38倍。疏水性的氨基酸在混浊蛋白中的含量为60.19%,在酒体蛋白中的含量为45.65%,前者为后者的1.32倍。酒体蛋白氨基酸平均疏水值为0.79,混浊蛋白质氨基酸平均疏水值为0.92,比酒体蛋白氨基酸平均疏水值高16.46%。表明混浊蛋白具有更强的疏水性。
2.4黄酒混浊蛋白质二级结构分析
蛋白质的二级结构是指多肽链的空间结构,不考虑侧链的构象及整个肽链的空间排列,常见的二级结构有α-螺旋、β-折叠、β-转角和无规则卷曲等[14]。傅里叶红外光谱(FTIR)是一种振动光谱,是一种研究蛋白质构象与功能关系的有效途径,目前广泛应用于研究蛋白质二级结构。
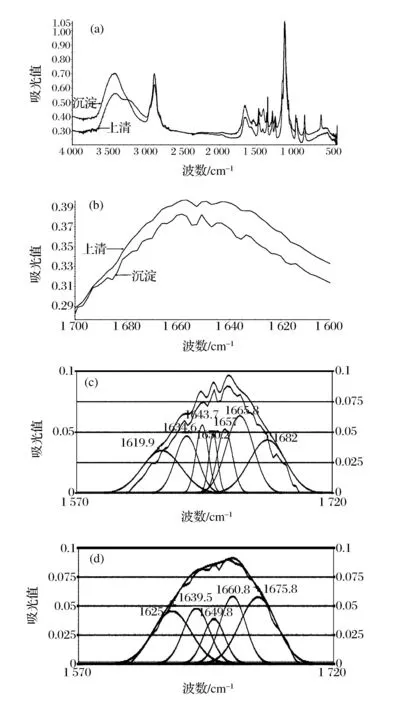
a-全波段傅里叶红外光谱图;b-酰胺I带;c-混浊酰胺I带;d-上清的酰胺I带图2 傅里叶红外光谱图及酰胺I带拟合曲线Fig.2 The FTIR spectra and the fitted curve
由图2(a)可以看出,在波段4 000~3 200 /cm,混浊蛋白质的吸光度明显大于上清蛋白质,而在酰胺I带(1 700~1 600 /cm)处,上清蛋白质的吸光度大于混浊蛋白质(图2 b),相对于混浊来说,上清蛋白质的吸光度偏向于低波段,这说明在混浊和上清中的蛋白质结构有差异。截取光谱图中酰胺I带的吸光度数据,利用PeakFit 4.12 software (美国Systat软件公司)软件进行谱图拟合,并根据不同的峰指认相应的二级结构,根据峰面积大小计算各二级结构的相对百分含量。
由图2c和d可知,黄酒混浊蛋白质和上清中蛋白质的拟合图存在显著性差异,混浊蛋白质有7个明显的峰,而上清中只存在5个,每个峰所对应的二级结构如表3所示。表4为混浊蛋白质和上清蛋白质中各二级结构的相对百分含量。
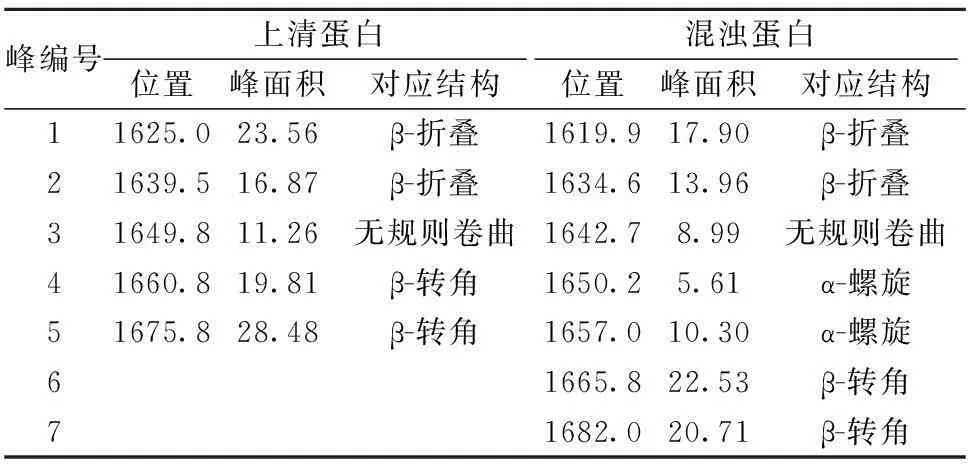
表3 傅里叶红外光谱拟合图谱分析(%)
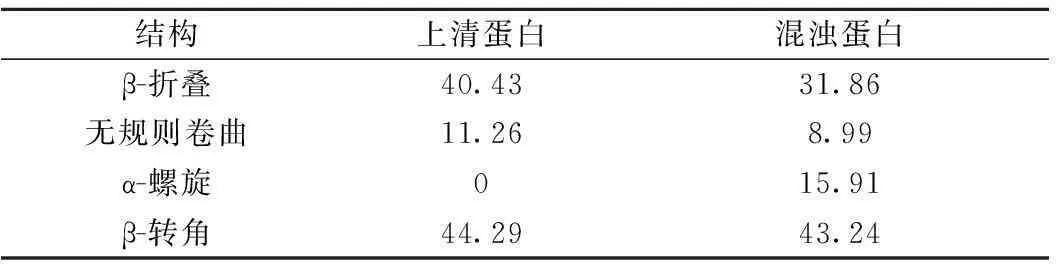
表4 黄酒混浊蛋白质和上清蛋白质二级结构含量(%)
由表4可知,混浊蛋白与上清蛋白的二级结构组成有显著的差异,其中最明显的是上清蛋白中不含有α-螺旋结构,而在混浊蛋白中α-螺旋的含量为15.91%,而β-折叠、无规则卷曲和β-转角在上清蛋白中的含量分别比混浊蛋白高出26.9%、25.3%和2.4%。研究发现,蛋白质二级结构与表面疏水性相关,并且其水溶性与α-螺旋含量负相关,与β-折叠和无规则卷曲正相关,而与其β-转角含量无相关性[11, 29-30]。高α-螺旋含量、低β-折叠和无规则卷曲含量是黄酒混浊蛋白质的主要结构特征。黄酒生产中,为了保证瓶装黄酒的生物稳定性,一般采用80~85 ℃、40 min的条件进行杀菌[31]。可能高温灭菌使蛋白质的高级结构包括二级结构破坏,从而导致疏水性增强,水溶性降低,最终形成混浊。
3结论
黄酒混浊蛋白主要分布在13~16 kDa和28~55.4 kDa之间。质谱鉴定结果表明,混浊蛋白中有6种来源于小麦的蛋白质,分别为类燕麦蛋白b1、类燕麦蛋白、二聚-α淀粉酶抑制剂、病程相关蛋白、病程相关蛋白-4、几丁质酶II,来源于水稻的蛋白质主要是类燕麦蛋白和β-淀粉酶。
黄酒混浊蛋白中谷氨酸含量最高,其次为脯氨酸和天冬氨酸;混浊蛋白质氨基酸平均疏水值为0.92,比黄酒上清中蛋白质氨基酸平均疏水值高16.46%。通过FTIR分析,α-螺旋结构在混浊蛋白质中的含量为15.91%,而相对应的上清蛋白质中不含α-螺旋,并且混浊蛋白中β-折叠、无规则卷曲结构含量显著低于其上清中相应指标的含量。因此,黄酒混浊蛋白的氨基酸组成的高疏水性和低水溶性是形成黄酒混浊的蛋白质的主要特征。
参考文献
[1]顾国贤.酿造酒工艺学[M].第2版.北京:中国轻工业出版社,2007.
[2]林峰,白少勇,邹慧君.黄酒蛋白质沉淀[J].酿酒科技,2005(9):69-72.
[3]钱俊青,张笑麟,张西宁.黄酒析出物化学成份的分析测定[J].食品科学, 1997,18(3): 45-49.
[4]谢广发,孟中法,周建弟.黄酒蛋白质的测定及其沉淀原因探讨[J].酿酒科技, 2002(3): 64-68.
[5]谢广发,周建弟,胡志明,等.瓶装黄酒酒脚成分的测定[J].酿酒科技, 2002(6):80-80.
[6]丁关海,周建弟.黄酒非生物性沉淀的成分及解决方法[J].酿酒, 2003, 30(3):42-43.
[7]杨国军,俞关松,尉冬青.黄酒中蛋白质分布及含量与酒质稳定性关系的研究[J].中国酿造,2005(10): 47-49
[8]樊世英,孙军勇,谢广发,等.澄清剂对黄酒混浊蛋白去除效果的研究[J].食品工业科技,2015, 36(8): 167-170.
[9]谭新勇.黄酒非生物混浊的初步研究[D].无锡:江南大学,2013.
[10]WEI W,RITA V,MONICA S,et al.A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J].Electrophoresis,2005,27(13):2 782-2 786.
[11]GAO X L,CUI C,REN J Y,et al.Changes in the chemical composition of traditional Chinese-type soy sauce at different stages of manufacture and its relation to taste[J].International Journal of Food Science & Technology,2011,46(2):243-249.
[12]LOZANO P, DIDIER C, JOSE L.Food protein nutrient improvement by protease at reduced water activity[J]. Jounal of Food Science, 1994, 59(4): 876-870.
[13]孙鹏飞,高献礼,闫爽,等.酱油二次混浊蛋白质的分离、鉴定及氨基酸分析[J].食品工业科技,2014, 35(5):87-90.
[14]ZHAO X Y,CHEN F S,XUE W T,et al. FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J].Food Hydrocolloids,2008(22): 568-575.
[15]JUINN-CHIN H,DAVID A.Heat-unstable proteins in wine.I.characterization and removal by bentonite fining and heat treatment[J].American Journal of Enology and Viticulture,1987,38(1): 11-16.
[16]魏桃英,寿泉洪,唐国芳.谈黄酒的非生物性浑浊和沉淀[J].酿酒,2009(4):56-57.
[17]TAKASHI I,KAZUHIRO S.Beer proteomics analysis for beer quality control and malting barley breeding[J]. Food Research International,2013,54(1):1 013-1 020.
[18]SILANO V,FURIA M,GIANFREDA L,et al. Proteinaceous α-amylase inhibitors[J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics,2004,1696(2): 12.
[19]SILANO V,FURIA M, GIANFREDA L, et al.Inhibition of amylases from different origins by albumins from the wheat kernel[J].Biochimica et Biophysica Acta (BBA) - Enzymology,1975,391(1):170-178.
[20]王文蒙.α-淀粉酶抑制剂的提取、分离及性质研究[D].天津:天津商业大学,2010.
[21]IULEK J,FRANCO O L,SILVA M,et al.Purification, biochemical characterisation and partial primary structure of a new alpha-amylase inhibitor from Secale cereale (rye)[J]. The International Journal of Biochemistry & Cell Biology, 2000, 32(11-12): 1 195-1 204.
[22]EMDADUL H,FUMITAKA A,ATSUSHI O, et al.Characterization of a wheat pathogenesis-related protein, TaBWPR-1.2, in seminal roots in response to waterlogging stress[J].Journal of Plant Physiology,2014, 171(8): 602-609.
[23]WANG X J,TANG C L,DENG L,et al.Characterization of a pathogenesis-related thaumatin-like protein gene TaPR5 from wheat induced by stripe rust fungus[J]. Physiologia Plantarum,2010,139(1):27-38.
[24]NAZ R,BANO A,WILSON N L,et al.Pathogenesis-related protein expression in the apoplast of wheat leaves protected against leaf rust following application of plant extracts[J].Phytopathology,2014,104(9): 933-944.
[25]刘纪元,佟少明,侯和胜.植物病程相关蛋白研究进展[J].黑龙江科技信息,2012(5):65-65.
[26]魏慧.小麦中类燕麦贮藏蛋白avenin-like的基因克隆、原核表达及加工品质效应研究[D].咸阳: 西北农林科技大学,2012.
[27]慕钰文.江苏啤酒大麦麦芽中P-淀粉酶对过滤性能的影响[D].无锡:江南大学,2013.
[28]高献礼,孙鹏飞,闫爽,等.酱油二次沉淀制备方法的对比[J].食品与发酵工业,2013,39(1): 46-50.
[29]WANG C, JIANG L Z, WEI D X, et al. Effect of secondary structure determined by FTIR spectra on surface hydrophobicity of soybean protein isolate[J]. Procedia Engineering, 2011,15:4 819-4 827.
[30]穆丽霞.大豆蛋白-糖接枝改性及其结构与功能特性研究[D].广州:华南理工大学,2010.
[31]谢广发.黄酒酿造技术[M].北京:中国轻工业出版社,2010.
Isolation, identification of haze proteins from Chinese rice wine and analysis of its amino acid composition and secondary structure
SUN Jun-yong1,2,3,FAN Shi-ying1,2,3,XIE Guang-fa3,4,LU Jian1,2,3,5
1(The Key Laboratory of Industrial Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)2(National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China)3(School of Biotechnology,Jiangnan University,Wuxi 214122,China)4(National Engineering Research Center for Chinese Rice Wine,China Shaoxing Rice Wine Group Co.,Ltd,Shaoxing 312000,China)5(Industrial Technology Research Institute of Jiangnan University in Suqian,Suqian 223800,China)
ABSTRACTThe haze proteins were isolated from Chinese rice wine, and separated by two-dimensional electrophoresis (2-DE), then identified with matrix-assisted laser desorption ionisation-time of flight/time of flight mass spectrometry (MALDI-TOF/TOF MS). The results showed that, the main components of haze proteins were proteins originated from wheat including avenin-like protein b1, avenin-like protein, dimer α-amylase inhibitor, pathogenesis-related proteins, pathogenesis-related protein - 4, and Class II chitinase, and proteins originated from rice including avenin-like protein and β-amylase. The amino acid composition and secondary structure of proteins in haze and supernatant were analyzed by high-performance liquid chromatography and fourier transform infrared spectrometer, respectively. It was found that haze proteins contained a large amount of glutamic acid, which accounted for 20.48% of total amino acids. Furthermore, the content of hydrophobic amino acids in the haze proteins was 24.2% higher than that in the supernatant. Higher content of α-helix with lower content of β-sheet and random coil was the major structural feature of the haze protein in Chinese rice wine.
Key wordsChinese rice wine; haze protein; MALDI-TOF/TOF MS; amino acid composition; secondary structure
收稿日期:2015-09-23,改回日期:2015-10-29
基金项目:973项目(2012CB720802);973项目(2013CB733602);绍兴市科技计划项目(申请编号2015018003);国家自然科学基金重点项目(31130043);江苏高校优势学科建设工程资助项目;高等学校学科创新引智计划(111计划)资助项目(111-2-06)
DOI:10.13995/j.cnki.11-1802/ts.201602001
第一作者:博士研究生,讲师(陆健教授为通讯作者,E-mail:jlu@jiangnan.edu.cn)。

