BDH2基因过表达对啤酒酵母双乙酰代谢的影响
BDH2基因过表达对啤酒酵母双乙酰代谢的影响
石婷婷,李凭,肖冬光*
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学 生物工程学院,天津,300457)
摘要利用基因工程手段,采用PCR技术扩增啤酒酵母S2中的双乙酰还原酶基因BDH2,构建了BDH2基因整合过表达的重组酵母菌株B2Z。利用real-time PCR的方法对酵母BDH2基因的表达水平进行了检测,相比于出发菌株,其BDH2基因的表达水平提高到原来的7.35倍。啤酒发酵实验表明,BDH2基因的过表达对双乙酰的降低有效果,B2Z双乙酰的峰值和双乙酰最终含量比出发菌株S2分别降低42.61%和32.73%,其他啤酒指标如酒精度、发酵度、残糖和风味物质与出发菌株略有变化,但各物质的浓度都在优质啤酒建议的范围之内,符合啤酒发酵的指标要求。
关键词啤酒;BDH2基因;基因工程;酿造;双乙酰
双乙酰是啤酒发酵过程中的重要副产物,它与2,3-戊二酮合称为连二酮,连二酮是影响啤酒风味成熟的重要物质。啤酒中2,3-戊二酮的含量远低于双乙酰,但是2,3-戊二酮的风味阈值又大大高于双乙酰,因此,双乙酰是决定啤酒风味成熟的重要物质,当啤酒中双乙酰的含量超过阈值就会产生一种令人不愉快的搜饭味,影响啤酒的感官质量[1-3]。
双乙酰是由啤酒酵母细胞通过缬氨酸代谢途径产生的α-乙酰乳酸(α-acetolactate)产生的,分泌至细胞外的α-乙酰乳酸经过非酶促的氧化脱羧反应自生合成双乙酰,生成的双乙酰被酵母重新吸收,在双乙酰还原酶的作用下被还原成乙偶姻,乙偶姻被乙偶姻还原酶进一步还原成2,3-丁二醇,再次分泌至细胞外[4-6],乙偶姻在啤酒中的风味阈值为3~50 mg/L,远大于双乙酰的0.1 mg/L,可促进啤酒口味达到成熟[7]。但在后酵和贮酒过程中,酵母数量少,且还原双乙酰的速度慢,造成双乙酰还原周期长,一般在啤酒发酵后期还原双乙酰需要约5~10 d[8],此阶段占啤酒酿造过程总时间的60%以上,因而双乙酰的形成与消除是啤酒风味成熟的重要限速步骤。BDH2基因所编码的双乙酰还原酶是双乙酰还原成乙偶姻过程中的关键酶[9],增加BDH2基因的拷贝数,可加快双乙酰的还原,减少双乙酰。本研究通过分子生物学的方法,将BDH2基因置于强组成型启动子后,在啤酒工业酵母中进行了加强表达,并进行啤酒发酵实验,检测发酵液中双乙酰的含量变化及其发酵性能,并利用real-time PCR的方法对酵母BDH2基因的表达水平进行了检测。
1材料和方法
1.1菌株和质粒(表1)
表1 本实验所使用菌株和质粒
1.2试剂和工具酶
引物,委托鼎国生物技术有限公司合成;高保真性DNA 扩增酶采用TransTaqHiFi,购自北京全式金生物技术有限公司;限制性内切酶、DNA 连接酶、去磷酸化酶购自大连宝生物公司;DNA提取试剂盒购自大连宝生物公司;G418、氨苄青霉素购自北京鼎国昌盛生物技术有限责任公司;鲑鱼精DNA,购自北京索莱宝科技有限公司。
1.3主要培养基
YEPD培养基:10 g/L酵母提取物,20 g/L葡萄糖,20 g/L蛋白胨,pH 6.0,121 ℃灭菌20 min。
YEPD(G418)培养基:YEPD固体培养基溶化后,降温至60℃左右时加入一定量的G418储存液,使得G418的最终质量浓度为600 mg/L。
LB培养基:10 g/L胰蛋白胨,10 g/L NaCl,5 g/L酵母提取物,pH 7.0,121 ℃灭菌20 min。
LB(Ampr)培养基:LB固体培养基溶化后,降温至60 ℃左右时加入一定体积的100 mg/mL的氨苄青霉素溶液,使得氨苄青霉素的最终质量浓度为100 mg/L。
麦芽汁培养基:称量一定量的粉碎的麦芽,按1∶4的料水比于65 ℃糖化至碘检完毕,用糖度计调整外观糖度至12°Brix,115 ℃灭菌20 min。
以上培养基的固体培养基需加20 g/L琼脂。
1.4实验方法
1.4.1引物设计(表2)

表2 本研究所用引物
1.4.2E.coli的转化
质粒和PCR扩增好的片段在E.coli中进行转化[10],构建BDH2过表达质粒。
1.4.3啤酒酵母的转化剂转化子鉴定
酵母转化采用醋酸锂转化法[11]。并且利用G418筛选转化子,提取酵母转化子的基因组后采用PCR 进行验证,设计转化子上不同位置的引物进行PCR 验证, 如果能够扩增得到预期大小的条带,则说明是正确的转化子。
1.4.4BDH2基因表达量的测定
利用real-time PCR的方法[12]检测BDH2基因表达量的变化。
1.4.5CO2失重的测定
发酵初期每天称重测定发酵液的质量。
1.4.6双乙酰的测定(啤酒分析方法)
应用采用邻苯二胺比色法测定[13]。
1.4.7还原糖、酒精度及发酵度的测定
还原糖采用斐林试剂法测定[14];酒精度和发酵度的测定依据啤酒分析方法进行测定[13]。
1.4.8风味物质的测定
啤酒发酵液经蒸馏后采用气相色谱法测定。内标物为乙酸正戊酯。气相色谱仪为Agilent 7890C;色谱柱 HPINNOWAX Polyethylene Glyco 260 ℃:30 m×320 μm×0.5 μm,配FID检测器。载气为高纯氮,流速2.5 mL/min。起始柱温为50 ℃,保持2 min,以 5℃/min的升温速度升至80 ℃,保持2 min,最后以10 ℃/min 的升温速度升至100 ℃。检测器温度为250 ℃,进样口温度为230 ℃,进样量为0.4 μL。分流方式为分流,分流比为20∶1。
1.5啤酒发酵实验
一级种子培养:取斜面菌种1环,接种于装有5 mL的12 °Brix麦汁培养基的试管中,在28 ℃、180 r/min下培养24 h。
二级种子培养:一级种子液按质量分数10%的接种量接入盛有50 mL的12 °Brix麦汁的150 mL三角瓶内,16 ℃静置培养72 h。
啤酒发酵:二级种子液经过离心得到酵母泥,酵母泥按质量分数0.5%的接种量接入盛有250 mL的12 °Brix麦汁的三角瓶内,10 ℃静置发酵9 d,4 ℃后酵至15 d。
2结果与分析
2.1BDH2过表达质粒的构建
选用一种酵母菌游离型质粒穿梭载体YEp352,一种组成型表达的酿酒酵母强启动子PGK,使插入到PGK启动子和终止子之间的目的基因可以在酿酒酵母中过量表达。本实验研究的出发酿酒酵母菌株对G418敏感,因此选择G418抗性作为筛选标记。
游离型质粒穿梭载体YEp352和PGK片段经BamHI 和SalI 酶切处理后,用DNA连接酶过夜连接,将PGK连接到YEP352质粒上;克隆目的基因BDH2,经XhoI酶切处理并去磷酸化后,插入表达载体YEP352上的PGK启动子和终止子之间;KANMX基因盒从PUG6质粒上进行PCR扩增,经BamHI酶切处理后并去磷酸化,连接到表达载体YEP352上的BamHI位点。成功构建了含有PGK1强启动子、目的基因BDH2和KANMX抗性基因的BDH2过表达重组质粒YEP-KPB2,见图1。

图1 重组质粒YEP-KPB2构建的流程Fig.1 Construction of recombinant plasmid YEP-KPB2
2.2重组酵母菌株的构建
以重组质粒YEP-KPB2为模板,GB2-UP和GB2-DOWN为引物扩增扩增得到重组片段“KanMXPGK+BDH2”。然后利用醋酸锂转化法使敲除盒与出发菌株S2基因组的BDH2基因上发生同源重组,生长在G418质量浓度为600 mg/L的YEPD平板上。对生长的转化子进行PCR验证,即以转化子基因组为模板,以K-UP和K-DOWN为引物,能够扩增得到1 600 bp的片段,与理论上KanMX基因大小一致,说明KanMX基因已经整合入转化子染色体上;再次,验证重组片段的各个组件是否都发生了正确的重组,以YZ-SUP和YZ-SDOWN为引物,能够扩增得到481 bp的片段;以YZ-XUP和YZ-XDOWN为引物,能够扩增得到780 bp的片段,并以出发菌株S2的基因组为对照模板,没有PCR扩增出相应的片段,说明转化子发生了正确的同源重组。转化子的PCR 验证结果见图2。最终筛选得到BDH2基因整合过表达的重组菌株,命名为B2Z。

图2 BDH2整合过表达重组菌株PCR验证Fig. 2 PCR analysis of the yeast recombinants with BDH2 overexpression1, 2 以K-UP和K-DOWN为引物进行验证;3, 4 以YZ-SUP和YZ-SDOWN为引物进行验证;5, 6 以YZ-XUP和YZ-XDOWN为引物进行验证;1, 3, 5 模板为出发菌株S2的基因组;2, 4, 6 模板为BDH2整合过表达重组菌株B2Z的基因组
2.3BDH2基因表达量的测定
利用real-time PCR的方法对酵母BDH2基因的表达水平进行了检测,见图3。
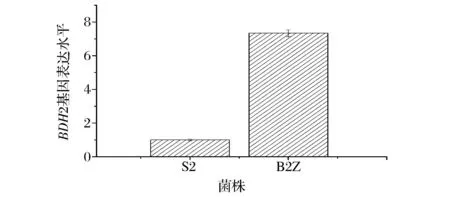
图3 重组菌株与出发菌株BDH2基因表达量对比Fig.3 Measurement of of expression levels of BDH2 gene in the recombinant strain and the host strain by real time PCR
由图3可知,BDH2基因的过表达,增加了BDH2基因的拷贝数,重组菌株相比于出发菌株,其BDH2基因的表达水平提高到原来的7.35倍。
2.4啤酒发酵期间CO2失重的变化
从发酵开始到发酵第9天,每天称重发酵液的质量,计算累计CO2失重,比较重组菌株和出发菌株的发酵速率,见图4。
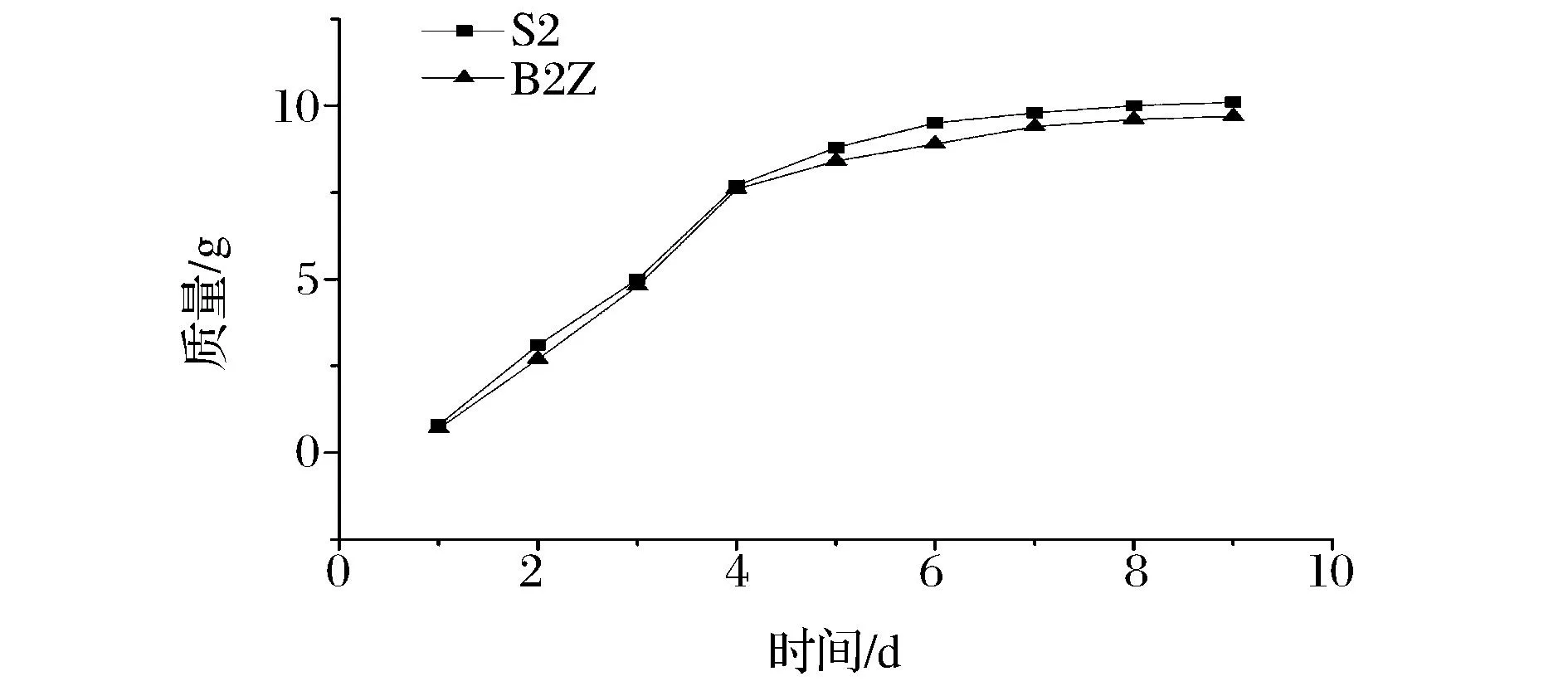
图4 重组菌株和出发菌株累计CO2失重的对比Fig. 4 Comparison of cumulative CO2 weightlessness of the recombinant yeast strain and the host strain
由图4可知,重组菌株B2Z和出发菌株S2,在发酵2~7 d累计CO2失重均呈对数值增加,在第9天时基本不再增加,期间,重组菌株B2Z的累计CO2失重比出发菌株S2略低,但是整体发酵趋势与S2一致,说明BDH2基因的过表达没有影响酵母的生长速率,也没有影响啤酒发酵的速度。
2.5重组菌株与出发菌株双乙酰代谢的比较
在啤酒发酵过程中测定了重组菌株和出发菌株的双乙酰的峰值,发酵结束时,测定了各菌株的双乙酰含量,见图5。
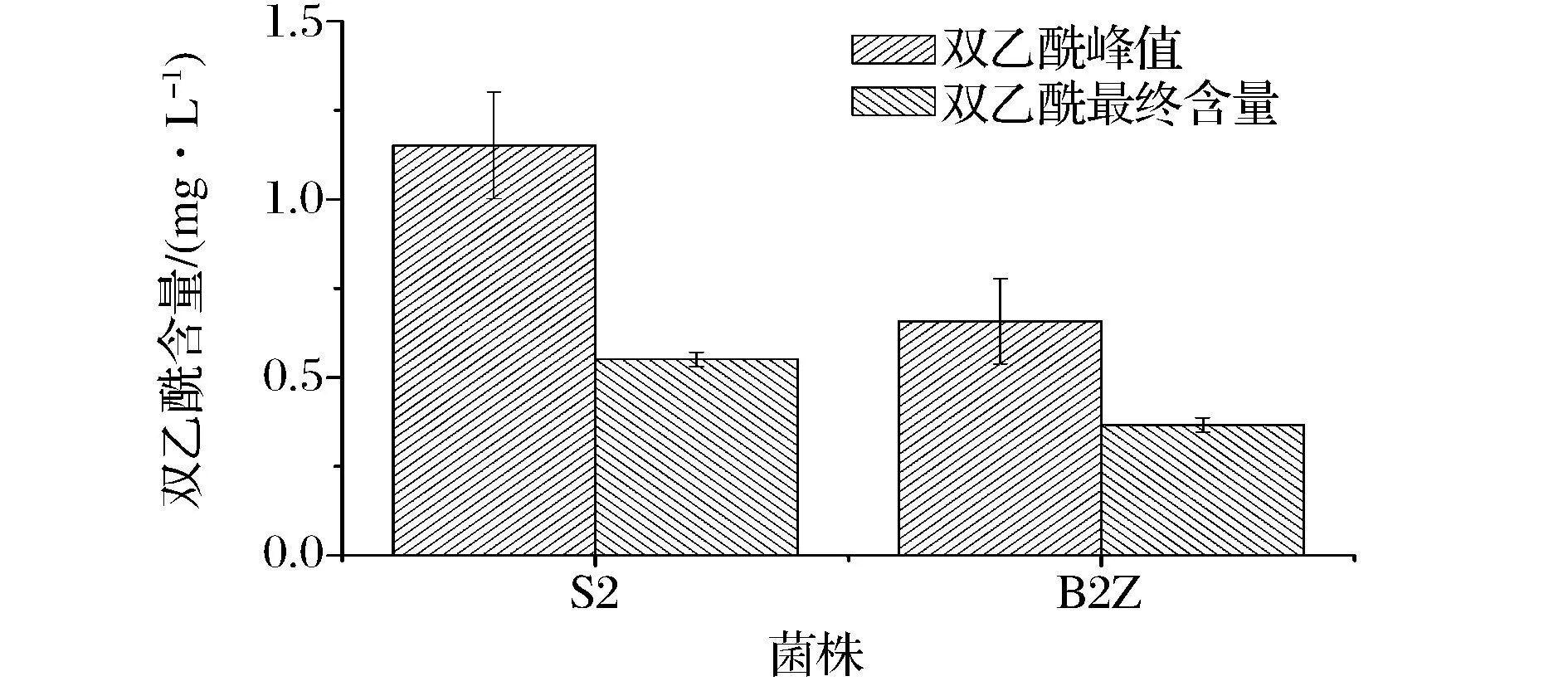
图5 重组菌株与出发菌株双乙酰代谢的对比Fig. 5 Comparison of diacetyl metabolic of the recombinant yeast strain and the host strain
由图5可知,在啤酒发酵过程中,重组菌株的双乙酰峰值比出发菌株降低了,出发菌株S2,重组菌株B2Z的双乙酰峰值分别为1.15 mg/L和0.66 mg/L,比出发菌株S2降低了42.61%;发酵结束时,出发菌株S2,重组菌株B2Z的双乙酰最终含量分别为0.55 mg/L和0.37mg/L,比出发菌株S2降低了32.73%。研究发现,利用质粒Yep352和磷酸甘油酸激酶基因PGK1的启动子,将启动子PGK1插入Yep352质粒中,驱动了下游目的基因BDH2的表达,使其拷贝数得以增加,提高目的基因BDH2的基因表达水平,可以降低双乙酰的含量,BDH2基因的过表达对啤酒发酵中双乙酰的降低有效果。
2.6啤酒发酵结束后残糖、酒精度及发酵度的测定
发酵结束时,测定了各重组酵母菌株与初发菌株的酒精度,真正发酵度和残糖,见表3。
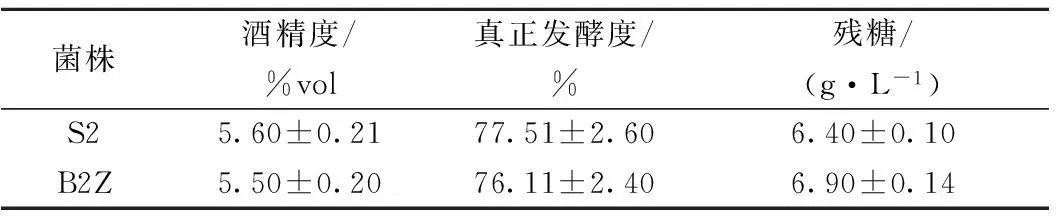
表3 重组菌株与出发菌株酒精度、真正发酵度
由表3看出,在发酵结束后重组菌株相比于出发菌株,残糖略高,酒精度略低于S2。在发酵结束后重组菌株与出发菌株在酒精度、残糖、外观发酵度和真正发酵度等指标上没有明显差异,并且各项指标均符合国家规定的标准,说明BDH2基因的过表达并没有明显影响到这些啤酒基础指标,重组菌株符合啤酒发酵的指标要求,具有一定的实际应用潜力。
2.7啤酒发酵结束后风味物质的测定
发酵结束时,测定了各重组酵母菌株与初发菌株之间代谢产生主要高级醇和酯类物质,见表4。
结果表明,BDH2基因过表达的重组酵母菌株与出发菌株酿制的啤酒相比,其发酵液中含有的某些主要高级醇和乙酸乙酯的量有所降低,乳酸乙酯和乙偶姻的量有所提高。这可能是双乙酰代谢途径某些物质代谢流发生变化导致一些醇类物质和酯类物质代谢能力的变化,BDH2基因的过表达降低了双乙酰的含量,使双乙酰还原为乙偶姻,因此乙偶姻的含量提高了。虽然各风味物质的量有所变化,但都在优质啤酒建议的范围之内。
表4重组菌株与出发菌株风味物质的比较

单位:mg/L
注:a代表重组菌株与出发菌株代谢产风味物质的量具有明显的差异(Student’s t testP≤0.05)。
3结论
以实验室保藏菌株为出发菌株,利用分子生物学方法对BDH2基因进行了整合过表达。进行啤酒发酵实验,结果显示BDH2基因的过表达确实能有效的降低双乙酰的含量,与出发菌株S2相比,双乙酰峰值降低了42.61%,最终双乙酰含量降低了32.73%。 利用real-time PCR的方法对酵母BDH2基因的表达水平进行了检测,相比于出发菌株,其BDH2基因的表达水平提高到原来的7.35倍。在啤酒发酵中,双乙酰的阈值范围为0.1~0.15 mg/L,本文中的啤酒发酵是实验室三角瓶小试发酵,未能达到工业上啤酒发酵的条件,因此,在后期双乙酰还原时未能使双乙酰还原到其阈值范围。其他啤酒指标如酒精度、发酵度、残糖和风味物质比出发菌株略有变化,但各物质的浓度都在优质啤酒建议的范围之内,符合啤酒发酵的指标要求。
参考文献
[1]KROGERUS K,GIBSON B R.Influence of valine and other amino acids on total diacetyl and 2,3-pentanedione levels during fermentation of brewer’s wort[J].Appl Microbiol Biotechnol.2013,97(15):6 919-6 930.
[2]MEILGAARD M C.Flavor chemistry of beer:Part II:Flavor and threshold of 239 aroma volatiles[J].MBAA Technical Quarterly,1975,12(3):151-168.
[3]KUSUNOKI K,OGATA T.Chromosomal integration and expression of two bacterial α-acetolactate decarboxylase genes in brewer's yeast[J].Yeast,2012,29(10):435-442.
[4]NAKATANI K,FUKUI N,NAGAMI K,et al.Kinetic analysis of ester formation during beer fermentation[J].Journal of the American Society of Brewing Chemists,1991,49(4):152-157.
[5]OHNO T,TAKAHASHI R.Role of wort aeration in the brewing process.Part 2:The optimal aeration conditions for the brewing process[J].Journal of the Institute of Brewing,1986,92(1):88-92.
[6]WANG J,XU A,WAN Y,et al.Purification and characterization of a new metallo-neutral protease for beer brewing fromBacillusamyloliquefaciensSYB-001[J].Appl Biochem Biotechnol,2013,170(8):2 021-2 033
[7]KELE P,LI X H,DUERKOP A.New luminescent ruthenium probes for detection of diacetyl[J].Microchemical Journal,2013,108:156-160.
[8]张吉娜,何秀萍,郭雪娜,等.低双乙酰抗老化啤酒酵母工程菌的构建[J].生物工程学报,2005,21(6):942-946.
[9]GONZALEZ E,FERNANDEZ M R,MARCO D,et al.Role ofSaccharomycescerevisiaeoxidoreductases Bdh1p and Ara1p in the metabolism of acetoin and 2, 3-butanediol[J].Applied and Environmental Microbiology,2012,76:670-679.
[10]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular Cloning:A Laboratory Manual and edition[M].Cold Spring Harbor:Cold Spring Harbor Laboratory Press,1989
[11]DANIEL Gietz R,WOODS R A.Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method[J].Methods in Enzymology,2002,350:87-96.
[12]LU Jun,DONG Jian,XIAO Dong-guang,et al.Construction of recombinant industrial brewer’s yeast with lower diacetyl production and proteinase A activity[J].European Food Research and Technology,2012,235(5):951-961.
[13]GB/T 4982-2008.啤酒分析方法[S]. GB/T 4982—2008,Method for analysis of beer.
[14]蔡定域.酿酒工业分析手册[M].北京:轻工业出版社,1988:63
Effects of overexpression ofBDH2 gene on diacetyl metabolic in beer yeast
SHI Ting-ting,LI Ping,XIAO Dong-guang*
(Key Lab of Industrial Fermenting Microbiology, Ministry of Education, Tianjin University of Science and Technology,Tianjin 300457, China)
ABSTRACTIn this paper, new industrial brewer’s yeast strains B2Z with BDH2 gene overexpression was constructed using genetic engineering by PCR amplification of the diacetyl reductase gene BDH2 in beer yeast S2. The expression levels of BDH2 gene in the recombinant strain and the host strain was measured by real time PCR, and compared with the host strain, the BDH2 gene expression level of B2Z was increased to 7.35 times. Beer fermentation experiments showed that overexpression of BDH2 gene could reduce the production of diacetyl, and the diacetyl peak and diacetyl concentration were decreased by 42.61% and 32.73% compared with those in the host strain S2. Other indicators such as alcohol, beer fermentation degree, residual sugar and flavor changed slightly, but were still in the suggested range of high quality beer, and conformed to the index requirements of beer fermentation.
Key wordsbeer; BDH2 gene; genetic engineering; brewing; diacetyl
收稿日期:2015-09-23,改回日期:2015-11-09
基金项目:食品微生物基因组改造(国家863计划)(2012AA022108);教育部“长江学者和创新团队发展计划”(IRT1166)
DOI:10.13995/j.cnki.11-1802/ts.201602003
第一作者:博士(肖冬光教授为通讯作者,E-mail:xiao99@tust.edu.cn)。

