大气细颗粒物对大鼠白细胞介素17表达的影响及连花清瘟的干预作用
韩书芝,梁会朋,张凤蕊,平芬
(1.河北省人民医院呼吸科,河北石家庄050051;2.河北省胸科医院,河北石家庄050048)
大气细颗粒物对大鼠白细胞介素17表达的影响及连花清瘟的干预作用
韩书芝1,梁会朋2,张凤蕊1,平芬1
(1.河北省人民医院呼吸科,河北石家庄050051;2.河北省胸科医院,河北石家庄050048)
摘要:目的探讨大气细颗粒物(PM2.5)急性暴露对大鼠肺部损伤的作用,及高、中、低剂量连花清瘟对其的保护作用。方法48只Wistar大鼠,随机分为4个实验组(PM2.5染尘组及高、中、低剂量连花清瘟干预组)和2个对照组(空白对照组及生理盐水对照组)。由石家庄市环境监测中心提供空气细颗粒物,制备PM2.5悬液,采用气管内滴注法。空白对照组无任何干预措施;生理盐水对照组给予气管滴注生理盐水(1 ml/kg);染尘组给予一次性气管内滴入PM2.5悬液(7.5 mg/kg);3组干预组首先分别连续灌胃给予低(生药2 g/kg)、中(生药4 g/kg)、高(生药8 g/kg)剂量的连花清瘟溶液4 d,第4天灌胃给药后分别经气管滴入PM2.5悬液(7.5 mg/kg)。应用酶联免疫分析(ELISA)法测定各实验组动物血清白细胞介素17(IL-17)及肺表面活性蛋白A (SP-A)水平,并在光镜下观察肺组织病理形态变化。结果空白对照组和生理盐水对照组间血清IL-17及SP-A差异无统计学意义(P>0.05),染尘组血清IL-17及SP-A水平较生理盐水对照组及空白对照组显著升高,差异有统计学意义(P<0.05);高、中、低剂量干预组较染尘组血清IL-17及SP-A水平均有不同程度降低,中高剂量组差异有统计学意义(P<0.05)。结论PM2.5急性暴露可以导致大鼠肺部损伤,连花清瘟对肺部损伤有保护作用。
关键词:环境细颗粒物(PM2.5);肺损伤;白细胞介素17;肺表面活性蛋白A;连花清瘟
大量流行病学研究表明,大气细颗粒物(PM2.5)与呼吸系统、心血管系统疾病及癌症等的入院率、发病率、死亡率密切相关[1]。PM2.5对健康的不利影响首先表现在呼吸系统,它会增加呼吸道感染、肺结核、肺癌等呼吸系统疾病的发病率[2]。PM2.5通过损伤呼吸道黏膜上皮细胞,部分沉积在肺泡内或肺间质内,激活肺内的免疫细胞,引起气道炎症反应,造成呼吸系统疾病[3]。中药复方制剂连花清瘟胶囊具有清瘟解毒,宣肺泄热的功效,已被广泛地应用于多种流感病毒感染引起的呼吸系统疾病[4]。本研究采集本地区大气细颗粒物,制备PM2.5悬液,观察PM2.5暴露及连花清瘟干预后大鼠血清中白细胞介素17(interleukin,IL-17)及表面活性蛋白A(surfactant protein,SP-A)的变化,探讨PM2.5对大鼠肺的损伤作用及连花清瘟的保护作用。
1 材料与方法
1.1PM2.5悬液配制
PM2.5由石家庄市环境监测中心提供,采用TEOM1405D双通道颗粒物监测仪收集大气细颗粒物,洗脱滤膜颗粒物,冷冻干燥,使用前以灭菌注射用水配制成浓度为7.5 mg/ml PM2.5悬液,超声震荡混匀。连花清瘟溶液为连花清瘟干膏粉41.73 g、20.87 g及10.43 g分别加入羟甲基纤维素钠溶液,配制成80%、40%和20%的高、中、低剂量连花清瘟溶液。
1.2实验动物分组及给药方法
48只雄性Wistar大鼠(河北医科大学实验动物中心提供),体重180~200 g,随机分为4个实验组(PM2.5染尘组及高、中、低剂量连花清瘟干预组)和2个对照组(空白对照组及生理盐水对照组),每组8只。实验动物在丙戊酸钠腹腔注射麻醉下气管注入PM2.5悬液染尘。空白对照组不予任何干预措施,生理盐水对照组给予气管内注入生理盐水(1 ml/kg)1次。染尘组给予气管内注入PM2.5悬液1 ml/kg (7.5 mg/kg)1次。连花清瘟干预组给予连花清瘟溶液10 ml/kg(相当于给予高、中、低剂量连花清瘟8g/kg、4 g/kg及2 g/kg)灌胃,共给药4 d,第4天灌胃后给予PM2.5悬液染尘,剂量及次数同染尘组。
1.3标本采集
丙戊酸钠腹腔注射麻醉下腹主动脉采集动脉血5 ml后放血处死大鼠(空白对照组直接处死,生理盐水对照组气管注入生理盐水后24 h处死,各实验组均染尘24 h后处死)。所取动脉血1 500 r/min离心15 min,分离血清,-80℃冰箱保存。
1.4指标检测
采用酶联免疫分析(ELISA)法测定(试剂盒购自美国BG公司)血清中IL-17和SP-A水平,操作步骤按试剂盒说明书进行。
1.5统计学方法
采用SPSS17.0统计软件进行数据分析,数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1大鼠肺组织病理
2个对照组病理切片未见异常表现(见图1、2);染尘组(见图3)光镜下可见肺泡间隔增厚,肺泡腔缩小,炎症细胞渗出,小支气管壁增厚,管腔内杯状细胞增生,周围炎症细胞浸润,肺间质纤维组织增生,间质水肿,毛细血管充血,小血管管壁增厚,周围可见嗜酸性粒细胞浸润。各干预组(见图4~6)可见随连花清瘟剂量增加,肺泡腔内炎症细胞渗出逐渐减轻。
2.2对照组、染尘组及连花清瘟组血清IL-17和SP-A水平的变化
空白对照组及生理盐水对照组大鼠血清IL-17 和SP-A水平差异无统计学意义(均P>0.05),染尘组大鼠血清IL-17和SP-A水平均显著高于空白对照组及生理盐水对照组,差异均有统计学意义(均P<0.05);中、高见剂量连花清瘟干预组血清IL-17 和SP-A水平均低于染尘组,差异有统计学意义(P<0.05);低剂量连花清瘟干预组血清IL-17和SP-A水平低于染尘组,但差异无统计学意义(P>0.05)。见附表。
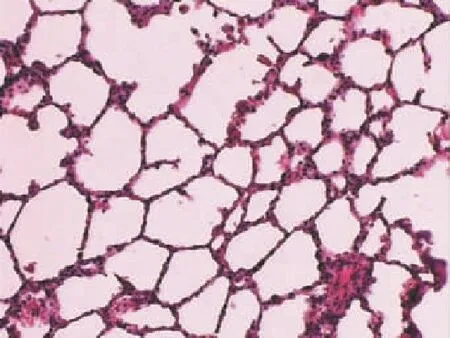
图1 生理盐水对照组(×200)

图2 空白对照组(×200)

图3 PM2.5染尘组(×200)

图4 低剂量连花清瘟干预组(×200)

图5 中剂量连花清瘟干预组(×200)

图6 高剂量连花清瘟干预组(×200)
附表 对照组、染尘组及连花清瘟干预组血清IL-17 和SPA水平的比较(n=8,±s)
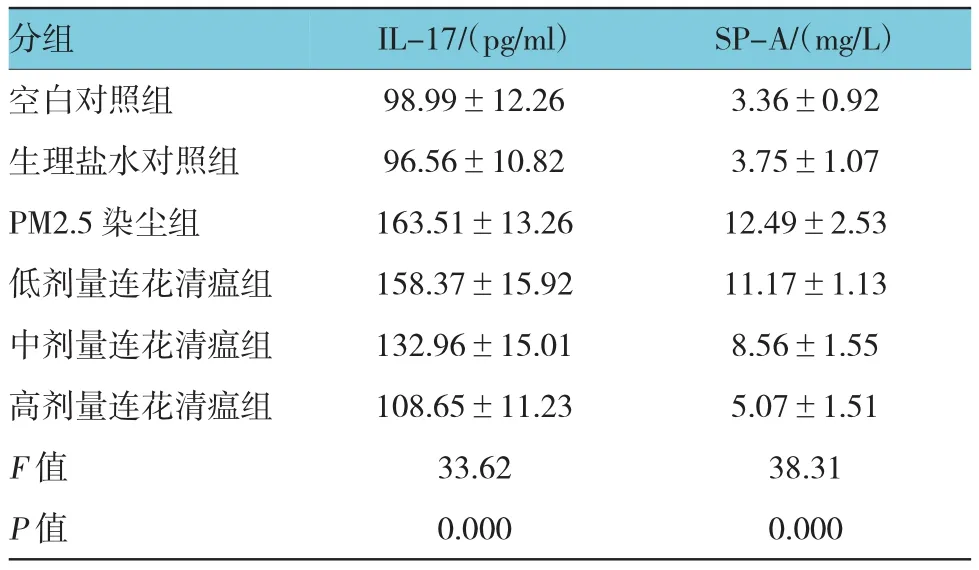
附表 对照组、染尘组及连花清瘟干预组血清IL-17 和SPA水平的比较(n=8,±s)
分组SP-A/(mg/L)空白对照组 3.36±0.92生理盐水对照组 3.75±1.07 IL-17/(pg/ml)98.99±12.26 96.56±10.82 PM2.5染尘组 12.49±2.53 163.51±13.26低剂量连花清瘟组 158.37±15.92 11.17±1.13中剂量连花清瘟组 132.96±15.01 8.56±1.55高剂量连花清瘟组 108.65±11.23 5.07±1.51 F值 33.62 38.31 P值 0.000 0.000
3 讨论
大气污染物经呼吸道吸收可直接作用于呼吸系统,因大气污染物含有害气体、化学物质及金属等,对机体的影响可因含有的物质不同而不同,其中颗粒物PM2.5对人体的损害较大,它不但自身有危害性,还可以吸附多种有害气体和病原微生物[5]。PM2.5可随空气进入小气道和肺泡并持续作用,当其到达肺泡时,被气道纤毛系统清除或者被巨噬细胞吞噬[6]。PM2.5被AM吞噬过程中可通过与之相关的编码转录因子和炎症相关因子基因转录水平的增高诱导大量促炎症因子释放,破坏细胞因子网络平衡,从而调节和启动肺局部炎症反应,诱导肺部炎症损伤。另一方面,PM2.5对肺部机械屏障作用的破坏使其清除异物作用下降,进一步诱导更严重的炎症反应[7]。
连花清瘟主要成分为连翘、金银花、麻黄、杏仁、石膏、板蓝根、绵马贯众、鱼腥草、广藿香、大黄、红景天、薄荷脑、甘草,从中药成分来看符合中医治疗炎症疾病的特点,它除了具有明确的抗病毒作用,对急性肺部感染效果显著,还具有一定的免疫调节作用[8]。流行病学调查及临床试验证实其提高细胞免疫功能,抑制病毒感染后的肺部炎性损害[7]。研究发现处方中麻黄、甘草能抑制大鼠肺组织肿瘤坏死因子(tumor necrosis factorα,TNF-α),白细胞介素1β(interleukin-1β,IL-1β)含量升高,具有较强抗炎症作用;大黄游离蒽醌也可抑制TNF-α等炎症介质的释放,减轻机体炎症反应[9-10]。夏敬文等[11]研究也发现连花清瘟可显著降低慢性阻塞性肺病大鼠模型血清、肺组织匀浆及肺泡灌洗液中IL-8和TNF-α含量,提示连花清瘟对气道炎症有抑制作用。
IL-17是近年来人们发现的一种新的细胞因子,主要由Th17细胞产生。IL-17是一种促炎症细胞因子,也是炎症反应的早期启动子,因其在诱导炎症方面具有强大的作用而备受重视。IL-17与其受体结合,主要通过NF-κB-DNA途径和有丝分裂原激活激酶途径发挥其生物学作用[12]。IL-17能诱导IL-8、IL-6、TNF-α等多种细胞因子和炎症介质的产生,导致机体产生强烈的炎症反应。而IL-8、IL-6、TNF-α在吸烟导致肺损伤的发病机制中具有重要作用[13]。IL-17还可通过促进C-X-C趋化因子诱导中性粒细胞活化和募集,促进气道炎症反应,参与肺损伤[14-15]。本研究结果提示PM2.5染尘组IL-17明显高于空白对照组和生理盐水对照组,中、高剂量连花清瘟干预组IL-17明显低于染尘组,提示PM2. 5通过诱导炎症反应导致肺损伤,连花清瘟通过抑制炎症反应减轻PM2.5导致的肺损伤。
肺表面活性物质是覆盖于肺泡表面,分为有4种特定表面活性蛋白A、B、C和D,SP-A、SP-D为水溶性蛋白,主要调节肺免疫功能。SP-A可通过损伤的肺泡-毛细血管膜屏障进入血液循环而成为肺损伤的血清标志物。血清中SP-A的量和肺损伤程度密切相关。SP-A是先天免疫系统的一部分,可通过与抗原递呈细胞和T淋巴细胞相互作用来调节先天免疫系统;也可直接作用于B淋巴细胞或间接通过刺激免疫细胞产生细胞因子作用于B淋巴细胞,使其激活并产生免疫球蛋白;通过抑制某些细胞因子和炎症介质的合成与释放,从而抑制炎症反应,可与特异性变应原结合,在气道炎症中起重要的免疫调节作用[16]。本研究结果提示PM2.5染尘组SP-A明显高于空白对照组和生理盐水对照组,中、高剂量连花清瘟干预组SP-A明显低于染尘组,提示PM2.5通过损害肺的免疫功能导致肺损伤,连花清瘟通过调节免疫功能拮抗PM2.5导致的肺损伤。
综上所述,本实验证实PM2.5急性暴露可导致大鼠免疫功能受损及肺部炎症,中、高剂量连花清瘟可保护免疫功能,抑制炎症反应,其具体调节机制有待进一步研究。
参考文献:
[1]TALBOTT E O,RAGER J R,BENSON S,et al. A case-crossover analysis of the impact of PM2.5 On cardiovascular disease hospitalizations for selected CDC tracking states[J]. Environ Res,2014,134 (10):455-465.
[2]DELFINO R J,WU J,TJOA T,et al. Asthma morbidity and ambient air pollution:effect modification by residential traffic-related air pollution[J]. Epidemiology,2014,25(1):48-57.
[3]SHUKLA A,TIMBLIN C,BERUBE K,et al. Inhaled particulate matter Causes expression of nuclear factor(NF)-kappaB-related genes and oxidant-dependent NF-kappaB activation in vitro[J]. Am J Respir Cell Mol Biol,2000,23(2):182-187.
[4]赵明敬,赵晓琴,赵威.连花清瘟胶囊治疗急性上呼吸道感染的临床效果评价[J].中华医院感染学杂志,2015,25(4):839-841.
[5]LAUMBACH R J. Outdoor air pollutants and patient health[J]. Am Fam Physician,2010,81(2):175-180.
[6]LUO B,SHI H,WANG L,et al. Rat lung response to PM2.5 exposure under different cold stresses[J]. Int J Environ Res Public Health,2014,11(12):12915-12926.
[7]PHIPPS J C,ARONOFF D M,CURTIS J L,et al. Cigarette smoke exposure impairs pulmonary bacterial clearance and alveolar macrophage complement-mediated phagocytosis of streptococcus pneumoniae[J]. Infect Immun,2010,78(3):1214-1220.
[8]董樑,夏敬文,龚益,等.连花清瘟胶囊治疗慢性阻塞性肺疾病急性加重期的临床疗效和作用机制[J].中成药,2014,36(5):926-929.
[9]赵杰,余林中,方芳,等.麻黄-甘草药对的抗炎作用及机制研究[J].中国实验方剂学杂志,2012,18(15):163-166.
[10]张燕,王平,杨永茂,等.大黄游离蒽醌对犬重症急性胰腺炎早期肠损伤的保护作用[J].中国实验方剂学杂志,2013,19(5):172-176.
[11]夏敬文,陈小东,张静,等.连花清瘟胶囊对慢性阻塞性肺病的治疗作用[J].复旦学报(医学版),2008,35(3):441-444.
[12]张莉,刘卫敏,吴开松,等.慢性阻塞性肺疾病患者白介素2、6、10、17及22表达研究[J].中国现代医学杂志,2011,21(24):3067-3069.
[13]王立婧,闫亮.吸烟对COPD患者肺功能及IL-8和TNF-α的影响[J].医学综述,2014,20(24):4606-4607.
[14]YAMADA H,NAKASHIMA Y,OKAZAKI K,et al. Th1 but not Th17 cells predominate in the joints of patients with rheumatoid arthritis[J]. Ann Rheum Dis,2008,67(9):1299-1304.
[15]ZHANG J,CHU S,ZHONG X,et al. Increased expression of CD4+IL-17+cells in the lung tissue of patients with stable chronic obstructive pulmonary disease(COPD)and smokers[J]. International Immunopharmacology,2013,15(1):58-66.
[16]闫立成,曹福源,赵海鹰,等.肺表面活性蛋白作为矽肺患者早期生物标志物的研究[J].现代预防医学,2015,42(9):1562-1563.
(张蕾编辑)
论著
Effect of surrounding fine particulate matter(PM2.5)on IL-17 expression in rats and antagonistic effects of Lianhuaqingwen
Shu-zhi Han1,Hui-peng Liang2,Feng-rui Zhang1,Fen Ping1
(1. Department of Respiratory Diseases,Hebei General Hospital,Shijiazhuang,Hebei 050051,China;2. Hebei Hospital of Thoracic Diseases,Shijiazhuang,Hebei 050048,China)
Abstract:Objectives To explore the lung injury of rats due to acute exposure to PM2.5,and to discuss the antagonistic role of Lianhuaqingwen to the injury. Methods Forty-eight healthy adult Wistar rats were randomly assigned into four experimental groups(PM2.5 group,low-dose Lianhuaqingwen group,medium-dose Lianhuaqingwen group and high-dose Lianhuaqingwen group)and two control groups(control group and saline control group). The PM2.5 suspension was prepared with fine particulates provided by Shijiazhuang Environmental Monitoring Center. The rat models were developed by exposure to PM2.5 through intratracheal drip. The saline control group was instilled with saline(1 ml /kg)once;the PM2.5 group was instilled with suspension of PM2.5 via trachea(7.5 mg/kg);the three intervention groups were given diet supplemented with different doses of Lianhuaqingwen(2 g/kg,4 g/kg and 8 g/kg respectively)for 4 days before drip with suspension of PM2.5. Interleukin 17(IL-17)and surfactant protein A(SP-A)in the serum were measured using ELASA. Pathological changes of the lungs were observed at the same time. Results The serum levels of IL-17 and SP-A were not significantly different between the saline control group and the control group(P>0.05). The levels of IL-17 and SP-A in the PM2.5 group were markedly higher than those in the saline control group and the control group(P<0.05). The level of IL-17 was significant differentbook=17,ebook=22between the high-dose Lianhuaqingwen group and the PM2.5 group(P<0.05),and the level of IL-17 in each intervention group was markedly changed compared with that in the PM2.5 group(P<0.05). Conclusions The acute exposure to PM2.5 can induce injury to rat's lungs. Lianhuaqingwen could produce antagonistic effects to inflammatory injury to rat's lung tissues.
Keywords:fine particulate matter(PM2.5);inflammatory injury;interleukin 17;surfactant protein A;Lianhuaqingwen
中图分类号:R-332
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.10.004
文章编号:1005-8982(2016)10-0016-04
收稿日期:2015-12-04

