转染白细胞介素18基因通过下调多药耐药基因表达增强顺铂对C6胶质瘤细胞毒作用*
吕雨虹,陈庆,赵娟,王彦玲,祝建峰,闫蕴力
(1.河北医科大学,河北石家庄050017;2.河北省胸科医院,河北石家庄050041)
转染白细胞介素18基因通过下调多药耐药基因表达增强顺铂对C6胶质瘤细胞毒作用*
吕雨虹1,陈庆2,赵娟1,王彦玲1,祝建峰2,闫蕴力1
(1.河北医科大学,河北石家庄050017;2.河北省胸科医院,河北石家庄050041)
摘要:目的探讨转染白细胞介素18(IL18)基因对大鼠C6胶质瘤细胞顺铂化疗敏感性的影响及可能的作用机制。方法体外培养转染IL18基因的C6/IL18细胞株和未转染的C6细胞系,MTT法观察顺铂对两类肿瘤细胞的抑制率;流式细胞术检测顺铂作用后转染及未转染肿瘤细胞的凋亡率;反转录PCR及蛋白质印迹法(Western blot)检测转染细胞内多药耐药基因(Mdr1)和拓扑异构酶TopoⅡα的mRNA水平和蛋白质水平的表达变化。结果顺铂对转染IL18基因的胶质瘤细胞株的抑制率明显高于未转染细胞(P<0.05),半数抑制浓度分别为29.66μg/ml和55.49μg/ml;流式细胞术显示顺铂作用后的转染细胞凋亡增多(P<0.05);反转录PCR及Western blot显示转染细胞的Mdr1基因表达显著下降,TopoⅡα基因表达无明显变化。结论转染IL18基因能够下调多药耐药基因Mdr1的表达,增强顺铂对大鼠C6胶质瘤细胞的毒作用。
关键词:白细胞介素18;C6胶质瘤;多药耐药基因;P糖蛋白
基因治疗是新兴的肿瘤治疗手段,其利用基因重组和转染技术,对肿瘤细胞基因组进行改良,以期望实现治疗肿瘤的目的。白细胞介素18 (Interleukin 18,IL18)是一种多功能的细胞因子,能够增强体内抗肿瘤免疫反应[1],是基因治疗的候选基因。李文玲[2]等应用逆转录病毒转染的方法构建了稳定表达具有生物活性的白细胞介素18的C6/ IL18细胞系,并在体外和体内观察到有显著意义的细胞生长抑制现象。不仅如此,蒋常文[3]等发现转染IL18基因能够显著性下调C6细胞周期相关基因PCNA、cyclin D1、cyclin B1的表达,上调P21的表达。然而,转染IL18基因能否下调多药耐药基因表达,增强化疗药物对肿瘤细胞毒性,尚未有深入的研究报道。明确转染基因能否增强化疗敏感性,将为基因治疗提供更广阔的应用前景。
1 材料与方法
1.1材料与试剂
大鼠C6胶质瘤细胞和导入IL18基因的C6/ IL18细胞系,河北医科大学细胞生物教研室制备并保存[2]。顺铂(齐鲁制药有限公司),RPMI 1640培养基(美国Gibco公司),胎牛血清(天津灏洋生物公司),四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)(美国Sigma公司),Annexin V-FITC/PI细胞凋亡双染试剂盒(美国Invitrogen公司),RT-PCR试剂盒(美国Invitrogen公司),小鼠抗大鼠βactin、Mdr1、TopoⅡα,以及辣根过氧化物酶标记羊抗鼠二抗均来自美国Santa Cruz公司。
1.2试验方法
1.2.1MTT检测不同浓度顺铂对肿瘤细胞的抑制率取对数生长期C6和C6/IL18细胞,接种于96孔培养板,24 h后根据不同药物浓度组:2.5、5.0、10.0、20.0、40.0、80.0及160.0μg/ml加入药物,对照组加入等量的生理盐水,每组均做3个复孔,实验重复3次(n=9)。药物与细胞共培养24 h后加入MTT,孵育4 h后终止反应。酶标仪(BIO-TEK ELX800,美国)在490 nm波长下测吸光值(A值)。根据公式计算细胞抑制率:对照孔A值-用药孔A值/对照孔A值×100%。由细胞抑制率与药物浓度的对数值作线性回归,求出顺铂对每种细胞的半数抑制浓度(IC50)。
1.2.2流式细胞术检测顺铂作用后的细胞凋亡率取对数生长期C6和C6/IL18细胞,接种于培养瓶中,24 h后加入终浓度为30.0μg/ml(C6/IL18细胞的IC50)的顺铂作用24 h,胰酶消化,冷PBS洗2次,Binding Buffer重悬细胞,设置阴性对照组(不加染料)、同型对照组(分别只加Annexin V-FITC和PI)以及药物处理组(混合Annexin V-FITC和PI),室温避光反应10 min上流式细胞仪(BD FACS Calibur,美国)检测,调节电压和补偿,收集10 000个事件,统计门内细胞的凋亡比例。实验重复3次。
1.2.3反转录PCR检测mRNA的表达Trizol法提取细胞总RNA,并进行反转录反应,反转录产物进行PCR反应,Mdr1、TopoⅡα、βactin和IL18的退火温度分别为51、55、53及59℃。引物见表1。

表1 扩增基因的引物序列及长度
1.2.4蛋白质免疫印迹法(Western blot)检测蛋白的表达提取细胞总蛋白,使用BCA法测定蛋白浓度,25μg/ml孔上样,蛋白经SDS-PAGE电泳分离后,转至NC膜上。NC膜用一抗4℃过夜孵育(Mdr1、TopoⅡα、βactin一抗均1∶1 000稀释),TBS洗膜,37℃二抗孵育1 h(1∶2 000稀释),洗膜后,滴加ECL化学发光液,采用凝胶成像系统(BIO-RAD Chemi Doc XRS,美国)记录图像。
1.3统计学方法
采用SPSS 19.0统计软件进行数据分析,实验数据以均数±标准差(±s)表示,作非配对t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1顺铂对C6/IL18和C6细胞抑制率的比较
顺铂对细胞的抑制率随浓度升高而增大(见图1),除0.5μg/ml外,其他浓度2.5、5.0、10.0、20.0、40.0、80.0及160.0μg/ml,对C6/IL18细胞的抑制率均高于C6细胞(见表2),P<0.05,n=9。经计算,顺铂对C6/IL18细胞的半数抑制浓度(IC50)为29.66μg/ml,明显低于其对C6细胞的IC50 55.49μg/ml,P<0.05。
2.2顺铂对C6/IL18和C6细胞凋亡率的比较
C6/IL18和C6细胞经顺铂作用24 h后,C6/IL18细胞凋亡率[(22.63±2.85)%,n =3]明显高于C6细胞凋亡率[(10.57±1.93)%,n=3,P=0.012,F=1.16]。
2.3转染IL18基因对C6细胞Mdr1和TopoⅡα基因表达的影响
反转录PCR和Western blot结果显示(见图2、3),相对于C6细胞,C6/IL18细胞的Mdr1 mRNA和蛋白表达水平均明显减少(见表3、4),TopoⅡα变化不明显。
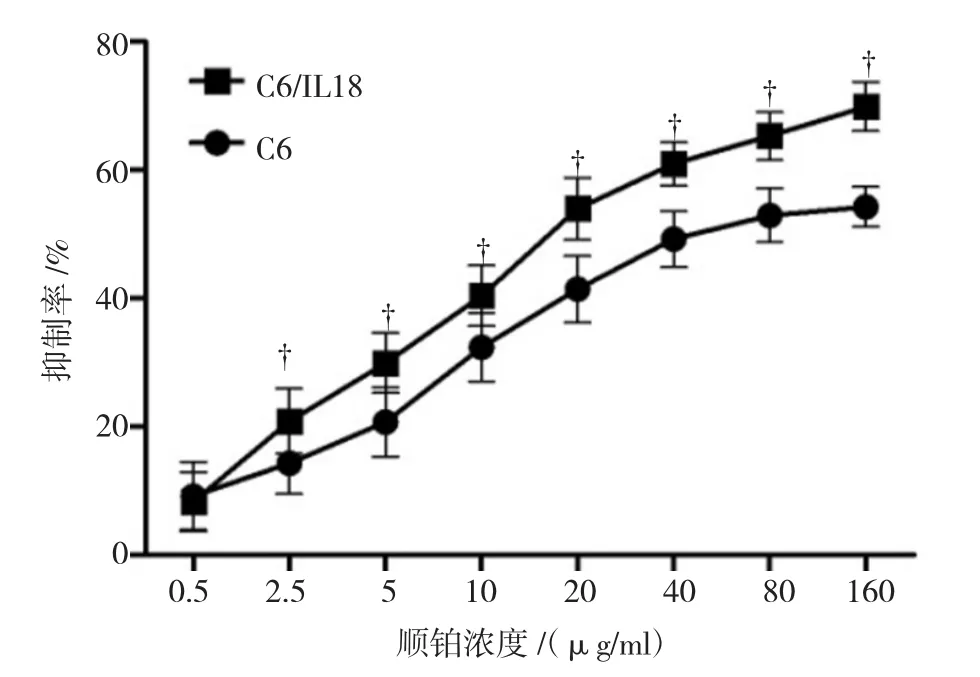
图1 顺铂对细胞的生长抑制曲线
表2 顺铂对细胞的生长抑制率(n=9,±s)
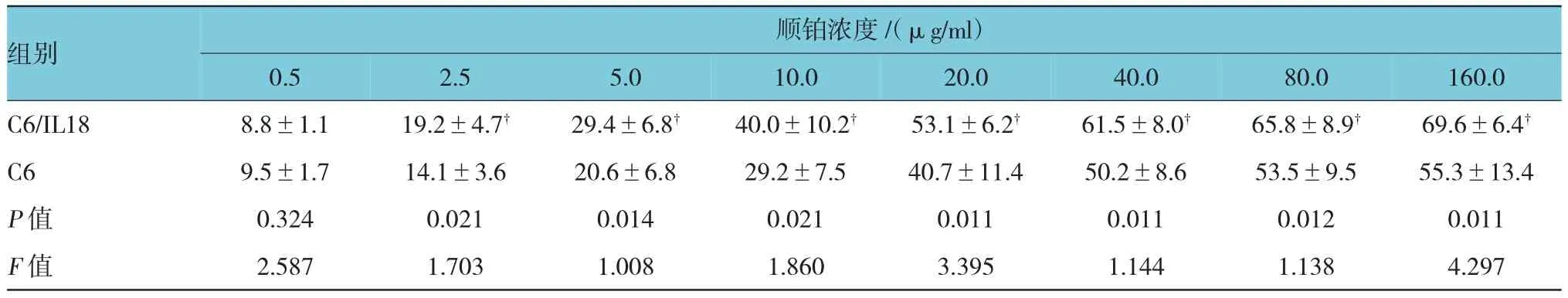
表2 顺铂对细胞的生长抑制率(n=9,±s)
注:†P<0.05
组别顺铂浓度/(μg/ml)0.5 2.5 5.0 10.0 20.0 40.0 80.0 160.0 C6/IL18 C6 P值F值8.8±1.1 19.2±4.7† 29.4±6.8† 40.0±10.2† 53.1±6.2† 61.5±8.0† 65.8±8.9† 69.6±6.4†9.5±1.7 14.1±3.6 20.6±6.8 29.2±7.5 40.7±11.4 50.2±8.6 53.5±9.5 55.3±13.4 0.324 0.021 0.014 0.021 0.011 0.011 0.012 0.011 2.587 1.703 1.008 1.860 3.395 1.144 1.138 4.297
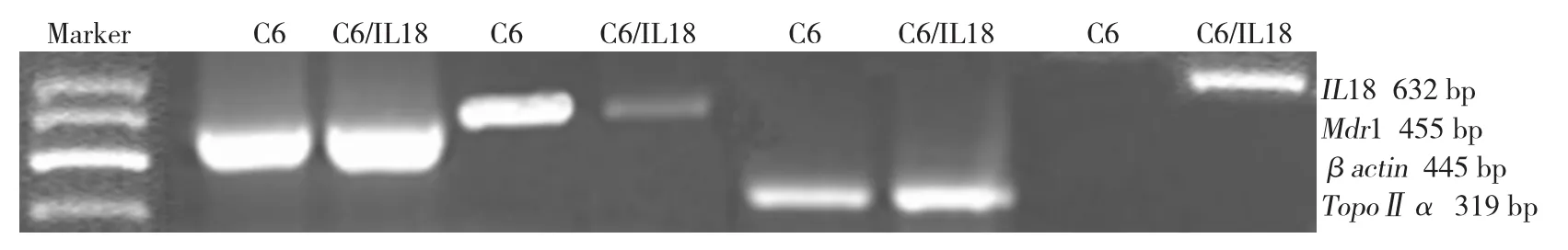
图2 转染IL18基因下调Mdr1转录水平
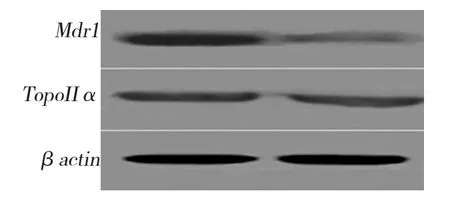
图3 转染IL18基因减少Mdr1蛋白表达
表3 Mdr1、TopoⅡα基因转录水平相对值(n=3,±s)
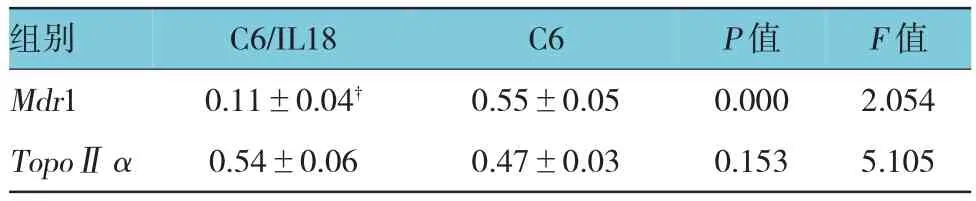
表3 Mdr1、TopoⅡα基因转录水平相对值(n=3,±s)
注:†P<0.05
组别 C6/IL18 C6 P值 F值Mdr1 0.11±0.04† 0.55±0.05 0.000 2.054 TopoⅡα 0.54±0.06 0.47±0.03 0.153 5.105
表4 Mdr1、TopoⅡα基因蛋白水平相对值(n=3,±s)
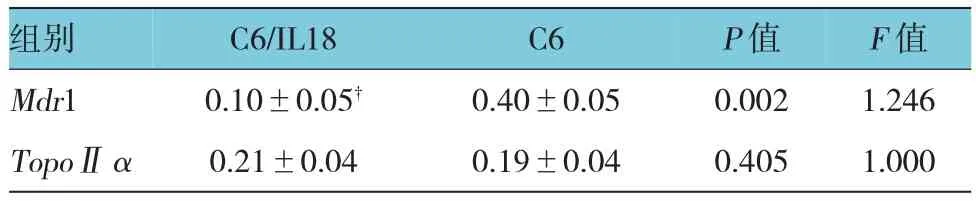
表4 Mdr1、TopoⅡα基因蛋白水平相对值(n=3,±s)
注:†P<0.05
组别 C6/IL18 C6 P值 F值Mdr1 0.10±0.05† 0.40±0.05 0.002 1.246 TopoⅡα 0.21±0.04 0.19±0.04 0.405 1.000
3 讨论
神经胶质瘤是成人中枢神经系统中最常见的原发肿瘤,占颅内肿瘤的70%,预后差,死亡率高。胶质瘤治疗采用手术、放化疗结合的手段,然而患者生存时间并没有大幅度提升和改善。主要原因是胶质瘤呈浸润性生长,手术不能完全切除;另一方面由于其内在的耐药性,化疗药物很难有效地杀伤肿瘤细胞,从而导致化疗失败。
化疗过程中,患者在接触化疗药物一段时间后,多数会发生耐药,并且对其他在结构和机制上完全不同的药物表现出交叉耐药,这种现象称多药耐药(multidrug resistance,MDR)。恶性肿瘤细胞产生多药耐药的机制尚未完全阐明,其中已知的最重要的形成机制是P糖蛋白(Pglycoprotein,Pgp)过度表达[4],该蛋白是跨膜转运蛋白,定位在细胞膜和高尔基体上,可以将药物分子泵出胞外,减少药物的胞内累积,不仅如此,Pgp对底物要求不严格,可将不同类型的药物泵出,从而形成多药耐药。Pgp过度表达,与肿瘤耐药、复发和预后密切相关[5-8]。周荣福[9]等的临床研究发现,人脑星形细胞瘤Pgp表达先天存在,对化疗药物有先天耐受性,当药物刺激后Pgp阳性表达能产生继发耐药或增强先天耐药。人类编码这一蛋白的基因为Mdr1,定位在7号染色体长臂2区1带,含28个外显子。Mdr1基因启动子及其邻近区域,可与多条信号通路的转录因子结合,调节Mdr1的转录[4,10-12]。另一条介导多药耐药的途径是DNA拓扑异构酶(Topoisomerase,Topo)的数量或活性减少[13]。真核细胞中TopoⅡ的主要作用是调节DNA空间结构,参与DNA修复、复制和转录。以TopoⅡ为靶点的抗肿瘤药物通过形成药物-酶-DNA复合物抑制DNA的复制与转录。研究发现[14-15],TopoⅡ的含量或活性下调,引起药物失去效靶,形成细胞耐药。这类耐药没有Mdr1基因过表达,主要表现为TopoⅡ基因突变或缺失;TopoⅡ酶水平减少或磷酸化水平提高。
白细胞介素18是一种多功能细胞因子,能够增强体内抗肿瘤免疫反应[1],是基因治疗的候选基因。研究表明[16],IL18基因单独转染,或与其他细胞因子联合转染,如IL12、IFN、FASL等,表现出显著地抑制肿瘤生长的特性。XU[16]等应用慢病毒转染的方法,将IL18和IFNβ基因导入骨髓基质干细胞,发现这些转基因细胞能显著抑制胶质瘤细胞生长,促进其凋亡;大鼠模型显示,这些转基因细胞还能增强其他抗肿瘤因子的分泌,以及CD4+和CD8+T细胞对瘤组织的浸润,延长荷瘤大鼠生存期。虽然转染IL18基因能显著地抑制肿瘤生长,但是这些研究中的肿瘤细胞并不能全部清除。转染IL18基因能否增强化疗效果尚未有深入研究。本研究首先观察C6/IL18和C6两种细胞,在不同浓度顺铂下的生长抑制情况,发现顺铂对C6/IL18细胞的生长抑制明显增强。之后,进一步检测这两种细胞的Pgp和TopoⅡα的mRNA和蛋白水平的变化,发现C6/IL-18细胞中Pgp表达量明显减少,这与顺铂对其有较高抑制率的结果相对应,推测转染IL18基因通过下调多药耐药基因Mdr1的表达,增强药物对C6细胞的毒作用。
Mdr1基因表达可被多条信号通路调节,其中ERK/MAPK和PI3K/AKT最密切相关。MUNOZ[17]等人的研究发现,胶质瘤细胞系对替莫唑胺耐药的过程包含两个阶段:早期阶段,胞浆内的Pgp转运到胞膜,伴随构象激活性改变;晚期阶段,肿瘤细胞自分泌EGF,与自身的EGFR受体结合,激活ERK1/2-JNK-AP-1信号通路,增强Mdr1基因转录。大量研究表明[18-21],药物作用肿瘤细胞会引起PI3K/AKT信号活化,进而上调Mdr1表达,应用小RNA干扰或抑制PI3K-AKT活性能下调Mdr1。而PI3K/AKT下游的哪个或哪些靶基因作用Mdr1,不同课题组得出的结果不尽相同。一些研究发现抑制耐药细胞的PI3K-AKT活性后,通过NF-κB途径调节Mdr1[19]。而其他研究发现,药物可通过Akt-mTOR信号通路增加Mdr1表达[20],阻断mTOR通路能抑制膜转运蛋白ABCB1、ABCC1和ABCG2的表达,逆转细胞的耐药性[21]。这些研究使用的药物以及肿瘤细胞类型不同,肿瘤基因组异质性较强,可能存在多个途径影响Mdr1表达。之前的研究报道C6细胞中转染IL18基因能够显著性上调P21的表达,下调周期蛋白cyclin D1和cyclin B1的表达,引起细胞周期阻滞[3]。而AKT活化介导的下游信号与这一作用相反,通过抑制P21的活性,稳定cyclin-CDK复合物,促进细胞周期进展。因此,转染IL18基因可能通过对抗PI3K-AKT信号,调节Mdr1基因表达。
综上所述,转染IL18基因能够下调Mdr1基因表达,减少细胞内Pgp蛋白水平,增强C6细胞的药物敏感性,为IL18基因治疗提供更广阔的应用前景。
参考文献:
[1]CHRISTOFIDES A,KOSMOPOULOS M,PIPERI C. Pathophysiological mechanisms regulated by cytokines in gliomas[J]. Cytokine,2015,71(2):377-384.
[2]李文玲,闫蕴力,单保恩,等.逆转录病毒介导IL18基因在大鼠胶质瘤细胞C6中的表达[J].细胞与分子免疫学杂志,2004,20(5):522-525.
[3]蒋常文,闫蕴力,马卫东,等. IL18基因转染对大鼠C6胶质瘤细胞生长特性的影响[J].细胞生物学杂志,2005,27(3):339-342.
[4]AMBUDKAR S V,KIMCHI-SARFATY C,SAUNA Z E,et al. P-glycoprotein:from genomics to mechanism[J]. Oncogene,2003,22(47):7468-7485.
[5]WU Q,YANG Z,NIE Y,et al. Multi-drug resistance in cancer chemotherapeutics:mechanisms and lab approaches[J]. Cancer Lett,2014,347(2):159-166.
[6]ABRAHAM J,SALAMA N N,AZAB A K. The role of P-glycoprotein in drug resistance in multiple myeloma[J]. Leuk Lym-phoma,2015,56(1):26-33.
[7]JAMROZIAK K,ROBAK T. Pharmacogenomics of MDR1/ABCB1 gene:the influence on risk and clinical outcome of haematological malignancies[J]. Hematology,2004,9(2):91-105.
[8]HAAR C P,HEBBAR P,WALLACE GC,et al. Drug resistance in glioblastoma:a mini review[J]. Neurochem Res,2012,37(6):1192-1200.
[9]周荣福,侯卫东,李飞,等. P糖蛋白在脑星形细胞瘤中的表达及意义[J].中国临床神经外科杂志,2007,12(12):729-731.
[10]CHEN K G,SIKIC B I. Molecular pathways:regulation and therapeutic implications of multidrug resistance[J]. Clin Cancer Res,2012,18(7):1863-1869.
[11]SUI H,FAN Z Z,LI Q. Signal transduction pathways and transcriptional mechanisms of ABCB1/P-gp-mediated multiple drug resistance in human cancer cells[J]. J Int Med Res,2012,40 (2):426-435.
[12]ANDORFER P,ROTHENEDER H. Regulation of the Mdr1 promoter by E2F1 and EAPP[J]. FEBS Lett,2013,587(10):1504-1509.
[13]TSURUO T,NAITO M,TOMIDA A,et al. Molecular targeting therapy of cancer:drug resistance,apoptosis and survival signal [J]. Cancer Sci,2003,94(1):15-21.
[14]JUN K Y,PARK S E,LIANG J L,et al. Benzo[b]tryptanthrin inhibits Mdr1,topoisomerase activity,and reverses adriamycin resistance in breast cancer cells[J]. Chem MedChem,2015,10(5):827-835.
[15]WANG Y L,YAN Y L,ZHOU N J,et al. Mechanism of multidrug resistance of human small cell lung cancer cell line H446/VP[J]. Chin Med J,2010,123(22):3299-3303.
[16]XU G,GUO Y,SENG Z,et al. Bone marrow-derived mesenchymal stem cells co expressing interleukin-18 and interferon-β exhibit potent antitumor effect against intracranial glioma in rats[J]. Oncol Rep,2015,34(4):1915-1922.
[17]MUNOZ J L,RODRIGUEZ-CRUZ V,GRECO S J,et al. Temozolomide induces the production of epidermal growth factor to regulate MDR1 expression in glioblastoma cells[J]. Mol Cancer Ther,2014,13(10):2399-2411.
[18]XIE X,TANG B,ZHOU J,et al. Inhibition of the PI3K/Akt pathway increases the chemo-sensitivity of gastric cancer to vincristine[J]. Oncol Rep,2013,30(2):773-782.
[19]LIN X,ZHANG X,WANG Q,et al. Perifosine downregulates MDR1 gene expression and reverses multidrug-resistant phenotype by inhibiting PI3K/Akt/NF-κB signaling pathway in a human breast cancer cell line[J]. Neoplasma,2012,59(3):248-256.
[20]WANG S F,CHOU Y C,MAZUMDE R N,et al. 7-Ketocholesterol induces P-glycoprotein through PI3K/mTOR signaling in hepatoma cells[J]. Biochem Pharmacol,2013,86(4):548-560.
[21]ZOU Z,ZHANG J,ZHANG H,et al. 3-Methyladenine can depress drug efflux transporters via blocking the PI3K-AKT-mTOR pathway thus sensitizing MDR cancer to chemotherapy[J]. J Drug Target,2014,22(9):839-848.
(张蕾编辑)
论著
Transfection of IL18 gene enhances cytotoxicity of cisplatin on C6 glioma cells by reducing Mdr1 expression*
Yu-hong Lyu1,Qing Chen2,Juan Zhao1,Yan-ling Wang1,Jiang-feng Zhu2,Yun-li Yan1
(1. Department of Cell Biology,Hebei Medical University,Shijiazhuang,Hebei 050017,China;2. Department of Gastroenterology,Hebei Chest Hospital,Shijiazhuang,Hebei 050041,China)
Abstract:Objective To explore the effect of transfection of interleukin 18(IL 18)on sensitivity of rat C6 glioma cells to cisplatin chemotherapy and the possible mechanism. Methods C6 cells with and without transfection of IL 18(C6/IL18 cells and C6 cells)were cultured in vitro. The growth inhibition ratios of both types of glioma cells were measured by MTT assay,when treated with cisplatin at various concentrations. Cell apoptosis was detected by flow cytometry after being treated with 50%inhibition concentration of cisplatin. The levels of mRNA and protein of Mdr1 and TopoⅡα were evaluated by reverse transcription-polymerase chain reaction(RT-PCR)and Western blot. Results Upon cisplatin treatment,the ratio of growth inhibition was significantly higher in the C6/IL18 cells than that in the C6 cells(P<0.05),the 50%inhibition concentration of cisplatin was 29.66 μg/ml and 55.49 μg/ml respectively. The apoptosis ratio of the C6/IL18 cells was higher than that of the C6 cells after treatment with cisplatin(P<0.05). In the C6/IL18 cells,the expressions of Mdr 1 was markedly down-regulated identified by RT-PCR and Western blot,but the expressions of TopoⅡα had no significant differences. Conclusions Transfection with IL 18 significantly reduces the expressions of Mdr1,then strengthens the chemo-sensitivity of C6 glioma cells to cisplatin.
Keywords:interleukin 18;C6 glioma cell;Mdr1;Pgp
中图分类号:R739.41
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.10.005
文章编号:1005-8982(2016)10-0020-05
收稿日期:2015-12-10
*基金项目:河北省医学科学研究重点课题计划(No:20160508)

