卵清蛋白水解及抗氧化肽制备工艺研究
薛海燕, 王战勇, 宋宏新, 李 珊
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
卵清蛋白水解及抗氧化肽制备工艺研究
薛海燕, 王战勇, 宋宏新, 李珊
(陕西科技大学 食品与生物工程学院, 陕西 西安710021)
摘要:卵清白蛋白是蛋清中主要的过敏原之一,采用胃蛋白酶水解可降低其过敏原性.本研究通过制备卵清白蛋白抗氧化活性多肽,以DPPH自由基清除率和水解度为指标,考察了底物质量分数、酶解时间、加酶量等因素对卵清白蛋白多肽抗氧化活性的影响.正交试验结果表明,胃蛋白酶的最佳水解条件为底物质量分数4%、酶解时间5 h、加酶量9 000 U/g,在此条件下卵清蛋白的水解度和DPPH自由基清除率均达到最大,分别为83.9%和89.2%.该条件下获得的卵清蛋白水解液可作为抗氧化剂或富含多种氨基酸的白蛋白营养液,在食品、医药等领域具有广泛的应用前景.
关键词:卵清白蛋白; 胃蛋白酶; 抗氧化活性; 水解度
0引言
卵白蛋白(Egg Albumin)是一种磷酸糖蛋白质,其含量占蛋清总蛋白质的54%,是蛋清中最主要的蛋白质[1],由386个氨基酸残基组成,相对分子质量约为45 000,等电点为4.5[2].卵白蛋白营养价值较高、加工与生物学性能良好,具有典型的蛋白质胶凝、乳化和起泡等功能特性,可在食品加工中赋予食品特殊的口感和风味.此外,还在免疫学研究和动物细胞培养及抗体制备中具有重要作用[3,4].
卵白蛋白经酶水解后形成多种活性肽,如增强免疫、抗氧化、抗高血压、抗肿瘤、抗菌和抗病毒等多种生理活性,其中抗氧化活性肽是研究最多的活性肽之一[5,6].已有报道证实抗氧化肽还具有抗癌、抗诱导、抗血栓、抗衰老和疲劳等多种生物活性[7,8],并能有效清除体内过剩的自由基,保护线粒体和细胞的正常结构及功能,抑制油脂氧化和螯合金属离子[9,10].Davalos等[11]研究发现卵白蛋白经胃蛋白酶水解后,可得到四种抗氧化肽,并且这4种抗氧化肽序列均包含于卵白蛋白序列中.
卵白蛋白分子由386个氨基酸残基组成,其中50%以上为疏水氨基酸.胃蛋白酶能作用于芳香族氨基酸(Leu、Asp、Glu)或其它疏水性氨基酸的羧基和氨基形成的肽键,而Leu和Glu残基与多肽的抗氧化相关[12].因此,本研究采用胃蛋白酶酶解卵清蛋白,探讨了其酶解获得抗氧化活性肽的最佳工艺条件,可为酶解卵白蛋白产生活性肽的生产工艺提供技术依据.
1材料与方法
1.1材料与仪器
(1)主要材料:卵清蛋白A5253(纯度62%~88%), Sigma公司;胃蛋白酶(酶活≥3 000 U/g), Sigma公司;二苯基苦基苯肼(DPPH,分析纯),Sigma公司;无水乙醇、氢氧化钠、盐酸等,均为分析纯,天津天力化学试剂有限公司.
(2)主要仪器:752型紫外可见分光光度计,上海光谱仪器有限公司;HC-3081型高速冷冻离心机,安徽中科中佳仪器有限公司;PHS-3C型pH计,北京赛多利斯仪器有限公司;HH-1型恒温水浴锅,常州国华电器有限公司;GL-802B型台式真空泵,江苏其林贝尔仪器制造有限公司.
1.2实验方法
1.2.1卵清蛋白的提取
(1)鸡蛋蛋清液的制备
在流水下去除蛋壳表面异物,打蛋分离蛋清与蛋白,搅拌至蛋清无泡沫.分别取10 mL的蛋清液6份,分别不加水、加1倍、加2倍、加3倍、加4倍、加5倍体积的蒸馏水进行稀释.
(2)盐析
在室温下,分别向6份蛋清液中加入等体积的饱和硫酸铵溶液(即50%饱和硫酸铵)进行盐析,静置1 h后在5 000 r/min下离心20 min,去除沉淀,将上清液pH调至4.6,去除其中卵白蛋白和卵粘蛋白,放置于冰箱中4 ℃过夜,将上清液在5 000 r/min下离心20 min,去除上清,留沉淀.
(3)超滤
将沉淀用水溶解,采用两步法超滤.第一步:采用50 kDa膜超滤,透过液作为第二步原料;第二步:用30 kDa膜超滤,保留浓缩液,冷冻干燥后得卵白蛋白产物,操作压力控制在20~40 psi.用0.1 mol/L的氯化钡溶液检验是否完全去除硫酸铵.
1.2.2胃蛋白酶的水解方法
用pH7.4的pbs缓冲液100 mL溶解3 g卵清蛋白→用盐酸调pH至1.8→将样品置于37 ℃水浴锅里→待样品温度升至酶解温度时加酶→酶解一定时间→用1 mol/L氢氧化钠调pH至5.0灭酶→离心(3 000 r/min,20 min)→取上清液待测.
1.2.3胃蛋白酶水解因素的考察
在反应温度37 ℃、pH 2.0时,改变底物质量分数4%、酶解时间4 h、加酶量8 000 U/g等三者中的一个,保持其余两个值不变,将时间调整为3 h、4 h、5 h、6 h、底物浓度调整为2%、3%、4%、5%、加酶量调整为7 000 U/g、8 000 U/g、9 000 U/g、10 000 U/g,来测定这三个条件对DPPH自由基清除率和水解度的影响.
1.2.4检测方法
(1)DPPH自由基清除率的测定
抗氧化活性可通过测定DPPH自由基清除率[13]来实现.即用100 mL无水乙醇溶解10 mg DPPH得到储备液,避光保存.使用时,稀释4倍得6.5×10-5mol/L的DPPH溶液,另将待测抗氧化剂配制成系列溶液.
对照组:2.5 mL的6.5×10-5mol/L DPPH乙醇溶液+0.5 mL蒸馏水;样品:2.5 mL的6.5×10-5DPPH mol/L乙醇溶液+0.5 mL样液;空白组:2.5 mL无水乙醇溶液+0.5 mL样液.
清除率(%)=[1-(Ai-Aj)/A0]×100%
(1)
式(1)中:A0—对照组吸光值;Ai—样液吸光值;Aj—未加DPPH的空白组吸光值.
(2)蛋白水解度的测定
蛋白水解度按式(2)进行计算:
蛋白水解度(%)=(氨基态氮/总氮)×100%
(2)
式(2)中:氨基态氮采用甲醛滴定法[14]测定,总氮采用微量凯氏定氮法[15]测定.
(3)SDS-PAGE电泳鉴定
根据式(1)~式(11)可定量计算水泥-矿渣二元体系的水化产物,为便于计算,这里假定活性氧化铝的与石膏反应形成的铝酸盐相均转化为单硫型硫铝酸该所以式(3)、式(5)和式(11)的反应不会发生。根据上述反应的近似化学计量式和表3给出的各物质的摩尔质量和摩尔体积,可定量计算水化产物的质量以及体积,其中质量表达式为
将提取的卵清蛋白采用12%分离胶、5%浓缩胶的SDS-PAGE电泳鉴定纯度.
1.2.5胃蛋白酶水解制备抗氧化活性肽的正交试验优化
以底物质量分数、酶解时间、加酶量为考察因素,以DPPH自由基清除率和水解度为指标,选取两个水平,进行L4(23)正交试验,以确定胃蛋白酶水解卵白蛋白的最佳工艺条件,并对最优组合进行验证实验.
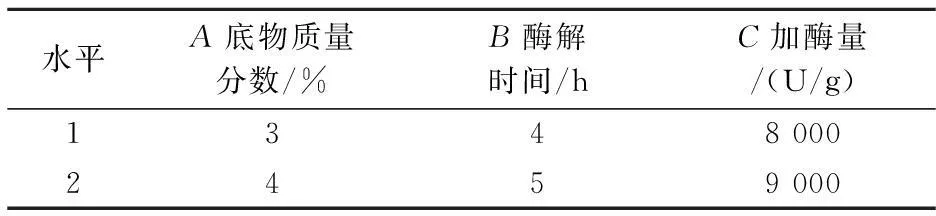
表1 正交试验因素水平表
2结果与分析
2.1卵白蛋白的提取结果
硫酸铵是蛋白质盐析时常用的中性盐,其浓度对蛋白质溶解度具有显著影响.pH是影响盐析的主要因素,当盐溶液pH为蛋白质等电点时,蛋白质溶解度最低,最易沉淀析出.鸡蛋清中的主要蛋白质除卵白蛋白外,还有卵转铁蛋白、卵类黏蛋白、卵粘蛋白、溶酶菌等.
实验中,将盐析离心后的上清液pH调至4.6,使卵白蛋白和卵粘蛋白达到等电点沉淀下来,两者的等电点分别在4.5~4.8和4.5~5.1.盐析后采用两步超滤来去除杂蛋白和硫酸铵,第一步选用50 kDa超滤膜可除去抗生物素蛋白、卵粘蛋白、卵转铁蛋白、丝氨酸蛋白酶抑制剂、G3卵球蛋白等分子量在50 kDa以上的蛋白质,而卵白蛋白(45 kDa)、溶菌酶(14.3 kDa)进入透过液中,成为第二步超滤的原料;第二步选用30 kDa超滤膜可去除溶菌酶和硫酸铵,从而保留了卵白蛋白.
采用半饱和硫酸铵两步盐析法提取出的卵白蛋白,在进行透析去除硫酸根离子后,再进行SDS-PAGE电泳鉴定,其结果如图1所示.M为标准低分子量蛋白,相对分子量为14 400~97 000.6个样品的条带均集中在45 kDa附近,而卵白蛋白分子量为45 kDa,所以提取出的蛋白质就是卵白蛋白;66 kDa到97 kDa之间的条带可能是一些分子量较大的蛋白没有被完全除去的缘故;第四泳道45 kDa主条带很清晰,45 kDa到66 kDa的明显被去除,卵类黏蛋白和卵粘蛋白的分子量分别为23 kDa和2.8 kDa都被明显除去.综合比较,稀释3倍时的分离效果较好.
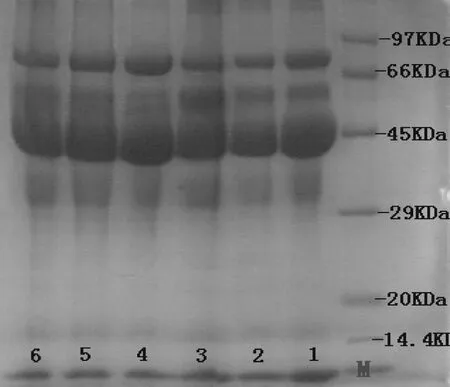
标有数字1、2、3、4、5、6的6列依次是不加蒸馏水、加1倍、加2倍、加3倍、加4倍、加5倍体积蒸馏水的蛋清液经盐析、透析后的样品蛋白液.图1 卵清蛋白的纯化SDS-PAGE电泳图
2.2不同水解条件对DPPH自由基清除率和水解度的影响
2.2.1胃蛋白酶酶解底物质量分数的影响
胃蛋白酶水解度随底物质量分数的增加呈上升趋势,当底物质量分数在4%~5%时,水解度增长趋于平缓,如图2所示.这表明当底物质量分数超过4%时,酶的催化能力已经饱和,再增加底物浓度,其反应速率也不会再有所增加.故选择底物质量分数为4%,以进行后续实验.
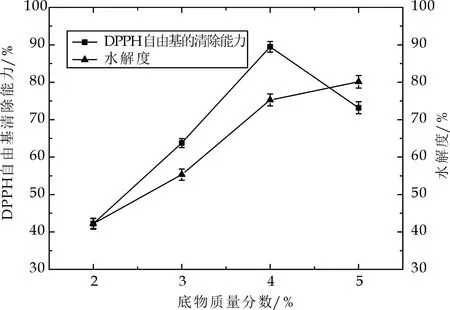
图2 底物质量分数对DPPH自由基清除率和水解度的影响
2.2.2胃蛋白酶酶解时间的影响
如图3所示,在酶解时间为4 h,时DPPH自由基清除能力达到85.0%.在反应开始时,胃蛋白酶与底物充分结合使DPPH自由基清除能力和水解度均快速增大;在4 h后,水解度依然增加,但DPPH自由基清除能力却在下降,表明抗氧化肽活性与片段长度相关,水解度增加,水解促使多肽变短,导致了DPPH自由基清除能力下降.综合考虑其它因素,可选择4 h进行后续实验.
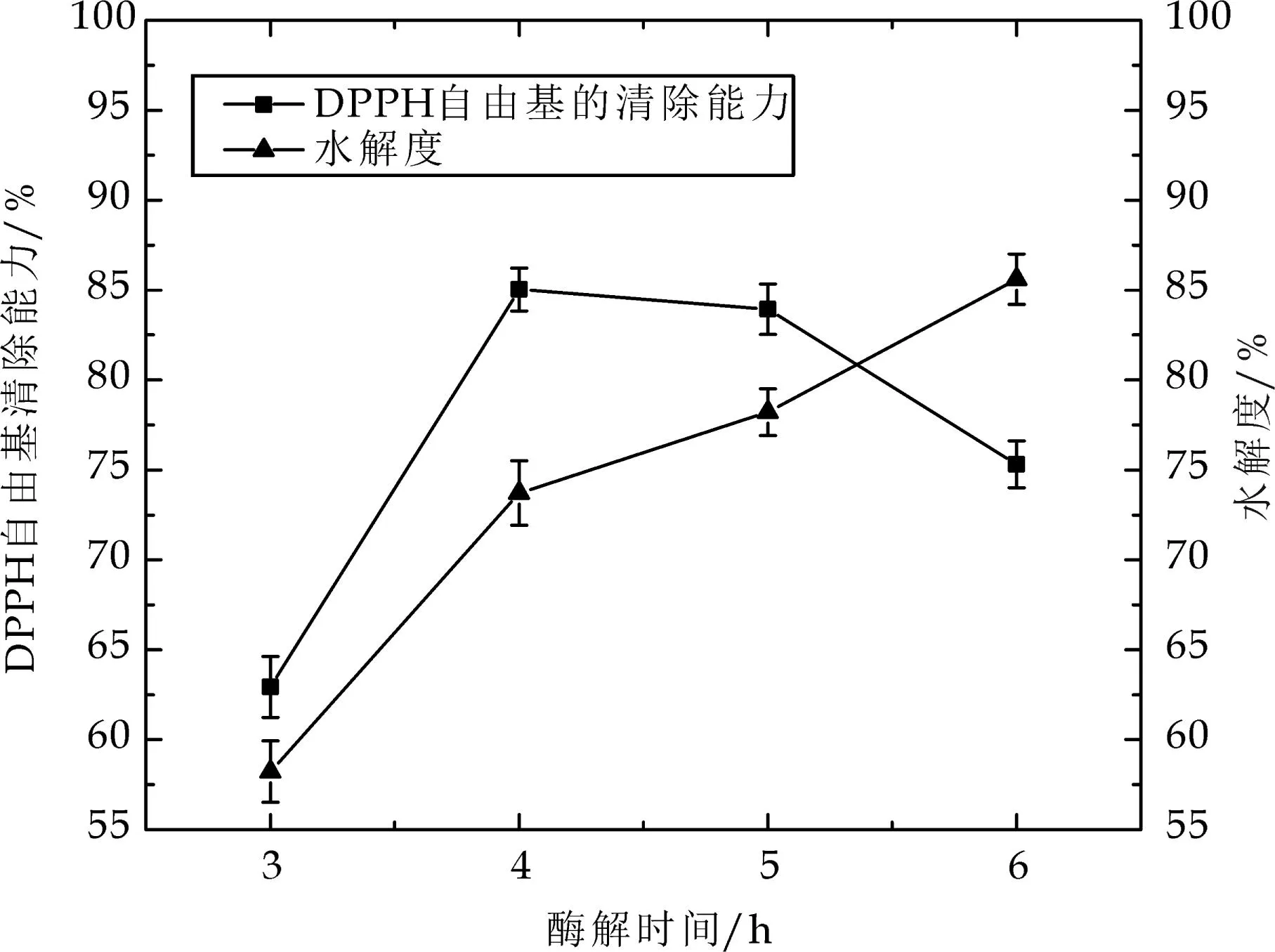
图3 酶解时间对DPPH自由基清除率和水解度的影响
2.2.3胃蛋白酶酶解加酶量的影响
如图4所示,当底物一定时,初始随加酶量的增加,水解度增加较快,在加酶量为8 000 U/g时,DPPH自由基清除能力达到86.3%.随着水解度提升多肽的含量增加,但具有抗氧化活性的多肽却减少,说明抗氧化活性肽具有特定结构和分子量;此外,已有研究报道[16],当酶量过高时,会导致酶本身的水解作用增强,也会阻碍酶对底物的水解.因此,综合考虑,可选择加酶量为8 000 U/g,以进行后续实验.
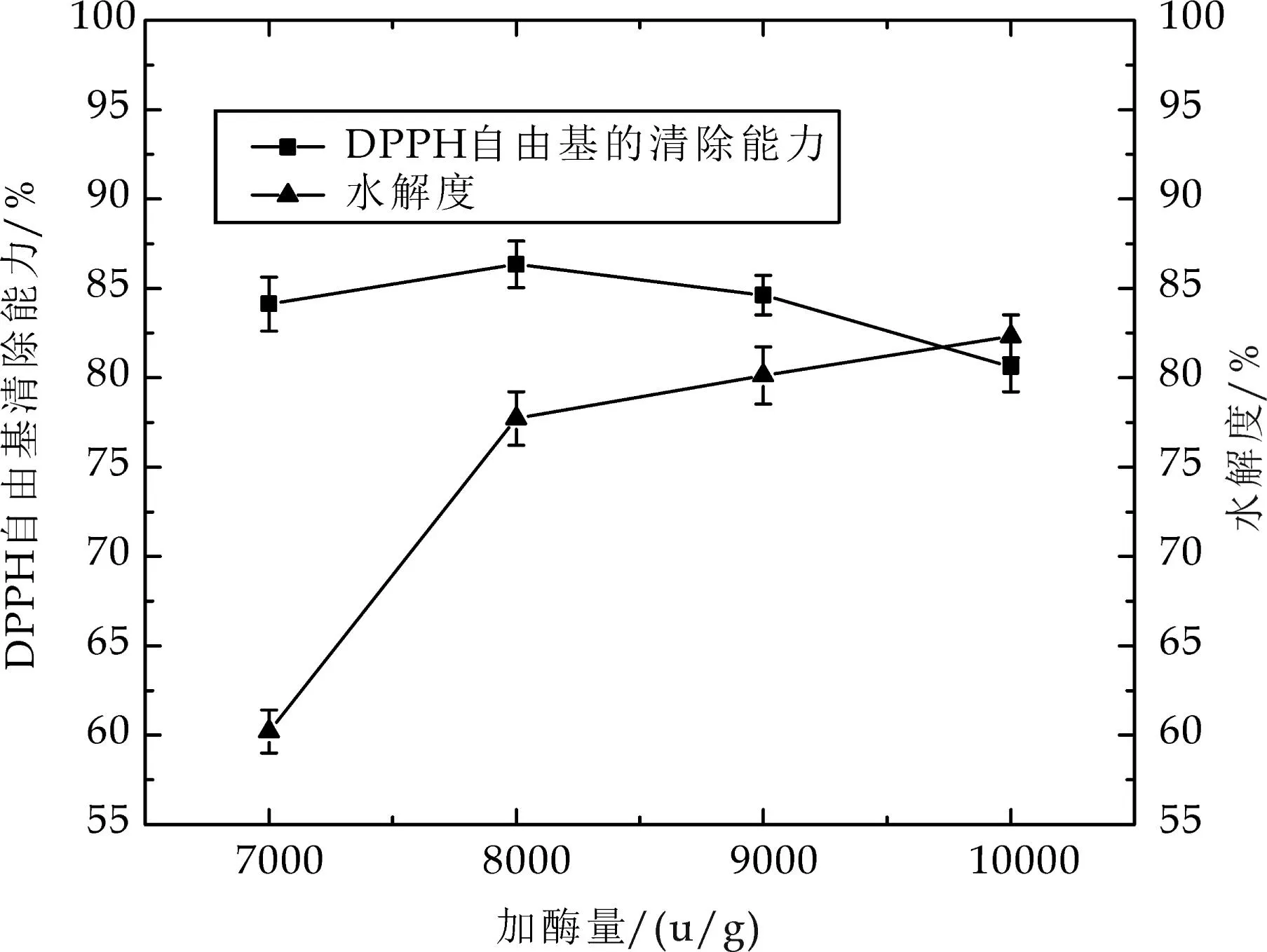
图4 加酶量对DPPH自由基清除率和水解度的影响
2.2.4卵清白蛋白水解物的电泳分析
不同底物质量分数水解物的电泳分析如图5所示.由图5可知,四种酶解液的分子量分布均有不同程度地降低,其中,当底物质量分数为4%时,水解物分子量小于27 kDa的分布更为集中,分子量相对较小.和单因素实验酶解底物质量分数4%的结果相符合,即水解物的DPPH自由基清除能力和水解度均较高.
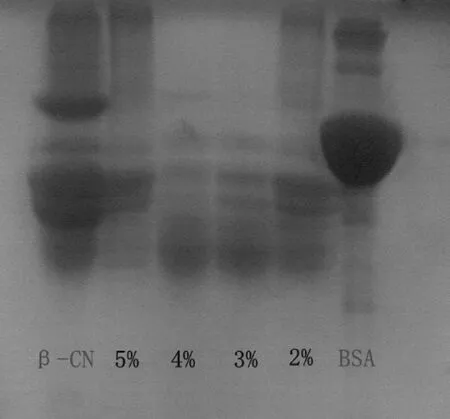
β-CN为β-酪蛋白;5%、4%、3%、2%分别代表水解液的底物质量分数;BSA为牛血清白蛋白 图5 胃蛋白酶酶解液电泳图谱
2.3正交试验结果
根据单因素实验结果设计正交试验,所得正交试验结果分析见表2所示.

表2 正交试验结果
由表2可知,通过极差分析得到影响DPPH自由基清除能力和水解度各因素的先后顺序均为A>C>B,即底物质量分数>加酶量>酶解时间.由R值比较可以看出,影响卵白蛋白DPPH自由基清除率和水解度的最优组合均为A2B2C2,即底物质量分数为4%、酶解时间5 h、加酶量为9 000 U/g.该组合在表中未涉及,经过实验验证测得该条件下DPPH自由基清除率和水解度分别为89.2%、83.9%.因此,确定最佳组合为A2B2C2.
2.4验证实验
采用底物质量分数4%、酶解时间5 h、加酶量9 000 U/g的酶解条件进行验证实验,其结果见表3所示.

表3 验证实验结果
在底物质量分数4%、酶解时间5 h、加酶量9 000 U/g条件下,胃蛋白酶水解卵白蛋白的DPPH自由基清除率达到89.2%、水解度为83.9%.自由基清除率高于其它实验组,因此,此条件为最佳酶解工艺条件.
3讨论
蛋清和蛋黄中都存在过敏原,但主要存在于蛋清中[17].本实验通过胃蛋白酶水解卵清蛋白制备抗氧化活性肽,一方面可降低蛋清过敏原性,另一方面可产生抗氧化活性肽.从鸡蛋中提取卵清蛋白并水解,水解物水解度高,可作为功能食品添加剂应用于食品加工中.
毕井辉等[18]通过不同的蛋白酶处理卵清蛋白后得到水解物,并检测其水解度,五种不同的酶的水解度最大值基本都保持在20%左右;徐明生和沈勇根等[19,20]用胃蛋白酶水解卵白蛋白,均得到了3个抗氧化活性多肽,分子量集中在450左右,超氧阴离子和羟基自由基的清除率分别为45%和56%;Tanzadehpanah等[21]利用胃蛋白酶水解鸵鸟蛋蛋清获得一个12肽,此多肽具有较强的抗氧化活性,在20μg/mL时,亚油酸自氧化抑制率为86.4%,在200μg/mL时,DPPH自由基的清除率达到81%.有研究认为C-或N-末端的疏水性Leu能够促进多肽与脂肪酸之间的相互作用,进而起到抗氧化作用[22];Chen等[23]用不同的酶酶解鸡蛋蛋清,发现水解产物的抗氧化性受水解时间和酶类型的影响;郑云等[24]选用四种蛋白酶水解卵清白蛋白,通过正交试验最终确定中性蛋白酶为水解的最佳用酶,且水解度可达到81.3%;唐文婷等[25]采用胃蛋白酶和胰蛋白酶复合水解,对其水解产物进行了体外抑菌实验和抗氧化能力测定,其DPPH自由基清除能力达到了85%左右;蒋雪薇等[26]研究了不同因素对卵白蛋白水解的影响,其水解度到达50.1%;本实验通过优化胃蛋白酶水解条件,得到了相对较高的DPPH自由基清除率和水解度.
4结论
胃蛋白酶对卵白蛋白的水解能力较强,通过优化得出了卵白蛋白经胃蛋白酶水解得到抗氧化活性肽的最佳工艺条件为:底物质量分数4%、酶解时间5 h、加酶量9 000 U/g.此时,DPPH自由基清除率和水解度分别为89.2%和83.9%.
参考文献
[1] 麻小娟.糖基化对卵白蛋白的构象及其抗原性和过敏原性的影响[D].南昌:南昌大学,2011.
[2] Huntington J A,Stein P E.Strueture and properties of ovalbumin[J].Journal of Chromatography B,2001,756(1-2):189-198.
[3] Masayuki Y,Nobuyuki, Masaaki H. Crystal structure of Sovalbumin as a non-loop-interted thermostabilized serpin form[J].Journal of Biological Chemistry,2003,278(37):35 524-35 530.
[4] Mine Y,Noutomi T,Haga N. Emulsifying and structural properties of ovalbumin[J].Journal of Agricultural and Food Chemistry,1991,39(3):443-446.
[5] 李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3-8.
[6] 任娇艳,赵谋明,崔春,等.草鱼源抗氧化肽的响应面法优化制备及活性评价[J].食品工业科技,2009,30(7):69-73.
[7] 张昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29(4):443-447.
[8] 陈星星,胡晓,李来好,等.抗疲劳肽的研究进展[J].食品工业科技,2015,36(4):365-369.
[9] 裴小平,唐道邦,肖更生,等.抗氧化肽制备的应用现状及趋势[J].食品工业科技,2009,30(2):319-322.
[10] 黄明,王璐莎.动物蛋白源抗氧化肽的研究进展[J].中国农业科学,2013,46(22):4 763-4 773.
[11] Davalos A,Miguel M,Bartolome B,et al.Antioxidant activityof peptides derived from egg white proteins by enzymatic hydrolysis[J].J Food Prot,2004,67(9):1 939-1 944.
[12] 王俊杰,赵燕,涂勇刚,等.蛋源性抗氧化肽研究进展[J].食品工业科技,2014,35(2):358-363.
[13] Heo S.J,Park E.J,Lee K.W,et al.Antioxidant activities of enzymatic extracts from brown seaweeds[J].Bioresource Technology,2005,96:1 613-1 623.
[14] 宁正祥.食品成分分析手册[M].北京:中国轻工业出版社,1998:120-121.
[15] GB/T 5009.5-2010,食品中蛋白质的测定[S].
[16] 翟瑞文,李雁群,陈子林,等.玉米面筋的酶水解[J].食品工业,1997(3):7-8.
[17] Anet J,Black J F,Baker R S,et al.Allergens in the white and yolk of hen′s egg:A study of IgE binding by egg proteins[J].International Archives of Allergy and Applied Immunology,1985,77(3):364-371.
[18] 毕井辉,汪何雅,钱和,等.不同酶处理对鸡蛋清中卵白蛋白致敏性的影响[J].食品工业科技,2012,33(19):72-75.
[19] 徐明生.鸡蛋卵白蛋白酶解物抗氧化肽研究[D].西安:陕西师范大学,2006.
[20] 沈勇根,徐明生,尹忠平,等.卵白蛋白抗氧化肽分离与纯化[J].中国食品学报,2011,8(11):16-22.
[21] Tanzadehpanah H,Asoodeh A,Chamani J.An antioxidant peptide derived from ostrich(struthio camelus) egg white protein hydrolysates[J].Food Res Int,2012,49(1):105-111.
[22] Ranathunga S,Rajapakse N,Kim S K.Purificationand characterization of antioxidative peptide derived from muscle of conger eel(conger myriaster)[J].Eur Food Res Technol,2006,222(3-4):310-315.
[23] Chen C,Chiy J,Zhao M Y,et al.Purification and identification of antioxidant peptides from egg white protein hydrolysate[J].Amino Acids,2012,43(1):457-66.
[24] 郑云,蔡木易,范慰慰.蛋清白蛋白酶解工艺的研究[J].食品与发酵工业,2005,31(12):69-71.
[25] 唐文婷,张晖,王立,等.卵白蛋白水解产物的抗菌性及抗氧化性[J].食品与生物技术学报,2014,33(3):241-247.
[26] 蒋雪薇,罗晓明,刘永乐.酶解卵清白蛋白条件的研究及其应用[J].食品与机械,2002(1):24-25.
【责任编辑:晏如松】
Preparation and antioxidant activity of peptides derived from ovalbumin
XUE Hai-yan, WANG Zhan-yong, SONG Hong-xin, LI Shan
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:Ovalbumin was one of the major allergen in egg white.And the pepsin hydrolysis can reduce allergens.In the work,peptides with antioxidant activity were prepared from ovalbumin by using DPPH radical scavenging activities and degree of hydrolysis as index.The influence of substrate concentration,enzymolysis time,and enzyme concentration on the antioxidant activity of peptides was also researched.Orthogonal experiment showed the most suitable condition of alkalineprotease to hydrolyze ovalbumin was substrate concentration of 4%,enzymolysis time of 5 h,alkaline protease of 9 000 U/g,respectively.Under the conditions,DPPH radical scavenging rates and degree of hydrolysis were 89.2% and 83.9%, respectively.So ovalbumin hydrolysates can be used as antioxidant and albumin nutrient containing amino acids,which can be widely applied in food,medicine,and other fields.
Key words:ovalbumin; pepsin; antioxidant activity; degree of hydrolysis
中图分类号:TS201.1
文献标志码:A
文章编号:1000-5811(2016)03-0126-06
作者简介:薛海燕(1979-),女,陕西兴平人,副教授,博士,研究方向:食品营养与安全
基金项目:国家自然科学基金项目(31301405); 陕西省科技厅科技统筹创新工程计划项目(2013KTZB02-02-05(2)); 陕西省教育厅专项科研计划项目(16JK1088); 西安市科技计划项目(CXY1434(4))
收稿日期:2016-03-28

