钳形铱配合物的研究进展*
毛国梁,甄 艳,徐雁男,宋 闯,刘振华
(东北石油大学化学化工学院 石油与天然气化工省重点实验室,黑龙江 大庆 163318)
钳型配合物在诸多领域有着广泛的应用,尤其在有机合成、有机催化领域具有突出的应用价值。它兼具金属有机化学和配位化学的特性,既含M—E σ键(配体的中心原子与金属原子的配位键),又有Donor-Metal配位作用。不同的配体结构与各种各样的过渡金属反应可以合成出种类繁多的钳形配合物,因此,钳形配合物的范围极其广泛,并且数量不断增加[1-6]。近些年来,由钳形配合物的统计数据分析可知,铱的配合物所占比重最大,约为22%(见图1),而且与传统的金属铱催化剂相比,钳形金属铱的催化剂具有突出的电子转移能力、与杂原子的高配位能力、较低的氧化还原电位。

图1 不同金属的钳形配合物占比
因而在催化转移脱氢、加氢、乙烯聚合等反应中得到应用研究。作者综述了金属铱的钳形配合物的结构、分类、合成方法及近年来在催化领域中的应用。
1 钳形配合物的结构及分类
1.1 钳形配合物的结构
钳形配合物由三齿配体与金属原子构成(见图2)。

图2 钳形配合物的通式以及最常见的结构
一般钳形配体通过至少一个M—E σ键与金属中心相连,三个配位原子与金属中心形成两个稳定的五元环[7]或者六元环[8-9],钳形配体的三齿螯合结构可以为金属原子提供被保护的环境。从很大程度上说,两个稳定的环阻碍了金属中心与配体的解离,从而提高了钳形配合物的热稳定性。此外,较强的σ键也对提高金属中心的稳定性起到的促进作用。因此,形成的金属配合物具有很好的稳定性。
图2所示DED′结构即为最典型的钳形配合物结构,当D和D′为相同的给电子体并且形成的两个金属螯合环相同时,称之为对称的钳形金属配合物,当D和D′为不同的给电子体或两个金属螯合环不同时,称之为非对称的钳形金属配合物。D和D′作为给电子体,其软硬度的不同可以影响钳形金属化合物的反应活性,此外,在给电子体上引入手性基团可以调节催化剂的对映选择性,L与金属中心作用的强弱对催化剂的化学选择性有很大的影响。在钳形配体的两臂处的W基团对配体的空间效应有影响,R基团对钳形配体的电子效应,空间效应有一定的调控作用。
1.2 钳形配合物的分类
钳形配合物的分类的依据是D和D′给电子体的类型和与金属原子相连的中心原子E,简言之,分类的依据是与金属紧密相连的三个原子,由此将其称为DED′型,D和D′可以为相同的给电子体,也可以为不同的给电子体,如PCP型、PCN型等。当钳形配体的两臂处的基团W为CaHb时,称之为DED′型;如果钳形配体的两臂处的基团W为N或NH,命名为DNEND′;如果两臂处的基团W为O,则称之为DOEOD′。若两臂处的基团W在臂上的原子不同时,比如其中一侧的基团W为CH,另一侧为N或NH,称之为DCEND′。如果杂环卡宾作为其中的一个供电子基团时,称之为CNHCED′,表示第一个碳原子为卡宾杂环的一部分;若两侧均为卡宾时,则称之为CEC′。
2 几种类型的钳形配体及钳形铱配合物
2.1 DED′型钳形配体及钳形铱配合物
2.1.1 DND′型钳形配体及钳形铱配合物
2006年,Milstein等[10]合成阴离子PNP型配合物1,配合物在芳香烃C—H活化反应中表现出较高的活性,形成了带有苯基的配合物2,然而这样形式化的活化作用并没有改变金属铱的氧化态。后来,研究者们通过加氢还原铱(Ⅲ)配合物3得到二氢配合物4,这样的加氢还原中吡啶配体的芳构化的实质过程是氢原子从金属迁移到苄基碳上。类似的反应,铱(Ⅰ)配合物2与一氧化碳的加成使金属中心被氧化,并且得到铱(Ⅲ) 配合物5(见图3)。

图3 PNP钳形铱配合物的结构
2015年,Feller等[11]通过具有吡啶基的钳形配合物6与氧气反应合成了铱钳形配合物[(tBuPNP*)Ir(R)(OH)](见图4中的配合物7)。通过NMR,EPR,质谱等的表征分析可知PNP的钳形配体提供了质子并最终形成了含非芳香环的羟基配合物。
Zhang等[12]合成了p-手性钳形PNP型铱配合物8和9(见图5),ORTEP图表明配合物8的结构接近于正八面体。含氯元素的配合物8与带有三个氢原子的配合物9被应用于酮类、烯烃与喹啉的不对称氢化反应,并且得到了含17%对映体的预期产物。2015年,Milstein等[13]又合成了以吡嗪为骨架的PNP型钳形配体10(见图5),位于吡嗪配体4号位的氮原子充当辅助配体的角色,从而有助于PNP钳形配体插入到大分子系统中。

图4 PNP钳形铱配合物的合成
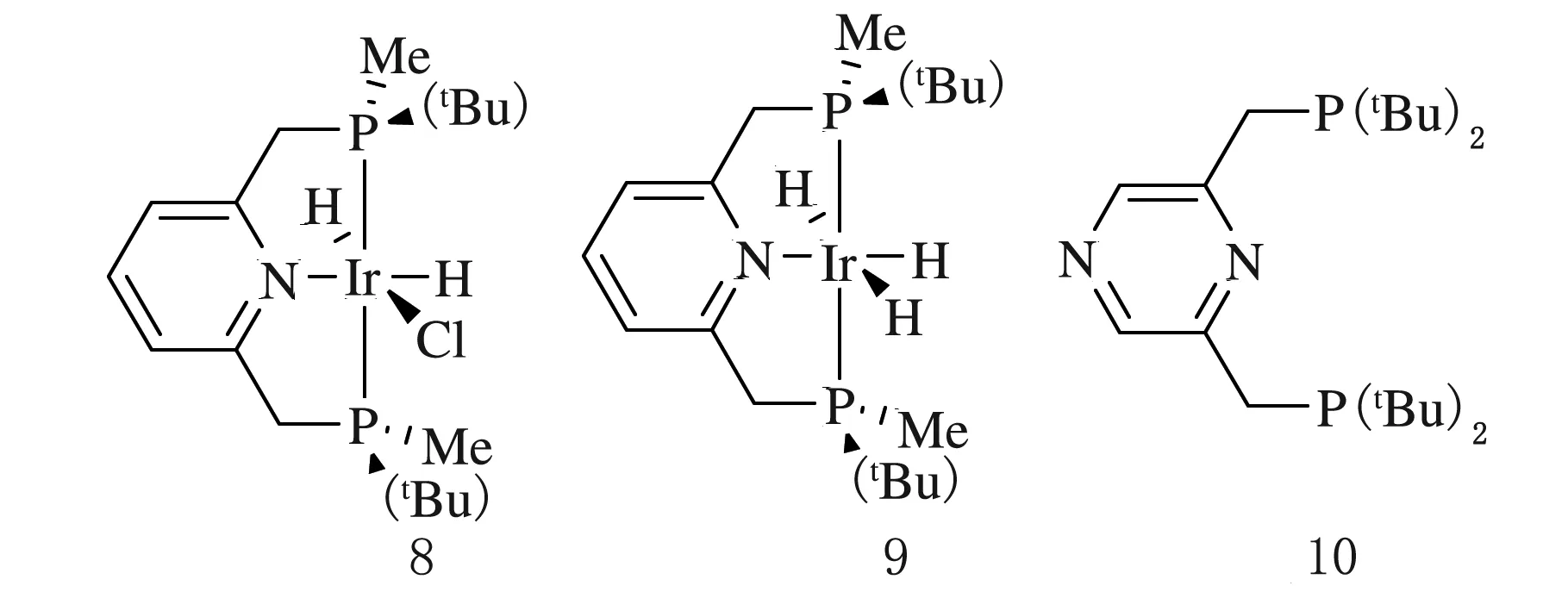
图5 PNP钳形铱配合物与吡嗪配体的结构
2.1.2 PCP型钳形铱配合物
Jensen和Kaska等[14-15]于1996年报道了钳形铱配合物(tBu4PCP)IrH211(见图6),由于配合物11在相对较高温度下仍然很稳定,且在脱氢反应中展现出较高的转化率。因此也使得它们在烷烃脱氢反应方面取得了突破性进展。1999年,Jensen和Goldman等[16]对配合物12a,12b(见图6)继续进行研究,发现12a与12b对于链烷烃的脱氢生成α-烯烃的反应表现出较高的动力学选择性。由此也使研究者认为配合物12b比11在链烷烃与环辛烷的脱氢反应中催化效率更高[17-18]。
2010年,Hartwig等人[19]通过用联氨分别与脂肪族钳形配合物13(见图6)和芳香族配合物14(见图6)反应对其进行N—H活化。反应得到的稳定性不同的两个产物15和16(见图7),配合物15在室温下是稳定的,而配合物16需要再经过第二步的N—H活化所得到的配合物才能在室温下稳定存在,由此可以得知sp3杂化的钳形配合物比sp2杂化的要稳定。

图6 PCP钳形铱配合物的结构

图7 PCP钳形铱配合物的结构
2014年,Wendt等[20]合成了脂肪族PCP型钳形铱的配合物17(见图7),但是这类化合物在脱氢反应中的催化活性非常低,可能是活性位易分解的原因。后来,Wendt等[21]又报道了新型环己基骨架的脂肪族PCP型钳形铱的配合物18(见图7)的合成。相对于类似的芳香族配体,这类含有sp3杂化碳原子的钳形配体具有更强的供电子性能。
2.2 DXEXD′型钳形配体及钳形铱配合物
2.2.1 DNNND′型钳形配体及钳形铱配合物
Haupt等[22]和Schirmer等[23]报道了常见的PNNNP型配体的合成路线如Scheme 1。2013年,Kempe等[24]通过向溶解于四氢呋喃中的PNNNP配体19a,19b加入[IrOMe(cod)]2合成钳形铱配合物20a,20b(见图8)。Huang等[25]在室温下向溶解于甲苯中的PNNNP配体21中加入0.5物质的量的[Ir(coe)2Cl]2得到钳形铱配合物22(见图8),但是,合成的这几种铱配合物对氧气和水比较敏感。

图8 PNNNP型钳形配体及钳形铱配合物的结构
2014年Huang等[26]合成了一系列显电中性的PNNNP钳形配体23,24(见图9),然后把这些配体的金属配合物应用于25 ℃,n(Al)∶n(Cr)=1 000,18×106Pa条件下的乙烯聚合,23a催化乙烯聚合得到1.48 g聚乙烯,产率为2.96×105g/(mol·h),并且改变反应条件得到的聚乙烯分子量分布较宽,从12 300到63 200。结果表明配体23a相应的金属配合物的催化产率是最高的,这样的结果说明W=NH,且R为空间位阻最大的叔丁基时,配体的催化活性是最高的。
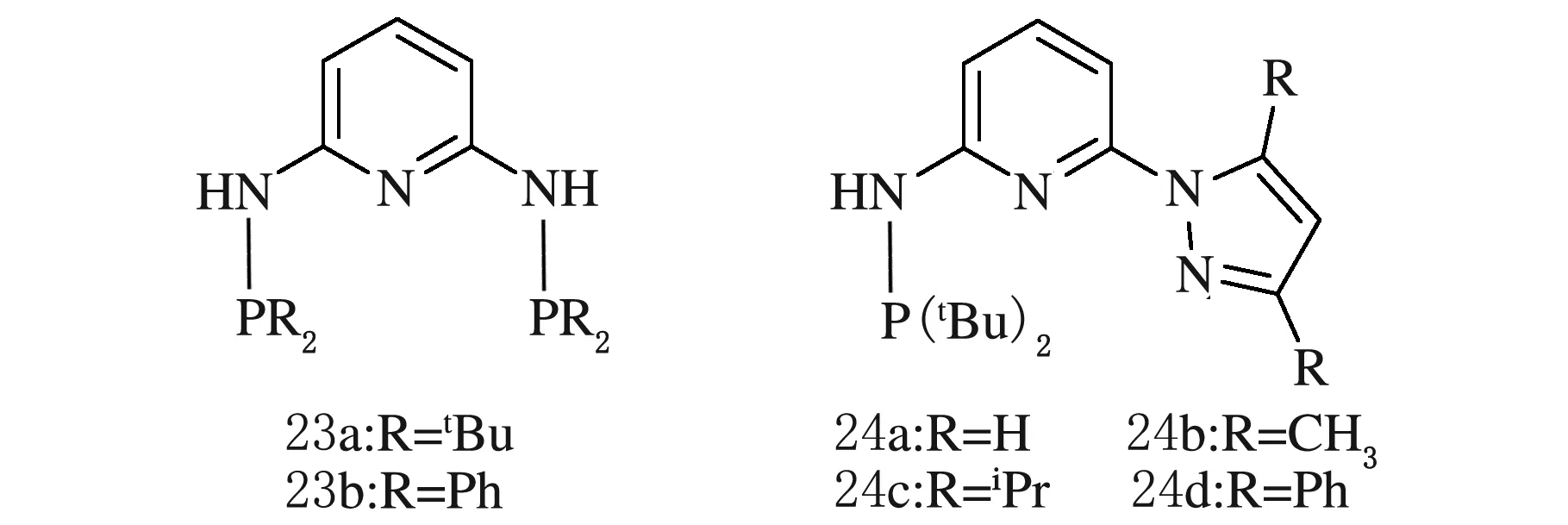
图9 PNNNP型钳形配体的结构
2.2.2 DOEOD′型配体及钳形铱配合物

图10 POCOP型钳形铱配合物的结构
近年来,Goldberg等[30]合成了POCOP 钳形配体 28(见图11)及相应的新型铱的配合物。他们分别得到了六配位的Ir(III)羰基配合物29和平面四配位的Ir(I) 羰基配合物30(见图11)。研究结果表明,与磷原子相连的取代基不同导致了金属中心的不同配位模式,这可能是由于空间位阻的影响。

图11 POCOP型钳形配体及钳形铱配合物的结构
2.3 DXEYD′钳形配体及钳形铱配合物
2012年Huang等[31]合成了PNNCN型钳形配体31(见图12),配体的两臂分别为强给电子体氨基膦与弱给电子体噁唑啉,它们的金属配合物在酮类加氢反应中比PNNNP型配合物表现出更高的催化活性。2014年,Huang等[27]又合成了PNCCP型配体32(见图12),它的钳形金属配合物在相同条件下(25 ℃,n(Al)∶n(Cr)=1 000,乙烯压力为18×106Pa)时,聚合物的产率为8×104g/(mol·h),比配体23的金属配合物为催化剂时的产率少了一个数量级。
Huang等[32]于2014年合成了PSCOP型铱配合物33(见图12),经过NaOtBu的活化后,配合物在COA和TBE作为氢接受体的脱氢反应中表现出非常高的稳定性。Huang等[33]还报道了两臂分别带有吡啶基与次磷酸基团的NCCOP型钳形铱配合物34(见图12),其中34b和34c经过NaOtBu活化后在环辛烯的脱氢反应中表现出较低的催化活性,而空间位阻效应相对较小的34a则表现出较高的反应活性。
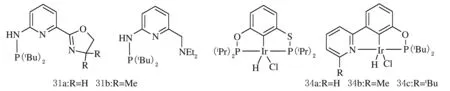
图12 DXEYD′型钳形配体及钳形铱配合物的结构
2.4 CNHCED′型钳形配合物
Chianese等[34-36]合成了双氮杂环钳形铱配合物35(见图13),缩写为CCC,这些配合物对线性烷烃或者环烷烃的脱氢有较高的催化活性,但是比常用的PCP型或者POCOP型配合物的活性要低。其中环辛烷与正十一烷的脱氢反应分别得到约103 TONs和97TONs的产物。2011年,Zuo和Braunstein等[37]合成的类似结构的NHC钳形铱配合物36(见图13)。反应时间相同(均为10 h),且四溴乙烷均为0.23 mL的情况下,150 ℃时,TOF值不存在;200 ℃时,TOF值为0.36 h-1;250 ℃时,TOF值为0.2 h-1。所以该钳形配合物应用于200 ℃,四溴乙烷为溶剂的条件下环辛烯的脱氢反应。

图13 CNHC ED′型钳形铱配合物的结构
3 结束语
近年来,钳形配体及其相应的配合物的研究日益受到关注,钳形配体最突出的特点之一就是它们的电子结构和空间效应的改变并不会影响配体对金属中心的配位能力。其中钳形铱配合物与传统的金属催化剂相比,具有易被修饰的结构,良好的官能团容忍性及较高的稳定性,因而在诸多领域应用广泛,尤其在链烷烃及环烷烃的脱氢反应中表现出较高的催化效率。钳形金属化合物化学极其丰富多彩,相信随着研究的不断深入,未来钳形金属化合物在基础研究及工业方面都将有着更加广阔的应用。
参 考 文 献:
[1] ALBRECHT M,VAN KOTEN G.Platinum group organometallics based on “pincer” complexes:sensors,switches,and catalysts[J].Angewandte Chemie International Edition,2001,40(20):3750-3781.
[2] VAN DER BOOM ME,MILSTEIN D.Cyclometalated phosphine-based pincer complexes:mechanistic insight in catalysis,coordination,and bond activation[J].Chemical reviews,2003,103(5):1759-1792.
[3] SINGLETON JT.The uses of pincer complexes in organic synthesis[J].Tetrahedron,2003,59(11):1837-1857.
[4] PUGH D,DANOPOULOS AA.Metal complexes with ‘pincer′-type ligands incorporating N-heterocyclic carbene functionalities[J].Coordination chemistry reviews,2007,251(5):610-641.
[5] MORALES-MORALES D,JENSEN C M.The chemistry of pincer compounds[M].Amsterdam:Elsevier,2007,287-309.
[6] BENITO-GARAGORRI D,KIRCHNER K.Modularly designed transition metal PNP and PCP pincer complexes based on aminophosphines:synthesis and catalytic applications[J].Accounts of chemical research,2008,41(2):201-213.
[7] ALBRECHT M,VAN KOTEN G.Metallorganische pinzetten-komplexe von elementen der platingruppe:sensoren,schalter und katalysatoren[J].Angewandte Chemie,2001,113(20):3866-3898.
[8] ALESSO G,CINELLU MA,STOCCORO S,et al.Gold (iii) six-membered N [caret]C [caret] N pincer complexes:synthesis,structure,reactivity and theoretical calculations[J].Dalton Transactions,2010,39(42):10293-10304.
[9] KOZLOV VA,ALEKSANYAN DV,NELYUBINA YV,et al.Cyclopalladation of meta-(diphenylthiophosphoryloxy) benzaldimines:NCS and unexpected NCO 5,6-membered pincer palladium complexes [J].Organometallics,2010,29(9):2054-2062.
[10] BEN-ARI E,LEITUS G,SHIMON L J W,et al.Metal-ligand cooperation in CH and H2activation by an electron-rich PNP Ir (I) system:facile ligand dearomatization-aromatization as key steps[J].Journal of the American Chemical Society,2006,128(48):15390-15391.
[11] FELLER M,BEN-ARI E,DISKIN-POSNER Y,et al.O2activation by metal-ligand cooperation with IrI PNP pincer complexes[J].J Am Chem Soc,2015,137:4634-4637.
[12] YANG Z,WEI X,LIU D,et al.P-Stereogenic pincer iridium complexes:synthesis,structural characterization and application in asymmetric hydrogenation[J].Journal of Organometallic Chemistry,2015,791:41-45.
[13] RIVADA-WHEELAGHAN O,DAUTH A,LEITUS G,et al.Synthesis and reactivity of iron complexes with a new pyrazine-based pincer ligand,and application in catalytic low-pressure hydrogenation of carbon dioxide[J].Inorg Chem,2015,54:4526-4538.
[14] GUPTA M,HAGEN C,FLESHER RJ,et al.A highly active alkane dehydrogenation catalyst:stabilization of dihydrido rhodium and iridium complexes by a P-C-P pincer ligand[J].Chem Commun,1996 (17):2083-2084.
[15] GUPTA M,HAGEN C,KASKA WC,et al.Catalytic dehydrogenation of cycloalkanes to arenes by a dihydrido iridium PCP pincer complex[J].Journal of the American Chemical Society,1997,119(4):840-841.
[16] LIU F,PAK EB,SINGH B,et al.Dehydrogenation of n-alkanes catalyzed by iridium “pincer” complexes:regioselective formation of α-olefins[J].Journal of the American Chemical Society,1999,121(16):4086-4087.
[17] ROSINI G,GOLDMAN A,JENSEN C,et al.Thermochemical alkane dehydrogenation catalyzed in solution without the use of a hydrogen acceptor[J].Chemical Communications,1997 (23):2273-2274.
[18] LIU F,GOLDMAN A.Efficient thermochemical alkane dehydrogenation and isomerization catalyzed by an iridium pincer complex[J].Chemical Communications,1999(7):655-656.
[19] HUANG,ZHENG,JIANRONG ZHOU,et al.Hartwig.N—H activation of hydrazines by iridium (I).double N—H activation to form iridium aminonitrene complexes[J].Journal of the American Chemical Society,2010,132(33):11458-11460.
[20] POLUKEEV AV,GRITCENKO R,JONASSON KJ,et al.Catalytic dehydrogenation of cyclooctane and triethylamine using aliphatic iridium pincer complexes[J].Polyhedron,2014,84:63-66.
[21] JONASSON KJ,POLUKEEV AV,WENDT OF,et al.PC (sp3) P pincer carbonyl complexes of iridium (I),and iridium (III) [J].RSC Adv,2015,5:15534-15538.
[22] BENITO-GARAGORRI D,BECKER E,WIEDERMANN J,et al.Achiral and chiral transition metal complexes with modularly designed tridentate PNP pincer-type ligands based on N-heterocyclic diamines[J].Organometallics,2006,25(8):1900-1913.
[23] SCHIRMER W,FLRKE U,HAUPT HJ.Zur charakterisierung von eigenschaften der versteiften dreizähnigen aminophosphanliganden N,N′-Bis (diphenylphosphino)-2,6-diaminopyridin und N,N-Bis (diphenylphosphino)-2-aminopyridin mit metallen der chromgruppe[J].Zeitschrift für anorganische und allgemeine Chemie,1989,574(1):239-255.
[24] MICHLIK S,KEMPE R.A sustainable catalytic pyrrole synthesis[J].Nature Chemistry,2013,5(2):140-144.
[25] GUO L,LIU Y,YAO W,et al.Iridium-catalyzed selective α-alkylation of unactivated amides with primary alcohols[J].Organic letters,2013,15(5):1144-1147.
[26] GONG D,LIU W,CHEN T,et al.Ethylene polymerization by PN3-type pincer chromium(Ⅲ) complexes[J].Journal of Molecular Catalysis A:Chemical,2014,395:100-107.
[27] MORALES-MORALES,DAVID,et al.Dehydrogenation of alkanes catalyzed by an iridium phosphinito PCP pincer complex[J].Inorganica chimica acta,2004,357(10):2953-2956.
[28] GÖTTKER-SCHNETMANN I,WHITE P,BROOKHART M.Iridium bis (phosphinite)p-XPCP pincer complexes:highly active catalysts for the transfer dehydrogenation of alkanes[J].Journal of the American Chemical Society,2004,126(6):1804-1811.
[29] WETHERBY AE,MUCHA NT,WATERMAN R.High activity and selectivity for silane dehydrocoupling by an iridium catalyst[J].ACS Catal,2012,2:1404-1407.
[30] GOLDBERG JM,WONG GW,BRASTOW KE,et al.The importance of steric factors in iridium pincer complexes[J].Organometallics,2015,34:753-762.
[31] CHEN T,HE LP,GONG D,et al.Ruthenium (II) pincer complexes with oxazoline arms for efficient transfer hydrogenation reactions[J].Tetrahedron Letters,2012,53(33):4409-4412.
[32] YAO W,ZHANG Y,JIA X,et al.Selective catalytic transfer dehydrogenation of alkanes and heterocycles by an iridium pincer complex[J].Angewandte Chemie International Edition,2014,53(5):1390-1394.
[33] JIA X,ZHANG L,QIN C,et al.Iridium complexes of new NCP pincer ligands:catalytic alkane dehydrogenation and alkene isomerization[J].Chemical Communications,2014,50(75):11056-11059.
[34] CHIANESE AR,DRANCE MJ,JENSEN KH,et al.Acceptorless alkane dehydrogenation catalyzed by iridium CCC-pincer complexes[J].Organometallics,2014,33:457-464.
[35] CHIANESE AR,MO A,LAMPLAND NL,et al.Iridium complexes of CCC-pincer N-heterocyclic carbine ligands:synthesis and catalytic C—H functionalization[J].Organometallics,2010,29:3019-3026.
[36] CHIANESE AR,SHANER SE,TANDLER JA,et al.Iridium complexes of bulky CCC-pincer N-heterocyclic carbene ligands:steric control of coordination number and catalytic alkene isomerization[J].Organometallics,2012,31:7359-7367.
[37] ZUO WW,BRAUNSTEIN P.N-heterocyclic dicarbene iridium(III) pincer complexes featuring mixed NHC/abnormal NHC ligands and their applications in the transfer dehydrogenation of cyclooctane[J].Organometallics,2011,31:2606-2615.

