β-catenin过表达鼻咽癌CNE2细胞模型的构建
林可焴 苏颖 何火聪 邹长棪 陈超
作者单位:350014 福州 福建省科技厅转化医学重点实验室 福建医科大学教学医院 福建省肿瘤医院放射生物学及肿瘤放射治疗学研究室
基础研究
β-catenin过表达鼻咽癌CNE2细胞模型的构建
林可焴 苏颖 何火聪 邹长棪 陈超
作者单位:350014 福州 福建省科技厅转化医学重点实验室 福建医科大学教学医院 福建省肿瘤医院放射生物学及肿瘤放射治疗学研究室
目的 构建β-catenin真核表达载体pcDNA3.1(+)/β-catenin并转染鼻咽癌CNE2细胞,检测β-catenin在CNE2细胞中的表达。方法 反转录-聚合酶链式扩增反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增目的基因β-catenin,胶回收纯化后克隆至pGEM-T Easy载体,挑选阳性克隆,抽提质粒进行kpn I/xba I双酶切和PCR鉴定,用T4 DNA连接酶将目的基因β-catenin与真核表达载体pcDNA3.1/Hygro(+)连接,构建重组的真核表达载体pcDNA3.1(+)/β-catenin,转化感受态细胞DH5α,再次抽提质粒进行PCR、kpn I/xba I双酶切和测序鉴定,然后用FuGENE HD将纯化的pcDNA3.1(+)/β-catenin转染入鼻咽癌CNE2细胞,经Hygromycin B筛选,采用实时荧光定量PCR和蛋白质印迹法(Western blot)验证转染细胞CNE2/β-catenin中β-catenin的表达。结果 PCR、双酶切及测序鉴定表明,成功构建了真核表达载体pcDNA3.1(+)/β-catenin;实时荧光定量 PCR和Western blot检测表明,与未转染细胞CNE2比较,被转染的CNE2/β-catenin细胞能够上调目的基因β-catenin的表达(P<0.01)。结论 成功构建真核表达载体pcDNA3.1(+)/β-catenin,并能在转染的CNE2/β-catenin细胞上调目的基因β-catenin的表达。
鼻咽肿瘤;真核表达载体;β-catenin;细胞模型
β-catenin是Wnt/β-catenin信号通路的核心,研究表明鼻咽癌细胞中β-catenin表达异常,而β-catenin异常高表达与鼻咽癌不良预后密切相关[1,2]。本研究通过构建β-catenin真核表达载体pcDNA3.1(+)/βcatenin并转染鼻咽癌CNE2细胞,观察其在CNE2细胞中的表达,进而构建β-catenin过表达鼻咽癌CNE2细胞模型,以期为进一步研究Wnt/β-catenin信号通路在鼻咽癌的生物活性和作用提供研究模型。
1 材料和方法
1.1 材料
人鼻咽癌细胞株CNE2由福建省肿瘤医院放射生物研究室培养保存。大肠杆菌DH5α购自Invitrogen公司,pGEM-T Easy载体购自Promaga公司,真核表达载体pcDNA 3.1/Hygro(+)购自Invitrogen公司;RPMI-1640购自Hyclone公司;新生牛血清购自杭州四季青生物材料有限公司;EX taq酶和TRizol购自Takara公司;质粒抽提试剂盒购自Qiagen公司,限制性内切酶kpn I和xba I购自NEB公司,FuGENEHD转染试剂购自Roche公司,逆转录试剂盒购自Fermentas公司;其余试剂均为进口或国产分析纯。
1.2 方法
1.2.1 引物设计 根据GeneBank中β-catenin基因mRNA的编码区序列(X87838.1)及xbaⅠ和kpnⅠ切酶保护碱基的要求设计与合成β-catenin扩增的PCR引物。β-catenin上游引物:5′-GGGGTACCATGGCTACTCAAGCTGATT-3’,β-catenin下游引物:5′-GCTCTAGATTACAGGTCAGTATCAAACCAGGC-3′,PCR产物为2 346 bp。其中在上游引物5′端引入kpnⅠ的酶切位点和两个保护碱基GG,下游引物5′引入xbaⅠ的酶切位点和两个保护碱基GC。
1.2.2 目的基因β-catenin的反转录-聚合酶链式扩增反应(reverse transcription-polymerase chain reaction,RT-PCR) 收集鼻咽癌CNE2细胞,提取细胞总RNA。反转录(RT)反应体系:RNA 3μg,Oligo(dT,0.5μg/μL)1μL,5倍反应缓冲液4μL,抑制剂1μL,dNTPmix(10mmol/L)2μL,反转录酶200 U,焦碳酸二乙处理的纯水(DEPC-treatedwater,DEPC水)补足至20μL。反应条件:42℃反应60min,70℃水浴5min终止反应后立即冰浴。PCR反应体系:cDNA模板2μL、10×buffer 2μL、dNTP 1.6μL、上下游引物各1μl、Taq酶0.2μL、加DEPC水至20μL。反应条件:94℃预变性4min;94℃45 s,55℃45 s,72℃3min,30个循环;72℃10min;4℃保存。1%琼脂糖凝胶电泳检测PCR产物,胶回收纯化目的基因β-catenin产物。
1.2.3 目的基因β-catenin的亚克隆 用T4 DNA连接酶将胶回收纯化的β-catenin与pGEM-T Easy载体于4℃连接过夜,得到亚克隆质粒pGEM-T/β-catenin,转化感受态细胞DH5α,取菌液100μL涂于含IPTG/ X-gal/氨苄青霉素的LB平板上,倒扣37℃培养过夜后挑选白色阳性克隆,于LB培养基扩培后抽提质粒,kpn I和xba I双酶切,然后胶回收双酶切后的目的基因产物β-catenin。以从白色阳性克隆抽提的质粒pGEM-T/β-catenin为模板,用上述β-catenin的PCR扩增引物对质粒pGEM-T/β-catenin进行PCR鉴定。1.2.4 真核表达载体pcDNA3.1(+)/β-catenin的构建
将上述kpn I和xba I双酶切产物经1%琼脂糖凝胶电泳,胶回收目的基因片段β-catenin,用T4 DNA连接酶将β-catenin与经同样双酶切的真核表达载体pcDNA3.1/Hygro(+)于4℃连接过夜,然后转化感受态细胞DH5α,涂于含50μg/μL氨苄青霉素的LB平板,37℃过夜培养,挑取单菌落接种到LB培养基,继续扩大培养后抽提质粒,进行kpn I和xba I双酶切鉴定、PCR鉴定和DNA测序鉴定。
1.2.5 真核表达载体pcDNA3.1(+)/β-catenin转染鼻咽癌CNE2细胞 CNE2细胞接种于24孔板,密度达80%~90%时用FuGENE HD转染试剂将纯化后的pcDNA3.1(+)/β-catenin真核表达载体转染细胞;转染48 h后,胰酶消化分离细胞,用含Hygromycin B的培养液重悬细胞后接种到6孔板中进行筛选培养,得到转染后的CNE2/β-catenin细胞;然后挑选两个细胞克隆(命名为CNE2/β-catenin/A和CNE2/β-catenin/B),进行β-catenin表达鉴定。
1.2.6 实时荧光定量PCR检测β-catenin mRNA表达 收集对数生长期的CNE2、CNE2/β-catenin/A和CNE2/β-catenin/B细胞,提取细胞总RNA,反转录后进行实时荧光定量PCR检测。内参照β-actin上游引物:5′-GGAAATCGTGCGTGACATT-3′,下游引物:5′-CAGGCAGCTCGTAGCTCTT-3′。β-catenin上游引物:5′-GCAGCAACAGTCTTACC-3′,下游引物:5′-AC A GGACTTGGGAGGTAT-3′。实时荧光定量PCR反应体系(20μL):去离子水3μL,PCR上下游引物(10μmol/L)各1μL,MasterMix10μL,DNA模板5μL。实时荧光定量PCR反应程序:预变性95℃10min;扩增95℃10 s,60℃10 s,72℃20 s,共40个循环;熔解曲线95℃10 s,60℃1min,然后升温至95℃(每度采集5次荧光,连续采集);冷却40℃30 s。以2-ΔΔCt值代表β-catenin基因的相对表达量。
1.2.7 Western blot检测β-catenin蛋白表达 收集对数生长期CNE2、CNE2/β-catenin/A和CNE2/β-catenin/ B细胞,胰酶消化后PBS清洗,1 200 r/min离心5min,去上清液后收集细胞并裂解,4℃高速离心后取上清液,用BCA法测定蛋白质浓度。将定量蛋白经10%聚丙烯酰胺凝胶电泳(SDS-PAGE),电转至NC膜,3%牛血清白蛋白(BSA)封闭,TTBS(Tris-HCl 20mmol/L,NaCl 150 mmol/L,0.1%吐温-20,pH 7.2)洗膜后加入β-catenin一抗与膜上抗原结合,用相应HRP标记的二抗与其反应后加ECL化学发光试剂,多功能成像分析系统成像。以β-catenin蛋白与β-actin蛋白电泳条带的吸光度比值表示β-catenin蛋白的表达量。
1.3 统计学处理
采用SPSS 17.0统计软件对数据进行分析,数据以均数±标准差(±s)表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 目的基因β-catenin的扩增
由鼻咽癌CNE2细胞提取的总RNA经RT-PCR扩增的产物,通过凝胶电泳验证,所获得的PCR目的产物片段约为2 346 bp(见图1),该片段与GeneBank中的β-catenin基因(X87838.1)CDS序列大小一致,表明β-catenin基因被成功获取。
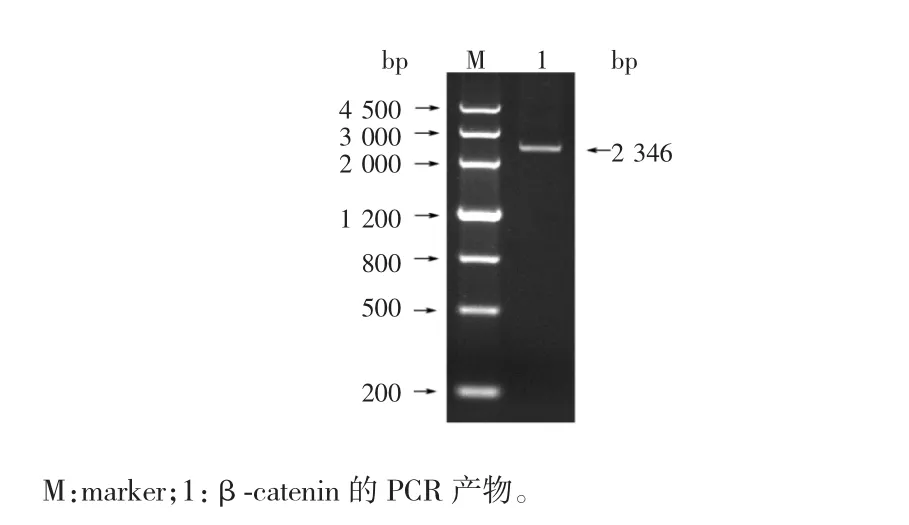
图1 目的基因β-catenin的PCR扩增
2.2 目的基因β-catenin的亚克隆及筛选鉴定
目的基因β-catenin与pGEM-T Easy连接而成的亚克隆质粒pGEM-T/β-catenin经1%琼脂糖凝胶电泳,在约为5 361 bp处可见一条明亮谱带,与β-catenin和pGEM-T Easy两者连接而成的亚克隆质粒大小一致(见图2泳道1);亚克隆质粒pGEM-T/β-catenin经kpn I与xba I双酶切后,在约为3 015 bp和2 346 bp处各见一条明亮的谱带(见图2泳道2),分别与pGEM-T Easy和β-catenin大小一致;以亚克隆质粒pGEM-T/β-catenin为模板进行β-catenin的PCR扩增,结果显示在2 346 bp处有一条与β-catenin大小一致的谱带(见图2泳道3)。以上结果说明成功构建了pGEM-T/β-catenin亚克隆载体。
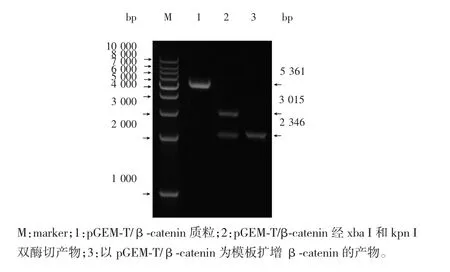
图2 pGEM-T/β-catenin亚克隆载体的构建
2.3 pcDNA3.1(+)/β-catenin真核表达载体的构建及鉴定
重组真核表达载体pcDNA3.1(+)/β-catenin转化感受态细胞DH5α后抽提质粒,经1%琼脂糖凝胶电泳,在约为7 946 bp处有一明亮谱带,大小与pcDNA3.1(+)/β-catenin分子量一致(见图3泳道1)。重组质粒pcDNA3.1(+)/β-catenin经kpn I与xba I双酶切,1%琼脂糖凝胶电泳,在约为5 600 bp和2 346 bp处各见一条明亮谱带,分别与pcDNA3.1/Hygro(+)和β-catenin大小一致(见图3泳道2)。以pcDNA3.1(+)/ β-catenin质粒为模板,用目的基因β-catenin上下游引物经PCR扩增,鉴定目的基因,结果在2 346 bp处可见一条明显的扩增谱带(见图3泳道3),与酶切得到的目的基因β-catenin对应的谱带位置一致。把经酶切鉴定和PCR鉴定正确的pcDNA3.1(+)/β-catenin质粒进行DNA测序,通过NCBI中的序列比对工具BLAST将测得的序列与设计的基因序列进行比对,结果提示二者一致,说明成功构建了真核表达载体pcDNA3.1(+)/β-catenin。

图3 真核表达载体pcDNA3.1(+)/β-catenin的构建
2.4 CNE2/β-catenin转染细胞中β-catenin mRNA的表达
实时荧光定量PCR检测结果显示,转染细胞CNE2/β-catenin/A及 CNE2/β-catenin/B中 β-catenin的mRNA表达分别为2.243±0.011和3.894±0.070,较未转染细胞CNE2的1明显上调,两种转染细胞与未转染CNE2细胞比较差异均有统计学意义(P<0.01)。说明pcDNA3.1(+)/β-catenin转染CNE2细胞可明显上调β-catenin基因的表达。见图4。
2.5 CNE2/β-catenin转染细胞中β-catenin蛋白的表达
Western blot检测结果显示,转染细胞CNE2/ β-catenin/A和CNE2/β-catenin/B的β-catenin表达分别为0.458±0.015和0.842±0.040,较未转染细胞CNE2的0.257±0.010明显上调,与未转染CNE2细胞比较差异均有统计学意义(P<0.01)。说明pcDNA3.1(+)/ β-catenin转染CNE2细胞可明显上调β-catenin蛋白的表达。见图5。
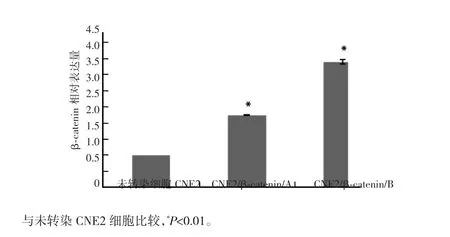
图4 CNE2/β-catenin转染细胞中β-catenin m RNA的表达
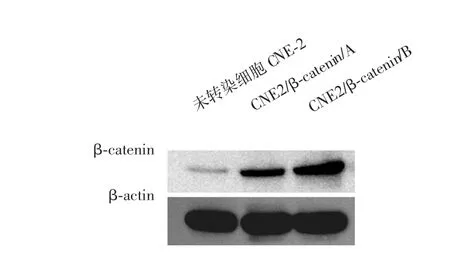
图5 CNE2/β-catenin转染细胞中β-catenin蛋白的表达
3 讨论
鼻咽癌为我国南方地区常见的恶性肿瘤,其病因尚不明确,目前认为鼻咽癌是由多因素引起,遗传易感性、环境因素以及EB病毒感染在鼻咽癌的发生、发展中起重要作用。放射治疗是鼻咽癌的主要治疗方法。随着放疗技术的进步及综合治疗的应用,鼻咽部疗效显著提高,早期患者5年生存率可达80%~90%,中晚期患者可达60%~70%,但10%~20%的早期及20%~30%的中晚期患者仍出现局部复发或远处转移[3,4]。因此,研究鼻咽癌发生发展的分子机制及其信号通路,进而探索有效的作用靶点,将可能为鼻咽癌的发病机制和治疗的研究提供科学依据。
研究表明,Wnt/β-catenin信号通路与肿瘤发生、发展密切相关,该信号途径的调控异常在多种人类肿瘤如乳腺癌、结直肠癌、前列腺癌、肝癌、食管癌等发生发展中起着重要作用[5~8]。多项研究表明,在肿瘤细胞中存在Wnt/β-catenin信号通路的异常活化。目前认为,β-catenin降解障碍致使细胞质内游离的 β-catenin积聚并进入细胞核,激活下游靶基因CyclinD1、c-myc的转录,是Wnt/β-catenin信号通路致癌的关键[9~11]。
近年多项研究表明,Wnt/β-catenin信号通路的调控异常与鼻咽癌发生发展存在密切关系[12,13]。研究提示Wnt/β-catenin信号通路调控异常可影响鼻咽癌治疗效果[14]。突变的β-catenin与鼻咽癌侵袭和转移有关,其中细胞质的β-catenin主要作用为减少鼻咽癌细胞间的黏附,促进鼻咽癌细胞侵袭和转移[15]。β-catenin的异常高表达与鼻咽癌的不良预后密切相关,其在早期鼻咽癌有更高的过表达率[1,2]。低分化鼻咽癌细胞比高分化鼻咽癌细胞有更高水平的细胞质内β-catenin和细胞核内β-catenin的表达,以及更高的β-catenin转录活性,说明前者的Wnt/β-catenin信号通路较后者明显处于更高的活化状态,提示Wnt/ β-catenin信号通路可能在抑制鼻咽癌细胞分化中起重要作用[16,17]。综上认为,Wnt/β-catenin信号转导通路的异常可能与鼻咽癌的发病机制相关。因此,构建相关的实验研究模型,将有助于进一步探讨Wnt/β-catenin信号转导通路在鼻咽癌发生发展中的作用机制。
本研究从低分化鼻咽癌细胞(CNE2)中提取总RNA,经特异性引物扩增β-catenin基因,经TA亚克隆、蓝白筛选、kpn I和xba I双酶切后,将目的片段与带有潮霉素抗性基因的pcDNA3.1/Hygro(+)真核表达载体连接,从而提高了重组克隆的准确性和可靠性。由于真核表达载体pcDNA3.1/Hygro(+)含有CMV启动子、SV40早期启动子、多克隆位点、Hygromycin抗性基因等,目的基因β-catenin可在导入鼻咽癌CNE2细胞中获得长期稳定的高水平表达,避免后续转染细胞的质粒丢失。通过对重组载体pcDNA3.1(+)/β-catenin的kpn I和xba I双酶切、PCR以及测序鉴定,证明重组质粒含有与GeneBank中β-catenin相同的编码区序列(X87838.1),说明真核表达载体pcDNA3.1(+)/ β-catenin构建成功。进而,通过FuGENE HD转染试剂将纯化的真核表达载体pcDNA3.1(+)/β-catenin转染鼻咽癌CNE2细胞,经Hygromycin B筛选后获得β-catenin转染的两株鼻咽癌细胞(CNE2/β-catenin/A和CNE2/β-catenin/B)。实时荧光定量PCR和Western blot检测表明,两株转染细胞均能够过表达目的基因β-catenin,提示成功构建了β-catenin过表达的鼻咽癌CNE2细胞模型(CNE2/β-catenin/A和CNE2/ β-catenin/B)。
综上所述,本研究成功构建了pcDNA3.1(+)/β-catenin真核表达载体,建立了β-catenin过表达的鼻咽癌CNE2细胞模型(CNE2/β-catenin/A和CNE2/β-catenin/B),为后续进一步探讨β-catenin在鼻咽癌中的作用机制提供研究模型。
[1] Xu L,Jiang Y,Z heng J,e t a l.A b e rr an t e x p r e ss ion o fβ-c a t enin an d E-c a d he r in i s c o rr e l a t e d w i t h poo r p r ogno s i s o f na s opha r yngea l c anc e r[J].H um P a t ho l,2013,44(7):1357-1364.
[2] 王菲莉,郭翔,袁太泽,等.W n t-1、β-c a t enin在鼻咽癌组织中的表达及其临床意义[J].癌症,2009,28(1):91-95.
[3] L in S,P an J,H an L,e t a l.N a s opha r yngea l c a rc inoma tr ea t e d w i t h r ed u c e d-v o l ume in t en s i t y-mo d u l a t e d r a d ia t ion t he r apy:r epo rt on t he 3-yea r ou tc ome o f a p r o s pe ct i v e s e r ie s[J].I n t J R a d ia t O n c o l B io l P hy s,2009,75(4):1071-1078.
[4] C hua D T,S ham J S,H ung K N,e t a l.P r e d i ct i v e f a ct o r s o f t umo r c ontr o l an d s u r v i v a l a ft e r r a d io s u r ge r y f o r l o c a l f ai l u r e s o f na s opha r yngea l c a rc inoma[J].I n t J R a d ia t O n c o l B io l P hy s,2006,66(5):1415-1421.
[5] M ohamme d M K,S hao C,W ang J,e t a l.W n t/β-c a t enin s igna l ing p l ay s an e v e r-e x pan d ing r o l e in s t em c e ll s e lf-r ene w a l,t umo r igene s i s an d c an c e r c hemo r e s i s t an c e[J].G ene s Di s,2016,3(1):11-40.
[6] Xu M,W ang S,S ong Y U,e t a l.A pigenin s upp r e ss e s c o l o r e ct a l c an c e r c e ll p r o l i f e r a t ion,mig r a t ion an d in v a s ion v ia inhi b i t ion o f t he W n t/β-c a t enin s igna l ing pa t h w ay[J].O n c o l L e tt,2016,11(5):3075-3080.
[7] L iu W,Xing F,l ii z umi-G ai r ani M,e t a1.N-my c d o w n s tr eam r egn l a t e d gene 1 mo d u l a t e s W n t-b e t a-c a t enin s igna ll ing an d p l eio tr opi c a ll y s upp r e ss e s me t a s t a s i s[J].EMB O M o l M e d,2012,4(2):93-108.
[8] L ee MA,K im WK,P a rk H j,e t a l.A n t i.p r o l i f e r a t i v e a ct i v i t y o f hy dno c a r pin,a na t u r a l l ignan,i s a ss o c ia t e d w i t h t he s upp r e ss ion o f W n t/b e t a-c a t enin s igna l ing pa t h w ay in c o l on c an c e r c e ll s[J].B ioo r g M e d C hem L e tt,2013,23(20):5511-5514.
[9] C a r mon KS,L oo s e D S.De v e l opmen t o f b ioa ss ay f o r d e t e ct ion o f W n tb in d ing a ff ini t ie s f o r in d i v i d ua l fr i zz l e d r e c ep t o r s[J].A na l B io c hem,2010,401(2):288-294.
[10]L uo J,C hen J,Deng Z L,e t a l.W n t s igna l ing an d human d i s ea s e s:w ha t a r e t he t he r apeu t i c imp l i c a t ion s[J].L a b I n v e s t,2007,87(2):97-103.
[11]H uang H,H e X.W n t/b e t a-c a t enin s igna l ing:ne w(an d o ld)p l aye r s an d ne w in s igh t s[J].C u rr O pin C e ll B io l,2008,20(2):119-125.
[12]Jiang R,N iu X,H uang Y,e t a l.β-C a t enin i s impo rt an t f o r c an c e r s t em c e ll gene r a t ion an d t umo r igeni c a ct i v i t y in na s opha r yngea l c a r-c inoma[J].A ct a B io c him B iophy s S in(S hanghai),2016,48(3):229-237.
[13]郑军,徐丽娜,石磊,等.β-连环蛋白表达在鼻咽癌癌变过程中作用的研究[J].中国耳鼻咽喉颅底外科杂志,2012,18(2):85-89.
[14]G uan GF,Z hang DJ,Z heng Y,e t a l.A b no r ma l W n t s igna l ing an d o v e r e x p r e ss ion o f ABCG2 c on tr i b u t e s t o dr ug e ffl u x p r ope rt ie s o f s i d epopu l a t ion c e ll s in na s opha r yngea lc a rc inoma[J].M o l M e d R ep,2015,12(3):4352-4357.
[15] S hi W,B a s t ianu tt o C,L i A,e t a l.M u lt ip l e d y s r egu l a t e d pa t h w ay s in na s opha r yngea l c a rc inoma r e v ea l e d b y genee x p r e ss ion p r o f i l ing[J]. I n t J C an c e r,2006,119(10):2467-2475.
[16]林琼琼,李锦添,王敏.W n t/β-c a t enin通路在鼻咽癌分化中的作用[J].中山大学学报(医学科学版),2005,26(4):384-387.
[17]游淑源,韩安家,张芬芬,等.鼻咽癌中EB病毒编码的LMP1对β-c a t enin转录活性及表达的影响[J].中华病理学杂志,2010,39(8):537-541.
[2016-06-24收稿][2016-07-29修回][编辑 罗惠予]
Construction of a CNE2 cellular model of nasopharyngeal carcinoma involvingβ-catenin overexpression
Lin Keyu,Su Ying,He Huocong,Zou Changyan,Chen Chao(Laboratory of Radiation Oncology and Radiobiology,Fujian Provincial Cancer Hospital,Teaching Hospital of Fujian Medical University,Fujian Key Laboratory of Tumor Translational Cancer Medicine,Fuzhou 350014,P.R.China)
Su Ying.E-mail:zjsuying@hotmail.com
objective The eukaryotic expression plasmid pcDNA3.1(+)/β-catenin was constructed and transfected into CNE2 nasopharyngeal carcinoma cells,andβ-catenin overexpression was verified in transfected cells.Methods Theβ-catenin gene was amplified by RT-PCR,gel-purified and cloned into pGEM-T Easy,then transformed into E.coli.Positive cloneswere screened by digesting extracted plasmid with Kpn I/Xba I and by analyzing with PCR.The subclonedβ-catenin gene was inserted into the eukaryotic expression vector pcDNA3.1/Hygro(+)using T4 DNA ligase,resulting in the recombinanteukaryotic expression plasmid pcDNA3.1(+)/ β-catenin.This construct was transformed into competent DH5αcells and positive clones were identified using PCR,Kpn I/Xba I digestion and DNA sequencing.Purified pcDNA3.1(+)/β-catenin was transfected into CNE2 cells using FuGENE HD transfection reagent,and transfectantswere selected using hygromycin B.Expression ofβ-catenin in transfected cellswas assessed using real-time fluorescence quantitative PCR and Western blotting.Results The eukaryotic expression plasmid pcDNA3.1(+)/β-catenin wasconstructed and confirmed by PCR,double enzyme digestion and DNA sequencing.Overexpression ofβ-catenin in transfected CNE2 cells was confirmed using real-time fluorescence quantitative PCR and Western blotting(P<0.01).Conclusion The eukaryotic expression plasmid pcDNA3.1(+)/β-catenin was constructed and can be transfected into CNE2 cells to up-regulateβ-catenin.These transfected cellsmay provide an in vitromodel for studying the role ofβ-catenin in nasopharyngeal carcinoma.
Nasopharyngeal neoplasm;Eukaryotic expression vector;β-catenin;Cellmodel
R739.6
A
1674-5671(2016)04-06
10.3969/j.issn.1674-5671.2016.04.01
福建省自然科学基金资助项目(2014J01299);福建省科技计划重点项目(2014Y0014);国家临床重点专科建设项目[国卫办医函(2013)554号]
苏颖。E-mail:zjsuying@hotmail.com

