脑尔康对实验性AD模型大鼠脑内兴奋性氨基酸含量的影响*
侯吉星 权乾坤 李 玺△ 西安市精神卫生中心(西安 710061)
脑尔康对实验性AD模型大鼠脑内兴奋性氨基酸含量的影响*
侯吉星权乾坤▲李玺△▲西安市精神卫生中心(西安 710061)
摘要目的:观察中药脑尔康对阿尔茨海默病(AD)模型大鼠胆碱乙酰转移酶(ChaT)、兴奋性氨基酸含量的影响及可能机制。方法:雄性SD大鼠随机分为对照组、模型组、多奈哌齐组、脑尔康组。采用大鼠双侧海马一次性注射Aβ1-42制作AD模型,对照组注射等剂量生理盐水。造模成功后第3天开始空白组和模型组给予生理盐水ig(0.5mL·d-1);多奈哌齐组及脑尔康组分别给予相应药物ig (14.3 mL· d-1),均每天一次。4周后,用Morris水迷宫法进行行为学测试,取材,免疫组化法观察ChaT表达,高效液相色谱分析法测定各组大鼠海马内兴奋性氨基酸含量。结果:①与模型组比较,多奈哌齐组及脑尔康组大鼠脑内ChaT表达明显增多(P<0.01);②与模型组比较,多奈哌齐组及脑尔康组兴奋性氨基酸水平有有明显的下降(P<0.01),且二者之间的结果无明显差异。结论:脑尔康可能通过对ChaT表达的保护作用以及下调AD模型大鼠海马内兴奋性氨基酸含量解除兴奋性氨基酸的毒性作用,达到防治AD的目的。
主题词脑尔康阿尔茨海默病动物,实验 大鼠
阿尔茨海默病(Alzheimer’s disease,AD)是一种常见的中枢神经系统退行性疾病,其发病机制仍未完全阐明。目前已经提出了胆碱能学说、谷氨酸能学说等假说。大量研究证明,兴奋性氨基酸类神经递质(excitatory amino acids,EAA)含量的改变与神经退行性病变、学习记忆的形成密切相关[1]。中药脑尔康已在临床应用多年,对老年痴呆患者有较好的改善作用。本次研究通过构建AD大鼠模型,应用脑尔康进行早期干预,通过观察行为学、胆碱能系统有关的酶学变化以及兴奋性氨基酸类神经递质等多方面探讨脑尔康抗痴呆的作用机制。
1材料
1.1动物健康雄性SD大鼠40只,体质量(260±10)g,西安交通大学医学院实验动物中心提供,合格证号SCXH(陕)2011-004。试验期间均以固体平衡饲料,自由饮水,在室温(22±2)℃、湿度(50±5)%的条件下饲养。
1.2主要药品与试剂中药脑尔康为院内制剂(陕卫药制剂注字920138),全方由人参、黄芪、川芎、丹参、益智仁、生地、菖蒲、冰片组成,由西安交通大学医学院第二附属医院中药房提供,按传统方法水煎,制成每毫升含生药1 g·mL-1。抗ChaT抗体(武汉博士德生物工程有限公司产品,批号121015);SABC免疫组化试剂盒(北京博奥森生物工程有限公司产品,批号120913);谷氨酸、天冬氨酸标准品(美国Sigma公司);色谱纯乙腈(德国MERCK公司);盐酸多奈哌齐片(卫材苏州制药有限公司,批号111013A)。
1.3主要仪器Morris水迷宫仪、数据自动采集机分析系统(中国医学科学院动物所);台式离心机(上海夏普电器有限公司产品,型号:WP850A);电动匀浆机(德国Heidolph公司,型号DIAX900);高效液相色谱分析仪(日本岛津公司,型号LC-10AD);脑立体定位仪(日本太阳株式会社,型号SN-3)。
2方法
2.1动物AD模型制备选择大鼠双侧海马区一次性注射Aβ1-42制备AD模型[2]。将Aβ1-42溶于灭菌生理盐水中,稀释为10μg·μL-1,密封后置于37 ℃培养箱中孵育7 d,使其成为具有毒性的凝聚态,4 ℃ 冰箱保存备用。大鼠经10%水合氯醛(3.5mL·kg-1)腹腔注射麻醉,固定于大鼠立体定位仪,参照大鼠脑立体定位图谱,用牙科钻钻开颅骨,微量注射器自硬脑膜垂直进针2.8 mm,每侧海马注射2μL Aβ1-42,缓慢注射5min,留针5 min,缓慢起针。空白组大鼠注射等体积生理盐水。术后局部局部消毒后缝合头皮,肌肉注射青霉素预防感染,连续3d。
2.2药物干预造模成功后,大鼠随机分为模型组、多奈哌齐组、脑尔康组。依据剂量估换计算公式,多奈哌齐组、脑尔康组每天分别给予相应药物ig(14.3g·kg-1·d-1);空白组和模型组每天给生理盐水ig(0.5 mL·d-1),共28 d。
2.3行为学测试采用Morris水迷宫法检测大鼠学习记忆成绩[3]。
2.4免疫组化检测ChaT表达水平完成行为学测试后,立即处死大鼠,取脑,4%多聚甲醛固定24 h,石蜡包埋,石蜡切片机切片,切片厚度4μm,每张切片含皮层、海马、齿状回,每只小鼠取5张切片,4张进行免疫组化染色,一张HE染色。免疫组织化学法(SABC法)分别检测各组大鼠海马区乙酰胆碱转移酶(ChaT)阳性表达情况。用Image pro plus图像分析软件测量ChaT的光密度(IOD)值。
2.5高效液相色谱分析法测定各组小鼠海马内兴奋性氨基酸含量大鼠脑组织样品的处理:脑组织称重,以1∶10 比例加入0.14 mol·L-1高氯酸,冰浴下充分匀浆,沉淀30 min,离心15 min,取上清液,加0.2mol·L-1KHCO3,混匀后于4℃离心5 min,取上清液,分装,于- 70℃保存待测。对照品溶液的制备:精密称取谷氨酸、天冬氨酸对照品10 mg,置于10mL容量瓶中,加0.5 mol·L-1碳酸氢钠(ph=9.0)溶液1mL,加1% 2,4二硝基氟苯乙腈溶液1mL,置60℃水浴中加热1 h。加乙腈稀释至10mL,作为对照品溶液。供试品溶液的制备:取海马组织,称重,加入生理盐水2mL匀浆,4000r离心10min,取上清液1mL,加入乙腈1mL沉淀,4000r离心10min,取上清液600uL置1.5 mLEP管中,加0.5mol·L-1碳酸氢钠(ph=9.0)溶液300uL,1%2,4二硝基氟苯乙腈溶液300uL,置60℃水浴中加热1h,作为供试品溶液。色谱条件:色谱柱:Kromasil C18柱。流动相:乙腈,醋酸盐缓冲液(6%醋酸钠水溶液:乙腈=70:30)。流速1mL·min-1,紫外检测,检测波长:360nm;柱温:30℃。采用梯度洗脱法,梯度洗脱条件:0min~乙腈:缓冲盐=0∶100;0-12min~乙腈:缓冲盐=12∶88;12-14min~乙腈:缓冲盐=20∶80;14-20min~乙腈:缓冲盐=40∶60;20-30min~乙腈:缓冲盐=60∶40;30-32min~乙腈:缓冲盐=70∶30;32-37min~乙腈:缓冲盐=0∶100;37-40min~乙腈:缓冲盐=0∶100,分别取对照品、供试品10uL进样、测定。
计算方法:外标法。
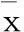
3结果
3.1脑尔康对AD模型大鼠ChaT表达的影响乙酰胆碱转移酶ChaT免疫组化染色结果显示:空白组大鼠皮层区、海马CA1、CA3及齿状回门区部位可见大量ChaT阳性神经元,免疫反应阳性产物较多,染色较深。①模型组在注射Aβ1-42后,海马CA1、CA3及齿状回门区ChaT免疫表达显著下降,染色变浅,与正常组比较有显著性差异(P<0.01)。②与模型组比较,多奈哌齐组和脑尔康组海马CA1、CA3及齿状回门区ChaT免疫阳表达较模型组升高(P<0.01),且二者之间无明显差异(P >0.05)。
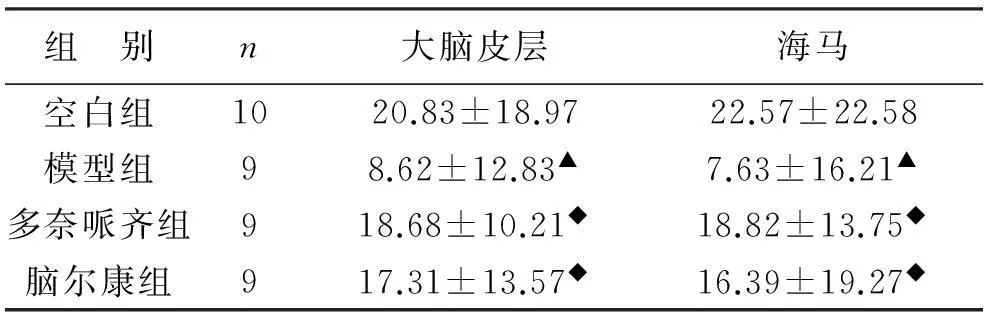
表1 脑尔康及对AD模型大鼠大脑皮层及海马内ChaT免疫阳性表达的变化(IOD)
注:与空白组比较▲P<0.01;与模型组比较◆P<0.01
3.2脑尔康及对AD模型大鼠海马内兴奋性氨基酸含量的影响谷氨酸(glutamate,Glu)与天冬氨酸(aspartate,Asp)是脑组织内含量较高的两种氨基酸,参与中枢神经系统的信息专递,为中枢神经系统中重要的兴奋性神经递质。谷氨酸主要分布在大脑皮层、小脑、海马及纹状体;天冬氨酸则主要分布小脑、丘脑。用高效液相色谱法测定各组大鼠海马内Glu和Asp,结果显示:①模型组Glu和Asp含量高于空白族,有显著性差异(P<0.01);②与模型组比较,多奈哌齐组、脑尔康组Glu含量明显减少(P<0.01);且二组Glu含量无明显差异(P>0.05)。

表2 脑尔康对AD模型大鼠海马内兴奋性氨基酸含量的影响
注:与空白组比较▲P<0.01;与模型组比较◆P<0.01
4讨论胆碱能系统受损在AD发病机制中占用重要地位,各种原因引起的基底前脑胆碱能神经元损伤以及与此相关的皮层及海马等脑区的胆碱能神经传递受损,在AD患者记忆及认知功能损伤过程中起重要作用。对大多数AD患者的脑研究显示,在许多皮层区域ChaT活性与这些皮层区域老年斑的密度呈现不恒定的显著负相关关系,本研究造模后,经水迷宫实验确定的AD大鼠,发现海马内神经元排列紊乱、不规则,部分神经元脱失;免疫组化染色显示大脑皮层和海马部位ChaT免疫阳性表达显著降低。此病理改变符合对AD患者脑的病理检查所见,较好地模拟了AD患者的特征性病变,是本实验进行AD病因病机以及治疗AD有效手段探索的重要依据。
在AD的发病机制中,谷氨酸能假说越来越受到重视。相关研究证实[4]Glu及其受体参与神经元信息传递,与学习记忆功能的形成密切相关,其作为神经枢及大脑皮质的补剂,主要存在于神经末梢谷氨酸囊泡内,对于兴奋传递及神经细胞的保护都具有特殊的重要意义。我们的研究结果显示,AD大鼠海马组织的Glu和Asp含量显著高于空白组,提示模型组大鼠脑内兴奋性氨基酸代谢紊乱。与模型组比较,脑尔康组、多奈哌齐组Glu含量均显著低于模型组,可见脑尔康可降低AD大鼠海马内兴奋性氨基酸含量,使AD大鼠海马内兴奋性氨基酸含量趋近于正常空白组。提示 AD 模型大鼠海马区 Glu 大量释放并堆积于突触间隙,使谷氨酸受体过度兴奋激活,从而引起一系列以神经细胞或其他组织细胞死亡为终结的病理生理变化,可能是Aβ1-42所致海马神经元损伤造成学习记忆障碍的机制之一,脑尔康能够在一定程度上降低Glu水平从而起到抗痴呆作用。
参考文献
[1]CoyleJ,Puttfarcken P.Oxidative stress,glutamate and neurodegenerative disorders.Science 1993,262:689-694.
[2]E.Hare,D.T.Weldon,P.W.Mantyh,et al.Dalayed behavioral effects following intrahippocampal injection of aggregated a beta(1-42).Brain Research,1999,815(1):1-10.
[3]叶翠飞,张丽,艾厚喜,等.2种水迷宫实验对拟痴呆模型动物学习记忆功能测试的比较[J].中国行为医学科学,2004,13(3):252.
[4]吕高萍. 阿尔茨海默病中西医早期诊断的研究进展[J].中华中医药杂志,2012,08:2142.
(收稿2015-03-11;修回2015-04-19)
【中图分类号】R749.16
【文献标识码】A
doi:10.3969/j.issn.1000-7369.2016.01.064
*陕西省科技攻关计划项目[2007K16-07(5)]
▲西安交通大学医学院第二附属医院(西安710004)
△通讯作者

