代谢综合征大鼠模型的建立与评价*
杨红莲 段玉红 淡 云 陕西中医药大学附属医院(咸阳 712000)
代谢综合征大鼠模型的建立与评价*
杨红莲段玉红淡云△陕西中医药大学附属医院(咸阳 712000)
摘要目的:高盐高脂饲料配合自由饮用果糖水建立代谢综合征大鼠模型。方法:SD大鼠喂饲高盐高脂饲料及自由饮用30%的的果糖水,连续8周。观察大鼠体重等一般状况;检测空腹血糖(FPG)、血脂,称量内脏脂肪重量并计算肥胖指数(Lee,s指数),检测空腹胰岛素(FINS)并计算胰岛素敏感性(ISI)和胰岛素抵抗指数(IRI)。结果:模型组大鼠体重明显增加。Lee,s指数、内脏脂肪重量、内脏脂肪重量/体重明显升高,血清FBG、TG、LDL、FINS含量升高,IRI升高,ISI降低。结论:高盐高脂饲料及饮用高糖饮料8周,可成功建立模型。
主题词代谢综合征疾病模型,动物大鼠
代谢综合征(Metabolic syndrome,MS)是以糖代谢异常、高血压、血脂异常、中心性肥胖等多种疾病或危险因素在个体聚集为特征的一组临床症候群[1]。本实验模拟中医临床肥甘厚味病因,探索给大鼠高脂高盐饲料及饮用高果糖水,建立与人类MS发生发展过程相似的MS动物模型,为探讨MS发病机制及寻找有效治疗MS的药物提供可靠地动物模型。
1材料与方法1.1动物与分组SD雄性大鼠,体重200±10g购自由第四军医大学实验动物中心,动物合格证号SCXK军2013-009号。适应性喂养1周后动物按体重随机分为对照组和模型组,每组15只。
1.2实验仪器贝克曼CX4型全自动生化分析仪,电子天平,沈阳龙腾电子有限公司生产。TDL-5 型高速台式离心机,上海安亭科学仪器厂生产。HP-8453紫外分光光度计(美国惠普公司)。
1.3药品与试剂GLU检测试剂盒(批号512051),TG检测试剂盒(批号506051),TC检测试剂盒(批号0707031),均为北京利德曼生化技术有限公司产品。125I-胰岛素放射免疫分析试剂盒为天津九鼎生物技术有限公司产品(批号20130420);试剂均为分析纯。乌拉坦,国药集团化学试剂有限公司出品,批号2009051203。
1.4MS模型的建立对照组动物给予标准齿类饲料,饮用自来水。模型组动物给予高盐高脂饲料(饲料组成:普通饲料63%,猪油20%,蛋黄5%,食用盐10%,胆固醇2%),饮用30%的果糖水。大鼠按上述方法持续喂养8周。
1.5检测项目与方法1.5.1一般状况记录:记录两组动物的精神状态、体重、摄食量、大小便和毛发光亮度等情况。
1.5.2体重、血糖和血压测量:分别于造模0、2、4、6、8周测量两组大鼠体重、空腹血糖(fast plasma glucose,FPG,应用微量血糖仪测量),并测量尾动脉收缩压。
1.5.3血脂、肥胖及胰岛素敏感性相关指标检测:第8周造模结束后,测量大鼠体长(从大鼠鼻尖到肛门的长度,cm),计算肥胖指数(Lee’s指数=[/体长(cm)]×103)[2]。动物禁食禁水12h,次日清晨以20%的乌拉坦腹腔注射麻醉,剂量为 0.5mL/100g 体重。腹腔静脉取血10mL,3000r/min离心15min,取血清检测血脂,胰岛素(Fasting insulin,FINS),根据FINS分别计算胰岛素抵抗指数(IRI)(IRI=(FBG×FINS)/22.50);胰岛素敏感指数(ISI)(ISI=In〔1/(FINS×FBG)〕)。并测量内脏脂肪重量(内脏脂肪重量=腹腔脂肪重量+肾囊周围脂肪重量+睾丸周围脂肪重量),计算内脏脂肪重量与体重的比值。
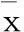
2结果2.1两组大鼠一般状况模型组大鼠在造模初可出现食欲减退,大便不成形,后期可逐渐消失;造模后期动物的毛色缺乏光泽,活动量偏少,出现不同程度精神萎靡。对照组大鼠毛色光滑,精神状态、活动量及二便均正常。
2.2两组大鼠肥胖相关指标比较造模期间,两组动物体重均持续增长。在造模第8周时,与对照组比较,模型组大鼠体重明显增加(P<0.05)。模型组大鼠Lee’s、内脏脂肪重量、内脏脂肪重量/体重与对照组比较均明显升高(P<0.05)。见表1。
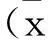
表1 两组大鼠体重、Lee’s指数、内脏脂肪重量、内脏脂肪重量/体重比较±s)
注:与对照组比较,△P<0.05
2.3两组大鼠空腹血糖、血脂情况比较模型组大鼠FPG水平明显高于对照组(P<0.05)。模型组大鼠血清TG、LDL水平均明显高于对照组(P<0.05)。见表2。
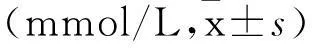
表2 两组大鼠FPG、TG、TC、HDL、LDL比较
注:与对照组比较,△P<0.05
2.4两组大鼠喂养不同时间尾动脉血压比较造模第6周、8周模型组大鼠尾动脉收缩压明显高于对照组(P<0.05),见表3。
2.5两组大鼠胰岛素敏感性相关指标比较模型组大鼠FINS水平、IRI与对照组比较均明显升高(P<0.05),ISI明显降低(P<0.05)。见表4。
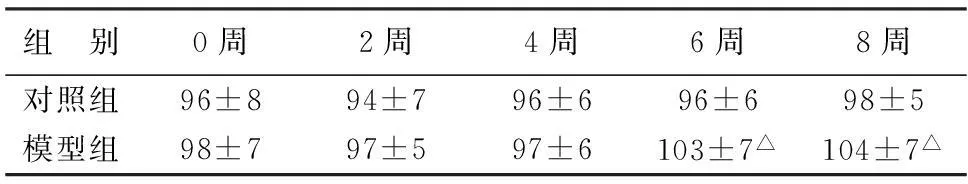
表3 两组大鼠造模0、2、4、6、8周尾动脉血压比较
注:与对照组比较,△P<0.05
表4 两组大鼠胰岛素敏感性各项指标比较±s)
注:与对照组比较,△P<0.05
3讨论MS模型造模方法有遗传、转基因和基因敲除、外科干预或药物诱导等,用这些方法建立的MS模型只具备了MS的部分特征。由于高热量高脂肪摄入是MS的重要发病因素,这些发病因素与中医临床MS患者饮食不节,过食肥甘厚味类似。而且,MS患者多表现为痰湿壅盛,湿浊为患。因而MS的模型建立应更多考虑饮食成份的影响。饮食诱导成为目前比较公认的符合人类MS发病特点的造模方法。本实验考虑到单纯选用高糖或高脂饮食虽也能诱导出现糖尿病、高血脂等MS组分,但因为耗时较长及模型不够典型等弊端,我们选用高脂(猪油20%,蛋黄5%,胆固醇2%)、高盐(10%)和高糖(30%果糖水)多因素复合建立MS大鼠模型。由于高果糖饮食可导致大鼠血脂异常、血糖增高、腹型肥胖及血压升高,出现较为典型的MS[3],且建立MS模型相对耗时较短[4]。此外,与蔗糖或葡萄糖相比,果糖可能更容易导致肥胖。因此,本研究选用果糖作为诱发MS的高糖因素。研究结果表明,随着喂养时间的延长,MS组大鼠出现了血压升高、血糖升高,血清TG、LDL含量均显著升高。体重明显高于对照组,内脏脂肪重量、Lee,s指数等显著增加。可见,本课题组采用的方法能成功诱导大鼠MS模型形成,而且在病因机上与中医临床类似。该模型为MS治疗药物的探讨奠定模型基础,特别是给MS的中医药防治提供参考。
有关高盐高糖高脂复合饮食诱导MS模型的机制尚不清楚。目前普遍认为 MS的发病机制主要是在肥胖的基础上产生胰岛素抵抗,结合脂肪因子等相互作用进一步发展而成。IR是指胰岛素的靶器官(包括脂肪细胞、肌肉细胞和肝细胞)对正常浓度的胰岛素产生反应不足的现象。亦即这些细胞需要更高的胰岛素浓度才能对胰岛素产生反应。IRI和ISI可一定程度反应IR。我们的实验结果也证实了IR的出现。造模8周后,与对照组比较,模型组大鼠FINS水平、IRI均明显升高,ISI明显降低。分析IR发生的病理机制,推测与以下因素有关:高糖既影响胰岛素与受体的结合,又影响胰岛素刺激的葡萄糖转运。高脂饮食可以改变脂肪酸的组分,从而能够独立影响胰岛素的活动,改变胰岛素的敏感性。高盐摄入易导致高血压,而高血压又可通过多种途径间接导致IR的发生。总而言之,由于MS发生机制复杂,各组分之间互相影响,相互为因,如何综合解释高盐高糖高脂饮食与MS发病之间的联系,还需要进一步探讨。
参考文献
[1]吴林根,王燕,朱峥,等.黄连素干预对代谢综合征及心脑血管疾病影响[J].心脏杂志,2015,27(3):348-352.
[2]Baret G,Peyronnet J,Grassi KD,et al.Increased intraabdominal adipose tissue mass in fructose fed rats:correction by metformin[J].Exp Clin Endocrinol Diabetes,2002,110:298.
[3]Bray G A,Nelsen S J,Popki B M.Consumption of high-fructose corn syrup in beverages may play a role in the epidemic of obesity [J] .Am J Clin Nutr,2004,79(4):537-543.
[4]罗雅君,李珂,赵琳.果糖的利用现状及其与现代流行病的关系研究进展[J].农产品加工,2013,(10):60-62.
(收稿2015-06-11;修回2015-07-12)
Establishment and evaluation of rats model of metabolic syndrome
The Affiliated Hospital of Shaanxi TCM University(Xianyang 712000)
Yang HonglianDuan YuhongDan Yun
ABSTRACTObjective:To establish rats model of metabolic syndrome with high salt and high fat feed and fructose water.Methods :SD rats were fed with high salt and high fat feed and drinking 30% fructose water for 8 wk consecutively.To observe the general conditions and body weight of rats; detect fasting blood glucose (FPG),blood fat;weigh visceral fat weight and calculate obesity index (Lee’s index),fasting insulin (FINS) and calculate insulin sensitivity (ISI) and insulin resistance index (IRI).Results:The weight of rats in the model group increased obviously.Lee’s index,visceral fat weight,visceral fat weight/body weight increased significantly,serum FBG,TG,LDL,FINS content increased,IRI increased,ISI decreased.Conclusion :The high salt and high fat diet and drinking high sugar beverages for 8 wk can establish rats model of metabolic syndrome successfully.
KEY WORDSMetabolic syndromeDisease models,animalRats
【中图分类号】R589
【文献标识码】A
doi:10.3969/j.issn.1000-7369.2016.01.063
*陕西省教育厅课题(12JK1030)
△陕西省咸阳市中心医院(咸阳712000)

