伏马菌素的毒性及其作用机理
张 荷,胡琼波,刘承兰
(华南农业大学 农学院 农药学系昆虫毒理研究室,广东 广州 510642)
伏马菌素的毒性及其作用机理
张荷,胡琼波,刘承兰
(华南农业大学 农学院 农药学系昆虫毒理研究室,广东 广州 510642)
[摘要]伏马菌素是主要由串珠镰刀菌和再育镰刀菌代谢产生的一类真菌毒素,其对农作物的污染在世界范围内普遍存在,尤其是玉米及玉米制品。在目前发现的多种伏马菌素中,伏马菌素B1是主要组分,且其毒性最大。本研究介绍了伏马菌素的化学结构、产毒菌株及在动物体内的代谢情况,着重概述了伏马菌素的毒性及其作用机理,并对今后如何减轻伏马菌素对人和动物的危害进行了探讨和展望。
[关键词]伏马菌素;毒性;作用机理
伏马菌素(Fumonisin,FB)主要是由串珠镰刀菌(Fusariumvertieilliodes)和再育镰刀菌(Fusariumproliferatum)代谢产生的一类水溶性代谢物[1-2]。1988年,Gelderblom等首次从串珠镰刀菌培养液中分离出伏马菌素[3],Laurent等[4]又从伏马菌素中分离出伏马菌素B1(Fumonisin B1,FB1)和伏马菌素B2(Fumonisin B2,FB2)。研究发现,伏马菌素是一类由不同的多氢醇和丙三羧酸组成的结构类似的双酯化合物,包括一个由20个碳组成的脂肪链及通过2个酯键连接的亲水性侧链[5]。目前已经证实,FB1是伏马菌素的主要成分,占伏马菌素总量的70%,同时也是导致伏马菌素毒性作用的主要组分[6]。伏马菌素在世界范围内广泛分布,能够污染多种粮食作物,尤其是玉米及玉米制品。此外,在其他一些作物或农产品中也检测到伏马菌素的污染。郭耀东等[7]在大米及其制品、面粉及其制品、其他谷物及其制品、干豆类、坚果等5类食品中检测到伏马菌素的污染,所抽样本中坚果样品中伏马菌素的平均含量最高,干豆类样品中含量最低。同时,伏马菌素还能引起家畜急性中毒,并具有潜在的致癌性。因此,它在食品与饲料安全中的意义越来越受到人们的重视。本研究介绍了伏马菌素的生物学特性,着重概述了伏马菌素的毒性及其相关的作用机理。
1伏马菌素的生物学特性
1.1化学性质
在自然界中,污染玉米及玉米制品的伏马菌素主要是FB1、FB2和FB3,其结构见图1[8]。
伏马菌素纯品为白色针状结晶,易溶于水,对热稳定,100 ℃蒸煮30 min也不能破坏其结构。伏马菌素酸解后会失去丙三羧酸酯基,但其水解产物仍然有毒[3]。
1.2产毒菌株
镰刀菌中的串珠镰刀菌和再育镰刀菌是伏马菌素的主要产毒菌株,同时也是侵染玉米等农作物的主要菌种。此外,花腐镰刀菌(Fusariumanthophilum)、芜菁状镰刀属(Fusariumnapiforme)、花腐状镰刀菌(F.anthophilum)、尖孢镰刀菌(F.oxysporum)以及交链胞属(Alternariaalternatafsplycopersici)等也能够产生伏马菌素,但这些产毒菌对粮食及其制品的污染程度较前两者都小[3]。

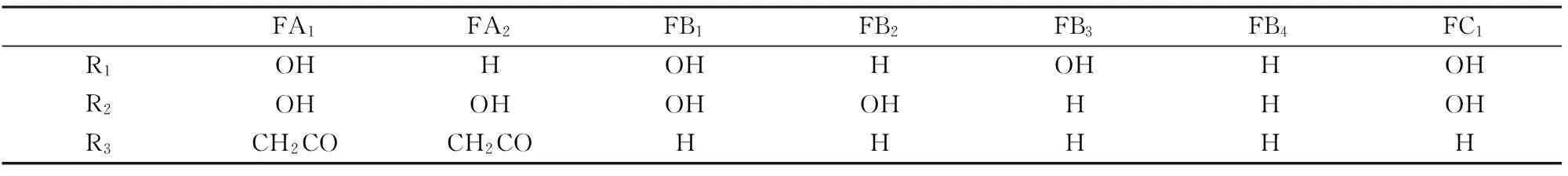
FA1FA2FB1FB2FB3FB4FC1R1OHHOHHOHHOHR2OHOHOHOHHHOHR3CH2COCH2COHHHHH
图 1伏马菌素的结构式[8]
Fig.1Structure of Fumonisins[8]
1.3伏马菌素在动物体内的代谢
伏马菌素在动物体内的吸收率很低,从而使其生物利用率较低。Shephard等[9]给大鼠腹腔注射含量为7.5 mg/kg的用14C标记的FB1水溶液,24 h后发现粪便内的标记物为66%,尿中为32%,肝中为1%,在肾脏和血红细胞内含量很少(<1%);用管饲法饲喂14C标记的FB1,发现标记物几乎全部出现在粪便内,在尿、肝、肾和血红细胞内含量很少,而且绝大多数标记物是未经代谢的FB1原体。Shephard等[10]研究发现,给长尾猴静脉注射FB1后,其粪便和肠内容物主要为FB1和局部水解型FB1(PHFB1)以及微量的氨基戊醇(AP1) 。Fodor等[11]经体内试验发现,猪对FB1的累计吸收率为4%,在食糜中发现1%的FB1转化为AP1,3.9%转化为PHFB1;粪便中的PHFB1占47%,AP1占12%;而且发现小肠也能代谢FB1。
2伏马菌素的毒性作用
2.1神经毒性
2.1.1对动物的神经毒性研究表明,伏马菌素能够引起马脑白质软化症,症状表现为紧张不安,如漫无目的性、麻痹性痴呆、运动失调、失明和淡漠等,同时能引起肝脏的一些变化[12]。据报道,在美国,因污染的玉米中伏马菌素含量相对较高,由此引起的马脑白质软化症案例也不断增加,提出伏马菌素可能与马的神经管缺陷有关[5]。用伏马菌素处理妊娠早期的大鼠能够增加后代神经管缺陷的发生率[13]。Kwon等[14]通过每天给刚出生3 d的大鼠皮下注射0.4 mg/kg或者0.8 mg/kg剂量的FB1,生长到第12天时发现大鼠体质量和脑部质量显著减少。进一步研究发现,给刚出生3 d的大鼠皮下注射8 mg/kg的FB1,生长到第12天发现FB1能够越过脑血屏障,但是在大脑中FB1的水平很低;注射更低剂量FB1(0.8 mg/kg)时,在大脑中没有发现FB1,推测可能是由于伏马菌素的脂溶性差且相对分子质量大[15]。Kovacic等[16]研究表明,对出生12个月的鲤鱼每天喂食含100 mg/kg或10 mg/kg FB1的饲料,能够减缓鲤鱼体质量的增加,并引起鱼的组织发病,如脑水肿、变质细胞的增加,炎症细胞的积累。Gbore等[17]分别用含0.2,5.0,10.0 和15.0 mg/kg FB1的饲料喂食刚断奶的仔猪6个月,发现当喂食含5.0 mg/kg或更高含量的FB1后,能够显著改变乙酰胆碱酯酶在仔猪脑的部分区域和垂体活性,说明当饲料中含有5.0 mg/kg或更高含量FB1可能会引起仔猪脑不良的生理反应,影响仔猪的发育。
2.1.2对神经细胞培养物的毒性大量的细胞活性试验表明,FB1对细胞低毒,且毒性与处理时间、浓度、神经细胞类型和动物种类有关。用100 μmol/L的FB1处理人类神经母细胞瘤细胞SH-SY5Y,48 h后观察到FB1能降低细胞的生存能力[18],但用200 μmol/L的FB1处理24 h,并没有发现其对细胞有毒性[19]。用50 μmol/L的FB1处理大鼠的星形胶质细胞时,8 d后观察到细胞死亡[20];而用相同浓度的FB1处理相同的细胞6 d,与对照组相比,发现细胞的生存能力没有发生明显变化[21]。不同的神经细胞对FB1的敏感性(毒性从高到低)表现为:人类U-118MG成胶质母细胞瘤细胞>大鼠GT1-7下丘脑细胞>大鼠C6成胶质母细胞瘤细胞>人类SH-SY5Y神经母细胞瘤细胞[22]。通过比较人类SH-SY5Y神经母细胞瘤细胞和人类U-118MG成胶质母细胞瘤细胞,认为神经胶质细胞对FB1的敏感性比神经元细胞高。
另有研究表明,伏马菌素与黄曲霉毒素有联合毒性。同时,Domijan等[23]研究FB1对谷氨酸盐神经元细胞的毒性影响时发现,FB1能使神经元细胞更容易受谷氨酸盐诱发的毒性危害。说明FB1和谷氨酸盐也可能存在联合毒性。
2.2动物内部器官的毒性及致癌性
目前,有关伏马菌素的毒性研究主要集中于FB1对肝、肾、肺和肠的毒性作用。大鼠的毒性试验(0,15,50和150 mg/kg FB1,喂养4周)表明,肝脏和肾脏是伏马菌素作用于大鼠的靶器官,肾脏对FB1敏感性要比肝脏高,在较低含量(雄性≥15 mg/kg,雌性≥50 mg/kg)就会造成大鼠的肾脏损伤,包括细胞增生、变性和细胞程序性死亡,而在FB1含量为150 mg/kg时,才会对肝脏产生毒性,病变主要是引起细胞增生、变性、坏死、胆管增生、纤维化、肝硬化[24]。成年猪摄入含有伏马菌素的饲料后,能够引起猪的肺水肿,并伴有胰脏细胞坏死和肝脏细胞的空泡化[25]。肠是防御毒素的第一屏障,仔猪口服试验(0.5 mg/kg,7 d)发现,FB1能够影响仔猪肠上皮细胞因子的产生[26]。Grenier等[2]研究水解后FB1(HFB1)对仔猪肠和肝脏的毒性发现,HFB1没有引起肝毒性,不会损害肠的形态,略微影响肠的免疫反应,这暗示FB1形式的改变可能减少FB1的危害。
另有研究表明,在高剂量或长期饲喂条件下,FB1可诱发啮齿类动物癌症。Gelderblom等[27]研究了FB1对雄性大鼠BDIX的慢性毒性,结果表明,给大鼠喂食含50 mg/kg FB1(纯度>90%)的饲料,26个月后诱发了大鼠肝癌;给Fischer 344/N/Netr大鼠长期(2年)喂食含FB1(50 mg/kg以上)的饲料, 可造成肾脏的损伤, 甚至诱发肾癌[28]。此外,研究发现,长期接触伏马菌素可能会诱发人类食道癌[29]。邱茂锋等[30]对食管癌高发区鹤壁市郊部分居民的伏马菌素摄入水平及尿二氢神经鞘氨醇/神经鞘氨醇(Sa/So)比值进行了调查,结果发现食管癌高发区男性的尿Sa/So比值高于低发区, 女性的尿Sa/So比值在高、低发区差异不大,说明男性对伏马菌素的敏感性高于女性,这种性别差异与食管癌的发病规律相吻合。结果表明,伏马菌素可能是诱发食管癌发生的危险因素之一。
2.3动物免疫毒性
伏马菌素能损害动物的免疫系统,造成免疫抑制,降低动物的自身免疫功能,使动物经疫苗免疫后产生抗体的水平不高或不齐。Qureshi等[31]研究了伏马菌素对仔鸡腹膜巨噬细胞的影响,结果发现,FB1(10~100 μg/kg,处理4 h)能够引起仔鸡巨噬细胞的形态变化,产生萎缩,同时还显著降低了细胞活性,产生功能性损伤,降低细胞的免疫应答作用,从而引起传染易感性的显著增加。Li等[28]给肉鸡饲喂含FB1的日粮,在第2周和第3周分别注射 0.5 mL的新城疫苗,注射7 d后发现,FB1能够对鸡新城疫疫苗抗体的产生造成抑制,显著降低鸡新城疫疫苗的抗体滴度。
伏马菌素也可能危害到人的免疫系统。Stockmann-Juvala等[32]用100 μmol/L处理人类树突细胞,发现FB1能够引起干扰素因子和趋化因子表达量的增加,而对树突细胞中其他因子的表达情况没有影响,这表明伏马菌素可能对人类有潜在的免疫毒性。Devriendt等[33]使用与人胃肠道类似的仔猪作为试验模型,研究口服FB1对人肠免疫系统的影响,结果发现,FB1能够使肠抗原呈递细胞的功能受损,减少主要组织相容性复合体Ⅱ分子的上调,降低T淋巴细胞的刺激功能。
2.4生殖毒性
伏马菌素对动物也存在生殖毒性。Francis等[34]用含10.0,20.0 mg/kg FB1和不含FB1饲料喂食大鼠14 d,发现大鼠的生育能力、妊娠期和胎儿体质量与对照相比显著降低,但并未引起大鼠卵巢组织病理学变化。Ewuola等[35]用含0.13,5.0,7.5 和10.0 mg/kg FB1的饲料饲养雄兔,探讨伏马菌素对雄兔生殖能力的影响,结果发现,雄兔精液中精子的能动性和生存能力随着FB1含量的增加而显著衰退,异常精细胞的数量随着FB1含量的增加而增加,在FB1达到7.5和10.0 mg/kg时,睾丸受到严重损害,表明在7.5 mg/kg FB1水平下饲养雄兔,可能降低雄兔的生殖能力。
2.5植物毒性
伏马菌素还具有一定的植物毒性,可干扰植物的正常生理代谢功能,引起植物细胞程序性死亡。Doehlert等[36]研究发现,伏马菌素并不影响玉米种子的发芽率,但可以抑制萌发种子中淀粉酶的生成,从而抑制玉米苗幼根的生长。Desjardins等[37]通过体外试验发现,伏马菌素能够引起玉米枯萎,在枯萎过程中,它可能作为一种毒害因子起作用。Abbas等[38]用伏马菌素溶液喷撒黑茄(SolanumnigrumL.)和番茄易感品种曼佗罗(DaturastramoniumL.)的叶表面,可导致作物的叶片形成枯斑,生长受到抑制甚至死亡。Kritzinger等[39]研究伏马菌素对牛豆的毒性时发现,FB1可显著抑制牛豆种子的萌发及根茎的生长,且可导致胚芽组织中细胞的质壁分离。借助TUNEL染色和DNA片段化分析,发现伏马菌素能够引起玉米、烟草、拟南芥、西红柿以及浮萍等多种植物的细胞程序性死亡[40]。
3伏马菌素毒性的作用机理
目前,对于伏马菌素毒性的作用机理尚未完全阐明,现就有关伏马菌素毒性作用机理的研究进展作一综述。
3.1伏马菌素对鞘脂类新陈代谢的损害
FB1是一种具有神经毒性的真菌毒素,在结构上与神经鞘氨醇(Sphingosine,SO)和二氢神经鞘氨醇(Shpinganine,SA)很相似,而鞘脂类是组成细胞膜和脂蛋白结构的重要组分,作为第二信使调控细胞的生长和分化[8]。Wang等[41]认为,FB1通过竞争方式抑制神经鞘氨醇N-2酰基转移酶损害鞘脂类的新陈代谢,导致神经鞘氨醇生物合成被抑制,造成复合鞘脂减少和游离二氢神经鞘氨醇的积累,阻碍了复合鞘脂的信号传递途径,从而改变细胞膜的活性。Wang等[42]在探索FB1影响人体肝细胞系HL-7702细胞周期的分子机制时发现,在不同浓度和不同处理时间下,FB1能显著增加cyclinE的表达,显著降低P21的表达。鞘脂类还可以通过它的接收器使细胞摄入叶酸,而叶酸免疫功能缺陷是神经管畸形的一个危险因子。Stevens等[43]对Caco-2细胞研究后认为, FB1通过抑制鞘脂类的合成使叶酸接收器功能紊乱,从而导致神经管发生病变。Myburg等[44]通过研究人类SNO食管癌细胞证实,FB1是通过细胞程序性死亡和坏死来诱导细胞死亡,且与FB1浓度有关系,在低浓度(4,8 μmol/L处理24 h)时,细胞膜会有囊泡形成,出现更小的与膜结合的凋亡小体,没有出现溶胀现象;在高浓度(16 μmol/L处理24 h)时,细胞会出现溶胀现象,溶胀是细胞坏死的指示器,因此认为细胞程序性死亡是低浓度FB1引起细胞死亡的机制,而坏死是高浓度引起细胞死亡的机制。研究表明,FB1引起小鼠的肝毒性反应涉及到鞘氨醇自由基的积累,但它并不能作为组织病理学判断FB1对小鼠肝毒性敏感的标准[45];随后,Sharma等[46]报道,FB1能诱导小鼠肝炎症性细胞因子肿瘤坏死因子TNFα的表达,小鼠体内缺少TNFα的接收器TNFR1或TNFR2时,FB1引起的肝毒性反应降低,小鼠体内缺少TNFα时,反而加重了小鼠的肝毒性反应[47]。在此基础上,Sharma等[47]研究了其他不同凋亡信号因子的调节,结果发现缺少TNFα的小鼠(TKO)中CD95-ligand(FasL)、TRAIL和下游信号分子FADD、TRADD和caspase8的表达量显著高于WT型小鼠,此研究解释了TKO型小鼠对于引起肝毒素外源物质的敏感性。方策[40]研究发现,FB1能诱导拟南芥细胞线粒体活性氧自由基的产生,线粒体膜电势的下降以及细胞内ATP浓度的显著升高,但并不会引起细胞内钙离子和一氧化氮浓度水平发生显著变化,表明来源于线粒体的H2O2是一种十分重要的、能调控FB1致死作用的信号分子。综上所述,伏马菌素可以引起鞘脂类代谢紊乱,影响细胞分化,导致细胞凋亡或死亡,但是伏马菌素引起细胞凋亡或死亡的机制还需要进一步深入研究。
3.2伏马菌素对氧化应激的影响
氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)产生过多,氧化程度超出氧化物的清除能力,氧化系统和抗氧化系统失衡,从而导致组织损伤。脂质过氧化过程中发生ROS氧化生物膜,即ROS与生物膜的磷脂、酶和膜受体相关的多不饱和脂肪酸的侧链及核酸等大分子物质发生脂质过氧化反应形成脂质过氧化产物(Lipid PerOxide,LPO),从而使细胞膜的流动性和通透性发生改变,最终导致细胞结构和功能的改变。Yin等[48]用1~10 mmol/L的FB1处理蛋黄卵磷脂双分子层,发现FB1提高了氧化作用,促进了自由基中间体的形成,加快了与脂质过氧化反应相联系的连锁反应,推测FB1加强了氧在细胞膜间的运输,增加了膜的通透性,从而诱导氧化应激和细胞损伤。Abel和Gelderblom[49]通过大鼠的肝脏试验,确认脂质过氧化反应是FB1毒性作用的一个机制,但不是唯一的作用机制。Domijan等[19]研究发现,FB1能增加大鼠的星形胶质细胞和人类SH-SY5Y神经母细胞瘤细胞中活性氧物质的生成,但是无剂量依赖性;在用FB1处理星形胶质细胞时,发现FB1没有改变脂质过氧化作用的水平,但谷胱甘肽的水平有剂量依赖性,认为氧化应激与FB1引起细胞毒性无相关性;试验数据也表明,细胞回应活性氧增加是通过增加谷胱甘肽综合体来保护自己,包括脂质过氧化作用。不同研究结果表明,脂质过氧化反应是FB1毒性作用的一种结果,而不是作用机制[21,49-50]。Xing等[51]研究发现,FB1能诱导活性氧产物产生,活性氧产物在FB1诱导细胞死亡过程中扮演双重角色,一方面能够促进叶绿体功能紊乱,另一方面能够促进水杨酸的积累,这为研究诱导子引发依赖于光的细胞死亡机制提供了新的视角。
3.3抑制线粒体中复合物I的合成
Domijan等[19]研究FB1对大鼠主要星形胶质细胞和人类神经母细胞瘤的毒性试验发现,FB1的细胞毒性有浓度和剂量依赖性,将细胞暴露在伏马菌素(200 μmol/L,处理24 h)环境下,发现FB1能够抑制线粒体呼吸链中复合物I的合成,从而导致线粒体比率的减小,影响细胞的呼吸作用、细胞膜的去极化、活性氧产物的感应和钙传递信号的反常;另外,线粒体中活性氧产物增加,但细胞内的还原性谷胱甘肽含量与预期的相反,其含量显著增加,推测可能是活性氧产物的增加刺激了线粒体的一些路径,从而引起谷胱甘肽含量的增加;表明线粒体功能障碍是FB1引起细胞毒性的作用机制。
3.4非遗传毒性
伏马菌素对神经酰胺合酶的抑制作用与其致癌性和毒性有关,基于作用机理和缺乏基因毒性的证据,伏马菌素被认为是没有遗传毒性的致癌物质。Bondy等[52]给杂合和纯合的小鼠饲喂含0,5,50和150 mg/kg FB1的食物26周(所用的杂合小鼠是对有遗传毒性的物质很敏感的品种),结果表明2种品种的小鼠在体质量、食物消耗量和血液参数等方面的变化相差甚微,支持了伏马菌素非遗传毒性的机制。
4结论
伏马菌素是污染粮食作物及其制品的一种主要真菌毒素,同时也是一种2B类致癌物(可能致癌物)[53],对动物和人类的健康有很大的潜在危害。伏马菌素可引起马的脑白质软化症、猪的肺水肿、啮齿类动物肾毒性和肝毒性,人类的原发性肝癌和食管癌等。但到目前为止,有关伏马菌素毒性作用机理尚不是很清楚。鉴于伏马菌素对人和家畜的危害,美国于2001年制定了伏马菌素在动物饲料和食品中的限量标准,规定在动物饲料中的最大残留限量(MRL)值为1~50 mg/kg,在食品中为2 mg/kg[8]。同时,联合国粮农组织和世界卫生组织食品添加剂联合专家委员会也制定了相关的标准,确定伏马菌素的每日最大耐受摄入量为2 μg/kg。美国食品药物管理局(FDA)规定玉米中伏马菌素的最高限量为1 mg/kg。欧盟对玉米(未加工)、玉米面(粉)和直接食用的玉米制品制定的限量标准分别为2,1和0.4 mg/kg[7]。当前,主要使用物理或者化学的方法来降低食品或饲料中伏马菌素含量,但这些措施会影响食品或饲料的质量。为此,欧盟提出不能使用化学方法来消除真菌毒素污染[49]。基于当前研究现状,本研究提出几点建议:(1)基于Lanubile等[54]发现,在玉米种粒和籽苗中,不同基因型在抵抗轮状镰刀霉菌时基因表达情况存在差异,因此可以通过改变种粒和籽苗的基因型,筛选出抗真菌感染的品种,进而减少伏马菌素对玉米的污染。(2)利用微生物基因工程,将水解酶基因导入到酵母或其他微生物中,产生大量的水解酶,应用于饲料中或受污染的玉米及其他粮食产物中,使其在动物体内水解FB1[55],减轻伏马菌素对动物的危害。(3)直接筛选抑制镰刀菌生长或产伏马菌素能力的活性物质来控制其对农产品的污染。本研究组在筛选活性微生物控制真菌产毒方面也取得了一些结果[56]。总之,在今后的研究中,除了要加强食品检测监督外,还要加强对伏马菌素作用机理的研究,进一步阐明其毒性作用机理,为预防其危害提供理论依据,同时,研究开发无毒、环保和高效的方法来减轻伏马菌素对农作物及其产品的污染。
[参考文献]
[1]Shin J,Kim J,Malapi-Wight M,et al.Protein phosphatase 2A regulatory subunits perform distinct functional roles in the maize pathogenFusariumverticillioides[J].Molecular Plant Pathology,2013,14(5):518-529.
[2]Grenier B,Bracarense A F L,Schwartz H E,et al.The low intestinal and hepatic toxicity of hydrolyzed fumonisin B1correlates with its inability to alter the metabolism of sphingolipids [J].Biochemical Pharmacology,2012,83(10):1465-1473.
[3]潘冬春,李敬根,钱根林,等.伏马菌素及其毒性作用 [J].上海畜牧兽医通讯,2012(5):56-57.
Pan D C,Li J G,Qian G L,et al.Fumonisin and toxicity [J].Shanghai Animal Husbandry and Veterinary Communications,2012(5):56-57.(in Chinese)
[4]Laurent D,Platzer N,Kohler F,et al.Macrofusin and micromonilin:Two new mycotoxins isolated from corn infected byFusariummoniliforme[J].Microbiol Aliment Nutr,1989,7(3):9-16.
[5]Voss K R R.Fumonisin toxicity and mechanism of action:Overview and current perspectives [J].Food Safety,2013,1(1):50-69.
[6]刘书宇,杨美华.伏马菌素的研究进展 [J].安徽农业科学,2009(24):11397-11399.
Liu S Y,Yang M H.Research progress on fumonisins [J].Anhui Agricultural Sciences,2009(24):11397-11399.(in Chinese)
[7]郭耀东,刘艺茹,袁亚宏,等.我国主要食品中伏马菌素污染水平分析与风险评估 [J].西北农林科技大学学报:自然科学版,2014,42(1):78-82,88.
Guo Y D,Liu Y R,Yuan Y H,et al.Fumonisins contamination in major food products and its dietary risk assessment in China [J].Journal of Northwest A&F University:Natural Science Edition,2014,42(1):78-82,88.(in Chinese)
[8]Domijan A.Fumonisin B1:A neurotoxic mycotoxin [J].Arhiv Za Higijenu Rada I Toksikologiju,2012,63(4):531-544.
[9]Shephard G S,Thiel P G,Sydenham E W.Determination of fumonisin B1in plasma and urine by high-performance liquid chromatography [J].Journal of Chromatography,1992,574(2):299-304.
[10]Shephard G S,Thiel P G,Sydenham E W,et al.Fate of a single dose of14C-Labelled fumonisin B1in vervet monkeys [J].Natural Toxins,1995,3(3):145-150.
[11]Fodor J,Balogh K,Weber M,et al.Absorption,distribution and elimination of fumonisin B(1) metabolites in weaned piglets [J].Food Additives and Contaminants Part a Chemistry Analysis Control Exposure & Risk Assessment,2008,25(1):88-96.
[12]金海涛,陈道付,李绍钰.伏马菌素的毒性作用研究 [J].饲料工业,2007(20):55-57.
Jin H T,Chen D F,Li S Y.The research of fumonisin toxicity [J].Feed Industry,2007(20):55-57.(in Chinese)
[13]Gelineau-Van Waes J,Voss K A,Stevens V L,et al.Maternal fumonisin exposure as a risk factor for neural tube defects [J].Advances in Food and Nutrition Research,2009,56:145-181.
[14]Kwon O S,Schmued L C,Slikker W.Fumonisin B1in developing rats alters brain sphinganine levels and myelination [J].Neurotoxicology,1997,18(2):571-579.
[15]Kwon O S,Sandberg J A,Slikker W.Effects of fumonisin B1treatment on blood-brain barrier transfer in developing rats [J].Neurotoxicology and Tteratology,1997,19(2):151-155.
[16]Kovacic S,Pepeljnjak S,Petrinec Z,et al.Fumonisin B1neurotoxicity in young carp (CyprinuscarpioL.) [J].Arhiv Za Higijenu Rada I Toksikologiju,2009,60(4):419-426.
[17]Gbore F A.Brain and hypophyseal acetylcholinesterase activity of pubertal boars fed dietary fumonisin B1[J].Journal of Animal Physiology and Animal Nutrition,2010,94(5):e123-e129.
[18]Stockmann-Juvala H,Mikkola J,Naarala J,et al.Oxidative st-ress induced by fumonisin B1in continuous human and rodent neural cell cultures [J].Free Radical Research,2004,38(9):933-942.
[19]Domijan A,Abramov A Y.Fumonisin B1inhibits mitochondrial respiration and deregulates calcium homeostasis:Implication to mechanism of cell toxicity [J].International Journal of Biochemistry & Cell Biology,2011,43(6):897-904.
[20]Osuchowski M F,Sharma R P.Fumonisin B1induces necrotic cell death in BV-2 cells and murine cultured astrocytes and is antiproliferative in BV-2 cells while N2A cells and primary cortical neurons are resistant [J].Neurotoxicology,2005,26(6):981-992.
[21]Galvano F,Campisi A,Russo A,et al.DNA damage in astrocytes exposed to fumonisin B1[J].Neurochemical Research,2002,27(4):345-351.
[22]Stockmann-Juvala H,Naarala J,Loikkanen J,et al.Fumonisin B1-induced apoptosis in neuroblastoma,glioblastoma and hypothalamic cell lines [J].Toxicology,2006,225(2/3):234-241.
[23]Domijan A M,Kovac S,Abramov A Y.Impact of fumonisin B1on glutamate toxicity and low magnesium-induced seizure activity in neuronal primary culture [J].Neuroscience,2012,202:10-16.
[24]Voss K A,Chamberlain W J,Bacon C W,et al.A preliminary investigation on renal and hepatic toxicity in rats fed purified fumonisin B1[J].Natural Toxins,1993,1(4):222-228.
[25]Harrison L R,Colvin B M,Greene J T,et al.Pulmonary edema and hydrothorax in swine produced by fumonisin B1,a toxic metabolite ofFusariummoniliforme[J].Journal of Veterinary Diagnostic Investigation,1990,2(3):217-221.
[26]Bouhet S,Oswald I P.The intestine as a possible target for fumonisin toxicity [J].Molecular Nutrition & Food Research,2007,51(8):925-931.
[27]Gelderblom W C,Kriek N P,Marasas W F,et al.Toxicity and carcinogenicity of theFusariummoniliformemetabolite,fumonisin B1,in rats [J].Carcinogenesis,1991,12(7):1247-1251.
[28]Li Y C,Ledoux D R,Bermudez A J,et al.Effects of fumonisin B1on selected immune responses in broiler chicks [J].Poultry Science,1999,78(9):1275-1282.
[29]Yoshizawa T A,Yamashita Luo Y.Fumonisin occurrence in corn from high-and low-risk areas for human esophageal cancer in China [J].Applied and Environmental Microbiology,1994(5):1626-1629.
[30]邱茂锋,刘秀梅,王玉华,等.某食管癌高发区人群伏马菌素摄入量及尿二氢神经鞘氨醇/神经鞘氨醇比值的调查 [J].卫生研究,2001(6):365-367.
Qiu M F,Liu X M,Wang Y H,et al.Survey on the fumonisins intake and the urinary Sa/So ratio of people suffered from a high incidence of esophageal cancer [J].Journal of Hygiene Research,2001(6):365-367.(in Chinese)
[31]Qureshi M A,Hagler W M J.Effect of fumonisin B1exposure on chicken macrophage functionsinvitro[J].Poultry Science,1992(1):104-112.
[32]Stockmann-Juvala H,Alenius H,Savolainen K.Effects of fumonisin B1on the expression of cytokines and chemokines in human dendritic cells [J].Food and Chemical Toxicology,2008,46(5):1444-1451.
[33]Devriendt B,Gallois M,Verdonck F,et al.The food contaminant fumonisin B1reduces the maturation of porcine CD11R1 (+) intestinal antigen presenting cells and antigen-specific immune responses,leading to a prolonged intestinal ETEC infection [J].Veterinary Research,2009(4):404.
[34]Francis A,Gbore T J O M,Gabriel-Ajobiewe R A O G.Evaluation of the reproductive toxicity of dietary fumonisin B1in rats [J].Jordan Journal of Biological Sciences,2012,5(3):183-190.
[35]Ewuola E O,Egbunike G N.Effects of dietary fumonisin B1on the onset of puberty,semen quality,fertility rates and testicular morphology in male rabbits [J].Reproduction,2010,139(2):439-445.
[36]Doehlert D C,Knutson C A,Vesonder R F.Phytotoxic effects of fumonisin B1on maize seedling growth [J].Mycopathologia,1994,127(2):117-121.
[37]Desjardins A E,Plattner R D,Nelsen T C,et al.Genetic analysis of fumonisin production and virulence ofGibberellafujikuroimating population A (Fusariummoniliforme) on maize (Zeamays) seedlings [J].Applied and Environmental Microbiology,1995,61(1):79-86.
[38]Abbas H K,Shier W T,Seo J A,et al.Phytotoxicity and cytotoxicity of the fumonisin C and P series of mycotoxins fromFusariumspp.fungi [J].Toxicon,1998,36(12):2033-2037.
[39]Kritzinger Q,Aveling T,van der Merwe C F.Phytotoxic effe-cts of fumonisin B1on cowpea seed [J].Phytoparasitica,2006,34(2):178-186.
[40]方策.伏马菌素诱导拟南芥程序性细胞死亡的细胞生物学研究 [D].广州:中山大学,2011.
Fang C.Cell biological analysis of FB1-induced programmed cell death inArabidopsisthaliana[D].Guangzhou:Zhong-shan University,2011.(in Chinese)
[41]Wang E,Norred W P,Bacon C W,et al.Inhibition of sphingolipid biosynthesis by fumonisins.Implications for diseases associated withFusariummoniliforme[J].The Journal of Biological Chemistry,1991(22):14486-14490.
[42]Wang S,Liu S,Yang L,et al.Effect of fumonisin B-1 on the cell cycle of normal human liver cells [J].Molecular Medicine Reports,2013,7(6):1970-1976.
[43]Stevens V L,Tang J.Fumonisin B1-induced sphingolipid depletion inhibits vitamin uptake via the glycosylphosphatidylinositol-anchored folate receptor [J].Journal of Biological Chemistry,1997,272(29):18020-18025.
[44]Myburg R B,Needhi N,Chuturgoon A A.The ultrastructural effects and immunolocalisation of fumonisin B1on cultured oesophageal cancer cells (SNO) [J].South African Journal of Science,2009,105(5/6):217-222.
[45]Sharma R P,Dugyala R R,Voss K A.Demonstration of in-situ apoptosis in mouse liver and kidney after short-term repeated exposure to fumonisin B1[J].Journal of Comparative Pathology,1997,117(4):371-381.
[46]Sharma R P,Bhandari N,He Q R,et al.Decreased fumonisin hepatotoxicity in mice with a targeted deletion of tumor necrosis factor receptor [J].Toxicology,2001,159(1/2):69-79.
[47]Sharma R P,He Q R,Johnson V J,et al.Increased expression of CD95-ligand and other apoptotic signaling factors by fumonisin B-1,a hepatotoxic mycotoxin,in livers of mice lacking tumor necrosis factor alpha [J].Cytokine,2003,24(5):226-236.
[48]Yin J,Smith M J,Eppley R M,et al.Effects of fumonisin B1on lipid peroxidation in membranes [J].Biochimica et Biophysica Acta,1998,1371(1):134-142.
[49]Abel S,Gelderblom W C A.Oxidative damage and fumonisin B1-induced toxicity in primary rat hepatocytes and rat liverinvivo[J].Toxicology,1998,131(2/3):121-131.
[50]Domijan A,Zeljezic D,Milic M,et al.Fumonisin B1:Oxidative status and DNA damage in rats [J].Toxicology,2007,232(3):163-169.
[51]Xing F,Li Z,Sun A,et al.Reactive oxygen species promote chloroplast dysfunction and salicylic acid accumulation in fumonisin B1-induced cell death [J].Febs Letters,2013,587(14):2164-2172.
[52]Bondy G,Mehta R,Caldwell D,et al.Effects of long term exposure to the mycotoxin fumonisin B1in p53 heterozygous and p53 homozygous transgenic mice [J].Food and Chemical Toxicology,2012,50(10):3604-3613.
[53]张岳平.镰刀菌真菌毒素产生与调控机制研究进展 [J].生命科学,2011(3):311-316.
Zhang Y P.The research advance of biosynthesis and regulation mechanism onFusariummycotoxins[J].Chinese Bulletin of Life Sciences,2011(3):311-316.(in Chinese)
[54]Lanubile A,Bernardi J,Marocco A,et al.Differential activation of defense genes and enzymes in maize genotypes with contrasting levels of resistance toFusariumverticillioides[J].Environmental and Experimental Botany,2012,78:39-46.
[55]徐瑾,伍松陵,常晓娇,等.伏马毒素生物合成和降解的研究进展 [J].中国粮油学报,2013(7):119-123.
Xu J,Wu S L,Chang X J,et al.The research progress of fusarium toxin biosynthesis and degradation [J].Journal of the Chinese Cereals and Oils Association,2013(7):119-123.(in Chinese)
[56]叶火春,赖先文,王艳丽,等.1株抑制镰刀菌生长及产生伏马菌素链霉菌的分离和鉴定 [J].西北农林科技大学学报:自然科学版,2013,41(7):150-156.
Ye H C,Lai X W,Wang Y L,et al.Isolation and identification of aStreptomycesstrain capable of inhibiting growth and fumonisin production of mycotoxigenicFusariumspecies[J].Journal of Northwest A&F University:Natural Science Edition,2013,41(7):150-156.(in Chinese)
第44卷 第1期2016年1月西北农林科技大学学报(自然科学版)JournalofNorthwestA&FUniversity(Nat.Sci.Ed.)Vol.44No.1Jan.2016
Toxicity and mechanism of Fumonisins
ZHANG He,HU Qiong-bo,LIU Cheng-lan
(LaboratoryofInsectToxicology,DepartmentofAgro-Chemicals,CollegeofAgriculture,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong510642,China)
Abstract:Fumonisins are one kind of mycotoxin,mainly produced by Fusarium vertieilliodes and Fusarium proliferatum.Crops contamination by Fumonisins is worldwide,especially for maize and maize products.Currently,Fumonisin B1 (FB1) is the main species among discovered Fumonisins with the largest toxicity.This paper briefly describes the chemical structure of Fumonisins,toxigenic strains and metabolism in animals,with the focuses on toxicity and mechanism.Discussion and outlook on how to reduce harm of Fumonisins to humans and animals are also presented.
Key words:Fumonisins;toxicity;mechanism
[文章编号]1671-9387(2016)01-0162-07
[中图分类号]TS201.6
[文献标志码]A
[作者简介]张荷(1990-),女,河南灵宝人,硕士,主要从事真菌毒素作用机理研究。E-mail:zhanghe900501@163.com[通信作者]刘承兰(1976-),男,湖南永兴人,副教授,博士,硕士生导师,主要从事农产品安全研究。
[基金项目]国家自然科学基金项目(31371959)
[收稿日期]2014-05-14
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.024
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.048.html
E-mail:liuchenglan@scau.edu.cn

