胞外ATP对菜豆光合能力的影响
焦青松,贾凌云,田武英,汤淑珍,冯汉青
(西北师范大学 生命科学学院,甘肃 兰州 730070)
胞外ATP对菜豆光合能力的影响
焦青松,贾凌云,田武英,汤淑珍,冯汉青
(西北师范大学 生命科学学院,甘肃 兰州 730070)
[摘要]【目的】 研究胞外ATP对菜豆(Phaseolus vulgaris L.)叶片光合能力的影响,为探讨胞外ATP对植物光合作用的调节作用提供参考。【方法】 以“农普12号”菜豆幼苗叶片为材料,以去离子水处理为对照,研究不同浓度(0.01,0.1,1.0 mmol/L)胞外ATP及其结构类似物AMP-PCP(胞外ATP受体的竞争性抑制剂)对菜豆叶片光合指标和叶绿素荧光参数的影响。【结果】 胞外ATP可以显著提升菜豆叶片的气孔导度(GH2O)、蒸腾速率(E)、胞内CO2浓度(Ci)和净光合速率(Pn),但对PSⅡ潜在最大光化学量子效率(Fv/Fm)、PSⅡ光适应下实际光化学效率(Y(Ⅱ))、非光化学荧光猝灭系数(NPQ)和光化学荧光猝灭系数(qP)等叶绿素荧光参数没有显著影响。AMP-PCP可以显著降低Pn;也可以促使E、GH2O和Ci降低,但与对照相比均未达到显著水平;对叶绿素荧光参数也均无显著影响。【结论】 胞外ATP能够促进菜豆叶片气孔开放调节,提高叶片净光合速率。
[关键词]细胞外ATP;气孔导度;光合能力;叶绿素荧光参数
三磷酸腺苷(ATP)通常被认为存在于细胞内部,主要功能是作为“能量货币”支持细胞的各种代谢活动。而近年来发现,动物、植物及微生物细胞能够将部分胞内ATP释放到胞外基质中,使得胞外也具有一定水平的ATP,即胞外ATP(Extracellular ATP,eATP)。人们继而在动物和绿藻细胞膜上发现了能特异性结合胞外ATP的跨膜受体蛋白(如P2X和P2Y蛋白),这些受体蛋白在胞质侧的结构域能调节胞内的信号传递[1-2]。在动物细胞的研究中发现,胞外ATP可以作为一种信号分子通过受体蛋白的介导作用,调节细胞的免疫反应、凋亡、生长、肌肉收缩及神经传导等多种生理学活动[3-4]。
相对于动物细胞胞外ATP的研究,有关植物胞外ATP的研究尚处于起步阶段。研究表明,植物细胞能够通过ATP结合转运载体蛋白或膜泡运输的方式将细胞内ATP释放到胞外,从而形成植物细胞的胞外ATP[5-6]。植物的胞外ATP也是一种重要的信号分子,其可通过受体介导的方式来调节植物细胞的生长、发育、抗病反应、细胞程序化死亡和重力反应等生理活动[4,7-10];一些重要的胞内信号分子,如钙离子、活性氧和一氧化氮等,也受到了胞外ATP及其受体的调控[11-14]。最新的研究已经在拟南芥中鉴定出特异性结合胞外ATP的受体蛋白,这使得植物胞外ATP的研究进入了一个全新的阶段[15]。
光合作用决定着植物的生长与发育,是植物最为重要的生理活动。然而,目前关于外源ATP对植物光合作用影响的研究报道较少。仅有的研究表明,增加外源ATP能够促进蚕豆和拟南芥叶片气孔的开放[16-17];而外源ATP水平降低则可导致烟草叶片中一些光合作用相关蛋白的表达水平下降[18]。这些研究提示,植物的光合作用也受到了外源ATP的调节。因为机械损伤、病原菌侵染和渗透压力等外界因素会造成外源ATP水平的变化[1,5,19];而这些因素又能改变植物的光合作用[20-22],因此,外源ATP对植物光合作用调节现象的发现,可能是进一步深入研究自然生态环境中植物光合作用变化内在原因的新的切入点。
除气孔因素外,光合作用是一个包括光能传递及气体交换的复杂化学反应过程,但植物胞外ATP的变化是否也会影响植物光合作用过程中的光能传递及气体交换则尚未见报道,而这是进一步明确胞外ATP对植物光合作用调节作用的重要基础。基于此,本研究用不同浓度的ATP及ATP受体抑制剂AMP-PCP处理菜豆叶片,分析各处理下叶片叶绿素荧光参数和气体交换参数的变化,以期为进一步了解胞外ATP对植物光合作用的调节作用及其变化机理提供借鉴。
1材料与方法
1.1材料
供试菜豆(PhaseolusvulgarisL.)品种为农普12号(由广州市农业科学院提供)。菜豆种子经体积分数2%的次氯酸钠表面消毒20 min后用蒸馏水充分冲洗,置于用蒸馏水浸湿的多层纱布中萌发。萌发后的种子转至培养室并移栽到塑料盆钵中,每盆1株;培养基质为营养土、蛭石和珍珠岩的混合物(体积比3∶1∶1)。培养室的昼夜温度为25 ℃/20 ℃,光照强度为(100±10) μmol/(m2·s),光照周期为12 h光照/12 h黑暗,空气湿度为50%。每天浇水1次以保持培养基质表层湿润。至植物的第1对真叶完全展开后,选取长势一致幼苗的叶片备测。
1.2试剂和仪器
ATP(三磷酸腺苷)和AMP-PCP(β,γ-亚甲基三磷酸腺苷)购自西格玛奥德里奇公司(Sigma-Aldrich Co.LLC);AMP-PCP为胞外ATP受体螯合剂,可与胞外ATP受体结合,从而抑制或消除胞外ATP引发的生理反应。测量仪器为GFS-3000便携式光合作用仪(Waltz,Germany)和 PAM-2500脉冲调制式叶绿素荧光仪(Waltz,Germany)。
1.3试验处理
用去离子水分别配制浓度为0.01,0.1,1.0 mmol/L的ATP和AMP-PCP溶液,用KOH调节pH 至6.7;对照(CK)试剂为去离子水,并用KOH调节pH 至6.7。选用1 mL注射器吸取等量的以上溶液和去离子水,以无针头注射法处理菜豆叶片。处理后2 h进行光合指标和叶绿素荧光参数的测定。
1.4光合指标和叶绿素荧光参数的测定
用GFS-3000便携式光合作用仪测定净光合速率(Pn)、 蒸腾速率(E)、气孔导度(GH2O)和胞内CO2浓度(Ci)等指标。每次测量前仪器预热60 min,ZP模式下调零30 min,设定流速(Flow)为标准值750 μmol/min,叶室风扇的速度为7,测量光为PAR=100 μmol/(m2·s),选用3 cm2叶室,设定叶室温度20 ℃,相对湿度50%,二氧化碳质量分数 0.05%,待各组参数稳定后记录数据。
参照Demmig-Adams等[23]的方法,用PAM-2500脉冲调制式叶绿素荧光仪测量叶绿素荧光参数F0、Fm、Fs、Fm′、F0′,计算暗适应下PSⅡ潜在最大光化学量子效率(Fv/Fm=(Fm-F0)/Fm)、光化学猝灭系数(qP=(Fm′-Fs)/(Fm′-F0′))与光适应下PSⅡ的实际光化学效率(Y(Ⅱ)=(Fm′ -Fs)/Fm′)[23]、相对电子传递速率ETR=PAR×Y(Ⅱ)×0.84×0.5和非光化学猝灭系数(NPQ=Fm/Fm′-1)等参数。每个处理重复测定3次。
1.5数据分析
将所得数据用Excel预处理,然后使用Origin 6.0统计软件进行显著性检验(显著为P<0.05、极显著为P<0.01),并绘图。
2结果与分析
2.1胞外ATP及AMP-PCP对菜豆净光合速率的影响
由图1可见,叶片的净光合速率(Pn)经过外源ATP处理后显著升高,且Pn随着外源ATP处理浓度的升高上升程度有所增加。当外源ATP浓度为0.01,0.1,1.0 mmol/L 时,Pn较对照分别增加11.2%(P<0.05)、11.1%(P<0.05)和14.7%(P<0.01);与ATP对Pn的影响相反,外源AMP-PCP导致叶片Pn显著下降,且下降程度随AMP-PCP处理浓度增加而增大,当AMP-PCP处理浓度为0.01,0.1,1.0 mmol/L 时,Pn较对照分别降低0.8%,16.3%,39.8%,并达到显著或极显著水平。

图 1 ATP及AMP-PCP对菜豆叶片净光合速率(Pn)的影响
2.2胞外ATP及AMP-PCP对菜豆叶片蒸腾速率的影响
蒸腾速率(E)表征了植物在单位时间内单位面积通过蒸腾作用所散失的水量。图2表明,与对照相比,3种不同浓度的ATP处理后菜豆叶片的E值均显著升高。而AMP-PCP 处理后E值呈下降趋势,但与对照相比未达显著水平。

图 2 ATP及AMP-PCP对菜豆叶片蒸腾速率(E)的影响
2.3胞外ATP 及AMP-PCP对菜豆叶片气孔导度的影响
气孔是植物与外界进行气体交换的主要通道及控制蒸腾作用的重要结构,气孔导度(GH2O)表征了气孔张开的程度。如图3 所示,外源ATP处理后菜豆叶片GH2O显著增大;而AMP-PCP处理则使GH2O有下降趋势,但与对照相比未达到显著水平。

图 3 ATP及AMP-PCP对菜豆叶片气孔导度(GH2O)的影响
2.4胞外ATP及AMP-PCP对胞内CO2浓度的影响
胞内CO2浓度(Ci)是衡量植物光合作用的重要指标。图4显示,外源ATP处理可使Ci显著升高,而AMP-PCP处理后Ci值没有显著改变。

图 4 ATP及AMP-PCP对菜豆叶片细胞内CO2浓度(Ci)的影响
2.5胞外ATP 及AMP-PCP对菜豆叶片PSⅡ潜在最大光化学量子效率的影响
Fv/Fm反映了PSⅡ的潜在最大光化学量子效率。由图5可知,外源ATP及AMP-PCP处理后,菜豆叶片Fv/Fm与对照相比均无显著性差异,说明二者对Fv/Fm影响均不大。

图 5 ATP及AMP-PCP 对菜豆叶片PS Ⅱ潜在最大光化学量子效率(Fv/Fm)的影响
2.6胞外ATP 及AMP-PCP对菜豆叶片PSⅡ光适应下实际光化学效率的影响
Y(Ⅱ)表征了光化学能量转换的有效量子产量,即光适应下PSⅡ的实际光化学效率。图6显示,随着外源ATP处理浓度的增加,菜豆叶片Y(Ⅱ)有上升趋势,而随着外源AMP-PCP浓度的增加,叶片Y(Ⅱ)则出现下降趋势;但ATP和AMP-PCP处理均未使Y(Ⅱ)出现显著性变化。

图 6 ATP及AMP-PCP对菜豆叶片PSⅡ光适应下实际光化学效率(Y(Ⅱ))的影响
2.7胞外ATP及AMP-PCP对菜豆叶片光化学猝灭系数的影响
光化学猝灭系数(qP)反映了PSⅡ天线色素吸收的光能中用于光化学电子传递的份额。图7表明,ATP 和AMP-PCP处理均未对qP产生显著影响。
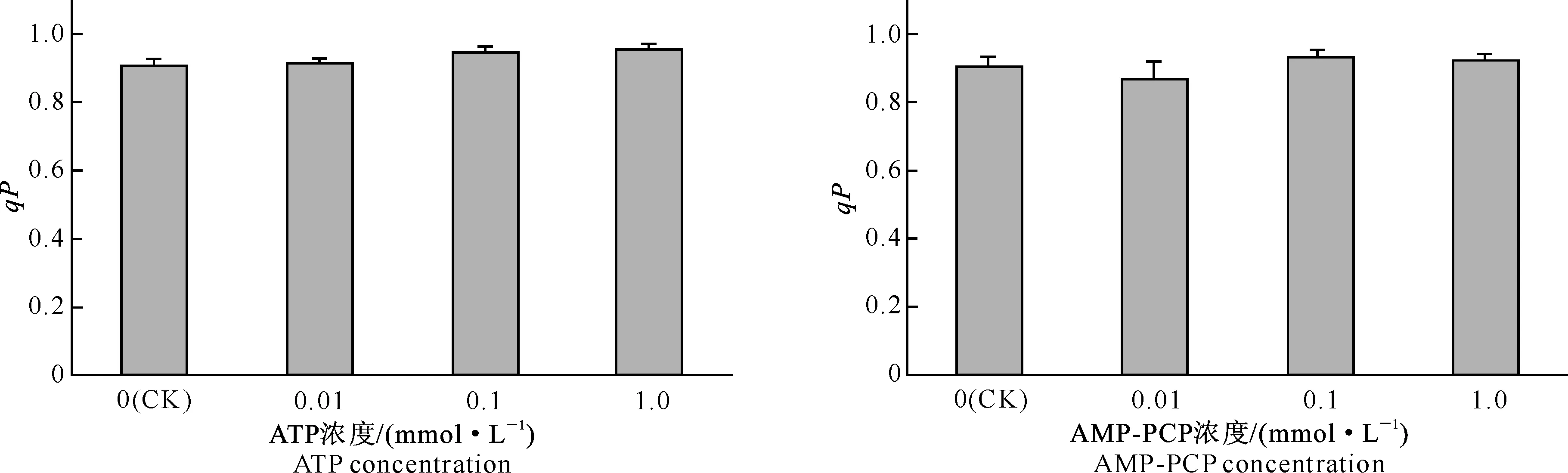
图 7 ATP及AMP-PCP对菜豆光化学猝灭系数(qP)的影响
2.8胞外ATP 及AMP-PCP对非光化学猝灭系数的影响
非光化学猝灭系数(NPQ)反映的是PSⅡ天线色素吸收的光能中未用于光合电子传递而以热的形式所耗散的部分。图8显示,随着ATP处理浓度的增加,菜豆叶片NPQ值呈逐渐降低趋势,但与对照相比未达到显著水平;AMP-PCP对NPQ的影响无规律性,且与对照相比均不显著。
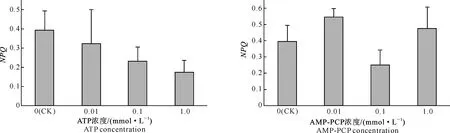
图 8 ATP及AMP-PCP对菜豆非光化学猝灭系数(NPQ)的影响
2.9胞外ATP及AMP-PCP对菜豆叶片PS Ⅱ相对电子传递速率的影响
ETR表征了经过PSⅡ的相对电子传递速率。图9表明,随着ATP处理浓度的增加,菜豆叶片ETR呈上升趋势;AMP-PCP处理则使ETR略有下降。但两种处理均未对ETR产生显著性影响。

图 9 ATP及AMP-PCP对菜豆叶片PSⅡ相对电子传递速率(ETR)的影响
3讨论
本研究结果显示,外源ATP增加导致菜豆叶片GH2O的增大,表明胞外ATP能够刺激菜豆叶片的气孔开放。最近有研究也显示,胞外ATP能够促进拟南芥和蚕豆叶片的气孔开放[16-17]。据此,可以初步确定外源ATP对植物气孔开放的刺激作用可能具有一定的普遍性。本研究也观察到,外源ATP增加导致菜豆叶片E和Ci的上升,由于气孔开放能够促进植物对CO2的吸收,增强植物的蒸腾作用,故推测菜豆叶片E和Ci增加可能与胞外ATP对植物气孔开放的刺激作用有关。
在植物的光合作用过程中,光反应阶段为光合的CO2固定提供了能量和还原力,而气孔对CO2的吸收及由此形成的胞间CO2则为光合RuBP羧化酶的碳固定阶段提供了原初底物[24]。有研究表明,这些不同阶段均可以独立影响最终的光合水平[25]。本研究发现,外源ATP增加能导致叶片Pn的上升,表明胞外ATP能够促进植物的光合作用。由于外源ATP处理下叶片Pn的上升伴随着GH2O和Ci的上升,而表征PSⅡ光能利用率的叶绿素荧光参数(Fv/Fm、Y(Ⅱ)、ETR、NPQ和qP)在此期间却均未发生显著变化,暗示胞外ATP对光合作用的促进作用可能与其刺激气孔开放,并促进叶片对CO2的吸收有关,而与PSⅡ的光能利用率无关。
Hao等[17]发现,胞外ATP对拟南芥叶片气孔开放的作用依赖于其对活性氧的刺激。而除了能够刺激活性氧的产生,胞外ATP 还可以增加细胞内钙离子、一氧化氮等信号分子的产生[7-10]。有研究表明,钙离子、一氧化氮也具有促进植物气孔开放的作用,因此胞外ATP对植物气孔开放的刺激作用也可能与钙离子或一氧化氮有关。此外,钙离子和活性氧可明显提高卡尔文循环中的CO2同化能力[26-27];而一氧化氮则可促进Rubisco基因的表达,从而提升植物碳固定的能力[28-29]。故推测胞外ATP除了通过刺激植物的气孔开放而增加叶片对CO2的吸收外,还可能通过其他多种方式影响植物最终的光合能力。
本研究中与胞外ATP对植物净光合速率影响效应相对应的是,胞外ATP的竞争性抑制剂AMP-PCP表现出与ATP相反的作用: AMP-PCP处理显著降低了Pn,且随着AMP-PCP处理浓度的增加对Pn的抑制作用逐步增强。且与ATP一样,AMP-PCP也未对叶绿素荧光参数产生显著影响,进一步说明叶片胞外ATP水平的变化不会引起植物PSⅡ光能利用率的改变,也表明胞外ATP水平变化所导致的叶片光合速率变化与光反应阶段PSⅡ的光能利用率无关。本研究中,在AMP-PCP处理下,E和GH2O均呈现出一定的下降趋势,这也与外源ATP对E和GH2O的影响效应相反;但E、GH2O和Ci值在AMP-PCP处理下与对照相比均不显著。据此推测,加入AMP-PCP后净光合速率降低可能与气孔的开闭具有一定的关系。但由于胞外本身存在一定水平的ATP,理论而言,AMP-PCP的加入只能通过竞争作用抑制部分胞外ATP的受体位点,因此对于叶片的GH2O、E及Ci值的影响较小。此外,Chivasa等[18]发现,外源AMP-PCP能够抑制植物叶绿体和线粒体ATP合成酶的表达水平,但外源ATP则对这2个指标无显著性影响,提示在AMP-PCP处理下,胞外ATP也可能是通过其他方式引起光合作用下降的,但其具体机制有待于进一步研究。
4结论
本试验发现,胞外ATP对菜豆叶片Fv/Fm、Y(Ⅱ)、NPQ和qP等叶绿素荧光参数无显著影响,但可显著增加GH2O、E、Ci和Pn的水平。表明胞外ATP可能主要是通过促进气孔开放和增加CO2吸收而提升叶片净光合速率的。
[参考文献]
[1]Song C J,Steinebrunner I,Wang X Z,et al.Extracellular ATP induces the accumulation of superoxide via NADPH oxidases inArabidopsis[J].Plant Physiology,2006,140(4):1222-1232.
[2]Chivasa S,Ndimba B K,Simon W J,et al.Extracellular ATP functions as an endogenous external metabolite regulating plant cell viability [J].The Plant Cell Online,2005,17(11):3019-3034.
[3]Roux S J,Steinebrunner I.Extracellular ATP:An unexpected role as a signaler in plants [J].Trends in Plant Science,2007,12(11):522-527.
[4]Tanaka K,Gilroy S,Jones A M,et al.Extracellular ATP signaling in plants [J].Trends in Cell Biology,2010,20(10):601-608.
[5]Bodin P,Burnstock G.Purinergic signalling:ATP release [J].Neurochemical Research,2001,26(8/9):959-969.
[6]Thomas T,Spyer K M.ATP as a mediator of mammalian central CO2chemoreception [J].The Journal of Physiology,2000,523(2):441-447.
[7]Wolf C,Hennig M,Romanovicz D,et al.Developmental defects and seedling lethality in apyrase AtAPY1 and AtAPY2 double knockout mutants [J].Plant Molecular Biology,2007,64(6):657-672.
[8]Wu J,Steinebrunner I,Sun Y,et al.Apyrases (nucleoside trip-hosphate-diphosphohydrolases) play a key role in growth control inArabidopsis[J].Plant Physiology,2007,144(2):961-975.
[9]Sun J,Zhang C L,Deng S R,et al.An ATP signalling pathway in plant cells:Extracellular ATP triggers programmed cell death inPopuluseuphratica[J].Plant,Cell & Environment,2012,35(5):893-916.
[10]Kim S Y,Sivaguru M,Stacey G.Extracellular ATP in plants:Visualization,localization,and analysis of physiological significance in growth and signaling [J].Plant Physiology,2006,142(3):984-992.
[11]Demidchik V,Nichols C,Oliynyk M,et al.Is ATP a signaling agent in plants? [J].Plant Physiology,2003,133(2):456-461.
[12]Demidchik V,Shang Z,Shin R,et al.Plant extracellular ATP signalling by plasma membrane NADPH oxidase and Ca2+channels [J].The Plant Journal,2009,58(6):903-913.
[13]Demidchik V,Cuin T A,Svistunenko D,et al.Arabidopsisro-ot K+-efflux conductance activated by hydroxyl radicals:Single-channel properties,genetic basis and involvement in stress-induced cell death [J].Journal of Cell Science,2010,123(9):1468-1479.
[14]Foresi N P,Laxalt A M,Tonón C V,et al.Extracellular ATP induces nitric oxide production in tomato cell suspensions [J].Plant Physiology,2007,145(3):589-592.
[15]Choi J,Tanaka K,Cao Y,et al.Identification of a plant receptor for extracellular ATP [J].Science,2014,343(6168):290-294.
[16]王芳.ROS和离子通道在eATP调控蚕豆气孔运动过程中的作用 [D].石家庄:河北师范大学,2010.
Wang F.The role of ion channel and ROS in eATP-regulated stomotal movement ofViciafaba[D].Shijiazhuang:Hebei Normal University,2010.(in Chinese)
[17]Hao L H,Wang W X,Chen C,et al.Extracellular ATP promotes stomatal opening ofArabidopsisthalianathrough heterotrimeric G protein alpha subunit and reactive oxygen species [J].Molecular Plant,2012,5(4):852-864.
[18]Chivasa S,Simon W J,Murphy A M,et al.The effects of extracellular adenosine 5′-triphosphate on the tobacco proteome [J].Proteomics,2010,10(2):235-244.
[19]Chivasa S,Murphy A M,Hamilton J M,et al.Extracellular ATP is a regulator of pathogen defence in plants [J].The Plant Journal,2009,60(3):436-448.
[20]Quilliam R S,Swarbrick P J,Scholes J D,et al.Imaging photosynthesis in wounded leaves ofArabidopsisthaliana[J].Journal of Experimental Botany,2006,57(1):55-69.
[21]Berger S,Papadopoulos M,Schreiber U,et al.Complex regulation of gene expression,photosynthesis and sugar levels by pathogen infection in tomato [J].Physiologia Plantarum,2004,122(4):419-428.
[22]Bolton M D.Primary metabolism and plant defense-fuel for the fire [J].Molecular Plant-Microbe Interactions,2009,22(5):487-497.
[23]Demmig-Adams B,Adams III W W.Xanthophyll cycle and light stress in nature:Uniform response to excess direct sunlight among higher plant species [J].Planta,1996,198(3):460-470.
[24]龚春梅,宁蓬勃,王根轩,等.C3和C4 植物光合途径的适应性变化和进化 [J].植物生态学报,2009,33(1):206-221.
Gong C M,Ning P B,Wang G X,et al.A review of adaptable variations and evolution of photosynthetic carbon assimilating pathway in C3 and C4 plants [J].Journal of Plant Ecology,2009,33(1):206-221.(in Chinese)
[25]Guo D P,Guo Y P,Zhao J P,et al.Photosynthetic rate and ch-lorophyll fluorescence in leaves of stem mustard (Brassicajunceavar.tsatsai) after turnip mosaic virus infection [J].Plant Science,2005,168(1):57-63.
[26]Siddiqui M H,Al-Whaibi M H,Basalah M O.Interactive effe-ct of calcium and gibberellin on nickel tolerance in relation to antioxidant systems inTriticumaestivumL. [J].Protoplasma,2011,248(3):503-511.
[27]李卫芳,王忠,韩鹰,等.小麦 Rubisco活化酶的纯化及其活性特性 [J].中国农业科学,2002,35(8):929-933.
Li W F,Wang Z,Han Y,et al.Purification and activity characteristic of Rubisco activase from wheat leaves [J].Scientia Agricultura Sinica,2002,35(8):929-933.(in Chinese)
[28]Qian H,Chen W,Li J,et al.The effect of exogenous nitric oxide on alleviating herbicide damage inChlorellavulgaris[J].Aquatic Toxicology,2009,92(4):250-257.
[29]Beligni M V,Lamattina L.Nitric oxide interferes with plant photo-oxidative stress by detoxifying reactive oxygen species [J].Plant,Cell & Environment,2002,25(6):737-748.
Effects of extracellular ATP on photosynthetic capacity of bean
JIAO Qing-song,JIA Ling-yun,TIAN Wu-ying,TANG Shu-zhen,FENG Han-qing
(CollegeofLifeScience,NorthwestNormalUniversity,Lanzhou,Gansu730070,China)
Abstract:【Objective】 The effects of extracellular ATP on photosynthetic capacity of bean (Phaseolus vulgaris L.) leaves were studied.【Method】 By measuring the chlorophyll fluorescence and gas exchange,the effects of extracellular ATP (eATP) with different concentrations (0.01,0.1,and 1.0 mmol/L) and AMP-PCP (β,γ-methyleneadenosine triphosphate,an inhibitor of eATP receptor) on photosynthesis of “Nongpu 12” bean leaves were studied. 【Result】 The treatment with eATP significantly increased the net photosynthesis rate (Pn),transpiration rate (E),stomatal conductance (GH2O),CO2 concentration in the cell (Ci) of leaves while there were no significant effects on maximal photochemical efficiency of PSⅡ(Fv/Fm),non-photochemical quenching coefficient (NPQ),and the coefficient of photochemical quenching (qP).The treatment with AMP-PCP significantly decreased the net photosynthesis rate (Pn).AMP-PCP also decreased E,GH2O and Ci with insignificant effects but did not affect the chlorophyll fluorescence parameters. 【Conclusion】 Treatment with eATP increased net photosynthesis rate by enhancing stomatal conductance.
Key words:extracellular ATP;stomatal conductance;photosynthesis capacity;chlorophyll fluorescence parameter
[文章编号]1671-9387(2016)01-0118-07
[中图分类号]Q945.11
[文献标志码]A
[作者简介]焦青松(1987-),男,河南睢县人,硕士,主要从事植物生理生化研究。E-mail:jiao.0820@163.com[通信作者]贾凌云(1982-),男,甘肃定西人,高级实验师,博士,主要从事植物生理生态学研究。
[基金项目]国家自然科学基金项目(31260059,30900105);教育部科学技术研究重点项目(211190);甘肃省财政厅高校基本科研业务费项目
[收稿日期]2014-05-07
DOI:网络出版时间:2015-12-0214:2510.13207/j.cnki.jnwafu.2016.01.018
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151202.1425.036.html
E-mail:flingyunjia1982@126.com

