内质网应激在慢性间歇低氧幼鼠脑损害中的作用*
李秀翠, 方 励, 李志洁, POONIT Neha Devi, 陈 帆, 蔡晓红△
(温州医科大学附属第二医院育英儿童医院 1儿童神经科, 2儿童呼吸科,浙江 温州 325027)
内质网应激在慢性间歇低氧幼鼠脑损害中的作用*
李秀翠1, 方 励2, 李志洁2, POONIT Neha Devi2, 陈 帆2, 蔡晓红2△
(温州医科大学附属第二医院育英儿童医院1儿童神经科,2儿童呼吸科,浙江 温州 325027)
目的: 探讨内质网应激在慢性间歇低氧幼鼠脑损害中的作用机制及salubrinal的干预作用。方法: 取SPF级健康雄性SD幼鼠64只,随机分为8组:间歇低氧(intermittent hypoxia,IH)2、4周组(2IH、4IH),对照(control, C)2、4周组(2C、4C),Salubrinal (SAL)干预2、4周组(2SAL、4SAL),二甲基亚砜(DMSO)溶剂对照2、4周组(2DMSO、4DMSO),每组8只。八臂迷宫测试各组幼鼠参考记忆错误(RME)、工作记忆错误(WME)及总错误(TE)次数,观察海马神经元凋亡变化,测定超氧化物歧化酶(SOD)活性,及内质网应激标志物C/EBP 同源蛋白(CHOP)、磷酸化真核翻译起始因子2α(p-eIF2α)和磷酸化蛋白激酶R样内质网激酶(p-PERK)的蛋白水平。结果: 与相应对照2C、4C组比较,间歇低氧2IH、4IH组幼鼠的RME、WME和TE升高(P<0.01),海马神经元凋亡指数(AI)升高(P<0.01),SOD活性下降(P<0.01),p-PERK和CHOP蛋白水平升高(P<0.01),p-eIF2α蛋白水平下降(P<0.05),4周组最明显;与对应间歇性低氧2IH、4IH组比较,药物干预组2SAL、4SAL组RME、WME和TE次数下降(P<0.05),AI下降(P<0.01),SOD活性升高(P<0.01),p-eIF2α的蛋白水平升高(P<0.01),CHOP表达下降(P<0.01)。结论: 慢性间歇低氧可上调记忆相关脑区p-PERK表达,启动内质网应激,从而诱导CHOP所介导的细胞凋亡,可能在慢性间歇低氧所致脑损伤中起重要作用。Salubrinal选择性抑制eIF2α去磷酸化,下调CHOP蛋白的水平,提高SOD活性,从而缓解内质网应激,减轻氧化应激,减少细胞凋亡。
阻塞性睡眠呼吸暂停低通气综合征; 内质网应激; 氧化应激; 细胞凋亡; Salubrinal
儿童阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)的发病率约1%~3%[1],多见于学龄前儿童,严重危害儿童健康及成长发育,相关文献表明神经系统损伤在儿童较常见[2]。我们前期的临床研究也证实神经系统损害所致的认知功能障碍[3]。目前OSAHS导致认知功能障碍的具体机制尚不明确。
近几年来研究发现,过度内质网应激(endoplasmic reticulum stress,ERS)也可启动细胞凋亡,它是一条新的细胞凋亡通路。内质网相关性死亡在神经变性疾病中备受关注,然而是否参与OSAHS认知损伤过程,尚无相关研究。本研究在前期建立慢性间歇低氧(intermittent hypoxia,IH)幼鼠模型的基础上,试图揭示内质网应激在慢性间歇低氧幼鼠记忆损害机制中的作用,进而阐明OSAHS儿童认知功能损害机制。
材 料 和 方 法
1 实验动物及分组
选择健康SPF级雄性Sprague-Dawley(SD)幼鼠(3~4周龄)64只,体重为100~120 g,做好标记,按随机数字表法分为8组:慢性间歇低氧2周(2IH)和4周组(4IH)、空气模拟对照(control, C)2周 (2C)和4周组(4C)、药物salubrinal (SAL)干预 2周(2SAL)和4周组(4SAL)、DMSO溶剂对照2周(2DMSO)和4周组(4DMSO),各组8只。
2 模型制备
按照此前的方法[4],建立OSAHS慢性间歇性低氧动物模型。调控复合模拟舱内氧气浓度,模拟IH环境:0.3 kPa压力通氮气30 s,停30 s,25 L/min流量通氧气12 s,停18 s,为一个循环,舱内低氧时氧浓度为10.0%±1.5%,复氧时氧浓度为21.0%±0.5%,CO2浓度<0.01%,每天7.5 h(8:00~15:30),每周7 d。SAL组和DMSO组进氧舱前0.5 h分别腹腔注射20.8 mL·kg-1·d-1的100 μmol/L salubrinal和1% DMSO[5],然后和IH组放入动物实验复合模拟舱内,模拟间歇性低氧环境。空气模拟对照组置于动物模拟对照舱内,向舱内输送压缩空气,氧浓度保持在21.0%±0.5%。前期研究[6]已对间歇性低氧模型进行验证,整个实验过程中保证舱内温度和室内温度22~24℃,湿度40%~50%。
3 实验方法
3.1 八臂迷宫行为学检测 参照本课题组前期实验方法[4, 7],对大鼠进行八臂迷宫训练,迷宫训练于造模结束前10 d开始进行,每日出氧舱后训练,造模结束当日行八臂迷宫测试。记录工作记忆错误(working memory error,WME)次数:重复进入已吃过食物臂的次数;参考记忆错误(reference memory error, RME)次数:进入不放饵臂的次数;总错误(total error,TE)次数:工作记忆错误和参考记忆错误之和。
3.2 取材 实验结束后,每组随机取6只大鼠,10%水合氯醛腹腔注射麻醉,抽取腹主动脉血3 mL,离心后取血清,-20 ℃冰箱保存;迅速断头处死,剥离颅骨快速分离左、右海马,置液氮保存。取每组剩下的2只幼鼠,暴露心脏,将输液针管刺入左心室,剖开右心耳排液,快速灌入0~4 ℃ 100 mL左右生理盐水,再用0~4 ℃ 200 mL左右的多聚甲醛缓慢灌注后迅速取脑,在视交叉后1 mm及4 mm处冠状切面切开,取中间脑块,浸入4%多聚甲醛固定12~24 h,依次浓度梯度酒精脱水、二甲苯透明、浸蜡、包埋。
3.3 各组幼鼠认知相关脑区海马超氧化物歧化酶(superoxide dismutase,SOD)活性测定及神经元凋亡的检测 将液氮保存的左侧海马组织称重后匀浆,用生理盐水稀释成1%的组织匀浆,黄嘌呤氧化酶法测定匀浆组织中及血清的SOD活性。包埋后的石蜡组织块常规切片(厚度为3 μm)用于TUNEL检测,检测过程按照TUNEL试剂盒说明书进行。TUNEL凋亡阳性细胞主要表现为染色质浓集,细胞核体积变小,呈现棕色,细胞核中有棕黄色颗粒者为阳性。每个样本随机选择5个高倍视野(×400),计算凋亡指数(apoptoic index,AI),AI=凋亡细胞数/计数细胞总数×100%。
3.4 Western印迹法检测海马磷酸化蛋白激酶R样内质网激酶(phosphorylated protein kinase R-like endoplasmic reticulum kinase, p-PERK)、C/EBP同源蛋白(C/EBP homologous protein, CHOP)和磷酸化真核翻译起始因子2α(phosphorylated eukaryotic translation initiation factor 2 alpha, p-eIF2α)蛋白水平的变化 各组幼鼠右侧海马组织采用RIPA缓冲液裂解,提取细胞总蛋白,BCA法检测蛋白含量。取100 μg蛋白上样,经10% SDS-聚丙烯酰胺凝胶电泳分离后转移至硝酸纤维膜上,5%牛血清白蛋白室温封闭2 h,I抗4 ℃孵育过夜,II抗室温下孵育2 h,ECL显影,Gel-Pro凝胶分析软件分析,以目的蛋白条带与内参照(β-actin)条带累积吸光度(IA)之比作为反映蛋白表达水平的相对指标。 I抗稀释度p-PERK、CHOP和p-eIF2α分别为1∶500、1∶1 000和1∶1 000,β-actin单克隆抗体稀释度为1∶1 000。
4 统计学处理
各组正态计量资料数据以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较方差齐者采用Bonferroni校正的t检验,方差不齐则采用Dunnett’s T3检验。所有资料经SPSS 18.0统计软件处理,以P<0.05为差异有统计学意义。
结 果
1 间歇低氧对各组幼鼠学习记忆的影响
八臂迷宫测试结果显示,2IH组和4IH组RME、WME和TE值与相应对照2C和4C组比较明显增加,差异有统计学显著性(P<0.01)。4IH与2IH组比较,各项错误次数亦明显增加(P<0.05);2SAL组和4SAL组RME、WME和TE与相应2IH组和4IH组比较明显减少(P<0.05),2SAL组与对照2C组比较差异无统计学显著性,4SAL组与4C组比较明显减少(P<0.01),2DMSO组和4DMSO组RME、WME和TE与相应2IH组和4IH组比较差异无统计学显著性,见图1。
2 各组幼鼠海马神经元凋亡的检测结果
TUNEL染色显示, 与相应对照2C和4C组比较,2IH和4IH组的海马神经元凋亡指数AI升高(P<0.01),4IH组AI高于2IH组(P<0.01);2C组与4C组的海马可见少许凋亡细胞,两组间差异无统计学显著性;与相应2IH和4IH组比较,2SAL和4SAL组的AI降低(P<0.01),比相应的2C和4C组升高(P<0.01);2DMSO和4DMSO组的细胞凋亡与相应的2IH和4IH组比较差异无统计学显著性,见图2、表1。
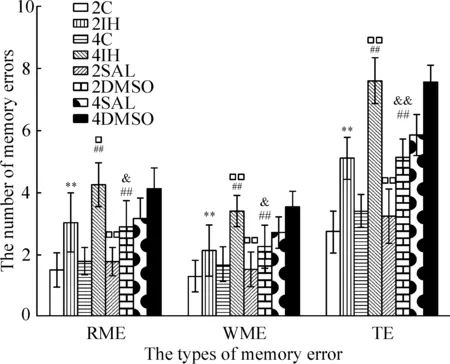
Figure 1.Working memory error (WME), reference memory (RME) and total error (TE) in different groups in an 8-arm radial maze test. Mean±SD.n=8.**P<0.01vs2C group;##P<0.01vs4C group;□P<0.05,□□P<0.01vs2IH group;&P<0.05,&&P<0.01vs4IH group.
图1 八臂迷宫测试各组幼鼠工作记忆错误、参考记忆错误和总错误数
3 各组幼鼠海马组织SOD活性的测定
与相应对照2C和4C组比较,2IH和4IH组海马和血清的SOD活性降低(P<0.01),4IH组明显低于2IH组(P<0.01)。2C与4C组比较差异无统计学显著性;与相应4IH组比较,4SAL组的SOD活性明显升高(P<0.01),4SAL组SOD活性低于4C组(P<0.05),差异有统计学显著性。2DMSO和4DMSO组与相应的2IH和4IH组比较,差异无统计学显著性,见表1。
4 Western blot法检测各组幼鼠海马p-PERK、CHOP和p-eIF2α蛋白含量的变化
与相应对照2C和4C组比较,2IH和4IH组幼鼠海马的p-PERK和CHOP蛋白水平升高(P<0.01),p-eIF2α蛋白水平降低(P<0.05);4IH组p-PERK和CHOP的蛋白水平比2IH组明显升高(P<0.01);与相应2IH和4IH组比较,2SAL和4SAL组的CHOP表达明显降低,p-eIF2α的蛋白水平升高(P<0.01);DMSO组与对应IH组比较,CHOP和p-eIF2α的蛋白水平差异无统计学显著性,见图3。
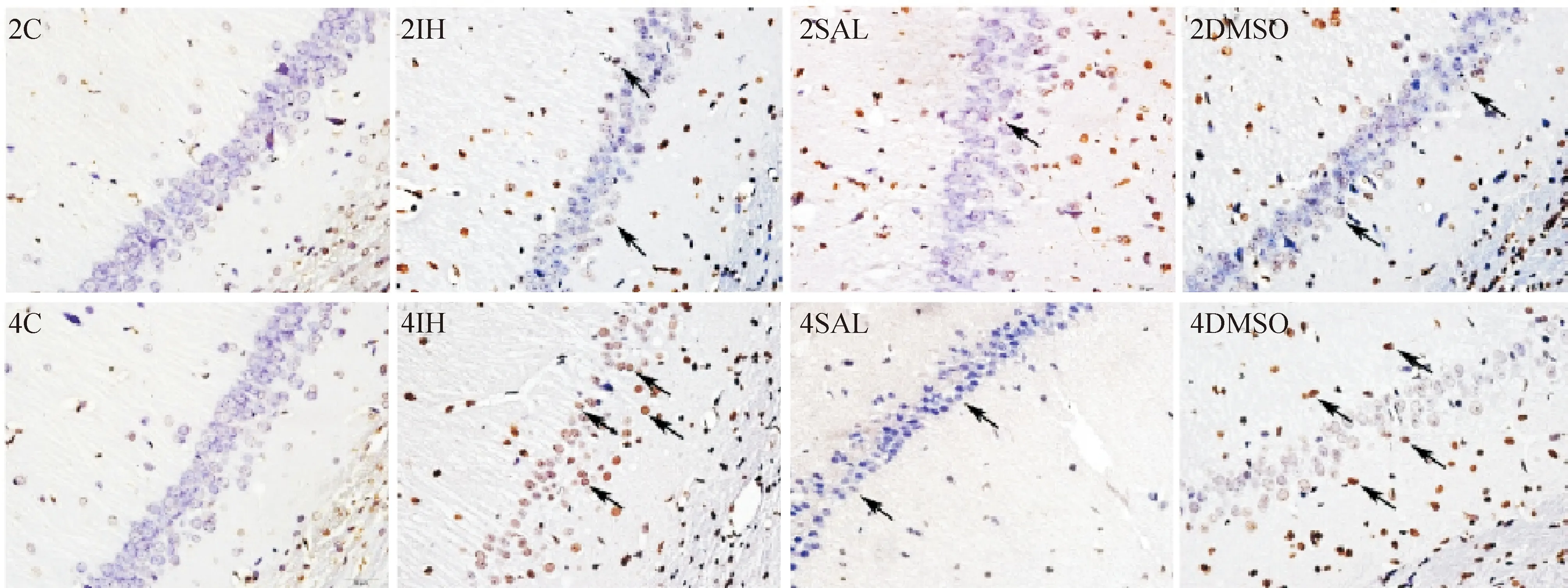
Figure 2.The changes of neuronal apoptosis in the hippocampus CA1 region by TUNEL-DAB staining (×400). TUNEL-positive staining neurons with condensed nuclei (arrow) in the hippocampus CA1 region were evident in CIH groups, especially in 4IH group. Treatment with SAL significantly decreased the number of TUNEL-positive cells, while normal nuclei were seen in control groups.
图2 海马CA1区TUNEL-DAB染色海马神经元凋亡变化
表1 各组幼鼠海马神经元凋亡指数及SOD活性的测定
Table 1.Neuronal apoptotic index (AI) and the activity of SOD in the hippocampus in the rats with different treatments (Mean±SD.n=4)
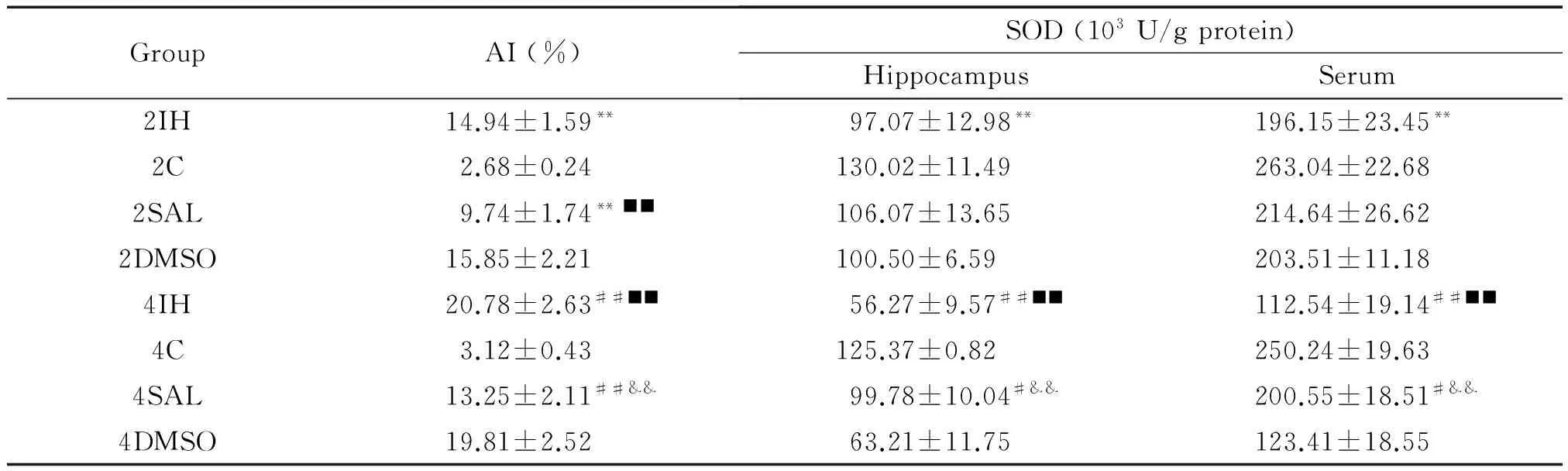
GroupAI(%)SOD(103U/gprotein)HippocampusSerum2IH14.94±1.59**97.07±12.98**196.15±23.45**2C2.68±0.24130.02±11.49263.04±22.682SAL9.74±1.74**■■106.07±13.65214.64±26.622DMSO15.85±2.21100.50±6.59203.51±11.184IH20.78±2.63##■■56.27±9.57##■■112.54±19.14##■■4C3.12±0.43125.37±0.82250.24±19.634SAL13.25±2.11##&&99.78±10.04#&&200.55±18.51#&&4DMSO19.81±2.5263.21±11.75123.41±18.55
**P<0.01vs2C group;#P<0.05,##P<0.01vs4C group;■■P<0.01vs2IH group;&&P<0.01vs4IH group.
讨 论
阻塞性睡眠呼吸暂停模式慢性间歇低氧是一种特殊低氧模式,是一种高频率的低氧,其特点为正常氧和低氧交替出现,平均每2~5 min发生 1 次,最低血氧饱和度可至20%或更低,低氧解除后都会恢复到正常氧水平,机体对间歇低氧较持续低氧难以适应,损害更为严重。OSAHS可引起学习记忆障碍已得到多方证实[8-9],我们前期的研究[4]也证明了这一点,并指出慢性间歇性低氧在其中发挥了重要作用。本实验通过八臂迷宫测试发现间歇性低氧组工作记忆、参考记忆错误和总错误数明显多于正常组,4IH组较2IH组更明显,提示间歇性低氧可损害幼鼠的学习记忆功能,且存在时间依赖性。学习记忆的主要解剖位置位于海马和前额叶皮层,认为海马CAl区与空间学习记忆有关[10]。本研究用TUNEL法检测到间歇性低氧组幼鼠海马CAl区和神经元产生较多凋亡小体,且随着低氧时间增加,凋亡越明显,表明慢性间歇低氧引起幼鼠海马神经元的损伤,从而导致学习记忆功能损害。
内质网应激是细胞早期应对各种应激的一种保护机制,主要由内质网膜上的3种蛋白PERK、IRE-1和ATF-6介导,以上3种蛋白表达上调,提示内质网应激产生。本研究发现间歇低氧能显著上调幼鼠海马PERK的磷酸化水平,说明间歇低氧诱导了内质网应激反应。内质网应激过强或过久就会启动死亡程序,主要由未折叠蛋白CHOP、c-Jun氨基末端激酶和caspase-12依赖的信号途径启动细胞凋亡。内质网过度应激发生时,PERK介导的eIF2α磷酸化同时也提高ATF4 mRNA与核糖体的结合效率[11],促进
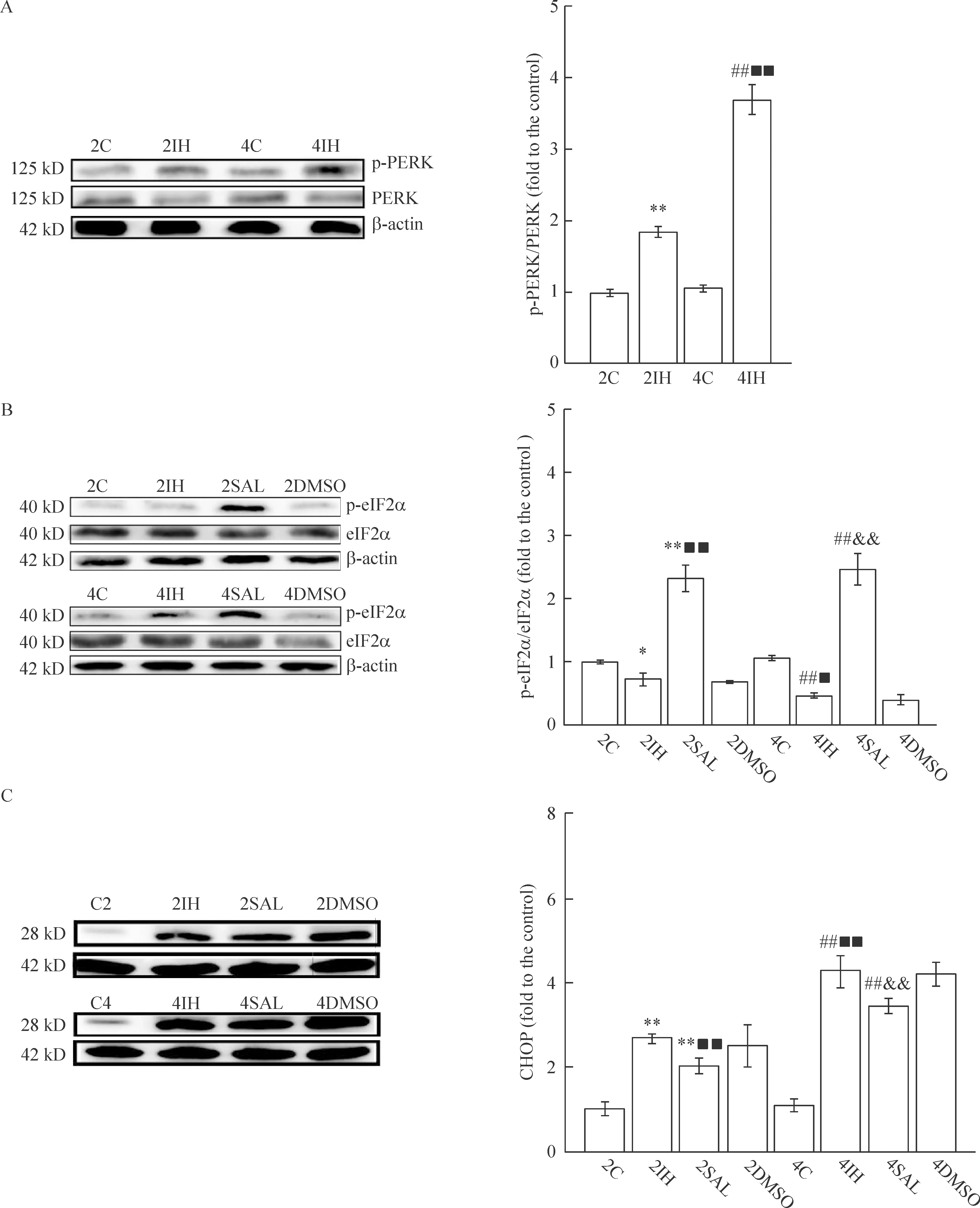
Figure 3.The protein levels of p-PERK (A), p-eIF2α (B), and CHOP (C) in the hippocampus. Mean±SD.n=3.*P<0.05,**P<0.01vs2C group;##P<0.01vs4C group;■P<0.05,■■P<0.01vs2IH group;&&P<0.01vs4IH group.
图3 各组幼鼠海马p-PERK、p-eIF2α和CHOP蛋白含量的变化
ATF4的翻译,ATF4转入核后,诱导CHOP基因的表达[12],过量表达的CHOP促进细胞凋亡。本研究用Western blot法检测发现间歇性低氧组p-PERK的蛋白水平增加,同时CHOP蛋白表达上调,并呈时间依赖性。表明间歇低氧因素持续存在超出内质网自我调节能力,使间歇性低氧幼鼠神经元细胞通过启动内质网膜蛋白PERK,从而上调CHOP,进而介导细胞凋亡。
Salubrinal可选择性地诱导eIF2α磷酸化和抑制其去磷酸化,本实验通过TUNEL法检测发现使用salubrinal 预处理可以减少内质网应激诱导的海马神经元凋亡,减少工作记忆错误、参考记忆错误和总错误数,同时发现SAL组的p-eIF2α水平明显高于IH组,CHOP表达下调,提示salubrinal在间歇性低氧幼鼠模型中可通过选择性地诱导eIF2α磷酸化对抗内质网应激诱导的细胞凋亡,减少认知功能损害。SOD是体内天然的抗氧化物,能清除氧自由基具有抗自由基损伤的作用,SOD的活性能间接反映脑组织中氧自由基水平和脂质过氧化反应的强弱,前期研究已表明氧化应激可引起间歇性低氧神经元凋亡[4],本实验进一步发现间歇性低氧组幼鼠海马及血清的SOD活性明显降低,而salubrinal干预组的SOD活性较间歇性低氧组升高,表明salubrinal可通过减轻内质网应激缓解氧化应激,从而减少细胞凋亡。这与Cao等[13]的研究是一致的,至于内质网应激如何影响氧化应激有待进一步研究。
本研究证明了慢性间歇低氧可通过内质网应激诱导氧化应激引起幼鼠海马神经元的凋亡;salubrinal药物可选择性地诱导eIF2α磷酸化和抑制其去磷酸化对抗内质网应激,减轻氧化应激,从而减少细胞凋亡,将来有望被开发为抗细胞凋亡的治疗药物,该研究为OSAHS儿童认知功能障碍的发生机制及治疗提供实验基础和理论依据。
[1] Farber JM. Clinical practice guideline: diagnosis and management of childhood obstructive sleep apnea syndrome[J]. Pediatrics, 2002, 110(6):1255-1257.
[2] Owens JA. Neurocognitive and behavioral impact of sleep disordered breathing in children[J]. Pediatr Pulmonol, 2009, 44(5):417-422.
[3] Cai XH, Li XC, Hu QQ, et al. Multiple system morbidities associated with children with snore symptom[J]. Pediatr Pulmonol, 2013, 48(4):381-389.
[4] Cai XH, Zhou YH, Zhang CX, et al. Chronic intermittent hypoxia exposure induces memory impairment in growing rats[J]. Acta Neurobiol Exp (Wars), 2010, 70(3):279-287.
[5] Sokka AL, Putkonen N, Mudo G, et al. Endoplasmic reticulum stress inhibition protects against excitotoxic neuronal injury in the rat brain[J]. J Neurosci, 2007, 27(4):901-908.
[6] 李秀翠,蔡晓红,温正旺,等. 间歇性低氧动物模型的建立及验证[J]. 医学研究杂志, 2012, 41(7): 57-61.
[7] 蔡晓红,张存雪,周永海,等. 慢性间歇低氧对幼鼠认知及相关脑区CREB的影响[J]. 中国病理生理杂志, 2010, 26(5):895-900.
[8] Skomro RP, Kryger MH. Clinical presentations of obstructive sleep apnea syndrome[J]. Prog Cardiovasc Dis,1999,41(5):331-340.
[9] Fung SJ, Xi M, Zhang J, et al. Apnea produces excitotoxic hippocampal synapses and neuronal apoptosis[J]. Exp Neurol, 2012, 238(2):107-113.
[10]Siesjö BK, Rehncrona S, Smith D. Neuronal cell damage in the brain: possible involvement of oxidative mechanisms[J]. Acta Physiol Scand Suppl, 1980, 492:121-128.
[11]Wiseman RL, Balch WE. A new pharmacology: drugging stressed folding pathways[J]. Trends Mol Med, 2005, 11(8):347-350.
[12]Liang C, Li H, Zhou H, et al. Recombinant Lz-8 fromGanodermaluciduminduces endoplasmic reticulum stress-mediated autophagic cell death in SGC-7901 human gastric cancer cells[J]. Oncol Rep, 2012, 27(4):1079-1089.
[13]Cao J, Dai DL, Yao L, et al. Saturated fatty acid induction of endoplasmic reticulum stress and apoptosis in human liver cells via the PERK/ATF4/CHOP signaling pathway[J]. Mol Cell Biochem, 2012, 364(1-2):115-129.
(责任编辑: 林白霜, 罗 森)
Effect of endoplasmic reticulum stress on brain injury following chronic intermittent hypoxia in growing rats
LI Xiu-cui1, FANG Li2, LI Zhi-jie2, POONIT Neha Devi2, CHEN Fan2, CAI Xiao-hong2
(1DepartmentofPediatricNeurology,2DepartmentofPediatricPulmonology,TheSecondAffiliatedHospitalandYuyingChildren’sHospital,WenzhouMedicalUniversity,Wenzhou325027,China.E-mail:caixh839@sina.com)
AIM: To explore the role of endoplasmic reticulum stress (ERS) in brain injury following chronic intermittent hypoxia in growing rats and the protective effect of treatment with salubrinal. METHODS: Healthy male SD rats (3~4-week-old, 100~120 g,n=64) were randomly assigned to 8 groups (8 rats in each group): the groups of intermittent hypoxia for 2 and 4 weeks (2IH and 4IH), the groups of control (C) for 2 and 4 weeks (2C and 4C), the groups of dimethylsulfoxide (DMSO) for 2 and 4 weeks (2DMSO and 4DMSO) and the groups of salubrinal for 2 and 4 weeks (2SAL and 4SAL). The 8-arm radial maze was used to assess the working memory error (WME), reference memory error (RME) and total error (TE) of the rats. The changes of neuronal apoptosis in the hippocampus were observed by terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) staining. The activity of superoxide dismutase (SOD), and the protein levels of endoplasmic reticulum stress marker compounds, C/EBP homologous protein (CHOP), phosphorylated eukaryotic translation initiation factor 2 alpha (p-eIF2α) and phosphorylated protein kinase R-like endoplasmic reticulum kinase (p-PERK), were analyzed. RESULTS: Chronic intermittent hypoxia (CIH) significantly increased RME, WME, TE and neuronal apoptotic index (AI) (P<0.01), and decreased the activity of SOD in the hippocampus and serum (P<0.01). The protein levels of p-PERK and CHOP progressively increased in hippocampus in IH groups (P<0.01), and p-eIF2α was downregulated (P<0.05). Treatment with salubrinal significantly decreased RME (P<0.05), WME (P<0.05), TE (P<0.01) and AI (P<0.01), and increased the activity of SOD (P<0.01). Salubrinal induced the phosphorylation of eIF2α significantly after CIH in hippocampus and downregulated the level of CHOP (P<0.01). CONCLUSION: Chronic intermittent hypoxia upregulates the protein levels of p-PERK and CHOP in the hippocampus, and decreases p-eIF2α protein and the activity of SOD. Salubrinal, a selective inhibitor of eIF-2α dephosphorylation, increases the activity of SOD and prevents CHOP protein activation throughout CIH exposure. Our findings suggest ERS-mediated cell apoptosis is one of the underlying mechanisms of cognitive dysfunction in OSAHS children. Further, a specific ERS inhibitor salubrinal should be tested for neuroprotection against CIH-induced brain injury.
Obstructive sleep apnea hypopnea syndrome; Endoplasmic reticulum stress; Oxidative stress; Apoptosis; Salubrinal
1000- 4718(2016)08- 1413- 06
2016- 02- 29
2016- 04- 21
浙江省自然科学基金资助项目(No. Y2110277);温州市科技计划项目(No. Y20140247);浙江省科技厅公益性技术应用研究计划资助项目(No. 2013C33174);温州市科学技术局科技合作项目(No. H20130001); 浙江省医药卫生科技计划(No. 2014ZDA014; No. 2011RCB027); 国家卫计委国家重点临床专科开放课题(No. 20130201);浙江省高校重中之重临床医学儿科学开放课题
R363
A
10.3969/j.issn.1000- 4718.2016.08.012
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0577-88002125; E-mail: caixh839@sina.com

