ATP敏感性钾通道在硫化氢抑制坏死性凋亡介导的高糖致H9c2心肌细胞炎症中的作用*
梁伟杰, 陈美姬, 何健华, 张稳柱, 程 飞, 兰 军, 冯鉴强, 黄惠敏△
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东 广州 511400;3中山大学附属第一医院黄埔院区儿科,广东 广州 510700; 4广州市番禺区石碁人民医院心血管内科,广东 广州 511450; 5东莞市第三人民医院心血管内科,6东莞市心血管疾病研究所,广东 东莞 523326)
ATP敏感性钾通道在硫化氢抑制坏死性凋亡介导的高糖致H9c2心肌细胞炎症中的作用*
梁伟杰1, 2, 陈美姬3, 何健华4, 张稳柱1, 2, 程 飞5, 6, 兰 军5, 6, 冯鉴强5, 6, 黄惠敏1, 2△
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东 广州 511400;3中山大学附属第一医院黄埔院区儿科,广东 广州 510700;4广州市番禺区石碁人民医院心血管内科,广东 广州 511450;5东莞市第三人民医院心血管内科,6东莞市心血管疾病研究所,广东 东莞 523326)
目的: 探讨ATP敏感性钾通道(KATP通道)在硫化氢(H2S)抑制坏死性凋亡介导的高糖(HG)致H9c2 心肌细胞炎症中的作用。方法: 应用Western blot法测定受体相互作用蛋白3(RIP3)和环氧化酶-2(COX-2)的表达水平;ELISA检测细胞培养液中白细胞介素-1β(IL-1β)和肿瘤坏死因子-α (TNF-α)的水平。结果: H9c2 心肌细胞经HG (35 mmol/L葡萄糖)处理24 h,其RIP3 的表达水平明显升高,100 μmol/L KATP通道开放剂二氮嗪(DZ)和400 μmol/L H2S的供体硫氢化钠(NaHS)预处理心肌细胞30 min均可抑制HG对RIP3 表达的上调;100 μmol/L KATP通道阻断剂5-羟基癸酸(5-HD)预处理心肌细胞30 min可阻断NaHS对HG上调RIP3 表达的抑制作用。另一方面,100 μmol/L坏死性凋亡的特异性抑制剂necrostatin-1共处理或100 μmol/L DZ、400 μmol/L NaHS预处理心肌细胞均能抑制高糖引起的心肌细胞炎症,使COX-2 表达及IL-1β和TNF-α的分泌水平均减少;而100 μmol/L 5-HD能明显拮抗NaHS的上述抗炎症反应作用。结论: KATP通道在H2S抑制坏死性凋亡介导的高糖致心肌细胞炎症反应中发挥重要的作用。
ATP敏感性钾通道; 硫化氢; 坏死性凋亡; 高糖; 心肌细胞; 炎症
糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种严重的糖尿病心血管并发症,是引起糖尿病病人心力衰竭和死亡的主要原因,受到全球的广泛关注。DCM的发病涉及多方面的机制,如氧化应激、心肌纤维化、慢性炎症和心肌细胞死亡等[1]。研究表明,在DCM患者或动物模型中,持续存在的炎症反应伴随大量的炎症细胞因子如白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的分泌及与炎症相关的信号分子,如核因子-κB(nuclear factor κB,NF-κB)、环氧化酶-2(cyclooxygenase-2,COX-2)等的激活,最终导致心肌损伤[2-4]。另一方面,心肌细胞死亡在DCM的发生过程中起关键的开启作用。坏死性凋亡(necroptosis)也称为程序性坏死(programmed necrosis),是近年来新发现的一种细胞死亡方式。在坏死性凋亡发生过程中,受体相互作用蛋白(receptor-interacting protein,RIP)家族,尤其是RIP3起重要的作用,过量表达的RIP3可导致坏死性凋亡的发生[5]。有报道指出,坏死性凋亡和细胞炎症反应的关系非常密切。Liu等[6]证实,坏死性凋亡的特异性抑制剂necrostatin-1(Nec-1)可减轻小鼠结肠癌细胞的炎症反应,提示坏死性凋亡可介导细胞的炎症反应。但是,在DCM的病理生理机制中,坏死性凋亡和炎症的关系如何目前尚未完全明确,因此,研究这个问题有重要的理论和临床意义。
ATP敏感性钾通道(ATP-sensitive K+channel,KATP通道)是Noma于1983年首先在豚鼠的心肌细胞中发现的,广泛存在于心肌细胞、骨骼肌细胞和血管平滑肌细胞中。多项研究表明,开放KATP通道对心肌有明确的保护作用[7-9]。新型气体信号分子硫化氢(hydrogen sulfide,H2S)是KATP通道的开放剂[10],能保护H9c2心肌细胞对抗高糖引起的心肌细胞毒性、凋亡、氧化应激、线粒体功能受损及炎症等损伤[11-14]。最近,我们证实,H2S通过调控KATP通道[12]及抑制坏死性凋亡对抗高糖引起的心肌细胞损伤[14],然而,KATP通道是否参与H2S对炎症反应及坏死性凋亡的抑制,迄今未见报道。
为此,本研究建立高糖损伤H9c2心肌细胞模型[11],重点探讨以下问题:(1)坏死性凋亡是否介导高糖致心肌细胞炎症反应;(2)开放KATP通道能否抑制坏死性凋亡介导的炎症反应;(3)KATP通道在H2S抑制坏死性凋亡介导的心肌细胞炎症反应中的作用。
材 料 和 方 法
1 材料
Nec-1和硫氢化钠(sodium hydrosulfide,NaHS)由Sigma-Aldrich供应;抗RIP3 抗体和抗COX-2 抗体购自CST;二氮嗪(diazoxide, DZ)和5-羟基癸酸(5-hydroxydecanoic acid,5-HD)购自Cayman;特级胎牛血清(fetal bovine serum,FBS)购自Gibco BRL;DMEM培养基(其葡萄糖浓度为5.5 mmol/L)由HyClone供应;TNF-α和IL-1β ELISA试剂盒由武汉华美生物工程有限公司提供。H9c2心肌细胞来源于胚胎期大鼠心脏组织的亚克隆细胞系,由中山大学实验动物中心供应。
2 方法
2.1 细胞培养 H9c2心肌细胞置于含10% FBS的DMEM培养基中,于5% CO2、37 ℃的条件下传代培养,待细胞生长至约80%的融合状态可用于实验。
2.2 实验分组 实验分为10组:(1)正常对照(control)组采用DMEM培养基作用心肌细胞24 h;(2)高糖(high glucose,HG)组用含有高浓度葡萄糖(35 mmol/L)的DMEM培养基作用心肌细胞24 h;(3) NaHS+HG组用400 μmol/L NaHS预处理心肌细胞30 min,PBS液洗2次后,用含高浓度葡萄糖的DMEM培养基作用24 h;(4) 5-HD+NaHS+HG组用100 μmol/L 5-HD作用心肌细胞30 min,撤去,PBS洗2次,后续步骤与第(3)实验组相同;(5) DZ+HG组用100 μmol/L DZ预处理心肌细胞30 min,PBS液洗2次后,用含高浓度葡萄糖的DMEM培养基作用24 h;(6) Nec-1+ HG组用100 μmol/L Nec-1与含高浓度葡萄糖的DMEM培养基共处理心肌细胞24 h;(7) NaHS组用400 μmol/L NaHS作用心肌细胞30 min,PBS洗2次,接着DMEM培养基处理24 h;(8) 5-HD组用100 μmol/L 5-HD作用心肌细胞30 min,PBS洗2次,接着DMEM培养基处理24 h;(9) DZ组用100 μmol/L DZ作用心肌细胞30 min,撤去,PBS洗2次,接着DMEM培养基处理24 h;(10) Nec-1组用100 μmol/L Nec-1与DMEM培养基共处理心肌细胞24 h。
2.3 Western blot法检测RIP3 和COX-2 的表达水平 在60 mm培养皿中种植H9c2 心肌细胞,待细胞生长至大约80%的融合度时,根据实验分组给予相应处理后,加入细胞裂解液,4 ℃的摇床上作用30 min,12 000 r/min高速离心10 min,以BCA法测定蛋白质含量。等量的蛋白经10%SDS-PAGE分离后,转移至PVDF膜上,5%脱脂奶粉封闭1 h,加入Ⅰ抗,即兔抗鼠RIP3、COX-2或GAPDH(浓度均为1∶1 000),4 ℃作用过夜后加入浓度为1∶2 500的Ⅱ抗稀释液,室温下孵育1.5 h,ECL法使PVDF膜显色,暗室中将显色条带曝光到医用X线片上,凝胶成像扫描系统分析结果。实验重复5次。
2.4 ELISA检测细胞培养液中IL-1β和TNF-α的水平 于96孔板中种植H9c2 心肌细胞,待细胞融合度达到约80%时,按照分组给予不同的处理后,收集培养基留作待测标本。ELISA操作流程根据试剂盒说明书进行,在终止显色反应后,用酶标仪测定各孔450 nm处吸光度(A)值。取5孔A值的平均数,根据以下公式计算出IL-1β和TNF-α的诱导释放率(%):处理组A/对照组A×100%。实验重复5次。
3 统计学处理
应用SPSS 17.0软件进行统计数据处理和分析,计量资料采用均数±标准误(mean±SEM)表示,单因素方差分析(one-way ANOVA)用于多个样本均数间的比较,SNK-q检验用于多个样本均数间的两两比较,以P<0.05为差异有统计学意义。
结 果
1 KATP通道开放剂抑制HG诱导的心肌细胞RIP3表达增加
图1显示,H9c2心肌细胞经HG (35 mmol/L葡萄糖)作用24 h后,其RIP3的表达明显增加,与control组比较,差异有统计学显著性(P<0.01)。应用100 μmol/L DZ(KATP通道开放剂)预处理心肌细胞30 min后再予HG作用心肌细胞24 h,RIP3的表达明显减少,与HG组比较,差异有统计学显著性(P<0.01)。100 μmol/L DZ本身对心肌细胞RIP3的基础表达无明显影响。

Figure 1.KATPchannel opener diazoxide (DZ) attenuated high glucose (HG)-induced up-regulation of RIP3 in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图1 KATP通道开放剂抑制HG诱导的心肌细胞RIP3表达增加
2 KATP通道介导H2S对HG上调RIP3表达的抑制作用
如前所述,HG可明显上调RIP3的表达;在HG处理心肌细胞前,应用400 μmol/L NaHS预处理心肌细胞30 min可使RIP3的表达明显减少,与HG处理组比较,差异有统计学显著性(P<0.01)。但是,在NaHS预处理前,应用100 μmol/L 5-HD(KATP通道阻断剂)作用心肌细胞30 min,可使NaHS对RIP3表达的抑制作用减弱,与NaHS预处理组比较,差异有统计学显著性(P<0.01)。400 μmol/L NaHS或100 μmol/L 5-HD本身对心肌细胞RIP3的基础表达无明显的影响,见图2。

Figure 2.KATPchannels contributed to the inhibitory effect of H2S on HG-induced increase in RIP3 expression in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group;△△P<0.01vsHG+NaHS group.
图2 KATP通道介导H2S抑制HG诱导的心肌细胞RIP3表达增加
3 坏死性凋亡抑制剂和KATP通道开放剂抑制HG诱导的心肌细胞COX-2 表达上调
HG作用心肌细胞24 h可明显上调COX-2的表达,与对照组比较,两者差异有统计学显著性(P<0.01)。但是,应用100 μmol/L Nec-1(坏死性凋亡的特异性抑制剂)和HG共处理心肌细胞24 h可明显拮抗HG对COX-2表达的上调作用,与HG组比较,差异有统计学显著性(P<0.01)。100 μmol/L Nec-1本身对心肌细胞COX-2的基础表达无明显影响。
与Nec-1的作用相类似,100 μmol/L DZ预处理心肌细胞也能明显地抑制HG对COX-2表达的上调,与HG组比较,差异有统计学显著性(P<0.01)。100 μmol/L DZ本身对心肌细胞COX-2的基础表达无明显影响,见图3。
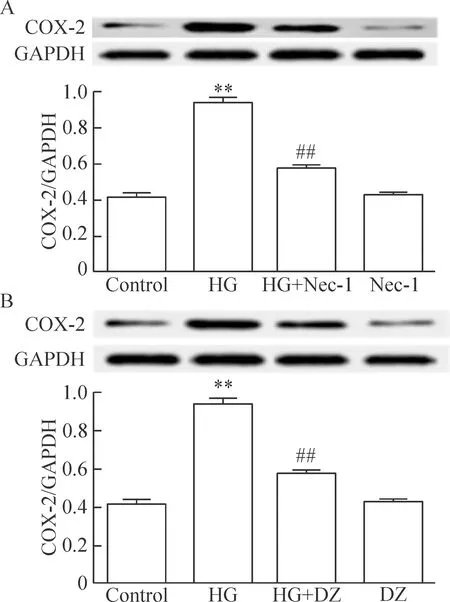
Figure 3.The inhibitor of necroptosis (A) and KATPchannel opener (B) attenuated HG-induced up-regulation of COX-2 in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图3 坏死性凋亡抑制剂和KATP通道开放剂抑制HG诱导的心肌细胞COX-2表达上调
4 KATP通道介导H2S对HG促进COX-2表达的抑制作用
如前所述,HG可促进COX-2的表达;应用400 μmol/L NaHS预处理心肌细胞30 min,可使COX-2 的表达明显减少,与HG处理组比较,差异有统计学显著性(P<0.01)。但是,在NaHS预处理前,应用100 μmol/L 5-HD预处理心肌细胞30 min可使NaHS对COX-2表达的抑制作用明显减弱,与NaHS预处理组比较,差异有统计学显著性(P<0.01)。400 μmol/L NaHS或100 μmol/L 5-HD本身对心肌细胞COX-2的基础表达无明显的影响,见图4。
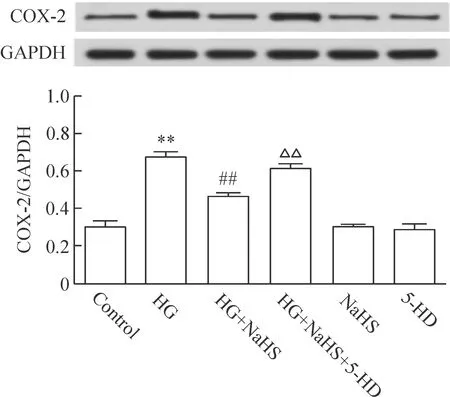
Figure 4.KATPchannels contributed to the inhibitory effect of H2S on HG-induced increase in the expression of COX-2 in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group;△△P<0.01vsHG+NaHS group.
图4 KATP通道介导H2S抑制HG诱导的心肌细胞COX-2 表达上调
5 KATP通道参与H2S对坏死性凋亡介导的HG致炎症细胞因子分泌的抑制
如图5所示,HG处理心肌细胞24 h可明显促进炎症细胞因子IL-1β和TNF-α的分泌,与control组比较,差异均有统计学显著性(P<0.01)。应用100 μmol/L Nec-1共处理或100 μmol/L DZ预处理心肌细胞能拮抗HG对炎症细胞因子分泌的促进作用,使IL-1β和TNF-α的分泌水平降低,与HG组分别比较,差异均有统计学显著性(P<0.01)。100 μmol/L Nec-1或100 μmol/L DZ本身不影响炎症细胞因子的基础分泌。
与Nec-1或DZ抑制炎症细胞因子分泌的作用相类似,应用400 μmol/L NaHS预处理心肌细胞30 min也可使IL-1β和TNF-α的分泌水平明显降低,与HG组比较,差异均有统计学显著性(P<0.01)。但是,在NaHS预处理前,应用100 μmol/L 5-HD作用心肌细胞30 min可明显拮抗NaHS对HG诱导炎症细胞因子分泌的抑制作用,使IL-1β和TNF-α的分泌水平升高,与NaHS预处理组比较,差异均有统计学显著性(P<0.01)。400 μmol/L NaHS或100 μmol/L 5-HD本身对炎症细胞因子的基础分泌无明显的影响。

Figure 5.KATPchannels mediated the inhibitory effect of H2S on HG-induced secretion of inflammatory cytokines mediated by necroptosis in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group;△△P<0.01vsHG+NaHS group.
图5 KATP通道参与H2S抑制坏死性凋亡介导的高糖致心肌细胞炎症细胞因子分泌
讨 论
炎症反应是高血糖引起心肌损伤的一个重要的病理生理机制。和我们之前的报道[12]及其它的研究结果[2-4]相一致,本研究再次证实,HG可引起明显的心肌细胞炎症反应,表现为炎症细胞因子IL-1β、TNF-α的分泌水平升高和炎症通路COX-2的激活。生理状态下COX-2在绝大部分组织细胞中是鲜有表达的,在炎症、缺氧、高血糖、肿瘤等病理状态下则表达呈增高趋势,诱导合成前列腺素类衍生物,是诱导炎症反应的一种重要的信号分子。研究表明,细胞炎症和坏死性凋亡的关系非常密切。最近,我们证实坏死性凋亡参与HG引起的心肌细胞损伤[14]。但是,坏死性凋亡是否参与HG引起的心肌细胞炎症尚不清楚。因此,在本研究中,我们观察了坏死性凋亡的特异性抑制剂Nec-1对HG诱导的心肌细胞炎症的影响,结果表明Nec-1可明显抑制HG引起的心肌细胞炎症反应,使炎症细胞因子的分泌和COX-2的表达减少,清晰地提示坏死性凋亡可介导HG诱导的H9c2心肌细胞炎症。Liu等[6]在结肠癌细胞(HT-29细胞)模型的研究结论与本文相似,且我们首次证实,在HG损伤心肌细胞的条件下,坏死性凋亡可激活COX-2通路,这可能是坏死性凋亡介导炎症的一个重要机制,但尚需进一步的探讨。
KATP通道是一种受细胞内ATP浓度调控的内向整流钾通道,其活性状态主要决定于胞内ATP与ADP的浓度。心肌细胞KATP通道的激活可通过缩短动作电位时程、减少钙超载、减少能量消耗、抑制线粒体渗透性转换孔开放等机制,发挥心肌保护作用。因坏死性凋亡可引起细胞内ATP浓度的变化[15],因此我们推测KATP通道可能对坏死性凋亡有一定的调控作用。为了验证我们的假设,我们首先观察了KATP通道开放剂DZ对HG上调RIP3表达的影响。结果表明,DZ可明显地拮抗HG对RIP3 表达的上调作用。此外,应用DZ预处理心肌细胞和应用坏死性凋亡的特异性抑制剂Nec-1共处理心肌细胞均产生类似的抗炎症反应作用,使IL-1β、TNF-α的分泌和COX-2的表达减少。上述结果提示,开放KATP通道可抑制坏死性凋亡及其介导的心肌细胞炎症反应。
重要的是,我们进一步探讨了高糖状态下,KATP通道在H2S抑制坏死性凋亡介导的心肌细胞炎症中的作用。H2S是继CO和NO之后被发现的第3种内源性气体信号分子,具有多种病理生理作用。H2S是KATP通道的开放剂[10],可通过调控KATP通道实现细胞保护作用。例如,H2S可激活KATP通道减轻缺氧对神经母细胞瘤细胞(SH-SY5Y细胞)的损伤[16];Bian等[17]报道,KATP通道介导H2S对缺血引起大鼠心肌细胞损伤的抑制作用;我们最近证实,H2S可通过开放KATP通道对抗HG引起的H9c2心肌细胞损伤[13]。为了探讨KATP通道是否介导H2S对HG诱发的心肌细胞炎症的抑制作用,本研究在上述研究的基础上,进一步观察KATP通道阻断剂5-HD预处理心肌细胞对H2S抑制HG致心肌细胞炎症反应的影响。结果表明,5-HD可明显减弱H2S的抗坏死性凋亡和抗炎症反应作用,使RIP3和COX-2表达水平明显上升,IL-1β和TNF-α分泌增多,提示在高糖状态下,通过激活KATP通道继而抑制坏死性凋亡介导的心肌细胞炎症反应,可能是H2S发挥其保护心肌细胞对抗HG引起的炎症反应的重要机制之一,这为深入阐明H2S的抗炎症机制提供了新颖的实验依据。
[1] Falcão-Pires I, Leite-Moreira AF. Diabetic cardiomyopathy: understanding the molecular and cellular basis to progress in diagnosis and treatment[J]. Heart Fail Rev, 2012, 17(3):325-344.
[2] Wen HL, Liang ZS, Zhang R, et al. Anti-inflammatory effects of triptolide improve left ventricular function in a rat model of diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2013, 12:50.
[3] Agrawal NK, Kant S. Targeting inflammation in diabetes: newer therapeutic options[J]. World J Diabetes, 2014, 5(5):697-710.
[4] Fang Q, Wang J, Wang L, et al. Attenuation of inflammatory response by a novel chalcone protects kidney and heart from hyperglycemia-induced injuries in type 1 diabetic mice[J]. Toxicol Appl Pharmacol, 2015, 288(2): 179-191.
[5] Luedde M, Lutz M, Carter N, et al. RIP3, a kinase promoting necroptotic cell death, mediates adverse remodelling after myocardial infarction[J]. Cardiovasc Res, 2014, 103(2):206-216.
[6] Liu ZY, Wu B, Guo YS, et al. Necrostatin-1 reduces intestinal inflammation and colitis-associated tumorigenesis in mice[J]. Am J Cancer Res, 2015, 5(10): 3174-3185.
[7] Eisen A, Fisman EZ, Rubenfire M, et al. Ischemic preconditioning: nearly two decades of research. A comprehensive review[J]. Atherosclerosis, 2004, 172(2):201-210.
[8] 孟繁学, 焦晓慧, 韩大英. ATP敏感钾通道在心血管系统中的作用[J]. 中国病理生理杂志, 2000, 16(1): 94-96.
[9] Sierra A, Zhu Z, Sapay N, et al. Regulation of cardiac ATP-sensitive potassium channel surface expression by calcium/calmodulin-dependent protein kinase II[J]. J Biol Chem, 2013, 288(3):1568-1581.
[10]Zhao W, Zhang J, Lu Y, et al. The vasorelaxant effect of H2S as a novel endogenous gaseous KATPchannel opener[J]. EMBO J, 2001, 20(21): 6008-6016.
[11]Xu W, Wu W, Chen J,et al. Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J]. Int J Mol Med,2013, 32(4):917-925.
[12]Xu W, Chen J, Lin J, et al. Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J]. Int J Mol Med, 2015, 35(1): 177-186.
[13]梁伟杰, 陈景福, 张稳柱, 等. ATP敏感性钾通道在硫化氢抑制高糖引起的心肌细胞损伤中的作用[J]. 中国病理生理杂志, 2015, 31(5):785-790.
[14]梁伟杰, 何洁仪, 张稳柱, 等. 硫化氢通过抑制坏死性凋亡对抗高糖引起的H9c2心肌细胞损伤[J]. 中国病理生理杂志, 2016, 32(3):385-391.
[15]Huang CY, Kuo WT, Huang YC, et al. Resistance to hypoxia-induced necroptosis is conferred by glycolytic pyruvate scavenging of mitochondrial superoxide in colorectal cancer cells[J]. Cell Death Dis, 2013, 4:e622.
[16]Tay AS, Hu LF, Lu M, et al. Hydrogen sulfide protects neurons against hypoxic injury via stimulation of ATP-sensitive potassium channel/protein kinase C/extracellular signal-regulated kinase/heat shock protein 90 pathway[J]. Neuroscience, 2010, 167(2):277-286.
[17]Bian JS, Yong QC, Pan TT, et al. Role of hydrogen sulfide in the cardioprotection caused by ischemic preconditioning in the rat heart and cardiac myocytes[J]. J Pharmacol Exp Ther, 2006, 316(2):670-678.
(责任编辑: 林白霜, 罗 森)
Role of ATP-sensitive potassium channels in inhibitory effect of hydrogen sulfide on high glucose-induced inflammation mediated by necroptosis in H9c2 cardiac cells
LIANG Wei-jie1, 2, CHEN Mei-ji3, HE Jian-hua4, ZHANG Wen-zhu1, 2, CHENG Fei5, 6, LAN Jun5, 6, FENG Jian-qiang5, 6, HUANG Hui-min1, 2
(1DepartmentofCardiology,CentralHospitalofPanyuDistrict,2CardiovascularInstituteofPanyuDistrict,Guangzhou511400,China;3DepartmentofPediatrics,HuangpuDivision,TheFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510700,China;4DepartmentofCardiology,ShiqiPeople’sHospitalofPanyuDistrict,Guangzhou511450,China;5DepartmentofCardiology,TheThirdPeople’sHospitalofDongguanCity,6CardiovascularInstituteofDongguanCity,Dongguan523326,China.E-mail: 9090430@qq.com)
AIM: To investigate the role of ATP-sensitive potassium (KATP) channels in the inhibitory effect of hydrogen sulfide (H2S) on high glucose(HG)-induced inflammation mediated by necroptosis in H9c2 cardiac cells.METHODS: The expression levels of receptor-interacting protein 3 (RIP3; an indicator of necroptosis) and cyclooxyge-nase-2 (COX-2) were determined by Western blot. The levels of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) were detected by ELISA.RESULTS: After H9c2 cardiac cells were treated with 35 mmol/L glucose (HG) for 24 h, the expression of RIP3 was significantly increased. Pre-treatment of the cells with 100 μmol/L diazoxide (DZ; a KATPchannel opener) or 400 μmol/L NaHS (a donor of H2S) for 30 min considerably blocked the up-regulation of RIP3 induced by HG. Moreover, pre-treatment of the cells with 100 μmol/L 5-hydroxydecanoic acid (5-HD; a KATPchannel blocker) attenuated the inhibitory effect of NaHS on HG-induced up-regulation of RIP3. On the other hand, co-treatment of the cells with 100 μmol/L necrostatin-1 (a specific inhibitor of necroptosis) or pre-treatment of the cells with 100 μmol/L DZ or 400 μmol/L NaHS attenuated HG-induced inflammatory responses, evidenced by decreases in the expression of COX-2 and secretion levels of IL-1β and TNF-α. However, pre-treatment of the cells with 100 μmol/L 5-HD significantly attenuated the above anti-inflammatory effects of NaHS.CONCLUSION: KATPchannels play an important role in the inhibitory effect of H2S on HG-induced inflammation mediated by necroptosis in H9c2 cardiac cells.
ATP-sensitive potassium channel; Hydrogen sulfide; Necroptosis; High glucose; Cardiomyocyte; Inflammation
1000- 4718(2016)08- 1364- 06
2016- 04- 05
2016- 05- 06
广东省自然科学基金资助项目(No. 2015A030313690);番禺区科技计划项目(No. 2015-Z03-57)
R363
A
10.3969/j.issn.1000- 4718.2016.08.004
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 020-34859342; E-mail: 9090430@qq.com

