生物素-亲和素桥接系统在骨组织工程中的应用
冯自豪, 李 伟, 刘家祺, 亓发芝
复旦大学附属中山医院整形外科, 上海 200032
·论著·
生物素-亲和素桥接系统在骨组织工程中的应用
冯自豪, 李伟, 刘家祺, 亓发芝*
复旦大学附属中山医院整形外科, 上海200032
[摘要]目的: 观察生物素-亲和素桥接系统(avidin-biotin binding system,ABBS)对骨组织工程中种子细胞与支架材料黏附的影响,探讨ABBS在骨组织工程的作用。方法: 以脂肪来源干细胞(adipose-derived stem cells,ADSCs)作为种子细胞、β磷酸三钙(β-tricalcium phosphate,β-TCP)作为支架材料建立组织工程骨模型。实验分为两组,对照组:ADSCs与多孔β-TCP支架复合物结合;实验组:ABBS修饰的ADSCs与多孔β-TCP支架复合物结合。通过免疫荧光以及流式细胞仪检测ADSCs生物素化的效率。计算并比较两组的细胞黏附率;在扫描电镜下观察 ADSCs与多孔β-TCP支架黏附的表面情况。结果: 生物素化的ADSCs荧光染色显示生物素结合部位在细胞胞质,且流式细胞仪检测提示生物素化细胞阳性率为95%。ADSCs与多孔β-TCP支架复合物结合10 min、30 min、60 min、12 h、24 h时,对照组和实验组的细胞黏附率分别为(2.31±0.14)%和(21.75±4.69)%、 (11.96±2.53)%和(54.82±12.37)%、(33.48±9.51)%和(78.69±15.65)%、 (78.29±10.63)%和(95.46±7.38)%、(94.79±10.42)%和(98.13±1.45)%。生物素化的 ADSCs 与亲和素化多孔β-TCP 支架材料的黏附效果在10 min、30 min、60 min、12 h 4个时间点明显高于未修饰的 ADSCs 与多孔β-TCP 支架的黏附效果(P<0.05)。电镜下观察,ABBS组与对照组无明显差别。结论: ABBS可以促进ADSCs在支架上早期黏附,有利于细胞增殖,并且对组织工程骨的生物相容性无明显影响。
[关键词]骨组织工程;生物素-亲和素桥接系统; 脂肪来源干细胞;β-磷酸三钙支架
较大的骨缺损一直是修复重建领域的难题。20世纪80年代,骨组织工程概念的提出为解决这一临床问题提供了新的思路和方法。种子细胞与生物支架结合构建的组织工程骨可以促进骨修复,而两者的紧密黏附是细胞间信息传递的基础,对细胞的增殖、表型的表达、细胞外基质的合成具有重要作用。因此,这也成为构建组织工程骨的首要关键步骤。近年来发展迅速的生物素-亲和素桥接系统(avidin-biotin binding system,ABBS)已广泛应用于分子生物学研究中,生物素和亲和素的非共价键结合使ABBS成为目前已知最强的一种结合粘连系统[1]。据此,本研究以脂肪来源干细胞(adipose-derived stem cells,ADSCs)作为种子细胞[2]、β-磷酸三钙(β-tricalcium phosphate,β-TCP)作为支架材料[3]建立组织工程骨模型,以ABBS修饰ADSCs,探讨ABBS对细胞黏附于生物支架的促进作用。
1材料与方法
1.1实验仪器及试剂恒温加热器(上海实验仪器厂有限公司),CKX41光学显微镜、倒置相差显微镜(日本Olympus公司),NOVA 扫描电子显微镜(美国FEI公司),荧光倒置显微镜(德国Leica公司),CS-101 电热干燥箱(重庆试验仪器设备厂),低温离心机(德国Eppendorf公司),电子精密天平(型号:FA2004,上海精密科学仪器有限公司),垂直层流洁净工作台(型号:CA-1390-1,上海上净净华设备有限公司)。0.25%胰酶-0.02%EDTA(上海试剂公司),PBS、DMEM、FBS(美国Gibco公司),地塞米松、抗坏血酸、吲哚美辛、L-谷氨酰胺、DMSO均购自美国Sigma公司,生物素、亲和素均购自美国Pierce公司。
1.2实验材料及动物新西兰大白兔1只(由复旦大学医学院实验动物科学部提供),雄性,6个月龄,体质量 2.5 kg 。取新西兰大白兔双侧腹股沟处脂肪组织,提取兔ADSCs。将纳米级多孔β-TCP支架材料制备成5 mm×5 mm×4 mm大小,置于24孔板中备用。
1.3实验方法
1.3.1ADSCs的生物素化处理将ADSCs置于 CO2培养箱中培养,吸除培养基并用PBS洗涤贴壁细胞2次,加入0.25%胰蛋白酶-0.02%EDTA 混合消化液 1~1.5 mL,吸去消化液,立即用含10%FBS的DMEM-F12(1∶1)完全培养基终止消化。将细胞悬液收集到离心管中,1 000 r/min离心5 min,弃上清,按1∶4进行传代培养,吸去瓶内残留培养液,用37℃的PBS清洗 2 次后,吸去残余液体,加入已临时配制好的生物素(3-Sulfo-NHS-Biotin)溶液(0.5 mg/mL)2 mL,轻轻摇晃后将培养瓶置于 CO2培养箱中孵育30 min。
1.3.2β-TCP支架材料的亲和素化处理将支架材料浸于 75%乙醇中过夜,取出后用 PBS 反复冲洗 3 次,晾干备用。将材料分为两组,实验组:支架材料浸于配制好的亲和素溶液(2 mg/mL)中,并于常温下孵育 2 h;对照组:支架材料浸于PBS中常温下孵育 2 h。孵育结束后,用 PBS 清洗 3~5 min,无菌保存备用。
1.3.3细胞黏附试验实验组:生物素化 ADSCs加亲和素化β-TCP 支架;对照组: ADSCs加β-TCP 支架。将2 mL密度为 1×106/mL 的ADSCs细胞悬液种植于支架材料表面, 并充分摇匀;从将细胞悬液加入材料表面开始计时,分别在10 min、30 min、1 h、12 h和 24 h,取出支架材料,于 2 mL PBS 中轻轻漂洗,去除表面未黏附的细胞, 用 0.25%胰蛋白酶-0.02%EDTA 混合消化液2 mL消化表面黏附的细胞。
1.4观察指标和检测指标
1.4.1ADSCs生物素化鉴定将未经生物素化处理的细胞作为对照。将生物素处理的细胞及对照组未处理细胞分别用 37℃ PBS轻轻清洗2遍,然后用 4%多聚甲醛固定 30 min,PBS 清洗 3~5 min,再用 avidin-FITC (1∶64)常温下孵育 5 min,然后 PBS 清洗 3~5 min,最后用 DAPI (5 μg/mL)复染细胞核,室温下孵育20 min,孵育结束后,用 PBS 清洗3~5 min。最后用封片液封片,立即于异硫氰酸荧光素(FITC)荧光显微镜下观察绿色荧光分布情况,并用流式细胞仪检测生物素化阳性率。
1.4.2细胞黏附率检测用细胞计数板计数PBS与混合消化液中的细胞,计算10 min、30 min、1 h、12 h和24 h的细胞黏附率。每组每个时间点各取3个标本检测。
1.4.3细胞-支架材料复合物相容性观察培养第1、4、7天肉眼观察实验组与对照组细胞-支架材料复合物的颜色、形状、表面情况。并于扫描电镜下观察,观察种子细胞在支架材料上的聚集、附着及生长情况。
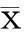
2结果
2.1ADSCs的生物素化鉴定经生物素化处理的ADSCs用avidin-FITC(1∶64)常温下孵育 5 min后,在荧光显微镜下观察发现细胞呈绿色,显示 ADSCs 细胞生物素化(图1A)。经流式细胞仪检测, ADSCs 细胞生物素化阳性率为 95%(见图1B)。

图1 ADSCs 的生物素化鉴定A:ADSCs生物素化处理后经 avidin-FITC 免疫荧光染色(×500); B: ADSCs 生物素化处理后经流式细胞仪检测, 灰色峰代表100%阳性对照,而红色峰代表ADSC生物素化鉴定的结果
2.2ADSCs与β-TCP以及 ABBS修饰后ADSCs与β-TCP 在不同时间点的黏附率将ADSCs细胞悬液种植于支架材料表面10 min、30 min、60 min、12 h、24 h时,对照组和实验组的黏附率分别为 (2.31±0.14)%和(21.75±4.69)%、(11.96±2.53)%和(54.82±12.37)%、(33.48±9.51)%和(78.69±15.65)%、(78.29±10.63)%和(95.46±7.38)%、(94.79±10.42)%和(98.13±1.45)%,前 4 个时间点两组间差异均有统计学意义(P<0.05),24 h时两组差异无统计学意义,见图2。
2.3细胞-支架材料复合物的观察刚接种兔ADSCs 的细胞-支架材料复合物呈粉红色,表面湿润。培养第 1、 4、 7 天,复合物颜色无明显变化,组间无明显差异。
细胞-支架材料复合物的扫描电镜观察:兔ADSCs接种多孔β-TCP 支架材料第1天,表面可见细胞附着,呈簇状聚集,顺应材料粗糙表面,未向周围伸展,支架材料孔隙内尚未见细胞生长;接种第4天,可见细胞紧密贴附于材料表面,孔隙内可见细胞生长;第7天,细胞充分伸展,相互连接,孔隙内观察到细胞生长,并可见部分细胞外有形成分填充支架材料的小孔,提示细胞外基质的产生(图3A、3B)。 电镜下观察显示,ABBS修饰后的ADSCs与β-TCP支架材料复合物与未经修饰的细胞-支架材料复合物无明显差别(图3 C、3D)。

图2 ADSCs 与β-TCP 以及 ABBS 修饰后 ADSCs 与β-TCP 在不同时间点的黏附率测定 *P<0.05与β-TCP相比;n=3,±s

图3 扫描电镜下观察ADSCs或ABBS 修饰后的ADSCs接种于β-TCP 支架材料复合物扫描电镜下观察A:ADSCs 与β-TCP 共培养 7 d(×1 000);B:ADSCs 与β-TCP共培养 7 d(×1 200);C: ABBS 修饰后 ADSCs 与β-TCP 共培养 7 d(×1 000);D: ABBS 修饰后 ADSCs 与β-TCP 共培养 7 d(×1 200)
3讨论
骨组织工程的关键步骤是种子细胞在支架上的黏附,直接将细胞悬液滴加到支架材料上是其常用的方法。尽管这种方式简便易行并已沿用多年,但存在细胞接种效率低、细胞分布不均匀的问题,导致组织工程骨质量下降,严重影响修复效果。提高种子细胞和支架之间的黏附力已经成为当前骨组织工程学迫切需要解决的问题。
有学者期望通过模仿生理情况下的细胞黏附机制,提高骨组织工程中种子细胞和支架的黏附能力。整合素是一类位于细胞表面的黏附性受体分子,属于异二聚体跨膜糖蛋白家族之一,是介导细胞与细胞外基质及细胞与细胞之间黏附的主要细胞表面受体。Jeschke等[4]通过应用整合素提高黏附能力来增加细胞结合的效率。在正常组织中,细胞和细胞外基质的黏附是通过细胞膜上的受体和细胞外基质中的纤连蛋白结合而完成的,已有学者将经纤连蛋白预处理的支架应用于组织工程研究[5]。
ABBS是近年来发展迅速的一门生物学技术[6-7]。生物素广泛分布于动、植物组织中,以卵黄和肝组织中含量较高,相对分子质量为244.31。亲和素又称抗生物素或卵白素,是从卵白蛋白中提取的一种由4个相同亚基组成的碱性糖蛋白。此外,阿维丁链霉菌(Streptomycesavidini, ATCC编号:27 419 )在生长过程中可分泌产生链霉亲和素(Streptavidin,SA)。亲和素相对分子质量为 68 000, 等电点(pI)为10.5,耐热,并耐受多种蛋白水解酶的作用。ABBS具有高灵敏度、高特异性、高稳定性和适用性。生物素易与蛋白质和核酸类等生物大分子结合,形成生物素衍生物,不仅能保持大分子物质的原有生物活性,并且具有多价性[8]。亲和素与生物素间的结合具有极高的亲和力,其反应呈高度特异性,不增加非特异性干扰,也不会因反应试剂浓度的不同而受影响。酸、碱、变性剂及有机溶剂均不会影响亲和素与生物素的结合力。ABBS的桥接作用: 生物素和亲和素都可偶联蛋白质、核酸、多糖和酶等各类生物活性物质,而且同时能与物理材料相结合。因此,有学者将 ABBS 技术应用于偶联内皮细胞和人工血管支架材料,内皮细胞的黏附率显著增高,在支架上所绑定的细胞数提高了 7.5 倍[9]。另有学者将 ABBS 技术用于黏合肝脏细胞和支架材料,发现肝脏细胞在10 min内便能够与生物支架材料结合,而且 ABBS 对肝细胞的分泌功能和跨膜信号的传递能力无影响[10]。
近年来,ABBS用于改善种子细胞在支架材料的黏附已有相关的报道。 ABBS 是一种不同于粘连蛋白-受体系统的新型粘连系统,是目前已知的最强的非共价键结合方式之一。一个亲和素分子可以与4个生物素分子结合,其亲和力可达1015M-1, 而粘连蛋白-受体系统的亲和力仅为 106M-1。Kuo等[11]将ABBS应用于组织工程,发现其可使种子细胞在支架材料表面的黏附力提高至少 2~3 倍。ABBS 的另一优点是结合速度非常快。国外有研究[12]报道,1 h内可有超过 70%的生物素化种子细胞黏附于亲和素处理过的材料表面,而仅有32%的未生物素化的种子细胞黏附于未经处理的材料表面。另有研究[13]报道,ABBS 在 10 min内即可显著促进种子细胞牢固地黏附于支架材料表面。关于利用 ABBS 系统是否能够有效促进 ADSCs 在多孔β-TCP 支架材料上的黏附,目前尚未见文献报道。
本实验采用 ABBS 接种方式使ADSCs与多孔β-TCP支架黏附,结果发现10 min、30 min、1 h、12 h和24 h对照组与实验组的黏附率分别为(2.31±0.14)%和(21.75±4.69)%、 (11.96±2.53)%和(54.82±12.37)%、 (33.48±9.51)%和(78.69±15.65)%、 (78.29±10.63)%和(95.46±7.38)%, (94.79±10.42)%和(98.13±1.45)%,前 4个时间点两组间有显著差异,24 h时两组差异无统计学意义,说明生物素化的 ADSCs 与亲和素修饰的β-TCP 支架材料间的细胞黏附效果在早期(12 h以内)明显优于未修饰的 ADSCs 和多孔β-TCP 支架。因此生物素-亲和素系统可以促进 ADSCs 在支架上的早期黏附,有利于细胞增殖。但 24 h 两组细胞黏附率无显著差异, 说明ABBS 仅有促进早期黏附的功能;而晚期两组黏附率差异性不大,可能与细胞的总量相关,在黏附后期,未黏附的细胞越来越少,两组间差异也因此越来越不明显。
在生物相容性实验中对细胞-支架材料复合物进行扫描电镜观察之前,需要对样品进行处理,其中用到临界点干燥法也即在无气液界面、无表面张力的临界状态下干燥细胞-支架材料复合物。因为不存在表面张力,所以不会引起细胞皱缩和变形,能够较好地保存样品的超微结构。操作中,以醋酸异戊酯作为脱水剂和置换剂,压力接近 1.013 2×107Pa(100 个大气压),否则容易导致实验失败。
无论是三维的多孔支架材料还是传统的二维材料,最先与组织细胞发生接触的是材料表面。因此细胞材料表面的黏附性非常重要,影响细胞的增殖、分化等生物学行为。通过扫描电镜的观察可以看出,兔 ADSCs 可以在纳米级多孔β-TCP 支架材料的表面附着,随着时间推移,可以向孔隙内生长,并在第7天分泌细胞外基质,证明支架材料与细胞的相容性好。一般情况下,细胞沿着材料表面的突起部分或纹理进行取向和迁移,这一现象称为接触诱导。细胞取向的程度取决于表面沟槽的深度与宽度,且与细胞种类有很大关系。实验中发现,细胞呈长梭状伸展,但材料表面形态为随机的凹凸相间的粗糙结构,这种细胞形态可能是由兔ADSCs本身的特性和材料特征共同决定的。
骨组织缺损是临床上常见的病症,而组织工程骨的构建对其治疗有重大意义。如何促进种子细胞与支架材料之间的黏附、结合成为目前相关研究的一大热点。我们的实验证实,ABBS可以促进ADSCs在支架上的早期黏附,有利于细胞增殖,并且对组织工程骨的生物相容性无明显影响。尽管目前仍有大量工作需要完成,仍有诸多问题需要探讨,但随着干细胞理论、材料学、细胞生物学的发展,随着组织工程学治疗策略的提出和不断完善,ABBS在组织工程及临床修复重建领域的应用将有广阔的研究前景。
参考文献
[1]孔令青,李勇,高洪,等. 生物素-亲和素标记技术[J]. 动物医学进展, 2008, 29(4):100-102.
[2]Maumus M, Peyrafitte JA, D’Angelo R, et al. Native human adipose stromal cells:localization,morphology and phenotype[J]. Int J Obes(Lond),2011,35(9):1141-1153.
[3]Wang W, Liu GJ, Xie XY, et al. Development and evaluation of lipid microbubbles targeted to alpha(v)beta(3)-integrin via biotin-avidin bridge[J]. J Microencapsul,2012,29(2):177-184.
[4]Jeschke B, Meyer J, Jonczyk A,et al. RGD-peptides for tissue engineering of articular cartilage [J]. Biomaterials, 2002, 23(16):3455-3463.
[5]陈希哲,杨连甲,付崇建,等. 含孔磷酸钙陶瓷复合自体成骨细胞骨组织工程大鼠模型的构建[J]. 中华实验外科杂志, 2002,19(5): 460-461.
[6]Dou XQ, Zhang J, Feng C.Biotin-avidin based universal cell-matrix interaction for promoting three-dimensional cell adhesion[J]. ACS Appl Mater Interfaces, 2015,7(37): 20786-20792.
[7]Zhang Y, Zhao Y, Lu S,et al. A high-throughput biotin-avidin-ELISA for studying expression of platelet membrane glycoproteins and its clinical application[J]. Tohoku J Exp Med, 2010, 222(1):83-88.
[8]Zhang W, Su P, Yang Y,et al. Development of a sensitive biotin-avidin amplified enzyme-linked immunosorbent assay for the determination of ketamine in biological samples[J] . J Immunoassay Immunochem, 2010,31(3): 205-216.
[9]Chan BP, Reichert WM, Truskey GA. Effect of strept- avidin-biotin on endothelial vasoregulation and leukocyte adhesion [J]. Biomaterials, 2004,25(18): 3951-3961.
[10]Kojima N, Matsuo T, Sakai Y. Rapid hepatic cell attachment onto biodegradable polymer surfaces without toxicity using an avidin-biotin binding system [J].Biomaterials, 2006, 27(28):4904-4910.
[11]Kuo YC, Ku IN. Effects of gel concentration, human fibronectin, and cation supplement on the tissue-engineered cartilage [J]. Biotechnol Prog, 2007, 23(1):238-245.
[12]Tsai WB, Wang PY, Chang Y, et al. Fibronectin and culture temperature modulate the efficacy of an avidin—biotin binding system for chondrocyte adhesion and growth on biodegradable polymers [J]. Biotechnol Bioeng, 2007,98(2): 498-507.
[13]Tsai WB, Wang MC. Effect of an avidin-biotin binding system on chondrocyte adhesion, growth and gene expression [J]. Biomaterials, 2005, 26(16):3141-3151.
[本文编辑]姬静芳
Application of avidin-biotin binding system in bone tissue engineering
FENG Zi-hao, LI Wei, LIU Jia-qi, QI Fa-zhi*
Department of Plastic and Reconstructive Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China
[Abstract]Objective: To observe the effect of avidin-biotin binding system(ABBS) to the adhesion between seed cells and scaffolds in bone tissue engineering, and investigate the role of ABBS in bone tissue engineering. Methods: We used adipose-derived stem cells (ADSCs) as seed cells and β-tricalcium phosphate (β-TCP) as scaffolds to establish tissue engineering bone, which was modified by ABBS. We used immunofluorescence and flow cytometry to test the efficiency of biotinylated ADSCs. The materials were divided into ABBS group (ADSCs and β-TCP modified by ABBS) and control group, and we tested the adhesion efficiency of both groups. We used scanning electron microscopy to detect the biocompatibility of ADSCs with the porous β-TCP scaffolds (control group) and the ABBS-modified porous β-TCP scaffolds (experimental group). Results: Biotinylated ADSCs staining showed that the biotin binding sites were in the cell cytoplasm, and flow cytometry showed that the rate of biotinylated positive cells was 95%. At different time points (10 min, 30 min, 60 min, 12 h, 24 h), the adhesion rates of control group vs ABBS group were (2.31±0.14)% vs (21.75±4.69)%, (11.96±2.53)% vs (54.82±12.37)%, (33.48±9.51)% vs (78.69±15.65)%, (78.29±10.63)% vs (95.46±7.38)%, and (94.79±10.42)% vs (98.13±1.45)%, respectively. The adhesion rate of the ABBS group during the early stages (10 min, 30 min, 60 min, 12 h) were much higher. There was no much difference between the two groups under scanning electron microscopy. Conclusions: ABBS can promote the adhesion of ADSCs on scaffolds during the early stage, which is good for cell proliferation, and has no obvious effect on the biocompatibility of tissue engineered bone.
[Key Words]bone tissue engineering; avidin-biotin binding system; adipose-derived stem cells; β-tricalcium phosphate scaffolds
[中图分类号]R 681
[文献标志码]A
[作者简介]冯自豪,主治医师. E-mail: feng.zihao@zs-hospital.sh.cn*通信作者(Corresponding author). Tel: 021-64041990-2575, E-mail: qi.fazhi@zs-hospital.sh.cn
[收稿日期]2015-12-12[接受日期]2016-03-10

