茉莉酸甲酯和生长素对苦玄参苷积累的影响
何志鹏 闫国跃 谢阳姣 李耀燕
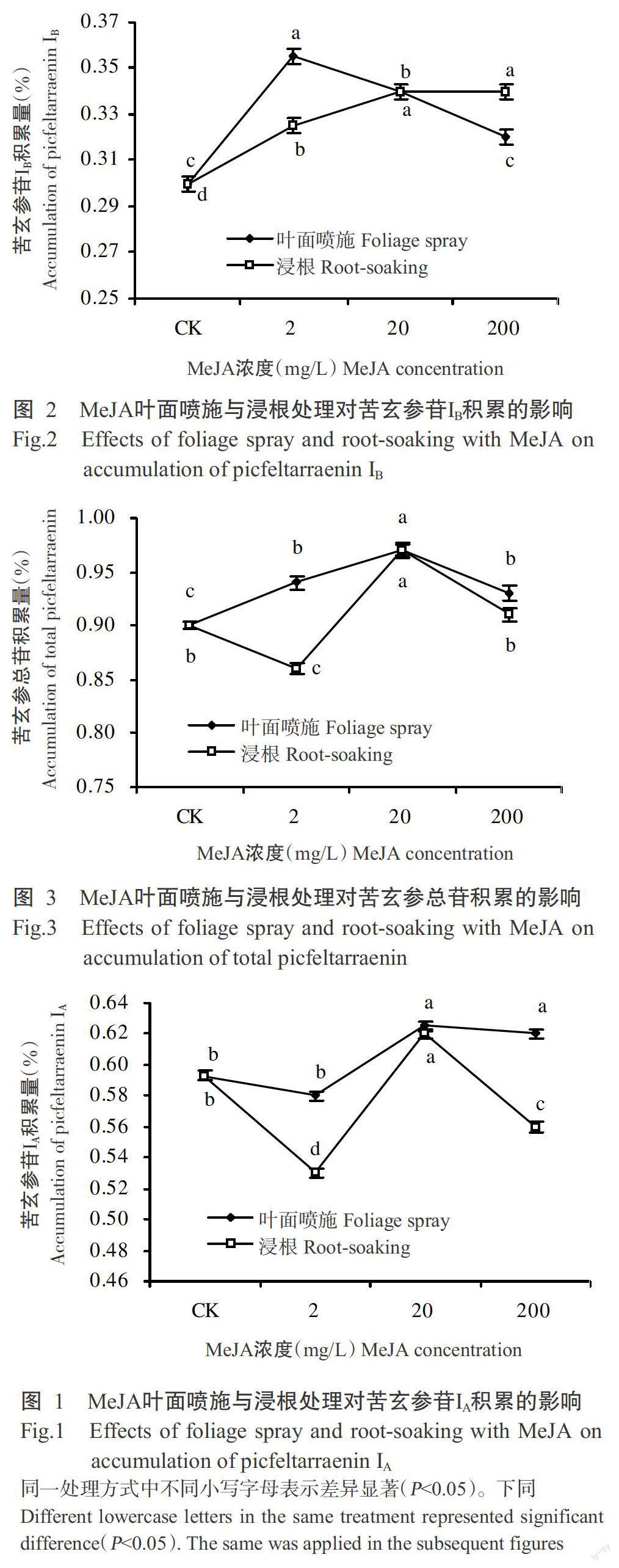
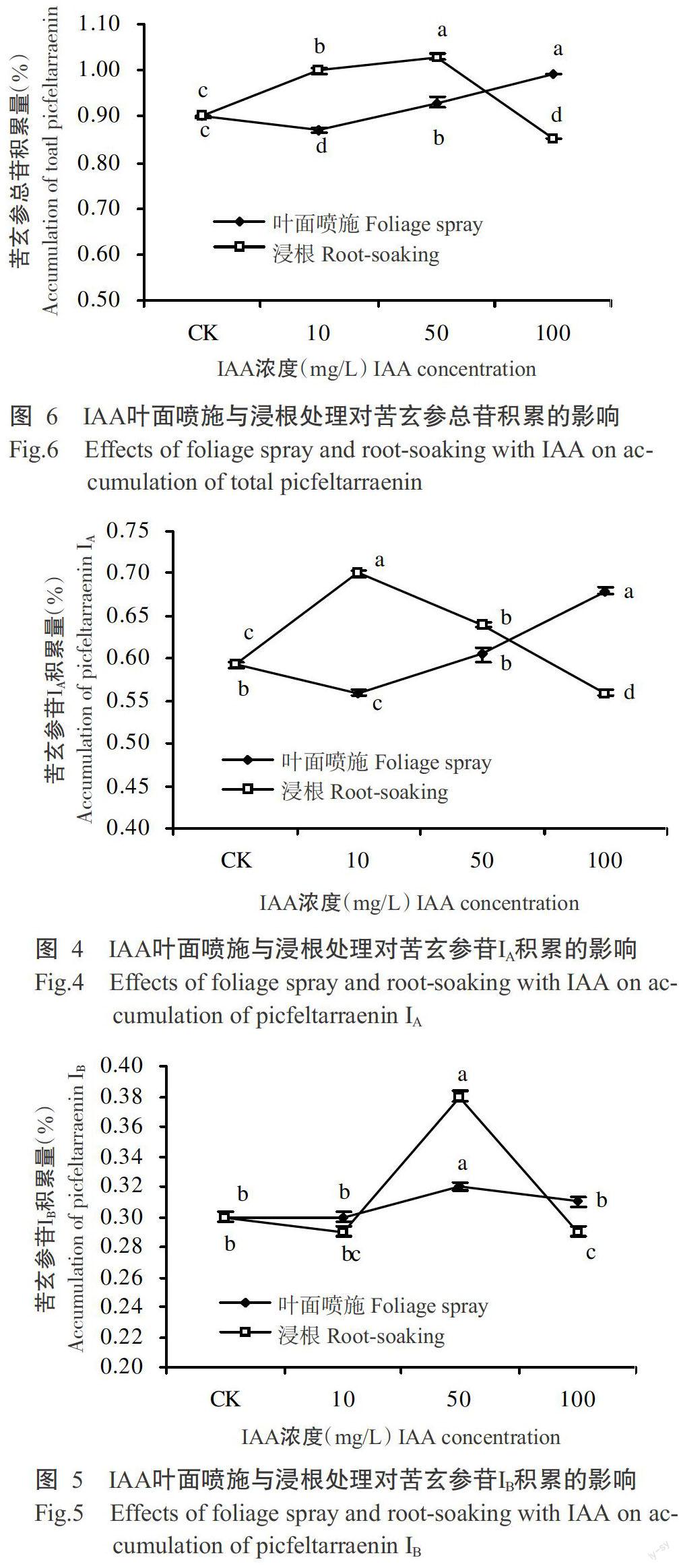
摘要:【目的】研究植物生长调节物质对人工种植苦玄参中苦玄参苷积累的影响,为苦玄参人工种植化学调控措施的制定提供参考。【方法】采用不同浓度的茉莉酸甲酯(MeJA)和生长素(IAA)对苦玄参植株进行叶面喷施和浸根处理,测定其苦玄参苷IA、IB及苦玄参总苷积累量。【结果】MeJA叶面喷施和浸根处理均以20 mg/L对苦玄参苷IA的调控效果最佳,此时苦玄参苷IA积累量最高,分别达0.63%和0.62%,均显著高于清水对照(CK)(P<0.05,下同)。2 mg/L MeJA叶面喷施对苦玄参苷IB的促进作用最强,随MeJA浓度增加其促进作用减弱;浸根处理时,随MeJA浓度增加其促进作用逐渐加强,至20 mg/L时苦玄参苷IB积累量达峰值0.34%。两种处理方式下,苦玄参总苷积累量均在MeJA濃度为20 mg/L时最高,叶面喷施整体优于浸根处理。IAA叶面喷施时,随其浓度增加,苦玄参苷IA积累量先降低后升高,浓度为100 mg/L时苦玄参苷IA积累量最高,达0.68%,显著高于CK和其他浓度处理;浸根处理时,苦玄参苷IA积累量的变化趋势与叶面喷施相反,浓度为10 mg/L时促进作用最强,随IAA浓度增加苦玄参苷IA积累量逐渐降低。两种处理方式均以IAA 50 mg/L对苦玄参苷IB的促进作用最强。IAA对苦玄参总苷积累量的影响与其对苦玄参苷IA的影响趋势相似,叶面喷施时100 mg/L的促进作用最强,浸根处理则以50 mg/L时苦玄参总苷积累量最高。两种处理方式相比,IAA浸根处理优于叶面喷施。【结论】MeJA和IAA均可通过叶面喷施和浸根处理促进苦玄参苷的积累,其中,MeJA宜选择20 mg/L进行叶面喷施, IAA宜选择50 mg/L进行浸根处理。
关键词: 茉莉酸甲酯;生长素;苦玄参苷;积累
中图分类号: S567.53 文献标志码:A 文章编号:2095-1191(2016)09-1470-05
Abstract:【Objective】The present study was conducted to investigate the impact of methyl jasmonate(MeJA) and indole-3-acetic acid(IAA) on accumulation of picfeltrarraenins in planted Picria felterrae Lour. individuals, in order to provide a reference for development of chemical regulation measures for planted individuals of the species. 【Method】Different concentrations of MeJA and IAA solutions were sprayed onto leaf surface and soaked roots of P. felterrae Lour. individuals, and accumulated amount of picfeltrarraenin IA and IB and total picfeltrarraenins were measured. 【Result】When the concentration of MeJA solution was 20 mg/L, the strongest regulative effect on picfeltrarraenin IA was achieved for both foliage spray and root soaking, the accumulative amount of picfeltrarraenin IA reaching the maximum levels, 0.63% and 0.62% respectively, significantly higher than that induced by clean water control(CK)(P<0.05, the same below). MeJA at 2 mg/L showed the strongest stimulative effect on accumulation of picfeltrarraenin IB, and this effect became weakened as the concentration increased; as regards root soaking, the promoting effect strengthened with increase in MeJA concentration, and accumulative amount of picfeltrarraenin IB reached the highest level 0.34% when concentration was 20 mg/L. The accumulative amount of total picfeltrarraenins reached the highest level when the MeJA concentration was 20 mg/L for both treatments, the overall effect of foliage spray was better than that of root soaking. For foliage spray with IAA solution, accumulative amount of picfeltrarraenin IA decreased firstly and then increased as concentration of IAA solution increased, and reached the maximum level 0.68% at 100 mg/L which was significantly higher than that induced by other concentrations and CK. For root soaking with IAA solution, accumulation of picfeltrarraenin IA showed a reverse trend relative to that for foliage spray, and stimulative effect of IAA reached the maximum level at 10 mg/L of IAA, accumulation of picfeltrarraenin IA dropped as IAA concentration increased. Both foliage spray and root soaking showed the strongest stimulative effect on accumulation of picfeltrarraenin IB at 50 mg/L of IAA. The effect of IAA on total picfeltrarraenins accumulation was similar to its effect on picfeltrarraenin IA, the stimulative effect reaching the highest level(i.e. the content of total picfeltrarraenins accumulation was at its peak) at 100 mg/L for foliage spray and at 50 mg/L for root soaking. Root soaking with IAA solution was better than foliage spray. 【Conclusion】Both MeJA and IAA can stimulate accumulation of picfeltrarraenins via foliage spray or root soaking. The best stimulative effect may be achieved when 20 mg/L of MeJA is used through foliage spray or 50 mg/L of IAA via root soaking.
Key words: methyl jasmonate(MeJA); indole-3-acetic acid(IAA); picfeltarraenin; accumulation
0 引言
【研究意义】苦玄参药材为玄参科植物苦玄参(Picria felterrae Lour.)的干燥全草(国家药典委员会,2015),具有消肿止痛、抗菌、消炎、镇痛等作用(王奇志等,2010;曾金强等,2010;陈君等,2013),在广西作为药用已有200多年的历史(蒋妮等,2013),是妇炎净胶囊、万通炎康片等知名中成药的主要原料之一。苦玄参主要药效成分为苦玄参苷IA和IB(王力生,2004),其含量是评价苦玄参药材优劣的重要指标。由于苦玄参野生资源随着环境的破坏越来越少,人工种植成为苦玄参药材的主要来源,但苦玄参经人工种植后苦玄参苷IA和IB含量普遍降低,药材质量下降。提高苦玄参苷IA和IB的含量,是保证人工种植苦玄参药材质量的关键。化学调控可显著促进许多植物次生代谢物质的合成(任昂,2012;朱宏涛等,2014),是提高人工种植药材药效成分含量的方法之一。因此,获得提高苦玄参苷含量的有效化控措施对人工种植苦玄参药材质量的提高具有重要意义。【前人研究进展】前人对苦玄参的生长条件、病虫害防治和抗逆性能等进行了大量研究(黄海连等,2013;蒋妮等,2013;谢阳姣和何志鹏,2013;谢阳姣等,2013),但在苦玄参药效物质含量的提高方面研究较少。化学调控措施是促进植物生长发育和提高植物次生代谢物质的一条重要途径,在促进药用植物生长和提高药效物质含量方面已被广泛应用。谢阳姣和何志鹏(2013)采用乙烯利对苦玄参生长进行调控,发现乙烯利可显著促进苦玄参植株生长,提高苦玄参生物产量。生长素(IAA)作为一种重要的植物激素,可参与调节植物生长发育的许多过程(付伟等,2013;翟开恩,2014);茉莉酸甲酯(MeJA)广泛存在于植物体中,可作为信号转导分子激发植物防御基因的表达(丛汉卿等,2016),也对某些药用植物的主要药用成分,如大型药用真菌中的灵芝三萜苷(任昂,2012)、三七中的总皂苷(朱宏涛等,2014)的合成具有促进作用。谢阳姣等(2013)研究表明,MeJA对提高苦玄参的抗病虫、抗旱涝等逆境胁迫能力也具有重要作用。【本研究切入点】本课题组前期利用IAA调控苦玄参的生长,发现其效果较好,但IAA对苦玄参苷积累的影响尚未明确;MeJA对灵芝三萜苷等的合成具有调控作用,但对苦玄参苷的作用和施用措施等仍需进一步研究。【拟解决的关键问题】采用叶面喷施和浸根的处理方式,研究MeJA和IAA两种常用生长调节物质对苦玄参中苦玄参苷积累的影响,为提高人工种植苦玄参药材的药用活性物质寻求有效的化学调控措施,也为提高人工种植苦玄参药材的质量提供指导。
1 材料与方法
1. 1 试验材料
根据《中华人民共和国药典》(国家药典委员会,2010)规定,本研究以苦玄参种子种植后的全株作为试验材料。苦玄参种子由广西梧州中恒集团股份有限公司提供,为经该公司鉴定并长期种植的栽培种。
试验用植物生长调节剂为MeJA和IAA,均为化学纯,购于Sigma-Aldrich公司。
1. 2 试验方法
1. 2. 1 试验设计 (1)MeJA浓度及施用方式:参考前期预实验结果,设3个MeJA浓度,分别为2、20和200 mg/L,以清水为对照(CK),3次重复,共12个处理;每处理均采用叶面喷施和浸根2种施用方式(CK不进行叶面喷施处理),共21个处理。(2)IAA浓度及施用方式:参考前期预实验结果,设3个浓度,分别为10、50和100 mg/L,与(1)共用CK,3次重复,共9个处理;每处理均采用叶面喷施和浸根2种施用方式,共18个处理。
1. 2. 2 材料培养 2014年11月收集苦玄参种子,于2015年2月底播种,5月移栽(6片真叶,株高10 cm左右),7月收获。为排除土壤复杂系统对施用效果的干扰,试验材料采用水培方式进行培养。水培装置为定制的方形水管,内径20 cm,长度110 cm,孔径8 cm,每个培养箱22个孔径(株),每处理用1个培养箱。水培液为改良的霍格兰氏营养液,每10 d更换1次;水泵驱动水循环解決供氧问题。
1. 2. 3 处理方法 配制待试浓度的处理液,选择傍晚时施用。叶面喷施方式:以喷雾器喷湿叶片正反两面;浸根处理方式:将培养箱里的营养液换为处理液,处理时间为1 h,处理结束后用清水清洗1次,换营养液继续培养。IAA为移栽新根发根后15 d开始进行处理;MeJA为移栽新根发根后30 d开始进行处理;之后隔15 d后再处理1次,共处理2次。种植管理除待试因素外,其余为常规管理。所有试验材料收获后,悬挂阴干,粉碎过20目筛,封口袋密封待测。
1. 3 测定指标及方法
以苦玄参苷IA和IB及苦玄参总苷(苦玄参总苷为IA与IB之和)作为评价指标,苦玄参苷IA和IB测定方法参照《中华人民共和国药典》2010版(国家药典委员会,2010)的高效液相色谱法并进行优化。
仪器设备:Agilent 1260高效液相色谱仪。试剂:乙腈(色谱纯试剂),甲醇(分析纯试剂),水(超纯水,自制)。
色谱条件:色谱柱:Agilent ZORBAX SB-C18(4.6 mm×250.0 mm,5 μm);流动相∶乙腈—水(35∶65);检测波长:264 nm;柱温:35 ℃;流速:1.0 mL/min;进样量20 μL。
标准品:苦玄参苷IA和IB,购自中国药品生物制品检定所。
标准溶液的配制:精密称取苦玄参苷IA对照品5.17 mg、玄参苷IB对照品4.95 mg,分别置于25.0 mL容量瓶中,用甲醇溶解并定容至刻度,制成母液。从苦玄参苷IA和IB的母液中各量取2.5 mL置于5.0 mL容量瓶中,制成混合标准溶液。
待测样品提取和测定:取苦玄参全草粉末1 g,精密称定,置具塞锥形瓶中,精密加入60%甲醇25.0 mL,密塞,称定重量,超声30 min,冷却后再称定重量,用60%甲醇补足减失的重量,摇匀、过滤,取续滤液过0.45 μm微孔滤膜过滤。与标准溶液采用同样的色谱条件测定,外标一点法计算样品含量。
1. 4 统计分析
采用SPSS 13.0对数据进行统计分析,采用S-N-K方差法检验各处理差异显著性。
2 结果与分析
2. 1 不同浓度MeJA叶面喷施和浸根处理对苦玄参苷积累的影响
2. 1. 1 对苦玄参苷IA积累的影响 由图1可看出,以不同浓度MeJA处理苦玄参,叶面喷施对苦玄参苷IA积累的效果整体优于浸根处理。无论是叶面喷施还是浸根处理,均以20 mg/L的效果最佳,此时苦玄参苷IA的积累量最高,分别达0.63%和0.62%,均显著高于CK(P<0.05,下同);200 mg/L叶面喷施对苦玄参苷IA的积累也有促进作用,显著高于CK,但与20 mg/L处理无显著差异(P>0.05,下同);2和200 mg/L浸根处理对苦玄参苷IA的积累则表现为抑制作用。
2. 1. 2 对苦玄参苷IB积累的影响 由图2可看出,无论是叶面喷施还是浸根处理,不同浓度MeJA均可对苦玄参苷IB的积累产生促进作用。叶面喷施时,2 mg/L的促进作用最强,此时苦玄参苷IB积累量最高,达0.36%;随着MeJA浓度升高,促进作用减弱,至200 mg/L时苦玄参苷IB积累量与对照无显著差异。浸根处理时,随着MeJA浓度的增加,促进作用逐渐加强,至20 mg/L时苦玄参苷IB积累量达峰值(0.34%),浓度继续增加至200 mg/L时苦玄参苷IB积累量与20 mg/L处理无显著差异。由此可知,叶面喷施宜选择浓度2 mg/L、浸根处理宜选择浓度20 mg/L;与浸根处理相比,叶面喷施所需浓度较低,且最优浓度下苦玄参苷IB积累量最高,放叶面喷施方式为首选处理方式。
2. 1. 3 对苦玄参总苷积累的影响 由图3可看出,叶面喷施时,随MeJA浓度增加,苦玄参总苷积累量呈先升高后降低的趋势,其中浓度为20 mg/L时苦玄参总苷积累量达峰值,显著高于其他浓度处理和CK。浸根处理时,2 mg/L MeJA对苦玄参总苷积累有抑制作用,20和200 mg/L MeJA对苦玄参总苷积累有促进作用,且浓度为20 mg/L时苦玄参总苷积累量最高。两种处理方式相比,叶面喷施整体优于浸根处理。
2. 2 不同浓度IAA叶面喷施和浸根处理对苦玄参苷积累的影响
2. 2. 1 对苦玄参苷IA积累的影响 由图4可知,叶面喷施时,随IAA浓度增加,苦玄参苷IA积累量先降低后升高,IAA浓度为100 mg/L时苦玄参苷IA积累量最高,达0.68%,显著高于CK和其他浓度处理。浸根处理时,苦玄参苷IA积累量的变化趋势与叶面喷施相反,IAA浓度为10 mg/L时的促进作用最强,随IAA浓度增加,苦玄参苷IA积累量逐渐降低。与MeJA相反,IAA浸根处理方式较叶面喷施所需浓度较低,产生的苦玄参苷IA含量较高,两种方式应优先选择浸根处理。
2. 2. 2 对苦玄参苷IB积累的影响 由图5可看出,无论是叶面喷施还是浸根处理,均以50 mg/L对苦玄参苷IB的促进作用最强,显著高于CK和其他浓度处理。两种处理方式相比,浸根处理优于叶面喷施。
2. 2. 3 对苦玄参总苷积累的影响 由图6可看出,不同浓度IAA对苦玄参总苷积累量的影响与其对苦玄参苷IA的影响趋势相似。叶面喷施的促进作用随IAA浓度的增加而增大,100 mg/L的促进作用最强;浸根处理时苦玄参总苷积累量随IAA浓度的增加呈先增后减的变化趋势,50 mg/L时苦玄参总苷积累量达峰值,浓度继续增大至100 mg/L时则呈抑制作用。两种处理方式相比,浸根处理优于叶面喷施。
3 讨论
植物体内萜类化合物的合成受各种信号转导途径的调控,在信号转导过程中,植物内源激素扮演诱导子作用来诱导信号的转导(任昂,2012)。通过外施植物生长调节剂,可起到內源生长素的作用,进而促进化合物的合成。苦玄参苷为四环三萜苷类化合物,其合成的具体信号转导过程及受何种激素诱导仍不清楚。本研究选择常用植物生长调节剂MeJA和IAA处理苦玄参植株,探讨其对苦玄参苷积累的影响,结果表明,在一定浓度范围内,MeJA和IAA对苦玄参苷的积累均有促进作用。MeJA对苦玄参苷的促进作用与其对灵芝三萜苷(任昂,2012)、三七总皂苷(朱宏涛等,2014)的调节作用相似,同时还可促进苦玄参抵抗病虫害、干旱、水涝等逆境胁迫的能力(谢阳姣等,2013);而IAA作为一种重要的植物生长调节物质,在促进苦玄参植株生长的同时,对苦玄参苷的积累也有一定促进作用。
苦玄参苷的积累部位主要为苦玄参叶和花苞,根中几乎检测不到苦玄参苷,其主要合成部位应该在地上部分(陈君等,2007),根部是否适合进行化控处理则需进一步验证。本研究采用叶面喷施和浸根处理两种常用的施肥方式,结果显示,两种处理方式下,不同浓度的MeJA和IAA均可对苦玄参苷的积累产生影响,其调控作用随浓度的变化而不同。这可能是植物生长调节剂通过苦玄参根部吸收后被运输到地上部分,进而参与了诱导苦玄参苷合成的信号转导途径。由于植物生长调节剂对活性物质合成的促进作用受浓度限制,且不同生长调节剂对生命过程的调节方式不同,因此不同的处理方式均应选择适宜的浓度。本研究结果表明,MeJA宜采用叶面喷施处理,而IAA采用浸根处理方式更优。此外,本研究中植物培养采用的是水培方式,植物根部对生长调节物质的吸收未受太多干扰,若采用土壤种植时,其适宜浓度可能会有所变化。因此,后续研究应对土壤种植最佳调节剂浓度的选择作进一步探究。
4 结论
本研究结果表明,MeJA和IAA均可通过叶面喷施和浸根处理两种方式促进苦玄参苷的积累。其中,MeJA在两种处理方式下的最佳浓度均为20 mg/L,且以叶面喷施效果较佳;IAA叶面喷施的最佳浓度为100 mg/L,浸根处理的适宜浓度为50 mg/L,以浸根处理方式效果较佳。
参考文献:
陈君,甄汉深,韦建华. 2007. 广西苦玄参不同药用部位的薄层鉴别与含量测定[J]. 华夏医学,20(6):1179-1181.
Chen J,Zhen H S,Wei J H. 2007. Identification and content assay of Picria fel-tarrae Lour. with high performance liquid chromatography[J]. Acta Medicinae Sinica, 20(6): 1179-1181.
陈君,甄汉深,韦建华. 2013. 苦玄参叶抗炎药理作用研究[J].海峡药学,25(2):23-15.
Chen J, Zhen H S, Wei J H. 2013. Study on anti-inflammation of Picria fel-tarrae leaves[J]. Strait Pharmaceutical Journal, 25(2): 23-15.
丛汉卿,齐尧尧,朱文丽,陈松笔,李丽. 2016. 木薯CKX基因的序列分析及其乙烯和茉莉酸甲酯诱导表达特性[J]. 江苏农业学报,32(3):506-513.
Cong H Q, Qi Y Y, Zhu W L, Chen S B, Li L. 2016. Sequence analysis of CKX gene and expression characteristics induced by ethylene and methyl jasmonate in Manihot esculenta Crantz[J]. Jiangsu Journal of Agricultural Sciences, 32(3): 506-513.
付偉,严旭,王超,潘建伟. 2013. 生长素调控极性运输载体PIN2质膜丰度与降解[J]. 浙江师范大学学报(自然科学版),36(3):325-330.
Fu W, Yan X, Wang C, Pan J W. 2013. Auxin regulation of its efflux transporter PIN2 plasma membrane abundance and degradation[J]. Journal of Zhejiang Normal University(Na-
tural Science), 36(3): 325-330.
黄海连,林伟国,冼卫清,王金桥,余生,黄演福. 2013. 黑膜覆盖栽培对苦玄参产量及经济效益的影响[J]. 贵州农业科学,41(6):72-74.
Huang H L, Lin W G, Xian W Q, Wang J Q, Yu S, Huang Y F. 2013. Effects of black film covering cultivation on the yield and economic[J]. Guizhou Agricultural Sciences, 41(6): 72-74.
蒋妮,白隆华,董青松,林伟国,黄宇声,余生. 2013. 苦玄参褐斑病病原鉴定及致病因素分析[J]. 湖北农业科学,52(16):3836-3838.
Jiang N, Bai L H, Dong Q S, Lin W G, Huang Y S, Yu S. 2013. Pathogen identification of Picria felterrae brown spot and analysis on the pathogenic factor[J]. Hubei Agricultural Sciences, 52(16): 3836-3838.
任昂. 2012. 茉莉酸甲酯对灵芝三萜生物合成的影响及其灵芝应答基因的差异表达研究[D]. 南京:南京农业大学:17-24.
Ren A. 2012. Study on the effect of methyl jasmonate on the ganoderic acid biosynthesis and differently expression of genes in response to methyl jasmonate in Ganoderma lucidum[D]. Nanjing: Nanjing Agricultural University: 17-24.
王力生. 2004. 苦玄参的化学成分研究及应用[D]. 北京:北京中医药大学:79-85.
Wang L S. 2004. Studies on the chemical constituents of Picria fel-terrae Lour. and its application[D]. Beijing: Beijing University of Chinese Medicine: 79-85.
王奇志,陈雨,王鸣,冯煦. 2010. 苦草提取物Pft-d对小鼠S180肉瘤、肝癌Heps的抗癌作用及体外细胞毒活性实验研究[J]. 现代药物与临床,25(2):134-137.
Wang Q Z, Chen Y, Wang M, Feng X. 2010. Study on antitumor activities of extracts Pft-d from Picria fel-terrae[J]. Drugs & Clinic, 25(2): 134-137.
谢阳姣,何志鹏. 2013. 乙烯利对苦玄参生长的影响[J]. 南方农业学报,44(7):1100-1104.
Xie Y J, He Z P. 2013. Effects of ethrel on growth of Picira fel-terrae Lour.[J]. Journal of Southern Agriculture,44(7): 1100-1104.
谢阳姣,何志鹏,林伟. 2013. 茉莉酸甲酯对苦玄参生长及苦玄参苷积累的影响研究[J]. 作物杂志,(2):80-84.
Xie Y J, He Z P, Lin W. 2013. Effects of methyl jasmonate on the growth and accumulation of picfeltrarraenin glycosides of Picria fel-terrae Lour.[J]. Crops,(2): 80-84.
曾金强,潘小姣,杨柯,韦志英,陈晨. 2010. 苦玄参不同提取部位抑制2215细胞分泌HBeAg和HBsAg的实验研究[J]. 中国医药导报,7(16):27-29.
Zeng J Q,Pan X J,Yang K,Wei Z Y,Chen C. 2010. Experimental study on the inhibitory effect on HBeAg and HBsAg excre-
ted by 2215 cells of different extracts of Picria fel-tarrae Lour.[J]. China Medical Herald, 7(16): 27-29.
翟開恩. 2014. 生长素调控水稻籽粒灌浆的机理初探[D]. 金华:浙江师范大学:20.
Zhai K E. 2014. Primary exploration of mechanisms underlying auxin regulation of rice grain filling[D]. Jinhua: Zhejiang Normal University: 20.
国家药典委员会. 2010. 中华人民共和国药典[K]. 北京:中国医药科技出版社.
Chinese Pharmacopoeia Commission. 2010. Pharmacopoeia of the Peoples Republic of China[K]. Beijing: China Medical Science Press.
国家药典委员会. 2015. 中华人民共和国药典[K]. 北京:中国医药科技出版社.
Chinese Pharmacopoeia Commission. 2015. Pharmacopoeia of the Peoples Republic of China[K]. Beijing: China Medical Science Press.
朱宏涛,李江,李元,张颖君. 2014. 茉莉酸甲酯对三七组培苗中总皂苷含量的影响[J]. 西部林业科学,43(2):72-78.
Zhu H T, Li J, Li Y, Zhang Y J. 2014. Effects of methy jasmonate on the content of total saponin in tissue culture seedlings of Panax notoginseng[J]. Journal of West China Forestry Science, 43(2): 72-78.
(责任编辑 王 晖)

