基于CGE技术的甘蔗SSR—PCR反应体系优化
桂意云 陈忠良 秦翠鲜 汪淼 刘丽敏 李杨瑞 黄东亮

摘要:【目的】优化基于毛细管凝胶电泳(CGE)技术的甘蔗SSR-PCR反应体系,为甘蔗遗传多样性和亲缘关系研究、分子辅助育种及遗传图谱构建提供技术支持。【方法】基于CGE技术,采用正交试验设计,选择dNTPs浓度、DNA聚合酶量、引物浓度和DNA模板量为考察因素进行优化,确定最佳SSR-PCR反应体系,并用于8个甘蔗种质资源材料的遗传多样性分析。【结果】最佳SSR-PCR反应体系(20 μL):dNTPs浓度0.15 mmol/L,DNA聚合酶1.5 U,引物浓度0.50 μmol/L,DNA模板量25 ng。利用该体系对8份来自不同国家地域的甘蔗种质材料进行遗传多样性分析,发现8对SSR引物共扩增出101个片段,其中多态性片段为93个,多态性比率为92.1%。聚类分析结果表明,参试材料间的遗传相似性系数为0.521~0.871,在相似性系数为0.614处,所有参试材料可分为两大类,3份国外种质材料PINDAR、CP72-1210、CP84-1198与ROC20、GT69-156聚为一类;而ROC26、GT02-237和GT97-69聚为另一类。【结论】基于CGE技术的SSR-PCR反应体系检测结果稳定,重复性好,适用于甘蔗的遗传分析及遗传作图。
关键词: 甘蔗;SSR分子标记;毛细管凝胶电泳(CGE);反应体系;遗传分析
中图分类号: S566.1 文献标志码:A 文章编号:2095-1191(2016)09-1463-07
Abstract:【Objective】SSR-PCR reaction system of sugarcane based on capillary gel electrophoresis(CGE) technology was optimized to provide technical support for research on genetic diversity and genetic relationship, molecular-assisted breeding and genetic map construction of sugarcane. 【Method】Four factors affecting SSR-PCR were optimized by orthogonal exprement based on CGE technology, including dNTPs concentration, primer concentration, Taq DNA polymerase amount and DNA template amount. Then the optimal SSR-PCR reaction system was confirmed and applied to genetic analysis of 8 sugarcane germplasm resources. 【Result】The results showed that, the optimal reaction system(20 μL) was composed of 0.15 mmol/L dNTPs, 1.5 U Taq DNA polymerase, 0.50 μmol/L primers and 25 ng DNA templates. Using optimal reaction system and 8 pairs of SSR primers, a total of 101 fragments were amplified from 8 sugarcane germplasms of several countries, 93 of which was polymorphic, with a polymorphism rate of 92.1%. The cluster analysis showed that, coefficient of genetic similarity among 8 germplasms ranged from 0.521 to 0.871. All tested materials could be clustered into two groups at similarity coefficient of 0.614, three foreign germplasms viz., PINDAR, CP72-1210, CP84-1198 and ROC20, GT69-156 were clustered into the same group, but ROC26, GT02-237 and GT97-69 were clustered into another group. 【Conclusion】The established SSR-CGE system is suitable for genetic diversity analysis and genetic mapping of sugarcane due to its stable detection result and good reproducibility.
Key words: sugarcane; SSR molecular marker; capillary gel electrophoresis(CGE); reaction system; genetic analysis
0 引言
【研究意義】甘蔗是世界上重要的糖料和能源作物,我国甘蔗糖产量占全国食糖总产量的90%以上(李杨瑞和杨丽涛,2009)。甘蔗常规育种工作量大、育种周期长、效率低,是当前甘蔗育种面临的共性问题。由于SSR分子标记具有数量多、多态性高、重复性好、遗传上呈共显性等优点,已被广泛应用于作物辅助育种、生物遗传学研究。对SSR分子标记进行检测时,与常规凝胶电泳检测方法相比,毛细管凝胶电泳(Capillary gel electrophoresis,CGE)具有高灵敏度、高效率、高准确性等优点(Bor et al.,2003;郝晨阳等,2005),可用于蛋白质、核酸等分子化合物的分离。因此,建立基于CGE技术的甘蔗SSR-PCR反应体系可快速准确鉴别甘蔗杂交后代,掌握甘蔗品种(系)间的遗传多样性与遗传关系,对于加快甘蔗育种进程具有重要意义。【前人研究进展】目前,已有大量关于SSR荧光标记CGE检测技术的研究报道。Huang等(2002)利用24对SSR荧光引物检测了来自五大洲共68个国家的998份六倍体面包小麦,共检测到470个等位基因,结果表明利用SSR荧光标记可快速获得用于种质登记的高通量指纹数据及评估物种遗传多样性。张凤娟(2004)利用SSR荧光标记CGE技术对杂交水稻冈优527进行真实性检测和纯度鉴定。易红梅等(2006)利用7对SSR荧光引物对192份玉米材料进行扩增,结果表明,CGE荧光检测比常规变性PAGE银染检测更适用于高通量材料的检测分析。梁俊等(2010)利用SSR荧光标记CGE技术对甘蔗属3个不同种的12个材料进行遗传多样性及遗传关系分析。程本义等(2011)以16个杂交水稻不育系、恢复系及组合为材料,建立了SSR荧光标记CGE检测方法,可准确读出目标DNA片段的大小,且检测数据精确,与常规凝胶电泳检测方法相比,其检测效率更高。邹丽梅等(2011)通过建立适用于玉米特定分离群体的高通量SSR检测技术,对180份玉米DH系材料进行扩增及电泳分析,结果发现该技术提高了玉米分子育种效率。【本研究切入点】虽然SSR荧光标记CGE技术已成功应用于水稻、小麦、玉米、甘蔗等作物遗传分析研究,但不同物种使用不同的PCR反应体系。PCR反应体系的建立是一个关键环节,反应体系中的多个因子均会直接影响PCR扩增效果及后续产物检测准确性,尤其甘蔗是异源多倍体植物,其基因组DNA较复杂,但目前鲜见基于CGE技术的甘蔗SSR-PCR反应体系优化的研究报道。【拟解决的关键问题】建立基于CGE技术的甘蔗SSR-PCR反应体系,并用于甘蔗种质资源遗传分析,为甘蔗遗传多样性和亲缘关系研究、分子辅助育种及遗传图谱构建等提供可靠、有效的技术支持。
1 材料与方法
1. 1 试验材料
供试甘蔗种质材料为PINDAR、ROC26、ROC20、CP72-1210、CP84-1198、GT02-237、GT97-69和GT69-
156,均采集自广西农业科学院甘蔗研究所甘蔗资源圃;DNA聚合酶、dNTPs、SLS(上样缓冲液,甲酰胺)、Genescan-500分子量内标和PAGE胶柱等购自生工生物工程(上海)股份有限公司;SSR引物由生工生物工程(上海)股份有限公司合成。
1. 2 总DNA提取
采用SDS法提取甘蔗总DNA(陈忠良等,2010;黄东亮等,2010):①取100 mg甘蔗嫩叶加入液氮于研钵中快速研磨成粉末,转入2.0 mL离心管,加入800 μL DNA抽提缓冲液,摇匀,65 ℃水浴40 min。②加入200 μL 5 mol/L KAc(pH 5.2)充分混匀,冰浴12 min,4 ℃下10000 r/min离心15 min,取上清液加入等体积酚/氯仿、氯仿各抽提1次,12000 r/min离心10 min。③上清液加入1/10体积3 mol/L NaAc(pH 4.8)和2倍体积无水乙醇,-20 ℃静置30 min沉淀DNA,再于4 ℃下10000 r/min离心10 min,弃上清液,用72%乙醇漂洗3次,晾干后加入100 μL TE溶解。④加入RNaseA至终浓度50 μg/mL,37 ℃水浴30 min。最后取2 μL总DNA液于0.8%琼脂糖凝胶电泳检测,-20 ℃保存备用。
1. 3 SSR引物筛选及合成
通过常规PAGE技术筛选出扩增条带清晰、多态性高、重复性好的SSR引物,然后合成荧光引物(正向引物序列5′端加入CY5荧光分子信标,反向引物为常规合成),再进行SSR荧光引物筛选(Cordeiro et al.,2001;Pan et al.,2007)。
1. 4 SSR-PCR反应体系的建立
以甘蔗ROC26的总DNA为模板,SMC336BS为引物,反应体系20 μL,每处理重复2次。采用正交试验设计L16(45),选择dNTPs(含Mg2+)浓度、DNA聚合酶量、引物浓度和DNA模板量为考察因素,每个因素设计4个水平(表1)。PCR扩增程序:94 ℃预变性5 min;94 ℃ 45 s,退火1 min(退火温度采用梯度PCR进行筛选),72 ℃ 50 s,进行30个循环;72 ℃终延伸2 min(陈忠良等,2010)。最后对PCR扩增结果依次打分(韩国辉等,2011)。
1. 5 PCR产物的CGE检测
利用BECKMAN COULTER CEQ 8000系统遗传分析仪对荧光SSR引物扩增的PCR产物进行CGE检测。每个上样孔的上样体系:20.0 μL SLS,0.1 μL Genescan-500分子量内标,1.0 μL稀释200倍的PCR产物。电泳分离程序:90 ℃变性2 min;进样电压2.0 kV,时间30 s;分离电压7.5 kV,时间40 min,保存样本信息。
1. 6 数据处理分析
利用GeneMapper-v3.0对遗传分析系统仪收集的数据进行分析(Levinson and Gutman,1987;Clark,1988;Schlotterer and Tautz,1992)。将SSR标记片段与Genescan-500分子量标准品比较,得到SSR标记片段长度。对信号稳定且易于判读的峰高采用“0-1”系统记录其位置,在相同的片段大小位置有峰高记为“1”,无峰高则记为“0”,建立甘蔗SSR标记的0、1数据矩阵。最后利用NTSYS-pc 2.1,结合UPGMA进行聚类分析。
2 结果与分析
2. 1 甘蔗总DNA提取结果
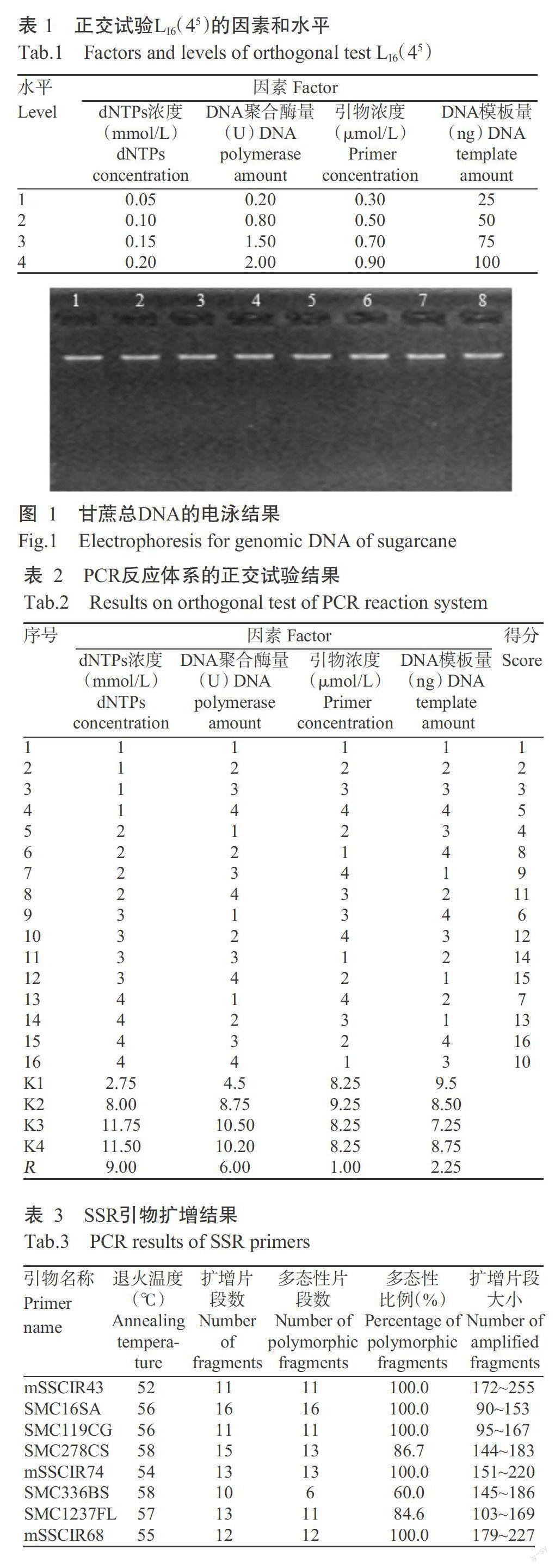
0.8%琼脂糖凝胶电泳检测结果如图1所示,提取的DNA样品条带明亮、清晰、完整,无拖尾现象,无明显RNA带,且点样孔下端干净不发亮,表明DNA未降解,纯度较高,蛋白质和RNA等杂质去除较彻底。经测定,OD260/OD280为1.76~1.87,OD260/OD230为1.89~2.07,表明提取的甘蔗总DNA质量较好,可用于SSR分子标记分析。
2. 2 PCR反应体系的正交试验结果
正交试验L16(45)结果如图2所示,16个组合的PCR产物均能检测到目标峰高信号,组合15的峰高最多、信号强且稳定;dNTPs浓度和DNA聚合酶量过低均会影响PCR产物生成,导致检测信号弱、峰高数少(扩增片段少);DNA聚合酶量和引物浓度过高会造成非特异性片段生成,检测到杂峰,影响目标峰高的判读。
PCR扩增结果得分如表2所示,目标峰高信号强、峰高数量多、稳定且易读取的最佳产物记16分,最差的记1分。对其进行直观分析,由于极差(R)大小能反映各因素对PCR反应体系的影响程度,正交设计的4个因素对SSR-PCR反应体系的影响排序依次为dNTPs浓度>DNA聚合酶>DNA模板量>引物浓度。根据各因素水平下的得分平均值(K)可初步确定最佳反应体系(20 μL):dNTPs 0.15 mmol/L,DNA聚合酶1.5 U,引物浓度0.50 μmol/L,DNA模板25 ng。这个体系与组合12(评分15分)最接近,仅DNA聚合酶用量有所不同。
2. 3 基于CGE技术的甘蔗SSR-PCR反应体系建立
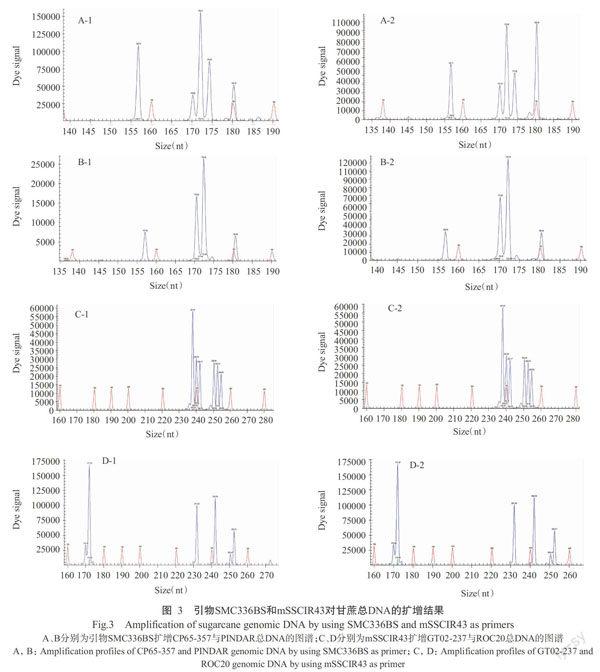
根據正交试验优化结果,采用最佳SSR-PCR反应体系(20 μL):dNTPs浓度0.15 mmol/L,DNA聚合酶1.5 U,引物浓度0.50 μmol/L,DNA模板量25 ng,用2对SSR荧光引物(SMC336BS和mSSCIR43)分别对2份甘蔗总DNA进行PCR扩增。扩增结果如图3所示,所选用引物对的PCR产物检测图谱出峰有序、信号强、条带峰单一、杂峰较少、重复性好,表明建立的基于CGE技术SSR-PCR反应体系稳定可靠。
2. 4 甘蔗种质资源遗传分析结果
利用基于CGE技术的SSR-PCR反应体系对8份甘蔗种质材料进行遗传多样性分析,结果表明,8对引物共扩增出101个片段(表3),扩增片段在90~255 bp,平均每对引物扩增出12.6个片段,其中多态性片段93个,多态性比率为92.1%。引物SMC16SA扩增的片段最多,为16个;引物SMC336BS扩增片段最少,为10个,但其在ROC20和ROC26各擴增出1个能区别于其他甘蔗品种的特异片段,大小分别为169(图4-c)和184 bp(图4-b);引物mSSCIR43则从ROC20、ROC26和CP84-1198各扩增出1个能区别于其他甘蔗种质材料的特异片段,大小分别为232、234和247 bp。其中,SMC336BS和mSSCIR43的扩增产物检测信号强、稳定、峰高单一、杂峰较少、区分度高,可将8份甘蔗种质材料有效区分,故用双引物组合产生的分子数据可用于DNA指纹身份证构建(图5)。
聚类分析结果如图6所示,8份甘蔗种质材料间的相似性系数平均值为0.657,CP84-1198和GT69-156的相似性系数最大,为0.871;PINDAR和ROC26的相似性系数最小,为0.521。在相似性系数0.614处,所有参试材料可分为两大类,3份国外种质材料PINDAR、CP72-1210、CP84-1198与ROC20、GT69-156聚为一类;而ROC26、GT02-237和GT97-69聚为另一类。3份桂糖种质材料(GT02-237、GT97-69和GT69-156)未聚在同一类,可能与其父母本亲缘关系有关。这说明8份甘蔗种质材料有丰富的遗传多样性,且建立的SSR- CGE技术体系检测结果稳定,重复性好,适用于甘蔗的遗传分析及遗传作图。
3 讨论
基于CGE荧光检测系统建立的DNA自动分析技术,灌胶、上样、片段分离和数据收集均自动完成,电泳检测时各样品中均加入分子量内标,可直接精确获得各泳道DNA片段的大小,区分度达1 bp,该技术具有高通量、高效率、高精确性等优点,特别适用于大规模材料的分析研究。Bor等(2003)仅用50 h就完成了198份样品约1000个位点的CGE荧光检测分析。郝晨阳等(2005)对5000份北方冬小麦样品进行检测,除去仪器损耗成本,多重PCR-SSR荧光标记分析技术和常规的变性PAGE银染技术的使用经费基本持平,但前者的效率显著高于后者。本研究中SSR荧光引物合成的成本约800元1对引物(2OD),保存年限为2年,其成本远高于普通引物的合成。常规的变性PAGE银染技术所需成本较低,一般的实验室就能完成,在分析较少的材料和位点时,是一套经济有效的检测技术,但人工读取胶板工作繁琐,且存在一定的人为误差。因此,建议先运用常规的变性PAGE银染检测法对SSR引物进行筛选,再对筛选出的引物进行荧光标记,并进行多重PCR扩增分析;将变性PAGE银染检测法与CGE荧光检测法有效结合起来完成试验材料的检测分析,可节省费用,同时提高工作效率。因此,SSR荧光标记CGE技术的不断完善和发展,为作物的分子辅助育种研究提供了有力的技术支持。
通过SSR荧光标记与CGE检测技术相结合,可实现SSR分子标记的自动化分析,而确立SSR-PCR反应最佳体系是实现自动化分析的前提。反应体系中各组分的含量均可能会影响PCR扩增的特异性、敏感性及产物的产量等。因此,本研究采用具有均衡分散性和整齐可比性的正交试验设计,实行多因素联合优化方法对甘蔗SSR-PCR反应体系的dNTPs浓度、DNA聚合酶量、引物浓度和DNA模板量进行优化,筛选各因素的最佳水平,获得最优水平组合,最终确立最佳PCR反应体系,并通过重复试验和8对SSR引物对其进行检验,结果表明所建立的SSR-PCR反应体系稳定可靠。利用该SSR-PCR反应体系和8对SSR引物对8份来自不同国家地区的甘蔗种质材料进行遗传多样性分析,并选用2对引物联合进行指纹图谱构建,结果表明SSR位点数量多、多态性高,且稳定性强、重复性好,为甘蔗种质资源遗传分析和遗传作图构建等提供了有效的技术支持。
4 结论
通过正交试验设计优化,建立了基于CGE技术的甘蔗SSR-PCR反应体系(20 μL):dNTPs浓度0.15 mmol/L,DNA聚合酶1.5 U,引物浓度0.50 μmol/L,DNA模板量25 ng。利用该体系对甘蔗种质材料进行检测分析,其结果稳定、重复性好,适合甘蔗的遗传分析及遗传作图。
参考文献:
陈忠良,秦翠鲜,郭元元,杨翠芳,罗海斌,何海波. 2010. 一种适用于甘蔗SSR-PCR的DNA快速提取方法[J]. 广西农业科学,41(11):1155-1157.
Chen Z L,Qin C X,Guo Y Y,Yang C F,Luo H B,He H B.2010. A rapid DNA extraction method from sugarcane leaves for SSR-PCR[J]. Guangxi Agricultural Sciences,41(11):1155-1157.
程本义,夏俊辉,龚俊义,杨仕华. 2011. SSR荧光标记毛细管电泳检测法在水稻DNA指纹鉴定中的应用[J]. 中国水稻科学,25(6):672-676.
Cheng B Y,Xia J H,Gong J Y,Yang S H. 2011. Application of capillary electrophoresis detection with fluorescent SSR marker in rice DNA fingerprint identification[J]. Chinese Journal of Rice Science,25(6):672-676.
韩国辉,向素琼,汪卫星,贾志刚,洪棋斌,梁国鲁. 2011. 柑橘SCoT分子标记技术体系的建立及其在遗传分析中的应用[J]. 园艺学报,38(1):1243-1250.
Han G H,Xiang S Q,Wang W X,Jia Z G,Hong Q B,Liang G L. 2011. Establishment and application of SCoT molecular marker system for citrus[J]. Acta Horticulturae Sinica,38(1):1243-1250.
郝晨陽,王兰芬,贾继增,董玉琛,张学勇. 2005. SSR荧光标记和银染技术的比较分析[J]. 作物学报,31(2):144-149.
Hao C Y,Wang L F,Jia J Z,Dong Y C,Zhang X Y. 2005. Comparison of fluorescence and silver-staining detection systems of microsatellite markers[J]. Acta Agronomica Sinica,31(2):144-149.
黄东亮,覃肖良,廖青,高轶静,方锋学. 2010. 高质量甘蔗基因组DNA的简便快速提取方法研究[J]. 生物技术通报,(5):101-106.
Huang D L,Qin X L,Liao Q,Gao Y J,Fang F X. 2010. Simple and rapid procedure for isolation of high quality genomic DNA from sugarcane[J]. Biotechnology Bulletin,(5):101-106.
李杨瑞,杨丽涛. 2009. 20世纪90年代以来我国甘蔗产业和科技的新发展[J]. 西南农业学报,22(5):1469-1475.
Li Y R,Yang L T. 2009. New developments in sugarcane industry and technologies in China since 1990[J]. Southwest China Journal of Agricultural Sciences,22(5):1469-1475.
梁俊,PAN Yong-bao,李杨瑞,方锋学. 2010. 利用SSR标记与毛细管电泳技术对甘蔗属进行的遗传分析[J]. 广西植物,30(1):106-111.
Liang J,Pan Y B,Li Y R,Fang F X. 2010. Assessment of genetic diversity in Saccharum using SSR markers and capillary electrophoresis[J]. Guihaia,30(1):106-111.
易红梅,王凤格,赵久然,王璐,郭景伦,原亚萍. 2006. 玉米品种SSR标记毛细管电泳荧光检测法与变性银染检测法的比较研究[J]. 华北农业学报,21(5):64-67.
Yi H M,Wang F G,Zhao J R,Wang L,Guo J L,Yuan Y P.2006. Comparison of two maize SSR detection methods:capillary electrophoresis with fluorescence detection method and denaturing PAGE silver_staining detection method[J].Acta Agricuiture Boreali-Sinica,21(5):64-67.
张凤娟. 2004. 杂交水稻冈优527品种真实性和纯度的SSR检测方法[D]. 杨凌:西北农林科技大学.
Zhang F G. 2004. The variety identification and purity detection of the hybrid rice GANG-YOU 527 using SSR marker[D].Yangling:Northwest Sci-Tech University of Agriculture and Forestry.
邹丽梅,王凤格,赵久然,许理文,易红梅,宋伟. 2011. 适用于玉米特定分离群体的高通量SSR检测技术研究[J]. 玉米科学,19(2):26-28,33.
Zou L M,Wang F G,Zhao J R,Xu L W,Yi H M,Song W. 2011.Mapping population of maize by high throughput measurement ssr electrophoresis technique[J]. Journal of Maize Sciences,19(2):26-28,33.
Bor P,Hindkjaer J,Kolvraa S,Ingerslev H J. 2003. A new approach for screening for Y microdeletions:capillary electrophoresis combined with fluorescent multiplex PCR[J]. Journal of Assisted Reproduction and Genetics,20(1):46-51.
Clark J M. 1988. Novel non-templated nucleotide addition reactions catalyzed by prokaryotic and eukaryotic DNA polymerases[J]. Nucleic Acids Research,16(20):9677-9686.
Cordeiro G M,Casu R,McIntyre C L,Manners J M,Henry R J.2001. Microsatellite markers from sugarcane(Saccharum spp.) ESTs cross transferable to erianthus and sorghum[J]. Plant Science,160(6):1115-1123.
Huang X,Borner A,Boder M,Ganal M. 2002. Assessing genetic diversity of wheat(Triticum aestivum L.) germplasm using microsatellite markers[J]. Theoretical and Applied Genetics,105(5):699-707.
Levinson G,Gutman G A. 1987. Slipped-strand mispairing:a major mechanism for DNA sequence evolution[J]. Molecular Biology & Evolution,4 (3):203-221.
Pan Y B,Scheffler B,Richard E P. 2007. High throughput genotyping of commercial sugarcane clones with microsatellite (SSR) DNA markers[J]. Sugar Tech,9:176-181.
Schlotterer C,Tautz D. 1992. Slippage synthesis of simple sequence DNA[J]. Nucleic Acids Research,20(2):211-215.
(责任编辑 陈 燕)

