青稞 F7-OMT基因的克隆及原核表达分析
牟 利,张鹍飞,李 鹏,方 建,刘新春,冯宗云
(四川农业大学农学院,四川成都 611130)
青稞 F7-OMT基因的克隆及原核表达分析
牟 利,张鹍飞,李 鹏,方 建,刘新春,冯宗云
(四川农业大学农学院,四川成都 611130)
摘要:类黄酮7-O-甲基转移酶(F7-OMT)具有甲基转移酶功能,能催化底物类黄酮甲基化产生植物抗毒素,提高植物的抗菌性。为了给进一步研究该酶蛋白的功能奠定基础,以青稞 “94-19-1” 为材料,采用同源克隆方法得到青稞 F7-OMT基因编码片段。生物信息学分析表明,青稞 F7-OMT开放阅读框(ORF)全长为1 173 bp,编码390个氨基酸,蛋白分子质量为42 207.8 Da,等电点pI为5.36,无信号肽序列,具有甲基转移酶2(Methyltransf_2,pfam00891)和二聚化(Dimerization,pfam08100)保守域。通过亚克隆将 F7-OMT连接到表达载体pET-32a上,构建pET-32a- F7-OMT融合表达载体,在E.coli BL21(DE3)pLysS中诱导表达,并采用亲和层析纯化法得到纯化蛋白。
关键词:青稞;类黄酮7-O-甲基转移酶;克隆;生物信息学分析;原核表达
青稞(HordeumvulgareL.var.nudum Hook. f.)又名裸大麦、元麦、米大麦,既是藏族牧民的主要粮食,也是生产啤酒和保健品的原料,还可作为牲畜的饲料。在青藏高原地区,青稞遗传资源类型丰富多样,具有三高(高蛋白、高纤维、高维生素)和两低(低脂肪、低糖)的营养结构组成和良好的医疗保健功能[1-2]。青稞中含有丰富的类黄酮化合物,与植物的生态防御密切相关,能直接或间接抵抗紫外线、重金属、微生物等的侵害[3]。目前有关类黄酮侧链羟基经甲基化反应产生植物抗毒素的研究较多[4],如甲基化生成的豆科类植物抗毒素紫苜蓿素[5]、樱花素[6]、芒柄花黄素[7]等。
甲基转移酶(Methyltransferase)调控甲基化反应,根据作用对象可分为遗传物质甲基转移酶和非遗传物质甲基转移酶[8]。催化非遗传物质的甲基转移酶种类繁多,功能复杂。氧甲基转移酶(OMT,O-methyltransferase)就是作用底物位点为氧的甲基转移酶,也是其中研究最为广泛的一类[9]。类黄酮氧甲基转移酶(FOMT,flavonoid O-methyltransferase)是氧甲基转移酶家族中的亚家族,通过催化S-腺苷甲硫氨酸(SAM,S-adenosyl-L-methionine)上的一个CH3转移到类黄酮上,产生S-腺苷-L-高半胱氨酸(SAH,S-Adenosyl-L-homocysteine)和甲氧基类黄酮[10]。甲氧基类黄酮具有更强的脂亲和性,更利于在细胞内的扩散,提高植物的抗菌性,从而增加植物抗胁迫能力[11-12],并赋予类黄酮更多的生理活性。
近年来,有关植物中类黄酮甲基转移酶的研究逐渐成为热点。研究表明,在禾本科植物中,禾白粉病菌诱导大麦产生类黄酮7-O-甲基转移酶F1-OMT[13],催化芹菜素7位羟基甲基化生成芫花素;小麦TaOMT2能催化黄酮和五羟黄酮甲基化产生单甲基、双甲基、三甲基黄酮[14];但对青稞类黄酮氧甲基转移酶的研究尚未见报道。
本研究所用材料为青稞品系“94-19-1”,由甘肃省甘南藏族自治州农科所经系谱法选育而成,具有高产、稳产、耐寒、耐旱、抗倒伏等特性,是前期测定的高黄酮含量品系[15]。本研究拟通过RT-PCR(Reverse transcription PCR)扩增得到cDNA,克隆得到 F7-OMT基因的编码区,并实现其在大肠杆菌中的表达及表达蛋白的纯化,目的是为研究该酶蛋白的结构、理化性质及功能等奠定基础,为进一步研究该基因在青稞中的表达提供依据,也为青稞高功能成分育种提供重要基因资源。
1材料与方法
1.1材 料
供试青稞材料为“94-19-1”,由甘肃省甘南藏族自治州农科所赠送。LA DNA聚合酶、pMD19-T simple Vector、限制性内切酶BamHⅠ和XhoⅠ、IPTG均购自TaKaRa公司(大连)。pET-32a载体于本实验室保存。E.coliDH5α菌株、E.coliBL21(DE3)pLysS菌株、TIANScript cDNA第一链合成试剂盒、普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均购于天根生化科技有限公司(TIANGEN)。Ni-Agarose His标签蛋白纯化试剂盒购自康为世纪生物科技有限公司。
1.2方 法
1.2.1总RNA的提取和cDNA第一链合成
培养青稞材料“94-19-1”至3叶1心期,采用改良的Trizol法提取其总RNA,并进行RT-PCR得到cDNA,具体操作参照TIANScript cDNA第一链合成试剂盒说明。
1.2.2青稞 F7-OMT基因的扩增
参照大麦F1-OMT(No.X77467)序列,设计特异性引物为F7-OMTF1:5′-ATGCAGGACACCAGTAGTACC-3′;F7-OMTR1:5′-CACGGCCTTTGCACCAAATC-3′。以青稞叶片总RNA逆转录合成的cDNA为模板,反应体系(总体积25 μL)为模板cDNA 1.5 μL(25~40 ng·μL-1),引物各 1 μL(10 ng·μL-1),LA DNA聚合酶 0.25 μL,2×GC buffer 12.5 μL,ddH2O 8.75 μL。PCR反应程序为:95 ℃预变性3 min;95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸90 s,变性到延伸共35个循环,最后72 ℃延伸10 min,4 ℃保存,扩增获得包含 F7-OMT基因全长ORF在内的序列。利用1.0%琼脂糖凝胶电泳分离检测到PCR产物并切胶回收。回收具体步骤参照TIANgel Midi Purification Kit 普通琼脂糖凝胶DNA回收试剂盒说明。
1.2.3青稞 F7-OMT基因的克隆及阳性筛选
将已获得的回收产物与pMD19-T simple Vector 16 ℃连接过夜。10 μL反应体系为回收产物 4.5 μL,pMD19-T 0.5 μL,solutionⅠ 5 μL。连接产物转化至E.coliDH5α菌株,以F7-OMTF1、F7-OMTR1为引物,参考该基因扩增程序进行PCR,挑选5个独立的阳性克隆,送至北京六合华大基因科技股份有限公司测序。
1.2.4重组表达载体的构建
根据已获得的目的基因序列设计包含ORF全序列的特异性引物(斜体前几个字母为保护碱基,斜体表示酶切位点):F7-OMTF(5′-CGCGGATCCATGCAGGACACCAGTAGTAC-3′);F7-OMTR:(5′-CCGCTCGAGCTATGGCTGGA CTTCAATGA-3′)。扩大培养筛选出的阳性克隆单菌落中的菌体,使用TIANprep Mini Plasmid Kit 质粒小提试剂盒提取其质粒。PCR扩增后产物电泳检测,切胶回收目的片段,同时扩大培养带有pET-32a载体的菌株,提取质粒。
将回收片段和pET-32a空载体同时进行双酶切。双酶切体系(20 μL)为ddH2O 6 μL,10×K buffer 2 μL,质粒或PCR回收产物 10 μL,BamHⅠ和XhoⅠ各1 μL。将完全双酶切切开的PCR回收产物和pET-32a载体按照如下比例于16 ℃连接过夜。连接体系(10 μL)为:酶切后纯化目的片段 6.5 μL,酶切后纯化pET-32a 2 μL,T4连接酶 0.5 μL,1×K Buffer 1 μL。
连接产物转化至E.coliDH5α菌株中,以F7-OMTF、F7-OMTR为引物,参考该基因克隆程序进行PCR检测,同时双酶切检测筛选阳性克隆,挑选3个独立的阳性克隆送至生工生物工程有限公司(Sangon Biotech)测序。筛选得到测序无突变的阳性克隆,命名为pET-32a-F7-OMT,提取质粒转化至E.coliBL21(DE3)pLysS菌株。
1.2.5菌株诱导表达及SDS-PAGE鉴定
取过夜培养的菌液接种于100 mL含抗生素Amp的LB液体培养基,37 ℃、200 r·min-1振荡3~5 h,期间测定OD600值至0.6~0.8之间。分装为每管3 mL,以一管不加IPTG作为对照,其他分别加IPTG至终浓度为0.4、0.5、0.6、0.8 mmol·L-1,每个浓度分别设置时间梯度1~5 h进行诱导,并进行SDS-PAGE鉴定蛋白,选取最优诱导条件。
1.2.6亲和层析纯化蛋白
活化带有重组质粒的菌株,并扩大培养30 mL。控制OD600至0.6~0.8之间,取3 mL作为对照,其余菌液采用最优诱导条件诱导目的蛋白,并参照Ni-Agarose His标签蛋白纯化试剂盒的说明进行纯化。
2结果与分析
2.1青稞 F7-OMT基因克隆结果
提取青稞材料“94-19-1”的3叶1心期总RNA,并进行琼脂糖凝胶电泳检测RNA完整性。以总RNA反转录所得的cDNA为模板,F7-OMTF1/F7-OMTR1为引物,PCR扩增后经1.0%琼脂糖凝胶电泳检测,结果得到与预期片段(1 284 bp)相符的单一、清晰的条带(图1)。将获得的目的条带切胶回收,连接至pMD19-T simple Vector,转入E.coliDH5α获得大量阳性克隆后测序,将测得的序列经Blastn序列比对,结果青稞 F7-OMT基因编码区与大麦类黄酮F1-OMT(X77467.1)ORF相似度为99.66%,4个碱基发生改变,同时导致3个氨基酸变化,表明获得了青稞 F7-OMT基因序列(图2)。
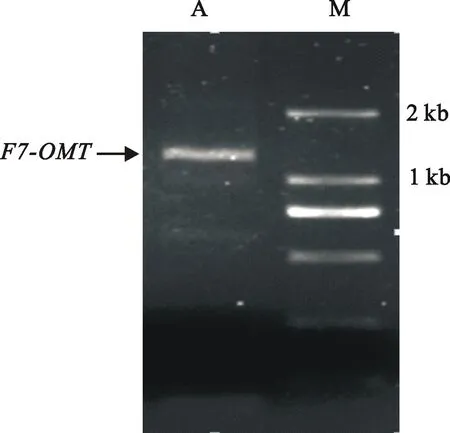
A: F7-OMT基因扩增片段;M:D2000 DNA marker
A: Amplification of F7-OMT gene fragment;M: D2000 DNA marker
图1青稞 F7-OMT基因的PCR产物
Fig.1 PCR products of F7-OMT gene in hulless barley
2.2青稞 F7-OMT基因的生物信息学分析
通过DNAMAN对青稞 F7-OMT基因进行分析,得到的cDNA全长为1 284 bp,其中ORF全长1 173 bp。通过NCBI CCD预测结果为具有甲基转移酶2家族(Methyltransf_2,pfam00891)保守域于118~367位氨基酸内和二聚化(Dimerization,pfam08100)保守域于53~101位氨基酸内。经ScanProsite初步预测到其His296(His/H,histidine)为接受质子的活性位点,而其Asp258(Asp/D,aspartic acid)为SAM结合位点。该基因预测蛋白分子质量为42 207.8 Da,等电点pI为5.36,为酸性蛋白。使用ProtParam分析其氨基酸,得到该蛋白负电荷的氨基酸(Asp+Glu)有41个,正电荷氨基酸(Arg+Lys)有27个,含亮氨酸(Leu)最多,为42个,占10.8%;色氨酸(Trp)最少,只有3个,占0.8%。半衰期为30 h,不稳定系数为40.69,属于不稳定蛋白。平均亲水性系数(GRAVY)为0.127。经SignalP 4.0 Server 预测无信号肽序列。使用PredictProtein预测到该酶蛋白二级结构中含α-螺旋(47.18%)、β-折叠(10%)、无规则卷曲(42.82%)。
2.3青稞F7-OMT氨基酸序列系统发育树分析
通过NCBI-blastp将青稞F7-OMT与其他物种O-甲基转移酶氨基酸序列进行同源性比对,结果表明青稞F7-OMT与大麦F1-OMT[13](CAA54616.1)相似度最高,为99%,与山羊草O-methyltransferase ZRP4[16](EMT02597.1)和乌拉尔图小麦5-pentadecatrienyl resorcinol O-methyltransferase[17](EMS46654.1)相似度分别为77%和73%,而与其他物种的相似性不到60%。并且与大麦O-methyltransferase(AB086416.1)和大麦Caffeic acid O-methyltransferase[18](Q96565)的氨基酸序列相似度仅为21.99%和25.06%。通过DNAMAN将青稞及其近源物种OMT进行多序列比对分析,发现其OMTs家族蛋白序列保守性较低,青稞F7-OMT氨基酸序列中His296对应的组氨酸高度保守(图3)。
采用MEGA 6.06对该酶与其他植物FOMT和其他种类OMTs等28种同一家族的甲基化酶类构建系统发育树(图4),结果显示,OMTs系统发育树分为两大类,第一类又分为两个亚类,其中青稞F7-OMT与大麦、山羊草、小麦、小米、水稻、玉米等单子叶植物的OMTs归为第二亚类,与第一亚类中的苜蓿、甘草、大豆、长春花、杏、李等双子叶OMTs在进化上有明显区分。从第一亚类可看出异黄酮O-甲基转移酶(IOMT)在进化上相较于FOMT保守性更强。从整个系统发育树来看,同一物种OMT家族中酶的相似性不一定更高,物种亲缘关系更近的功能相似的OMTs同源性越强,且7-OMTs并不是非常保守。

方框中D表示Asp258,为SAM结合位点;方框中H表示His296,为接受质子的活性位点;*表示终止密码子
D in the box is Asp258for binding site of SAM;H in the box is His296for active site of accepting protons;* is terminator codon
图2青稞 F7-OMT基因的ORF序列及其预测氨基酸序列
Fig.2Total ORF sequence and putative amino acid sequence of F7-OMT gene in hulless barley

三角形指示组氨酸活性位点 Triangle is active site of histidine
2.4原核表达载体的构建和鉴定
用引物F7-OMTF/F7-OMTR扩增产物与pET-32a空载体经BamHⅠ和XhoⅠ双酶切,过夜连接后转化至E.coliDH5α。涂平板挑菌后扩大培养,抽提质粒再经BamHⅠ和XhoⅠ双酶切检测鉴定为阳性克隆(图5)。将阳性克隆菌株送测序(Sangon Biotech),经DNAMAN比对测得序列和前期获得的序列,结果表明该基因ORF无突变,获得该基因的重组表达载体。
2.5青稞F7-OMT的诱导表达和SDS-PAGE分析
从DH5α中提取质粒转入BL21(DE3)pLysS中,经扩大培养4 h后菌液OD600值0.6左右。分别取IPTG终浓度0.4、0.5、0.6、0.8 mmol·L-1,每管3 mL,诱导4 h。经SDS-PAGE检测,随浓度增加条带变化不明显,但在60 kDa左右处有较粗条带。取扩大培养的OD600菌液3 mL作空白对照,摇菌5 h,其余的加入IPTG控制其终浓度为0.8 mmol·L-1,分装为5管,每管3 mL,分别摇1~5 h。同时将pET-32a空载体转入BL21(DE3)pLysS,同样扩大培养至菌液OD600为0.6左右,分装为5管,每管3 mL,摇菌1~5 h。经SDS-PAGE检测,含有重组质粒未加IPTG培养5 h的菌和含空载体培养1~5 h的菌中60 kDa中没有明显变化;加入IPTG含重组质粒培养1~5 h的菌在60 kDa左右可以明显看到随培养时间增加而变粗的条带,培养5 h的条带最粗,该菌其他条带与其他菌没有明显差别(图6)。结果表明成功诱导表达出青稞F7-OMT蛋白。
箭头表示青稞F7-OMT蛋白 Arrow is F7-OMT protein in hulless barley
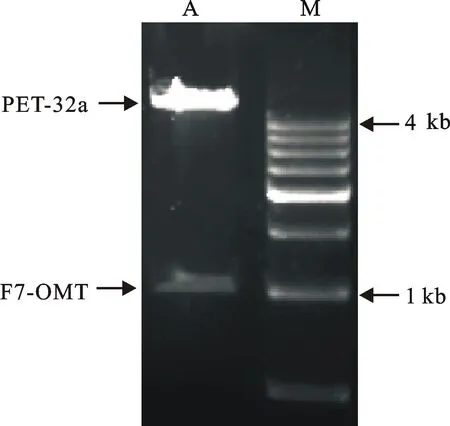
A:目的基因与pET-32a;M:500 bp DNA ladder
A: Target gene fragment and pET-32a; M: 500 bp DNA ladder
图5双酶切鉴定目的基因与pET-32a
Fig.5Target gene products and pET-32a
identified with double enzyme digestion
2.6青稞F7-OMT蛋白的亲和层析纯化
扩大培养并按最优条件(IPTG浓度0.8 mmol·L-1,5 h)诱导表达含重组表达质粒的BL21(DE3)pLysS,经亲和层析纯化后得到与目的条带位置相符的单一条带(图7),说明成功纯化得到目的蛋白即青稞F7-OMT蛋白。
3讨 论
植物OMTs家族因底物多样性形成庞大甲基转移酶家族,类黄酮OMTs通过夺取类黄酮羟基中的质子转移甲基而改变底物结构,并改变底物的理化性质和功能。类黄酮有抗氧化、类雌激素、参与植物生长和花色形成、参与植物抗胁迫等作用[19-21]。目前关于植物OMTs cDNA的克隆及其结构、功能的研究较多,如豆科类[22-24]、番茄[25]、烟草[26]、拟南芥[11,27]、水稻[6,28-29]、小麦[14]、月季[30]、葡萄[31]等。尤其关于转移甲基产生大量植物抗毒素,增加植物抵抗病菌感染方面研究较多。目前豆科植物由于其黄酮含量较高,对其OMTs研究较为深入。对禾本科OMTs也已有一定研究,但在青稞材料中尚未有研究。
本研究经青稞F7-OMT氨基酸序列同源比对,发现在底物结合区域所预测出的His高度保守。其主要原因可能是其咪唑基团中的两个N原子易发生质子化反应,而夺取其他基团中的质子,SAM上的甲基转移到去质子化的底物羟基上,形成其甲基化产物[32]。而SAM与OMTs结
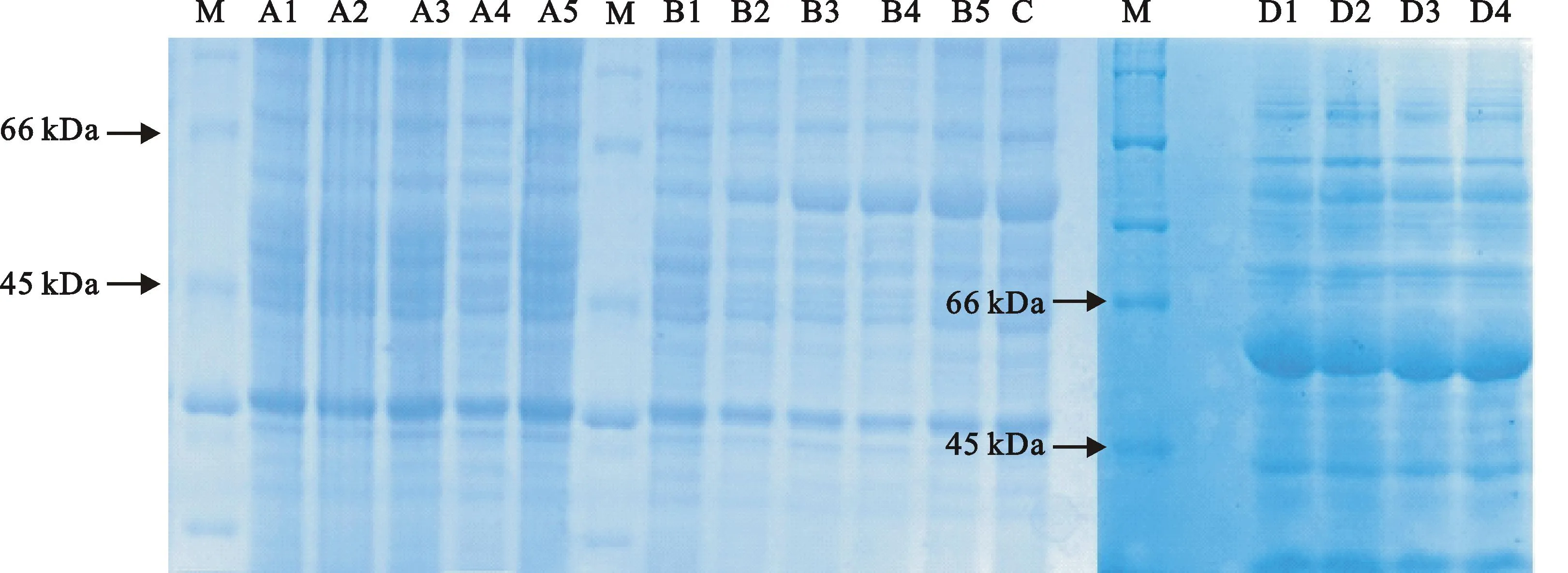
M:广谱蛋白Marker(CWBIO);A1~A5:空载体加IPTG诱导1~5 h;B1~B5:重组质粒加IPTG诱导1~5 h;C:重组质粒未加IPTG诱导5 h;D1~D4:重组质粒IPTG终浓度分别为0.4、0.5、0.6、0.8 mmol·L-1
M: Protein marker(CWBIO);A1-A5:Original vector induced by IPTG for 1-5 h;B1-B5:Recombinant vector induced by IPTG for 1-5 h;C:Recombinant vector induced without IPTG for 5 h;D1-D4:Recombinant vector induced by IPTG at the final concentration of 0.4,0.5,0.6,0.8 mmol·L-1
图6目的蛋白在大肠杆菌中的诱导表达
Fig.6Expression of target protein inE.coliinduced by IPTG
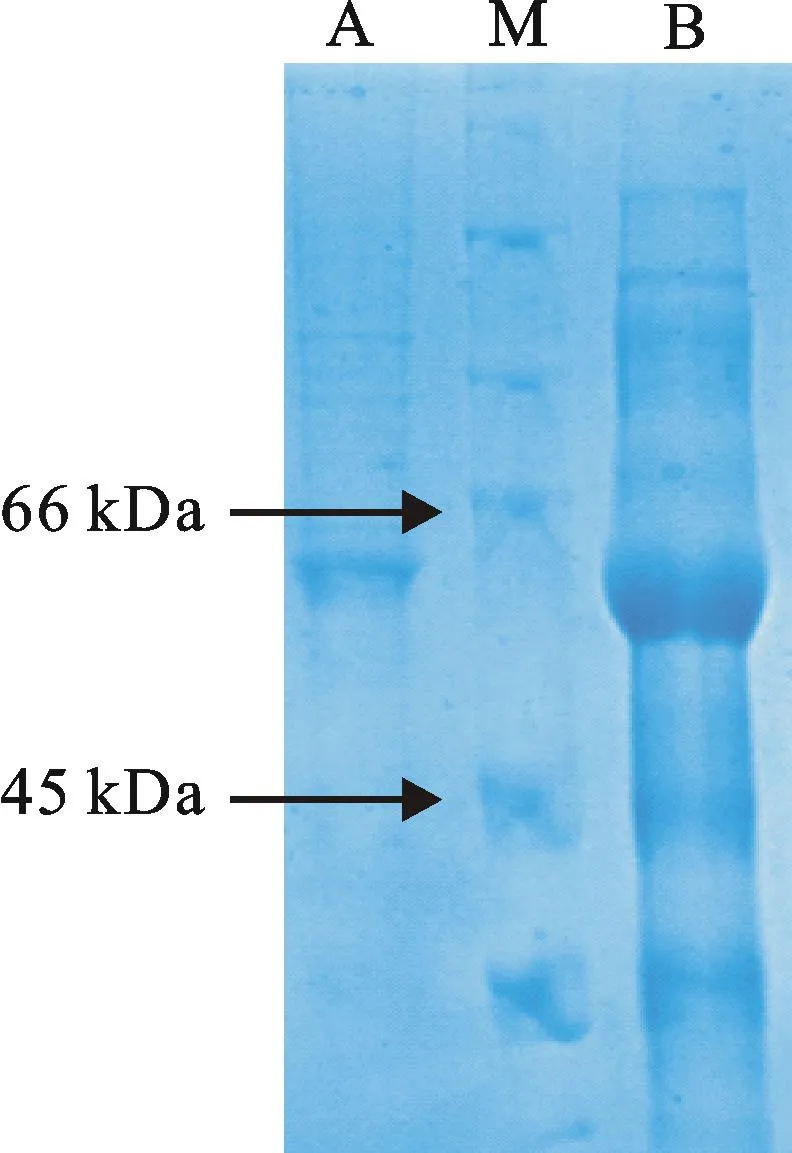
M:广谱蛋白Marker(CWBIO);A:纯化的目的蛋白;B:加IPTG诱导5 h的重组质粒
M: Protein marker(CWBIO);A:Purified target protein;B:Recombinant vector induced by IPTG for 5 h
图7目的蛋白的亲和层析纯化
Fig.7Affinity chromatography purification of target protein
合位点较多,预测分析尚不准确。通过对含有甲基转移酶2和二聚化保守域的OMTs做系统发育树分析显示出其种类多样性,其主要原因可能是同个物种中黄酮种类多样性使得与其结合的酶结构多样性。7-OMTs并没有高度保守,说明类黄酮与氧甲基转移酶结合还有其他黄酮结构区域参与,可能正是这些不同导致7-OMTs千差万别[33-34]。在依赖SAM的OMTs中,因其需要与结构已经固定的SAM结合,所以其SAM结合域保守性较强[35]。青稞F7-OMT与禾本科植物同源性更高说明OMT符合系统进化规律,7-OMTs保守性不高以及豆科类异黄酮OMT同样具有很高保守性,这与Kim等[32]的分析结果一致。
仅通过同源性分析来研究植物OMTs功能尚不准确[36],要对青稞F7-OMT功能做进一步研究还需原核表达得到其纯化蛋白。本研究中构建原核表达载体pET-32a-F7-OMT后,调整诱导表达IPTG终浓度对重组目的蛋白表达影响不明显,说明该基因原核表达体系对IPTG浓度不敏感,这与重组质粒pET32a-AKT1结果一致[37]。在诱导表达时将IPTG控制其终浓度为0.8 mmol·L-1、诱导时间为5 h时得到的目的蛋白含量最高,而空载体采用同样处理不能得到相同条带,说明该蛋白能在原核表达载体pET-32a中较好地表达。该结果为研究该蛋白的底物特异性及其功能提供了一定的基础。
目前OMTs的克隆研究只是集中在cDNA方面,关于其他基因元件对该基因的影响鲜有研究,如其启动子和内含子序列的相关报道较少;其次对于该基因多态性研究也较少;另外OMTs在植物抗病毒中与其他拮抗反应相关性,以及在植物抵御病菌反应中地位的报道也较少。随着基因工程和分子生物学发展,后期将高黄酮含量与OMTs相结合,有望培育出抗病性强、高营养价值的转基因植株。
参考文献:
[1]宋 慧,李 勇.黄酮类化合物的保健作用[J].中国食物与营养,2004(11):45-47.
Song H,Li Y.Health care function of brass compound [J].FoodandNutritioninChina,2004,11:45-47.
[2]杨 涛,曾亚文,萧凤回,等.药用大麦及其活性物质研究进展[J].麦类作物学报,2007,27(6):1154-1158.
Yang T,Zeng Y W,Xiao F H,etal.Research progress on medicina barley and its active substance [J].JournaofTriticeaeCrops,2007,27(6):1154-1158.
[3]Middleton E M,Teramura A H.The role of flavonol glycosides and carotenoids in protecting soybean from ultraviolet-B damage [J].PlantPhysiology,1993,103(3):741-752.
[4]龚凌霄,倪勤学,张 英.植物抗毒素研究进展及其作为食品功能性成分的应用前景[J].天然产物研究与开发,2012,24(3):421-425.
Gong L X,Ni Q X,Zhang Y.Research on phytoalexins and its application prospect as a food functional component [J].NaturalProductResearchandDevelopment,2012,24(3):421-425.
[5]He X Z,Reddy J T,Dixon R A.Stress responses in alfalfa (MedicagosativaL.).XXII.cDNA cloning and characterization of an elicitor-inducible isoflavone 7-O-methyltransferase[J].PlantMolecularBiology,1998,36(1):43-54.
[6]Shimizu T,Lin F,Hasegawa M,etal.Purification and identification of naringenin 7-O-methyltransferase,a key enzyme in biosynthesis of flavonoid phytoalexin sakuranetin in rice [J].JournalofBiologicalChemistry,2012,287(23):19315-19325.
[7]Akashi T,Sawada Y,Shimada N,etal.cDNA cloning and biochemical characterization of S-adenosyl-L-methionine:2,7,4′-trihydroxyisoflavanone 4′-O-methyltransferase,a critical enzyme of the legume isoflavonoid phytoalexin pathway[J].PlantCellPhysiology,2003,44(2):103-112.
[8]田 铃,嵇保中,刘曙雯,等.甲基转移酶的功能与分类[J].生命的化学,2007,27(5):425-427.
Tian L,Ji B Z,Liu S W,etal.Research progress of methyltransferese [J].ChemistryofLife,2007,27(5):425-427.
[9]马成英,施江,吕海鹏,等.茶树氧甲基转移酶基因的克隆及原核表达[J].茶叶科学,2013,33(6):532-540.
Ma C Y,Shi J,Lv H P,etal.Cloning and prokaryotic expression of o-methyltransferase from camellia sinensis [J].JournalofTeaScience,2013,33(6):532-540.
[10]张传丽,仲月明,沈丹红,等.植物类黄酮O-甲基转移酶研究进展[J].西北植物学报,2012,32(6):1274-1281.
Zhang C L,Zhong Y M,Shen D H,etal.Recent progress in plant flavonoid O-methyltransferase [J].ActaBotanicaBoreali-OccidentaliaSinica,2012,32(6):1274-1281.
[11]Yang H,Ahn J H,Ibrahim R K,etal.The three-dimensional structure of Arabidopsis thaliana O-methyltransferase predicted by homology-based modelling [J].JournalofMolecularGraphicsandModelling,2004,23(1):77-87.
[12]Brahim R K,Muzac I.The methyltransferase gene superfamily:a tree with multiple branches [M].Amsterdam:Pergamon Press,2000:349-384.
[13]Christensen A B,Gregersen P L,Olsen C E,etal.A flavonoid 7-O-methyltransferase is expressed in barley leaves in response to pathogen attack [J].PlantMolecularBiology,1998,36(2):219-227.
[14]Zhou J M,Gold N D,Martin V J J,etal.Sequential O-methylation of tricetin by a single gene product in wheat [J].BBA-GeneralSubjects,2006,1760(7):1115-1124.
[15]余春磊,齐国昌,张鹍飞,等.大麦花后四种主要黄酮物质含量的动态变化[J].麦类作物学报,2014,34(2):222-226.
Yu C L,Qi G C,Zhang K F,etal.Studies on the accumulation of four major flavonoids after flowering in barley [J].JournaofTriticeaeCrops,2014,34(2):222-226.
[16]Jia J,Zhao S,Kong X,etal.Aegilops tauschii draft genome sequence reveals a gene repertoire for wheat adaptation [J].Nature,2013,496(7443):91-95.
[17]Ling H Q,Zhao S,Liu D,etal.Draft genome of the wheat A-genome progenitorTriticumurartu[J].Nature,2013,496(7443):87-90.
[18]Lee J E,Kleinhofs A,Graner A,etal.Genomic sequence and mapping of a methyljasmonate-induced O-methyltransferase from barley (HordeumvulgareL.)[J].MitochondrialDNA,1997,7(6):357-363.
[19]邹凤莲,寿森炎,叶纨芝,等.类黄酮化合物在植物胁迫反应中作用的研究进展[J].细胞生物学杂志,2004,26(1):39-44.
Zou F L,Shou S Y,Ye W Z,etal.Advances in the research on flavonoid biosynthesis and plant stress response [J].ChineseJournalofCellBiology,2004,26(1):39-44.
[20]Harborne J B.The comparative biochemistry of phytoalexin induction in plants [J].BiochemicalSystematicsandEcology,1999,27(4):335-367.
[21]Kidd P S,Llugany M,Poschenrieder C H,etal.The role of root exudates in aluminium resistance and silicon-induced amelioration of aluminium toxicity in three varieties of maize (ZeamaysL.)[J].JournalofExperimentalBotany,2001,52(359):1339-1352.
[22]Liu C J,Dixon R A.Elicitor-induced association of isoflavone O-methyltransferase with endomembranes prevents the formation and 7-O-methylation of daidzein during isoflavonoid phytoalexin biosynthesis[J].PlantCellOnline,2001,13(12):2643-2658.
[23]Deavours B E,Liu C J,Naoumkina M A,etal.Functional analysis of members of the isoflavone and isoflavanone O-methyltransferase enzyme families from the model legumeMedicagotruncatula[J].PlantMolecularBiology,2006,62(4-5):715-733.
[24]Kim B G,Lee H J,Park Y,etal.Characterization of an O-methyltransferase from soybean [J].PlantPhysiologyandBiochemistry,2006,44(4):236-241.
[25]Maria V G R,Nikolay O,Adèle H,etal.An O-methyltransferase modifies accumulation of methylated anthocyanins in seedlings of tomato [J].PlantJournal,2014,80(4):695-708.
[26]Pellegrini L,Geoffroy P,Fritig B,etal.Molecular cloning and expression of a new class of ortho-diphenol-O-methyltransferases induced in tobacco (NicotianatabacumL.) leaves by infection or elicitor treatment [J].PlantPhysiology,1993,103(2):509-517.
[27]Muzac I,Wang J,Anzellotti D,etal.Functional expression of an Arabidopsis cDNA clone encoding a flavonol 3′-O-methyltransferase and characterization of the gene product [J].ArchivesofBiochemistryandBiophysics,2000,375(2):385-388.
[28]Kim B G,Lee Y,Hur H G,etal.Flavonoid 3′-O-methyltransferase from rice:cDNA cloning,characterization and functional expression [J].Phytochemistry,2006,67(4):387-394.
[29]Rakwal R,Agrawal G K,Yonekura M,etal.Naringenin 7-O-methyltransferase involved in the biosynthesis of the flavanone phytoalexin sakuranetin from rice (OryzasativaL.) [J].PlantScience,2000,155(2):213-221.
[30]Wu S Q,Watanabe N,Mita S,etal.Two O-methyltransferases isolated from flower petals ofRosachinensisvar.spontanea involved in scent biosynthesis [J].JournalofBioscienceandBioengineering,2003,(96):119-128.
[31]Hugueney P,Provenzano S,Verriès C,etal.A novel cation-dependent O-methyltransferase involved in anthocyanin methylation in grapevine [J].PlantPhysiology,2009,150(4):2057-2070.
[32]Kim B G,Sung S H,Chong Y,etal.Plant flavonoid O-methyltransferases:substrate specificity and application [J].JournalofPlantBiology,2010,53(5):321-329.
[33]Kim B G,Jung B R,Lee Y,etal.Regiospecific flavonoid 7-O-methylation with Streptomyces avermitilis O-methyltransferase expressed inEscherichiacoli[J].JournalofAgriculturalandFoodChemistry,2006,54(3):823-828.
[34]Kim B G,Lee Y J,Lee S,etal.Altered regioselectivity of a poplar O-methyltransferase,POMT-7 [J].JournalofBiotechnology,2008,138(3):107-111.
[35]Gupta A,Kumar P H,Dineshkumar T K,etal.Crystal structure of Rv2118c:an AdoMet-dependent methyltransferase fromMycobacteriumtuberculosisp7Rv 1,2 [J].JournalofMolecularBiology,2001,312(2):381-391.
[36]Zubieta C,He X Z,Dixon R A,etal.Structures of two natural product methyltransferases reveal the basis for substrate specificity in plant O-methyltransferases [J].NatureStructural&MolecularBiology,2001,8(3):271-279.
[37]张战锋,韩丽乔,庄俊华,等.pET32a-AKT1重组质粒的构建与表达[J].国际检验医学杂志,2014,35(9):1092-1094.
Zhang Z F,Han L Q,Zhuang J H,etal.Construction and expression of recombinant plasmids pET32a-AKT1 [J].InternationalJournalofLaboratoryMedicine,2014,35(9):1092-1094.
Cloning and Prokaryotic Expression Analysis of F7-OMT Gene from Hulless Barley
MOU Li,ZHANG Kunfei,LI Peng,FANG Jian,LIU Xinchun,FENG Zongyun
(College of Agronomy,Sichuan Agricultural University,Chengdu,Sichuan 611130,China)
Abstract:Flavonoid 7-O-methyltransferase(F7-OMT) can produce phytoalexin with the ability of methylating flavonoids for its methyltransferase function so that it can improve the antibacterial property in plant.In order to lay further research foundation for the protein,the objective gene sequence of F7-OMT was cloned from the hulless barley material “94-19-1” by using the homology-based cloning technique in this research,bioinformatics analysis showed the full length of open reading frame (ORF) with 1173 bp in F7-OMT that encoded 390 amino acid residues. The calculated molecular mass of the putative protein without signal peptide was 42207.8 Da and the isoelectric point was predicted as 5.36. And the gene had Methyltransf_2 and Dimerization domains that were highly conserved. pET-32a- F7-OMT fusion expression vector,which could be induced to express in E.coli BL21(DE3)pLysS was constructed. The purified protein was obtained through affinity chromatography purification method.
Key words:Hulless barley;Flavonoid 7-O-methyltransferase;Cloning;Bioinformatics analysis;Prokaryotic expression
中图分类号:S512.3;S330
文献标识码:A
文章编号:1009-1041(2016)01-0018-08
通讯作者:冯宗云(E-mail:zyfeng49@126.com)
基金项目:国家现代农业产业技术体系(大麦青稞体系)建设专项(CARS-05)
收稿日期:2015-08-18修回日期:2015-10-07
网络出版时间:2016-01-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160108.1820.006.html
第一作者E-mail:pasheaty@hotmail.com

