春小麦育种材料抗旱性和穗发芽抗性分子标记鉴定
孙晓燕,魏 旭,赵春芝,杨 燕
(1.内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018; 2.内蒙古巴彦淖尔盟农业科学研究所,内蒙古巴彦淖尔 015000)
春小麦育种材料抗旱性和穗发芽抗性分子标记鉴定
孙晓燕1,魏 旭1,赵春芝2,杨 燕1
(1.内蒙古农业大学生命科学学院,内蒙古呼和浩特 010018; 2.内蒙古巴彦淖尔盟农业科学研究所,内蒙古巴彦淖尔 015000)
摘要:为给春小麦生育早期抗旱和收获期抗穗发芽育种提供抗性亲本,利用与小麦抗旱性相关的分子标记TaNRX-B1a1、TaNRX-B1b1和 FerA1-intrl以及与小麦穗发芽抗性相关的分子标记Vp1B3、Vp1A3和Tamyb10D对137份内蒙古春小麦育种材料进行检测。结果表明,73B609等共58份材料的抗旱性分子标记均属于抗旱基因型,占供试材料的42.34%,其单倍型组合为 TaNRX-B1a/TaFer-A1a,可以用作抗旱育种的亲本材料。中国春既属于Vp-1Bb等位基因类型,同时用标记Tamyb10D检测时也属于抗穗发芽类型。辽春10号在3个分子标记的检测中均属于抗穗发芽的等位基因类型,同时又是 TaNRX-B1a/TaFer-A1a单倍型,所以辽春10号在抗穗发芽和抗旱性聚合育种中可以作为亲本使用。
关键词:小麦;抗旱性;穗发芽抗性;STS标记
干旱是影响小麦产量和品质最主要的非生物因素之一[1],而我国又是水资源短缺的国家,所以提高小麦的抗旱性能是小麦生产对育种提出的要求。抗旱相关的分子标记的开发及其有效性评价对选育抗旱性小麦新品种具有重要意义。随着分子生物学的发展,与小麦抗旱相关蛋白基因的定位和相关标记的研究取得一定进展。比如,Morgan等[2]利用中国春异代换系,将渗透调节相关的基因定位于7A染色体上,并且获得了与渗透调节相关基因紧密连锁的RFLP标记Xpsr119。Peng等[3]指出在受到干旱胁迫时,抗旱小麦品种可表达较多与抗氧化有关的蛋白。活性氧的积累是导致在干旱胁迫下细胞组分损伤的直接原因之一,植物体内活性氧的清除主要依靠一些抗氧化保护的酶类[4]。因此,提高植物的抗氧化能力可增强植物对非生物胁迫的耐性。硫氧还蛋白(Thioredoxin,Trx)是一类广泛存在于植物体内的多功能蛋白,参与光合作用中的电子传递、被氧化蛋白质的修复、体内活性氧的清除等生理代谢[5-7]。张 帆等[8]根据普通小麦Trx超家族新基因 TaNRX-B1开发了1对与小麦抗旱性相关的显性互补STS标记TaNRX-B1a1和TaNRX-B1b1,可以检测出两种与抗旱性相关的等位变异 TaNRX-B1a和 TaNRX-B1b。其中,单倍型为 TaNRX-B1a的材料的抗旱性极显著高于单倍型为 TaNRX-B1b的材料。铁结合蛋白(Ferritin,Fer)是存在于植物体内的铁储藏蛋白,可以提高植物防御氧化胁迫能力[9]。鞠丽萍等[10]根据不同抗旱性小麦中 TaFer-A1基因的序列差异,开发出共显性STS标记FerA1-intrl,可以在不同抗旱性小麦中检测出两种等位变异类型,分别为TaFer-A1a和 TaFer-A1b,且单倍型为TaFer-A1a的材料的抗旱性极显著高于单倍型为 TaFer-A1b的材料。
穗发芽极大地降低了小麦的产量和加工品质[11]。目前抗穗发芽小麦育种已经成为全世界小麦育种亟待解决的关键问题之一[12]。降低小麦品种穗发芽损害的一个主要方法是利用分子标记辅助育种对品种的穗发芽抗性进行筛选,这样可以加快穗发芽抗性品种的育成。目前已经有许多与小麦穗发芽抗性相关的分子标记被开发和应用,其中,标记Vp1A3 和 Vp1B3是根据白粒小麦休眠基因 viviparous-1在不同穗发芽抗性小麦材料中的序列差异开发出的2个与白粒小麦穗发芽抗性相关的分子标记,并且在育种亲本和后代的选择中表现出了高效的筛选效果[13-14]。用标记Vp1B3在不同休眠特性的小麦材料中共可以检测出5种等位基因类型,分别为 Vp-1Ba、 Vp-1Bb、 Vp-1Bc、 Vp-1Bd和 Vp-1Be,其中, Vp-1Bb和 Vp-1Bc是抗穗发芽基因型, Vp-1Bb与 Vp-1Bc基因型相比具有更高的穗发芽抗性[15-19]。标记Vp1A3位于小麦3A染色体上,由两对引物组成,包括TaVp-1AF2/R2和TaVp-1AF4/R4,在各种不同基因型材料中检测出17种等位变异类型;其中用引物TaVp-1AF2/R2目前检测出9种片段类型,分别为774 bp(用字母A表示)、789 bp(B)、783 bp(L) 、780 bp(K)、765 bp(J) 、762 bp(G)、759 bp(R)、733bp(H)和725 bp(I),其中检测出G片段类型的材料属于抗穗发芽类型材料[17],所以一般情况下,用分子标记Vp1A3筛选抗穗发芽材料时只用引物TaVp-1AF2/R2检测即可。标记Tamyb10D是根据不同休眠特性的小麦材料中 Tamyb10-D1基因的序列差异开发出的1个与小麦穗发芽抗性相关的STS标记,共可以检测出2种片段类型,一种可以扩增出1 629 bp的片段,另外一种未扩增出此特异性片段,前者属于抗穗发芽类型[20]。
我国春小麦主要种植省区包括黑龙江、吉林、甘肃、内蒙古和新疆,在小麦播种季节和生育早期经常会遇到干旱胁迫,而在收获季节同样会受到穗发芽的损害。本研究利用与小麦抗旱性相关的分子标记TaNRX-B1a1、TaNRX-B1b1和 FerA1-intrl以及与小麦穗发芽抗性相关的分子标记Vp1B3、Vp1A3和Tamyb10D,对137份内蒙古春小麦育种材料进行抗旱性和穗发芽抗性筛选,以期为春小麦生育早期抗旱和收获期抗穗发芽育种中亲本的选择提供理论依据。
1材料与方法
1.1供试材料
供试材料为137份内蒙古春小麦育种材料,均由内蒙古巴彦淖尔市农业科学研究所提供。
1.2分子标记
本研究中抗旱基因型检测的分子标记选用TaNRX-B1a1[8]、TaNRX-B1b1[8]和 FerA1-intrl[10];抗穗发芽基因型检测的分子标记选用Vp1B3[17]、Vp1A3[13-19]和Tamyb10-D[20],其中标记Vp1A3只选用引物TaVp-1AF2/R2。各标记的详细信息见表1。
1.3DNA的提取和基因组PCR扩增
采用CTAB法[21]提取供试材料幼苗的基因组DNA。 PCR反应体系为15 μL,包括ddH2O 10.55 μL、10×PCR Buffer 1.5 μL、2.5 mmol·L-1dNTP Mix 1.2 μL、20 mmol·L-1的上下游引物各0.3 μL、5 U·μL-1LATaq酶(购自TaRaKa公司)0.15 μL和30 ng 模板DNA 1 μL。PCR扩增程序:94 ℃预变性5 min; 94 ℃
变性30 s至1 min,退火30 s至1 min,72 ℃延伸30 s至1 min,35个循环;72 ℃延伸10 min。标记TaNRX-B1a1、TaNRX-B1b1、Vp1B3和Tamyb10D的PCR产物用2.0%的琼脂糖凝胶电泳检测;标记Fer-A1intrl的PCR产物用12%的聚丙烯酰胺凝胶电泳检测;标记Vp1A3的PCR产物用6%的聚丙烯酰胺凝胶电泳检测。

表1 本研究选用的分子标记
X1表示等位变异暂时并未命名
X1 indicated the allele was not named temporarily
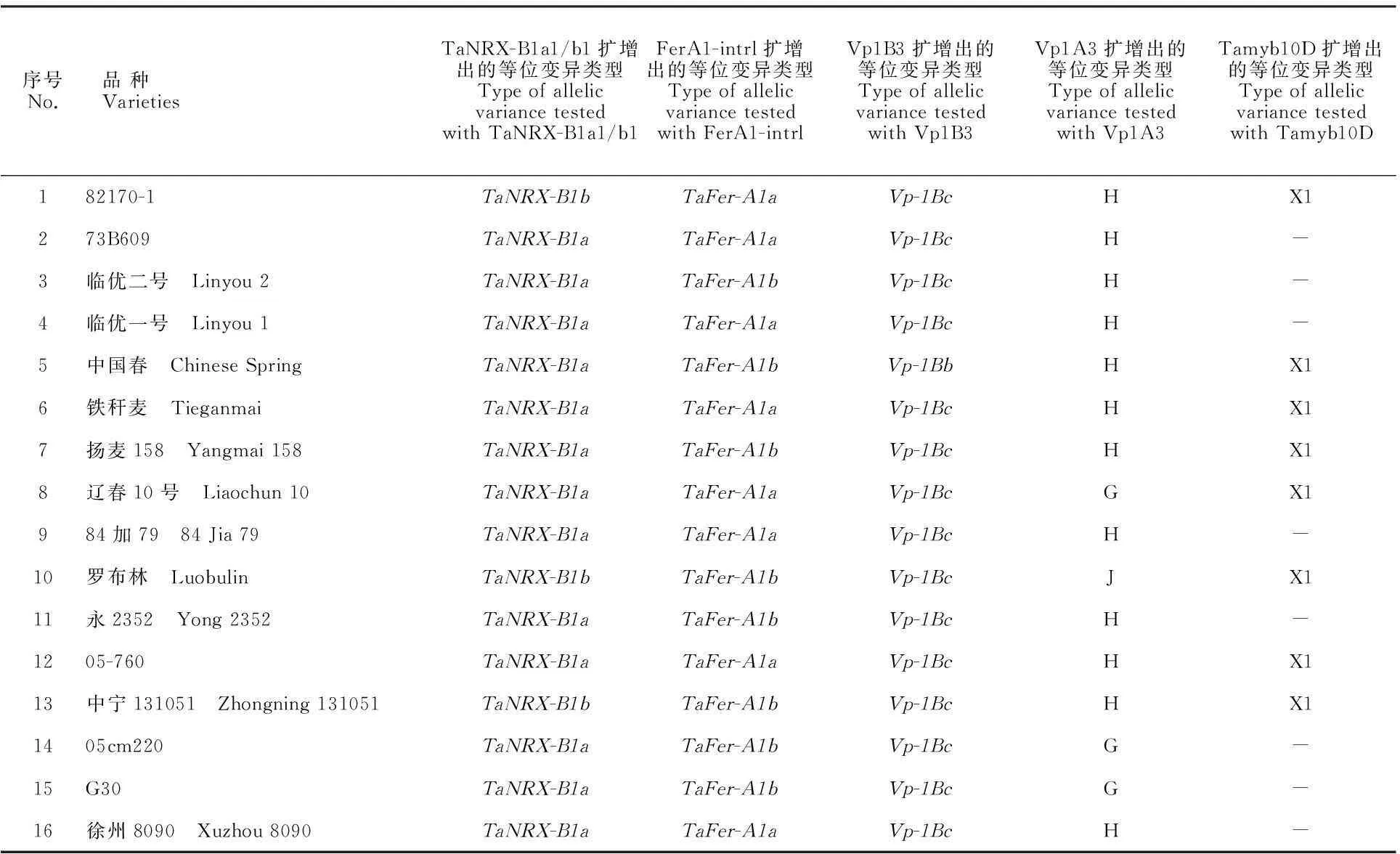
表2 五种标记对137份春小麦育种材料的检测结果
(续表2Continued table 2)
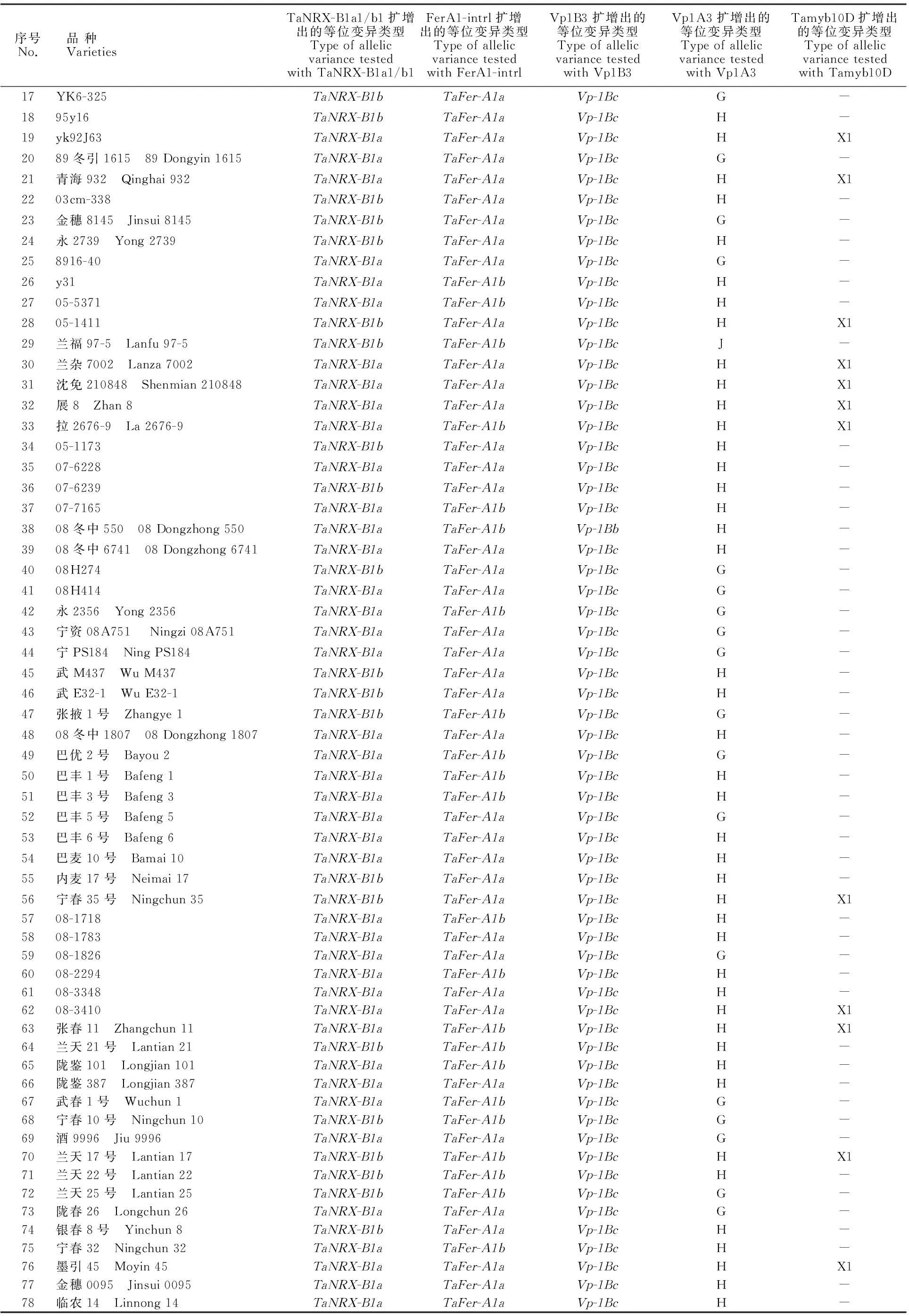
序号No.品种VarietiesTaNRX-B1a1/b1扩增出的等位变异类型TypeofallelicvariancetestedwithTaNRX-B1a1/b1FerA1-intrl扩增出的等位变异类型TypeofallelicvariancetestedwithFerA1-intrlVp1B3扩增出的等位变异类型TypeofallelicvariancetestedwithVp1B3Vp1A3扩增出的等位变异类型TypeofallelicvariancetestedwithVp1A3Tamyb10D扩增出的等位变异类型TypeofallelicvariancetestedwithTamyb10D17YK6-325TaNRX-B1bTaFer-A1aVp-1BcG-1895y16TaNRX-B1bTaFer-A1aVp-1BcH-19yk92J63TaNRX-B1aTaFer-A1aVp-1BcHX12089冬引1615 89Dongyin1615TaNRX-B1aTaFer-A1aVp-1BcG-21青海932 Qinghai932TaNRX-B1aTaFer-A1aVp-1BcHX12203cm-338TaNRX-B1bTaFer-A1aVp-1BcH-23金穗8145 Jinsui8145TaNRX-B1bTaFer-A1aVp-1BcG-24永2739 Yong2739TaNRX-B1bTaFer-A1aVp-1BcH-258916-40TaNRX-B1aTaFer-A1aVp-1BcG-26y31TaNRX-B1aTaFer-A1bVp-1BcH-2705-5371TaNRX-B1aTaFer-A1bVp-1BcH-2805-1411TaNRX-B1bTaFer-A1aVp-1BcHX129兰福97-5 Lanfu97-5TaNRX-B1bTaFer-A1bVp-1BcJ-30兰杂7002 Lanza7002TaNRX-B1aTaFer-A1aVp-1BcHX131沈免210848 Shenmian210848TaNRX-B1aTaFer-A1aVp-1BcHX132展8 Zhan8TaNRX-B1aTaFer-A1aVp-1BcHX133拉2676-9 La2676-9TaNRX-B1aTaFer-A1bVp-1BcHX13405-1173TaNRX-B1bTaFer-A1aVp-1BcH-3507-6228TaNRX-B1aTaFer-A1aVp-1BcH-3607-6239TaNRX-B1bTaFer-A1aVp-1BcH-3707-7165TaNRX-B1aTaFer-A1bVp-1BcH-3808冬中550 08Dongzhong550TaNRX-B1aTaFer-A1bVp-1BbH-3908冬中6741 08Dongzhong6741TaNRX-B1aTaFer-A1aVp-1BcH-4008h174TaNRX-B1bTaFer-A1aVp-1BcG-4108H414TaNRX-B1aTaFer-A1aVp-1BcG-42永2356 Yong2356TaNRX-B1aTaFer-A1bVp-1BcG-43宁资08A751 Ningzi08A751TaNRX-B1aTaFer-A1aVp-1BcG-44宁PS184 NingPS184TaNRX-B1aTaFer-A1aVp-1BcG-45武M437 WuM437TaNRX-B1bTaFer-A1aVp-1BcH-46武E32-1 WuE32-1TaNRX-B1bTaFer-A1aVp-1BcH-47张掖1号 Zhangye1TaNRX-B1bTaFer-A1bVp-1BcG-4808冬中1807 08Dongzhong1807TaNRX-B1aTaFer-A1aVp-1BcH-49巴优2号 Bayou2TaNRX-B1aTaFer-A1bVp-1BcG-50巴丰1号 Bafeng1TaNRX-B1aTaFer-A1bVp-1BcH-51巴丰3号 Bafeng3TaNRX-B1aTaFer-A1bVp-1BcH-52巴丰5号 Bafeng5TaNRX-B1aTaFer-A1aVp-1BcG-53巴丰6号 Bafeng6TaNRX-B1aTaFer-A1aVp-1BcH-54巴麦10号 Bamai10TaNRX-B1aTaFer-A1aVp-1BcH-55内麦17号 Neimai17TaNRX-B1bTaFer-A1aVp-1BcH-56宁春35号 Ningchun35TaNRX-B1bTaFer-A1aVp-1BcHX15708-1718TaNRX-B1aTaFer-A1bVp-1BcH-5808-1783TaNRX-B1aTaFer-A1aVp-1BcH-5908-1826TaNRX-B1aTaFer-A1aVp-1BcG-6008-2294TaNRX-B1aTaFer-A1bVp-1BcH-6108-3348TaNRX-B1aTaFer-A1aVp-1BcH-6208-3410TaNRX-B1aTaFer-A1aVp-1BcHX163张春11 Zhangchun11TaNRX-B1aTaFer-A1bVp-1BcHX164兰天21号 Lantian21TaNRX-B1bTaFer-A1bVp-1BcH-65陇鉴101 Longjian101TaNRX-B1aTaFer-A1bVp-1BcH-66陇鉴387 Longjian387TaNRX-B1aTaFer-A1aVp-1BcH-67武春1号 Wuchun1TaNRX-B1aTaFer-A1bVp-1BcG-68宁春10号 Ningchun10TaNRX-B1bTaFer-A1bVp-1BcG-69酒9996 Jiu9996TaNRX-B1aTaFer-A1aVp-1BcG-70兰天17号 Lantian17TaNRX-B1bTaFer-A1bVp-1BcHX171兰天22号 Lantian22TaNRX-B1bTaFer-A1bVp-1BcH-72兰天25号 Lantian25TaNRX-B1bTaFer-A1bVp-1BcG-73陇春26 Longchun26TaNRX-B1aTaFer-A1aVp-1BcG-74银春8号 Yinchun8TaNRX-B1bTaFer-A1aVp-1BcH-75宁春32 Ningchun32TaNRX-B1aTaFer-A1bVp-1BcH-76墨引45 Moyin45TaNRX-B1aTaFer-A1aVp-1BcHX177金穗0095 Jinsui0095TaNRX-B1aTaFer-A1aVp-1BcH-78临农14 Linnong14TaNRX-B1aTaFer-A1aVp-1BcH-
(续表2Continued table 2)
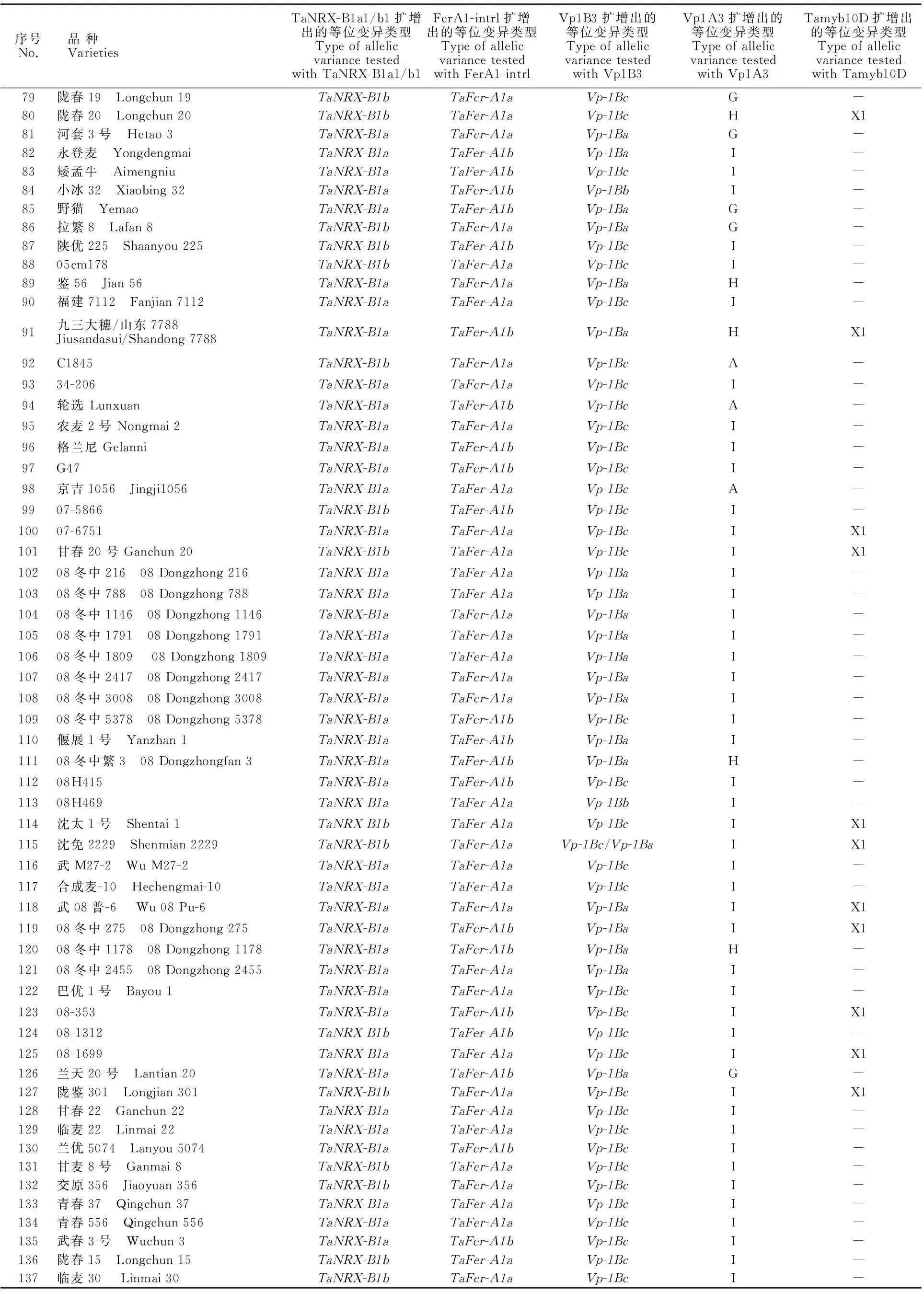
序号No.品种VarietiesTaNRX-B1a1/b1扩增出的等位变异类型TypeofallelicvariancetestedwithTaNRX-B1a1/b1FerA1-intrl扩增出的等位变异类型TypeofallelicvariancetestedwithFerA1-intrlVp1B3扩增出的等位变异类型TypeofallelicvariancetestedwithVp1B3Vp1A3扩增出的等位变异类型TypeofallelicvariancetestedwithVp1A3Tamyb10D扩增出的等位变异类型TypeofallelicvariancetestedwithTamyb10D79陇春19 Longchun19TaNRX-B1bTaFer-A1aVp-1BcG-80陇春20 Longchun20TaNRX-B1bTaFer-A1aVp-1BcHX181河套3号 Hetao3TaNRX-B1aTaFer-A1aVp-1BaG-82永登麦 YongdengmaiTaNRX-B1aTaFer-A1bVp-1BaI-83矮孟牛 AimengniuTaNRX-B1aTaFer-A1bVp-1BcI-84小冰32 Xiaobing32TaNRX-B1aTaFer-A1bVp-1BbI-85野猫 YemaoTaNRX-B1aTaFer-A1bVp-1BaG-86拉繁8 Lafan8TaNRX-B1bTaFer-A1aVp-1BaG-87陕优225 Shaanyou225TaNRX-B1bTaFer-A1bVp-1BcI-8805cm178TaNRX-B1bTaFer-A1aVp-1BcI-89鉴56 Jian56TaNRX-B1aTaFer-A1aVp-1BaH-90福建7112 Fanjian7112TaNRX-B1aTaFer-A1aVp-1BcI-91九三大穗/山东7788Jiusandasui/Shandong7788TaNRX-B1aTaFer-A1bVp-1BaHX192C1845TaNRX-B1bTaFer-A1aVp-1BcA-9334-206TaNRX-B1aTaFer-A1aVp-1BcI-94轮选LunxuanTaNRX-B1aTaFer-A1bVp-1BcA-95农麦2号Nongmai2TaNRX-B1aTaFer-A1aVp-1BcI-96格兰尼GelanniTaNRX-B1aTaFer-A1bVp-1BcI-97G47TaNRX-B1aTaFer-A1bVp-1BcI-98京吉1056 Jingji1056TaNRX-B1aTaFer-A1aVp-1BcA-9907-5866TaNRX-B1bTaFer-A1bVp-1BcI-10007-6751TaNRX-B1aTaFer-A1aVp-1BcIX1101甘春20号Ganchun20TaNRX-B1bTaFer-A1aVp-1BcIX110208冬中216 08Dongzhong216TaNRX-B1aTaFer-A1aVp-1BaI-10308冬中788 08Dongzhong788TaNRX-B1aTaFer-A1aVp-1BaI-10408冬中1146 08Dongzhong1146TaNRX-B1aTaFer-A1aVp-1BaI-10508冬中1791 08Dongzhong1791TaNRX-B1aTaFer-A1aVp-1BaI-10608冬中1809 08Dongzhong1809TaNRX-B1aTaFer-A1aVp-1BaI-10708冬中2417 08Dongzhong2417TaNRX-B1aTaFer-A1aVp-1BaI-10808冬中3008 08Dongzhong3008TaNRX-B1aTaFer-A1aVp-1BaI-10908冬中5378 08Dongzhong5378TaNRX-B1aTaFer-A1bVp-1BcI-110偃展1号 Yanzhan1TaNRX-B1aTaFer-A1bVp-1BaI-11108冬中繁3 08Dongzhongfan3TaNRX-B1aTaFer-A1bVp-1BaH-11208H415TaNRX-B1aTaFer-A1bVp-1BcI-11308H469TaNRX-B1aTaFer-A1aVp-1BbI-114沈太1号 Shentai1TaNRX-B1bTaFer-A1aVp-1BcIX1115沈免2229 Shenmian2229TaNRX-B1bTaFer-A1aVp-1Bc/Vp-1BaIX1116武M27-2 WuM27-2TaNRX-B1aTaFer-A1aVp-1BcI-117合成麦-10 Hechengmai-10TaNRX-B1aTaFer-A1aVp-1BcI-118武08普-6 Wu08Pu-6TaNRX-B1aTaFer-A1aVp-1BaIX111908冬中275 08Dongzhong275TaNRX-B1aTaFer-A1bVp-1BaIX112008冬中1178 08Dongzhong1178TaNRX-B1aTaFer-A1bVp-1BaH-12108冬中2455 08Dongzhong2455TaNRX-B1aTaFer-A1aVp-1BaI-122巴优1号 Bayou1TaNRX-B1aTaFer-A1aVp-1BcI-12308-353TaNRX-B1aTaFer-A1bVp-1BcIX112408-1312TaNRX-B1bTaFer-A1bVp-1BcI-12508-1699TaNRX-B1aTaFer-A1aVp-1BcIX1126兰天20号 Lantian20TaNRX-B1aTaFer-A1bVp-1BaG-127陇鉴301 Longjian301TaNRX-B1bTaFer-A1aVp-1BcIX1128甘春22 Ganchun22TaNRX-B1aTaFer-A1aVp-1BcI-129临麦22 Linmai22TaNRX-B1aTaFer-A1aVp-1BcI-130兰优5074 Lanyou5074TaNRX-B1aTaFer-A1bVp-1BcI-131甘麦8号 Ganmai8TaNRX-B1bTaFer-A1aVp-1BcI-132交原356 Jiaoyuan356TaNRX-B1bTaFer-A1aVp-1BcI-133青春37 Qingchun37TaNRX-B1aTaFer-A1aVp-1BcI-134青春556 Qingchun556TaNRX-B1aTaFer-A1aVp-1BcI-135武春3号 Wuchun3TaNRX-B1aTaFer-A1bVp-1BcI-136陇春15 Longchun15TaNRX-B1bTaFer-A1aVp-1BcI-137临麦30 Linmai30TaNRX-B1bTaFer-A1aVp-1BcI-
“-”表示未扩增出目的片段
“-” represent nonspecific amplification fragment
2结果与分析
2.1标记Vp1B3的检测结果
利用标记Vp1B3对137份春小麦育种材料进行检测,结果(图1、表2)发现,中国春等4份材料扩增出845 bp的特异性片段,属于 Vp-1Bb单倍型,占供试材料的2.92%;82170-1等112份材料扩增出569 bp的特异性片段,属于 Vp-1Bc单倍型,占供试材料的81.75%;武08普-6等20份材料扩增出652 bp的特异性片段,属于 Vp-1Ba单倍型,占供试材料的14.60%;沈免2299同时扩增出569 bp和652 bp的特异性片段,属于 Vp-1Ba/ Vp-1Bc杂合基因型,占供试材料的0.73%。
2.2标记Vp1A3的检测结果
利用标记Vp1A3对137份春小麦育种材料进行检测,结果(图2、表2)发现,永登麦等46份材料扩增出725 bp的特异性片段,属于I片段类型,占供试材料的33.58%;C1845等3份材料扩增出774 bp的特异性片段,属于A片段类型,占供试材料的2.19%;82170-1等58份材料扩增出733 bp的特异性片段,属于H片段类型,占供试材料的42.34%;罗布林和兰福97-5扩增出765 bp的特异性片段,属于J片段类型,占供试材料的1.46%;临优一号等28份材料扩增出762 bp的特异性片段,属于G片段类型,占供试材料的20.44%。

M:DL2 000;1:武08普-6;2:08H414;3:武E32-1;4:08H415;5:张掖1号;6:08H469;7:沈太1号;8:08冬中275;9:武M437;10:巴优2号;11:08-1826;12:巴优1号;13:宁PS184;14:08冬中2455;15:宁资08A751
M:DL2 000; 1:Wu 08 Pu-6;2:08H414;3:Wu E32-1;4:08H415;5:Zhangye 1;6:08H469;7:Shentai 1;8:08 Dongzhong 275;9:Wu M437;10:Bayou 2;11:08-1826;12:Bayou 1;13:Ning PS184;14:08 Dongzhong 2455;15:Ningzi 08A751
图1标记Vp1B3扩增的部分结果
Fig.1PCR fragments amplified with the marker Vp1B3 in part of varieties

I:永登麦;H:临优二号;G:临优一号;J:罗布林;A:轮选
I:Yongdengmai;H:Linyou 2;G:Linyou 1; J:Luobulin;A:Lunxuan
图2标记Vp1A3扩增的部分结果
Fig.2PCR fragments amplified with the
marker Vp1A3 in part of varieties
2.3标记Tamyb10D的检测结果
利用标记Tamyb10D对137份春小麦育种材料进行检测,结果(图3、表2)发现,82170-1等31份材料扩增出1 629 bp的特异性片段,属于抗穗发芽基因类型,占供试材料的22.6%;73B609等106份材料并未扩增出上述特异性片段,属于感穗发芽基因类型,占供试材料的77.4%。
2.4标记TaNRX-B1a1和TaNRX-B1b1的检测结果
利用显性互补STS标记TaNRX-B1a1和TaNRX-B1b1对137份春小麦育种材料进行检测,结果(图4、表2)发现,标记TaNRX-B1a1在河套3号等90份材料中扩增出841 bp的特异性片段,在82170-1等47份材料中没有此特异性片段产生;相反,标记TaNRX-B1b1在82170-1等47份材料中扩增出870 bp的特异性片段,在河套3号等90份材料中没有此特异性片段产生。说明河套3号等90份材料属于 TaNRX-B1a单倍型,占供试材料的65.69%;82170-1等47份材料属于 TaNRX-B1b单倍型,占供试材料的34.31%。
2.5标记 FerA1-intrl的检测结果
利用共显性STS标记 FerA1-intrl对137份春小麦育种材料进行检测,结果(图5、表2)发现,河套3号等87份小麦品种(系)扩增出167 bp的片段,属于TaFer-A1a单倍型,占供试材料的63.5%;永登麦等50份小麦品种(系)中扩增出170 bp的片段,属于 TaFer-A1b单倍型,占供试材料的36.5%。

M:DL2000;1:河套3号;2:永登麦;3:82170-1;4:临优二号;5:临优一号;6:中国春;7:铁秆麦;8:扬麦158;9:小冰32;10:辽春10号;11:84加79;12:罗布林;13:野猫;14:拉繁8;15:陕优225;16:05cm178;17:05cm220;18:G30;19:95y16;20:yk92J63;21:鉴56;22:89冬引1615;23:青海932;24:03cm-338
M:DL2000; 1:Hetao 3; 2:Yongdengmai; 3:82170-1; 4:Linyou 2; 5:Linyou 1; 6:Chinese Spring; 7:Tieganmai; 8:Yangmai 158; 9:Xiaobing 32; 10:Liaochun 10; 11:84 Jia 79; 12:Luobulin; 13:Yemao; 14:Lafan 8; 15:Shaanyou 225; 16:05cm178; 17:05cm220; 18:G30; 19:95y16; 20:yk92J63; 21:Jian 56; 22:89 Dongyin 1615; 23:Qinghai 932; 24:03cm-338
图3标记Tamyb10D扩增的部分结果
Fig.3PCR fragments amplified with the marker Tamyb10D in part of varieties
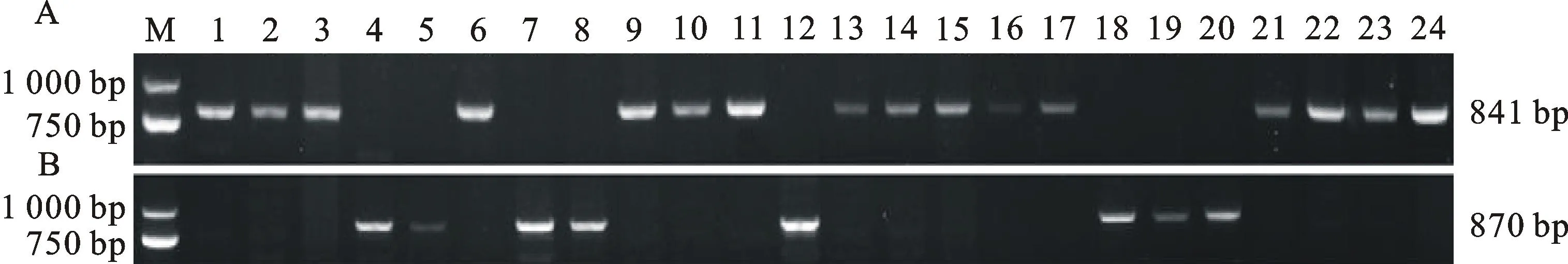
M:DL2000;1:鉴56;2:89冬引1615;3:青海932;4:03cm-338;5:金穗8145;6:福建7112;7:中宁131051;8:永2739;9:九三大穗/山东7788;10:永2352;11:8916-40;12:C1845;13:34-206;14:y31;15:05-5371;16:05-760;17:轮选;18:05-1411;19:农麦2号;20:兰福97-5;21:兰杂7002;22:沈免210848;23:格兰尼;24:G47
M:DL2000;1:Jian 56;2:89 Dongyin 1615; 3:Qinghai 932; 4:03cm-338; 5:Jinsui 8145; 6:Fujian 7112; 7:Zhongning 131051; 8:Yong 2739; 9:Jiusandasui/Shandong 7788; 10:Yong 2352; 11:8916-40; 12:C1845; 13:34-206; 14:y31; 15:05-5371; 16:05-760; 17:Lunxuan; 18:05-1411; 19:Nongmai 2; 20:Lanfu 97-5; 21:Lanza 7002; 22:Shenmian 210848; 23:Gelanni;24:G47
图4标记TaNRX-B1a1(A)和TaNRX-B1b1(B)扩增的部分结果
Fig.4PCR fragments amplified with the marker TaNRX-B1a1(A) and
TaNRX-B1b1(B) in part of varieties

1:辽春10号;2:84加79;3:罗布林;4:野猫;5:拉繁8;6:陕优225;7:05cm178;8:05cm220;9:G30;10:徐州8090;11:YK6-325;12:95y16;13:yk92J63;14:鉴56;15:89冬引1615
1:Liaochun 10; 2:84 Jia 79; 3:Luobulin; 4:Yemao; 5:Lafan 8; 6:Shaanyou 225; 7:05cm178; 8:05cm220; 9:G30; 10:Xuzhou 8090; 11:YK6-325; 12:95y16; 13:yk92J63; 14:Jian 56; 15:89 Dongyin 1615
图5标记FerA1-intrl扩增的部分结果
Fig.5PCR fragments amplified with the marker FerA1-intrl in part of varieties
3讨 论
提高小麦的抗旱性能和穗发芽抗性是小麦抗逆育种中两个非常重要的育种目标,也是春小麦种植区在小麦生产中经常遇到的两个问题。在春小麦抗旱和抗穗发芽的育种中,正确地选择抗性亲本是决定育种成败的一个非常关键的因素。无论是小麦抗旱性还是穗发芽抗性,其抗性机理都是较为复杂的。所以如果抗性亲本选择单一依靠一个分子标记(根据某一抗性机理开发出来的分子标记),其结果的可靠性就会降低;如果使用不同的分子标记(根据影响某一抗性机理的不同因素开发出来的分子标记)对育种亲本进行综合筛选,就会提高结果的可靠性。小麦的抗旱性是一个受众多基因控制的复杂的数量性状,且与气候、土壤等环境因素相互作用,并且在小麦的不同生长发育阶段表现出一定的差异[22]。Mudgett等[23]根据诱导基因的表达产物所涉及的不同代谢功能,将干旱胁迫应答蛋白分为功能蛋白和调节蛋白两大类,功能蛋白涉及水通道蛋白、脂转移蛋白、蛋白酶抑制因子、光合结构保护酶、LEA蛋白、渗透调节物质和可溶性糖、抗氧化胁迫酶以及参与损伤修复的蛋白等;调节蛋白包括转录因子、蛋白激酶和蛋白磷酸酶等。本研究利用与小麦抗旱性相关的显性互补标记TaNRX-B1a1和TaNRX-B1b1以及共显性的STS标记 FerA1-intrl(均与氧胁迫信号转导途径的机理相关)在137份春小麦育种材料中共筛选出58份抗旱性材料,均属于TaNRX-B1a/TaFer-A1a的单倍型组合,占总数的42.34%。说明这套材料的总体抗旱水平比较高,再进一步结合田间观察和测试结果,完全可以从中筛选出优良抗旱亲本。
温度、湿度以及种子休眠性、α-淀粉酶活性、α-淀粉酶抑制剂、种皮颜色和颖壳抑制物等因素都影响小麦穗发芽抗性[24]。其中种子的休眠特性是影响小麦穗发芽抗性众多因素中的一个主要影响因素。本研究利用3个与小麦种子休眠特性相关的分子标记Vp1B3、Vp1A3和Tamyb10D,对研究材料的穗发芽抗性进行筛选,并且以前的研究表明标记Vp1B3和Vp1A3中的抗穗发芽的等位基因可能是通过非等位基因的互作来共同影响小麦种子的休眠特性,而且 TaVp-1Agm和TaVp-1Bb是影响小麦籽粒休眠特性的主要的等位基因类型[14]。在王晓丽[20]的研究中,发现标记Tamyb10D与种子的休眠特性有显著的相关性。本研究中,中国春既属于TaVp-1Bb的等位基因类型,同时用Tamyb10D检测时属于抗穗发芽的片段类型,所以从基因水平上再一次证明了中国春是抗穗发芽的基因型材料,结合多年的大田表现,证明中国春在抗穗发芽性状上的可靠性。同时辽春10号在用3种与穗发芽抗性相关的分子标记检测时,均都属于抗穗发芽的等位基因类型,同时属于TaNRX-B1a和TaFer-A1a的单倍型组合。所以辽春10号在抗旱性和抗穗发芽的聚合育种中可以做亲本使用。
参考文献:
[1]Banuelos G S,Fakra S C,Walse S S,etal.Selenium accumulation,distribution,and speciation in spineless prickly pear cactus:a drought- and salt-tolerant, selenium-enriched nutraceutical fruit crop for biofortified foods [J].PlantPhysiolgy,2011,1(155):315-327.
[2]Morgan J M,Tan M K.Chromosomal location of a wheat osmoregulation gene using RFLP analysis [J].AustralianofPlantPhysiology,1996,23:803-806.
[3]Peng Z,Wang M,Li F,etal.A proteomic study of the response to salinity and drought stress in an introgression strain of bread wheat [J].MolecularCellularProteomics,2009,12:2676-2686.
[4]Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J].PlantPhysiologyandBiochemistry,2010,48:909-930.
[5]Arnér E S J,Holmgren A.Physiological functions of thioredoxin and thioredoxin reductase [J].EuropeanJournalofBiochemistry,2001,267:6102-6109.
[6]Wong J H,Balmer Y,Cai N,etal.Unraveling thioredoxin-linked metabolic processes of cereal starchy endorsperm using proteomics [J].FEBSLetters,2003,547:151-156.
[7]Meyer Y,Vignols F,Reichheld J P.Classification of plant thioredoxins by sequences similarity and intron position [J].MethodsinEnzymology,2002,347:394-402.
[8]张 帆,蒋 雷,鞠丽萍,等.一个普通小麦Trx超家族新基因TaNRX的克隆与抗旱相关标记开发 [J].作物学报,2014,40(1):29-36.
Zhang F,Jiang L,Ju L P,etal.Cloning a novel geneTaNRXof Trx superfamily and developing its molecular markers related to drought resistance in common wheat [J].ActaAgronomicaSinica,2014,40(1):29-36.
[9]周志钦.植物铁结合蛋白基因研究现状 [J].生物技术,2001,11(3):29-33.
Zhou Z Q.Studies of the ferritin gene in plants [J].Biotecnology,2001,11(3):29-33.
[10]鞠丽萍,张 帆,蒋 雷,等.小麦 TaFer-A1基因抗旱相关分子标记的开发 [J].麦类作物学报,2014,33(5):901-906.
Ju L P,Zhang F,Jiang L,etal.Developmennt of specific molecular marker of TaFer-A1 for improving drought resistance in wheat [J].JournalofTriticeaeCrops,2014,33(5):901-906.
[11]Groops C,Gay G,Perretant M R.Study of the relationship between pre-harvest sprouting and grain color by quantitative trailoci analysis in a white×red grain bread-wheat cross [J].TheoreticalandAppliedGenetics,2002,104:39-47.
[12]Humphreys D G,Noll J.Methods for characterization of pre-harvest sprouting resistance in a wheat breeding program [J].Euphytica,2002,126:61-65.
[13]罗家传,朱高纪,吴秋艳,等.河南主栽小麦品种抗穗发芽研究 [J].农业科技通讯,2008(12):37-40.
Luo J C,Zhu G J,Wu Q Y,etal.The study on pre-harvest sprouting in Henan main planting wheat varieties [J].BulleninofAgiculturalScienceandTechnology,2008(12):37-40.
[14]杨 燕,赵献林,张 勇,等.四个小麦抗穗发芽分子抗性标记有效性的验证与评价 [J].作物学报,2008,34(1):17-24.
Yang Y,Zhao X L,Zhang Y,etal.Evaluation and validation of four molecular markers associated with pre-harvest sprouting tolerance in Chinese wheats [J].ActaAgronomicaSinica,2008,34(1):17-24.
[15]任立世,刘进英,杨 燕.107份小麦历史品种抗穗发芽基因型的检测 [J].麦类作物学报,2015,35(6):752-758.
Ren L S,Liu J Y,Yang Y.Determination of pre-harvest sprouting resistance genotypes with Vp1A3 and Vp1B3 in 107 Chinese historical wheat cultivars [J].JurnalofTriticeaeCrops,2015,35(6):752-758.
[16]Yang Y,Zhao X L,Xia L Q,etal.Development and validation of a Viviparous-1 STS marker for pre-harvest sprouting resistence in Chinese wheat [J].TheoreticalandAppliedGenetics,2007,115:971-980.
[17]Yang Y,Zhang C L,Liu S X,etal.Characterization of the rich haplotypes of Viviparous-1A in Chinese wheats and development of a novel sequence-tagged site marker for pre-harvest sprouting resistence [J].MolecularBreeding,2014,33(1):75-88.
[18]Hattori T,Terada T,Hamasuna S T.Sequence and functional analyses of the rice gene homologous to the maize Vp1 [J].PlantMolecularBiology,1994,24:805-810.
[19]McCarty D R,Hattori T,Carson C B,etal.The Viviparous-1 developmental gene of maize encodes a novel transcriptional activator [J].Cell,1991,66:895-905.
[20]王晓丽. Tamyb10基因在不同穗发芽抗性白粒小麦中等位变异的鉴定和分子标记研发 [D].呼和浩特:内蒙古农业大学,2014.
Wang X L.Identification and Development of a Tamyb10 STS Marker for Pre-harvest Sprouting Tolerance in Chinese Wheat [D].Huhhot:Inner Mongolia Agricultural University,2014.
[21]Gale K R,Ma W,Zhang W,etal.Simple high-through-put DNA markers for genotyping in wheat [C]//Proceedings 10th Australian Wheat Breeding Assembly,2001:26-31.
[22]Lan J S.Comparison of evaluating methods for agronomic drought resistance in crops [J].ActaAgriculturaeBoreali-OccidentalisSinical,1998,7(3):85-87.
[23]Mudgett M B,Clarke S.Hormonal and environmental responsiveness of developmentally regulated protein repair Lisoaspartyl methyltransferase in wheat [J].JournalofBiologycalChemistry,1994,269:25605-25612.
[24]Gale M D,Flintham J E,Devos K M.Cereal comparative genetics and pre-harvest sprouting [J].Euphytica,2002,126:21-25.
Identification of Drought and PHS Tolerance with Molecular Markers in Spring Wheats
SUN Xiaoyan1,WEI Xu1,ZHAO Chunzhi2,YANG Yan1
(1.College of Life Sciences,Inner Mongolia Agricultural University,Hohhot,Inner Mongolia 010018,China;2.Institute of Scientific Research,Bayan Nur,Inner Mongolia 015000,China)
Abstract:In order to screen the breeding parents with drought resistance at early growth and development stages and PHS resistance at harvest,five molecular markers,including two dominant complementary markers TaNRX-B1a1 and TaNRX-B1b1,and a co-dominant STS markers FerA1-intrl associated with drought resistance in wheat,and the other three STS markers Vp1B3,Vp1A3 and Tamyb10D associated with PHS tolerance were selected to identify drought tolerance and PHS tolerance of 137 spring wheat germplasms. The results showed that total 58 varieties (with the frequency of 42.34%) carried the haplotype combinations of TaNRX-B1a/TaFer-A1a,which could be used as potential parents for drought tolerance breeding.Chinese Spring was identified as Vp-1Bb haplotype,which was further identified as PHS tolerance when screened with marker Tamyb10D.Liaochun 10 had not only PHS resistence haplotypes for all three markers associated with PHS tolerance,but also carried haplotype combination of TaNRX-B1a/TaFer-A1a . Consequently,cultivar Liaochun 10 could be used as a potential parent in pyramiding breeding for improving the PHS tolerance and drought tolerance.
Key words:Wheat; Drought resistance; Pre-harvest sprouting resistance; STS marker
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)01-0036-08
通讯作者:杨 燕(E-mail:yangyanchutao@126.com)
基金项目:国家自然科学基金项目(31160247; 31260320); 内蒙古农业大学优秀青年科学基金项目(2014XYQ-18);内蒙古农业大学博士科研启动基金项目(BJ07-62)
收稿日期:2015-09-24修回日期:2015-11-15
网络出版时间:2016-01-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160108.1820.010.html
第一作者 E-mail:Celandine0919@163.com (孙晓燕);weixu0727@163.com (魏 旭,与第一作者同等贡献)

