外源玉米pepc基因对小麦C3、C4途径相关基因表达的效应
王永霞,许为钢,胡 琳,李 艳,齐学礼,王会伟,李小博
(1.南京农业大学/作物遗传与种质创新国家重点实验室,江苏南京 210095; 2.河南省农业科学院小麦研究所/小麦国家工程实验室/河南省小麦生物学重点实验室,河南郑州 450002)
外源玉米pepc基因对小麦C3、C4途径相关基因表达的效应
王永霞1,2,许为钢1,2,胡 琳2,李 艳2,齐学礼2,王会伟2,李小博1,2
(1.南京农业大学/作物遗传与种质创新国家重点实验室,江苏南京 210095; 2.河南省农业科学院小麦研究所/小麦国家工程实验室/河南省小麦生物学重点实验室,河南郑州 450002)
摘要:为进一步探讨外源玉米pepc基因改良小麦光合性能的机制,以基因枪介导T4代的转玉米pepc基因小麦为试验材料,研究了抽穗期和灌浆期外源pepc基因对小麦内源光合相关酶基因表达的影响,并分析了转基因小麦的光合生理特性及其产量性状表现。结果表明,小麦抽穗期,pepc基因的表达上调了小麦C4微循环ppdk基因(丙酮酸磷酸双激酶基因)、nadp-me基因(NADP-苹果酸酶基因)、ca基因(碳酸酐酶基因)和C3循环rbcL基因(Rubisco大亚基基因)的表达;小麦灌浆期,pepc基因的表达仍显著上调C4微循环ppdk基因和nadp-me基因的表达,而ca基因和C3循环rbcL基因、rbcS基因(Rubisco小亚基基因)的表达量与对照差异不大。相应的酶活性在转基因植株中比对照有所提高,灌浆期增幅最大。两个测定时期的转基因小麦旗叶净光合速率(Pn)均比对照显著提高,在灌浆期增幅最大,比对照提高10.35%~22.77%。产量性状方面,转基因小麦的单穗粒数和收获指数均有所提高。上述研究结果表明,玉米C4型pepc基因导入小麦后,促进了小麦原有的C4循环,从而提高了小麦的光合效率和籽粒产量。
关键词:磷酸烯醇式丙酮酸羧化酶;转基因小麦;基因表达;净光合速率
光合作用与作物的生长及产量形成密切相关,在主要的禾谷类作物(如水稻和小麦)中大约85%的干物质是通过光合作用积累的。通过对作物光合效能进行改良来实现作物生产性能的提高是作物遗传改良的一个重要途径。绿色植物根据其固定CO2的作用机制分为C3、C4和景天酸代谢(CAM)途径3种不同的类型,干旱、高温及高光强的条件下,C4植物的光合能力显著优于C3植物,具有较高的光合效率及营养和水分利用效率[1]。大部分重要农作物如水稻、小麦、马铃薯和大豆等都属于C3植物,较低的光合效率是限制其生物学产量进一步提高的重要因素。在过去的25年中,人们利用基因工程和转基因技术在增强Rubisco羧化酶反应效率[2-8]及将C4途径相关酶基因转入C3植物等方面做了大量的工作[9]。其中,从玉米(Zeamays)、高粱(Sorghumvulgare)和苋菜(Acalypha)等C4植物中克隆到的与C4光合作用途径相关的关键酶基因,如磷酸烯醇式丙酮酸羧化酶(PEPC)、丙酮酸磷酸双激酶(PPDK)和NADP-苹果酸酶(NADP-ME)、磷酸烯醇式丙酮酸羧化激酶(PCK)等基因,已成功转入水稻[10-13]、小麦[14-18]、烟草[19-20]等C3作物中。在获得的转基因植物中,C4高光效基因pepc均能得到表达,转pepc基因植株较未转化对照产量显著提高[16-18,21-23]。对高表达玉米pepc基因的转基因水稻和小麦的研究表明,外源pepc提高了转基因植株的光合效能[23-24]。
C4植物和CAM植物是由C3植物进化而来,在大豆、小麦和水稻等C3植物的叶片中存在着较低功效的C4光合循环[25-30],因此在分析导入单一的C4循环基因如pepc等对C3作物光合效能的影响时,应当考察其与C3作物的C4微循环的关系。目前,这方面的研究主要集中在将玉米pepc基因导入C3作物后对后者的相关酶学效率、光合特性和抗逆特性等表观性状的影响效应,而对已有C4循环相关酶基因表达的影响却鲜有报道。本课题组将玉米pepc基因cDNA序列成功导入普通小麦中,并对转玉米pepc基因小麦的T0代到T3代进行连续研究,结果表明,转基因植株中PEPC活性比对照提高了1.6~2.8倍,净光合速率比对照提高了20%[17-18,23,31-32]。本研究以T4代转玉米pepc基因小麦为材料,研究玉米pepc基因导入小麦后,对小麦C4循环中ppdk、nadp-me和ca(碳酸酐酶,Carbonic anhydrase)基因以及控制C3循环中碳同化关键酶基因rbcL(Rubisco大亚基,Rubisco large subunit)和rbcS(Rubisco小亚基,Rubisco small subunit)表达量的调节效应,同时,对转基因小麦的光合生理特性及其产量性状表现进行分析,以期为进一步探讨外源玉米pepc基因改良小麦光合性能的机制提供参考。
1材料与方法
1.1供试材料
供试材料为普通小麦品种周麦19(对照,转基因受体)及T4代转玉米pepc基因小麦株系1-27-3、1-45-3和1-51-4[31],均由河南省农业科学院小麦研究所分子育种研究室提供。所有材料于2011年10月种植于国家黄淮海转基因小麦中试与产业化基地(河南原阳),种植方式为行距25 cm,株距10 cm,常规大田管理。
1.2外源pepc基因的PCR检测
采用CTAB法提取T4代转基因小麦各株系和对照植株幼苗叶片的基因组总DNA。以各转基因株系及对照植株基因组总DNA、质粒p3301-pepc和PCR反应用水为模板,利用C4型高光效pepc基因的特异性引物(F:5′-CGCCCTTC CATACAGTCTCA-3′,R:5′-CATCTCGCTTCC GTGCTTAG-3′,均由上海生工生物技术服务公司合成。)进行PCR扩增。反应体系(25 μL):10×Buffer 2.5 μL,10 mmol·L-1dNTP 0.5 μL,上下游引物(20 μmol·L-1)各0.25 μL,DNA模板 1.25 μL,Taq酶(5 U·μL-1)0.15 μL,ddH2O 20.1 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。扩增产物经1.0%琼脂糖凝胶电泳分离,溴化乙锭染色后使用凝胶成像系统进行观察。
1.3旗叶净光合速率(Pn)的测定
于抽穗期(2012年4月25日)和灌浆期(2012年5月12日)上午9:00-11:00,分别选取长势一致的转基因株系和对照植株的主蘖旗叶,采用CIRAS-2型光合测定系统测定Pn。其中,测定时CO2浓度设定为380 μmol·L-1,温度和光照强度与自然环境相同,每个转基因株系和对照株系测定10个单株,往返重复测定3次。同时,分别取所测植株旗叶0.1 g和0.5 g分装后于液氮中速冻后保存于-80 ℃冰箱备用。
1.4产量性状调查
取收获后自然风干的各转基因株系及对照植株各30株,调查单茎重、单穗重、单穗粒数、千粒重和收获指数等产量相关性状,并对各项指标进行t-检验。
1.5光合相关酶基因的实时荧光定量PCR分析
取出1.3中保存于液氮中的各转基因株系和对照植株的0.1 g旗叶,利用植物总RNA提取试剂盒(北京康为世纪生物科技有限公司)提取总RNA。根据PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(Takara公司)的操作流程进行第一链cDNA的合成。参照已有的玉米pepc基因、NCBI数据库中光合相关酶基因的编码序列,用Primer 3.0软件设计引物(表1)。以小麦actin基因为内参,采用Toyobo公司SYBR Green RT-PCR试剂盒在Bio-Rad CFX96实时荧光定量PCR仪上进行表达分析。基因相对表达量参照Livak等[33]的2-ΔΔCt法进行计算。
1.6光合相关酶活性的测定
取出1.3中保存于液氮中的各转基因株系和对照植株的0.5 g旗叶,在适量的Tris-HCl缓冲液(10 mmol·L-1MgCl2、5 mmol·L-1DTT、1 mmol·L-1EDTA、1% PVP和10%甘油,pH 7.0)中冰浴研磨,磨细碎后全部转移到2 mL离心管内,放置30 min左右,15 000 r·min-14 ℃离心15 min,弃沉淀,上清液用于酶活测定。酶活性的测定均在室温(30 ℃)下进行,用UV-4802型紫外可见光分光光度计测定并记录340 nm处的光吸收值,以及反应底物的浓度变化。
PEPC活性的测定参照Ku等[10]的方法进行。3 mL反应体系中包含2.8 mL反应液[50 mmol·L-1tricine-KOH(pH 8.0)、0.1 mmol·L-1EDTA、1 mmol·L-1DTT、10 mmol·L-1MgCl2、10 mmol·L-1NaHCO3、3 U NAD-苹果酸脱氢酶、0.2 mmol·L-1NADH]和0.1 mL酶提取液,以0.1 mL 的40 mmol·L-1PEP启动反应,PEP的终浓度是2 mmol·L-1。
PPDK活性的测定参照Hatch和Slack[34]的方法进行。3 mL反应体系中含有2.8 mL反应液[25 mmol·L-1Hepes-KOH(pH 8.0)、 8 mmol·L-1MgSO4、10 mmol·L-1DTT、10mmol·L-1NaHCO3、2 mmol·L-1丙酮酸钠、5 mmol·L-1(NH4)2SO4、1 mmol·L-1葡萄糖-6-磷酸、2.5 mmol·L-1K2HPO4、0.2 mmol·L-1NADH、0.5 U PEPC及2 U NAD-MDH]和0.1 mL酶提取液,以0.1 mL 的30 mmol·L-1ATP启动反应,ATP的终浓度是1 mmol·L-1。

表1 实时荧光定量PCR所用引物
NADP-ME活性的测定参照陈景治等[35]的方法进行。3 mL反应体系中含有2.8 mL反应液[50 mmol·L-1Tris-HC1(pH 8.0)、1 mmol·L-1MgCl2、1 mmol·L-1MnCl2、1 mmol·L-1EDTA及0.33 mmol·L-1NADP]和0.1 mL酶提取液,以0.1 mL的 150 mmol·L-1苹果酸启动反应,苹果酸的终浓度是5 mmol·L-1。
RuBPc活性的测定参照魏锦城等[36]和Kung等[37]的方法进行。3 mL反应体系中含有2.8 mL反应液[100 mmol·L-1Tris-HCl(pH 7.8)、5 mmol·L-1ATP、3 mmol·L-1NADH、50 mmol·L-1DTT、200 mmol·L-1NaHCO3、4 U磷酸肌酸激酶、16 U磷酸甘油酸激酶、10 U磷酸甘油醛脱氢酶]和0.1 mL酶提取液,以0.1 mL的37.5 mmol·L-1RuBP启动反应,RuBP的终浓度为1.25 mmol·L-1。
2结果与分析
2.1外源pepc基因的PCR检测结果
利用pepc基因的特异性引物对T4代转基因小麦、对照植株、质粒p3301-pepc及PCR反应用水进行PCR检测,结果(图1)发现,各转基因植株和质粒p3301-pepc在800 bp附近均有特异性条带,而对照植株和PCR反应用水却未扩增出相应的特异性条带。说明外源pepc基因已经整合到小麦基因组中。
2.2旗叶Pn的比较分析
在抽穗期,转基因株系旗叶Pn比对照植株提高9.92%~17.04%;在灌浆期,转基因株系旗叶Pn比对照植株提高10.35%~22.77%。进一步方差分析结果(表2)表明,在以上2个时期,各转基因株系旗叶Pn与对照植株之间的差异均达到显著水平。
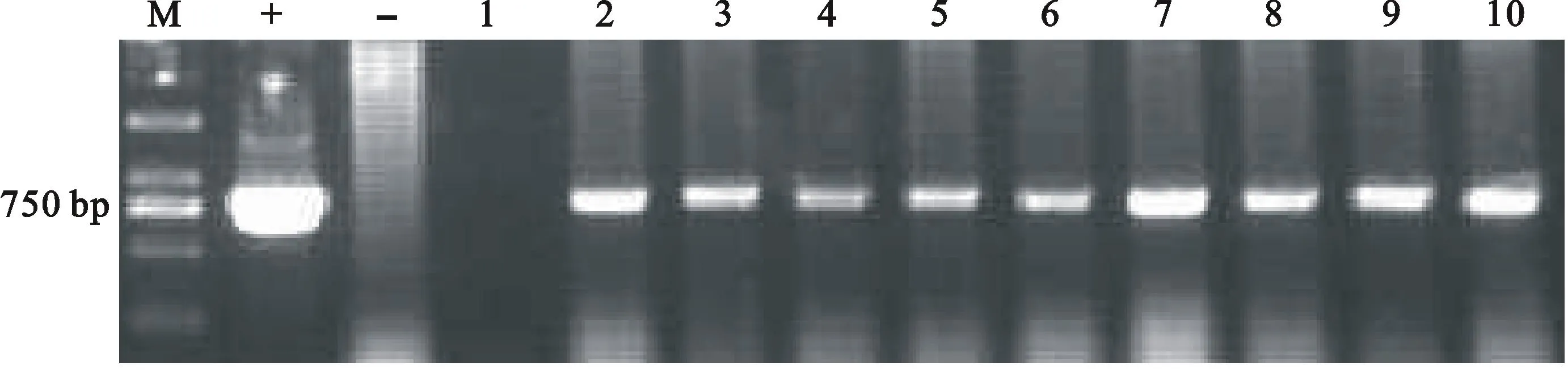
M:DL2000;+:质粒p3301-pepc;-:周麦19;1:水对照;2~10:T4代转基因植株
M: DL2000;+:Plasmid p3301-pepc; -:Zhoumai 19; 1:Water control; 2-10:T4transgenic plants

图1 T4代转pepc基因小麦的PCR检测结果
数据为10个单株重复的平均值±标准差; *P<0.05;**P<0.01
Mean±SD based on the average of ten plants; *P<0.05; **P<0.01
2.3产量性状的比较分析
由表3可知,总体上,与对照植株相比,各转基因株系产量性状的各项指标均有所提高。其中,各转基因株系的单穗粒数和收获指数、转基因株系1-27-3的单穗重和千粒重、转基因株系1-45-3的单茎重和单穗重及转基因株系1-51-4的千粒重显著高于对照植株。说明转基因株系提高了籽粒产量。
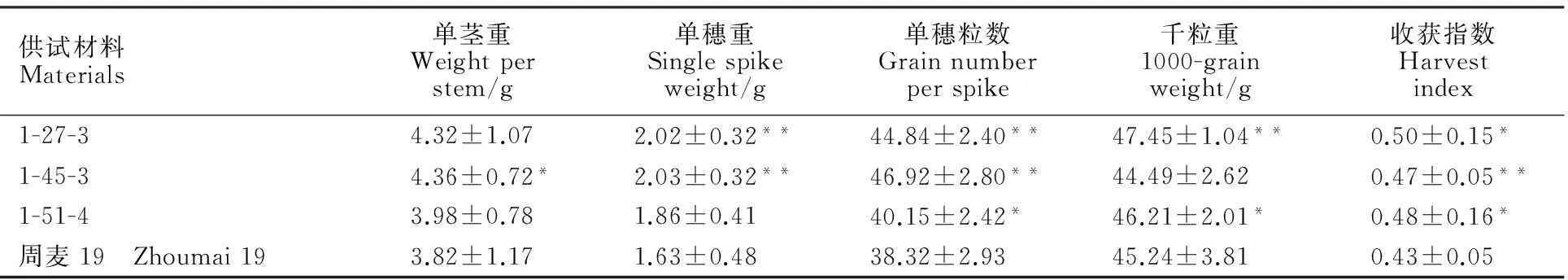
表3 各转基因株系和对照周麦19的产量性状
数据为30个单株重复的平均值±标准差; *P<0.05;**P<0.01
Mean ± SD based on the average of thirty; *P<0.05; **P<0.01
2.4光合相关酶基因的表达分析
2.4.1外源pepc基因相对表达量的变化
由图2可知,对照植株中也存在cDNA扩增产物,说明实时荧光定量PCR检测到的表达量中含有小麦内源pepc基因的转录物。外源pepc基因导入后,无论在抽穗期还是灌浆期,不同转基因株系的pepc基因相对转录水平均显著高于对照植株。2.4.2C4微循环光合相关酶基因相对表达量的变化
由图3可知,外源pepc基因导入后,无论在小麦抽穗期还是灌浆期,不同转基因株系的C4微循环光合相关酶基因相对转录水平均高于对照植株,但是同一时期不同基因及不同时期相同基因在不同株系中的相对表达量相对于对照植株的提高程度有所差异。转基因株系1-27-3的C4微循环光合相关酶基因(除ca基因外)在抽穗期和灌浆期的相对表达量均显著高于对照;转基因株系1-45-3的ppdk基因在抽穗期和灌浆期的相对表达量均显著高于对照,而nadp-me基因和ca基因在抽穗期和灌浆期的相对表达量与对照植株的差异并未达到显著水平;转基因株系1-51-4的C4微循环光合相关酶基因在抽穗期的相对表达量与对照植株的差异均未达到显著水平,而ppdk基因和nadp-me基因在灌浆期均显著高于对照植株。
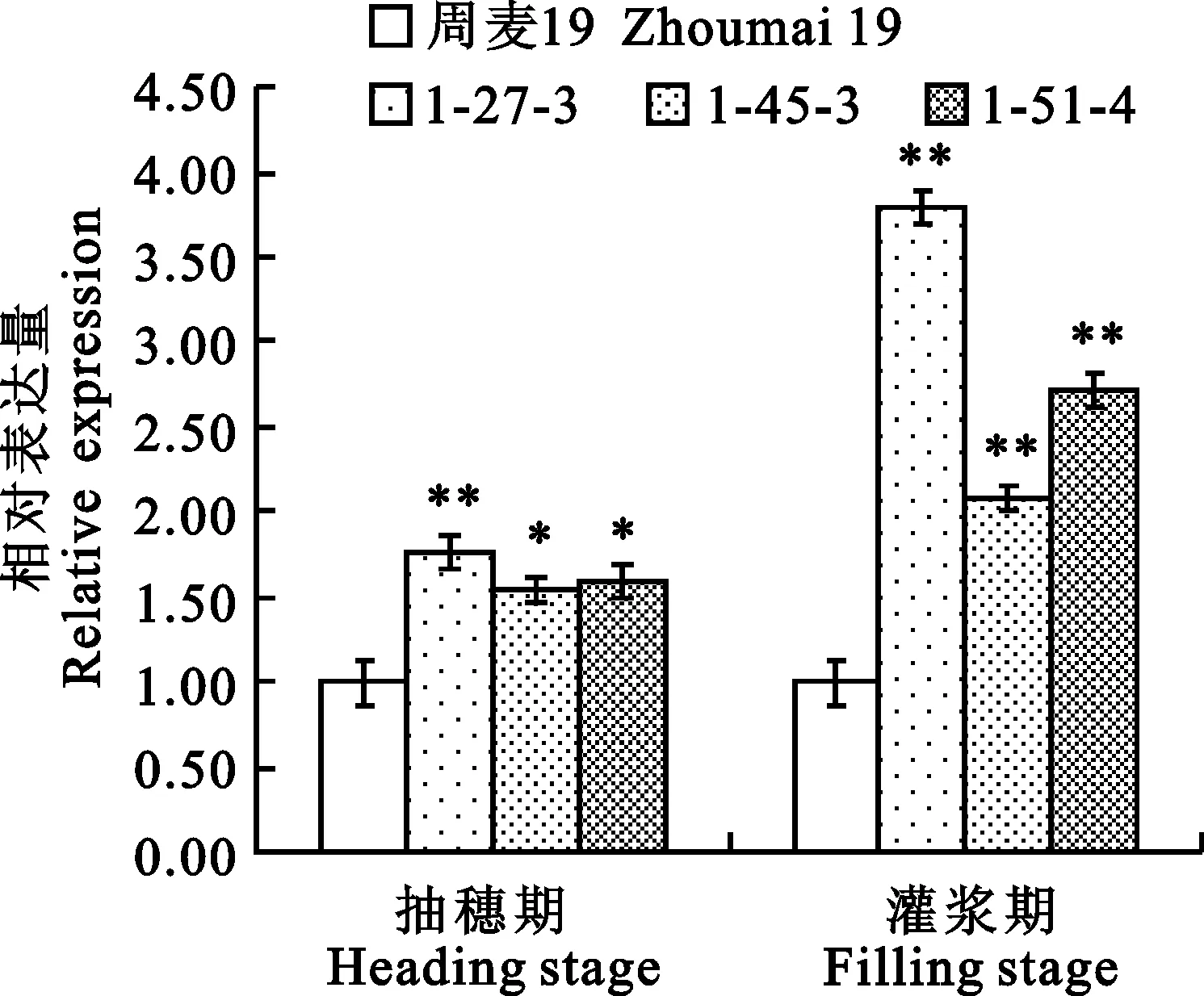
*:P<0.05;**:P<0.01
2.4.3C3循环光合相关酶基因相对表达量的变化
由图4可知,外源pepc基因导入后,各转基因小麦株系的C3循环光合相关酶基因在抽穗期相对表达量均高于对照植株,其中,rbcL基因与对照植株差异显著;但在灌浆期各转基因株系的C3循环光合相关酶基因的相对表达量均低于对照植株,但与对照植株的差异并未达到显著水平。
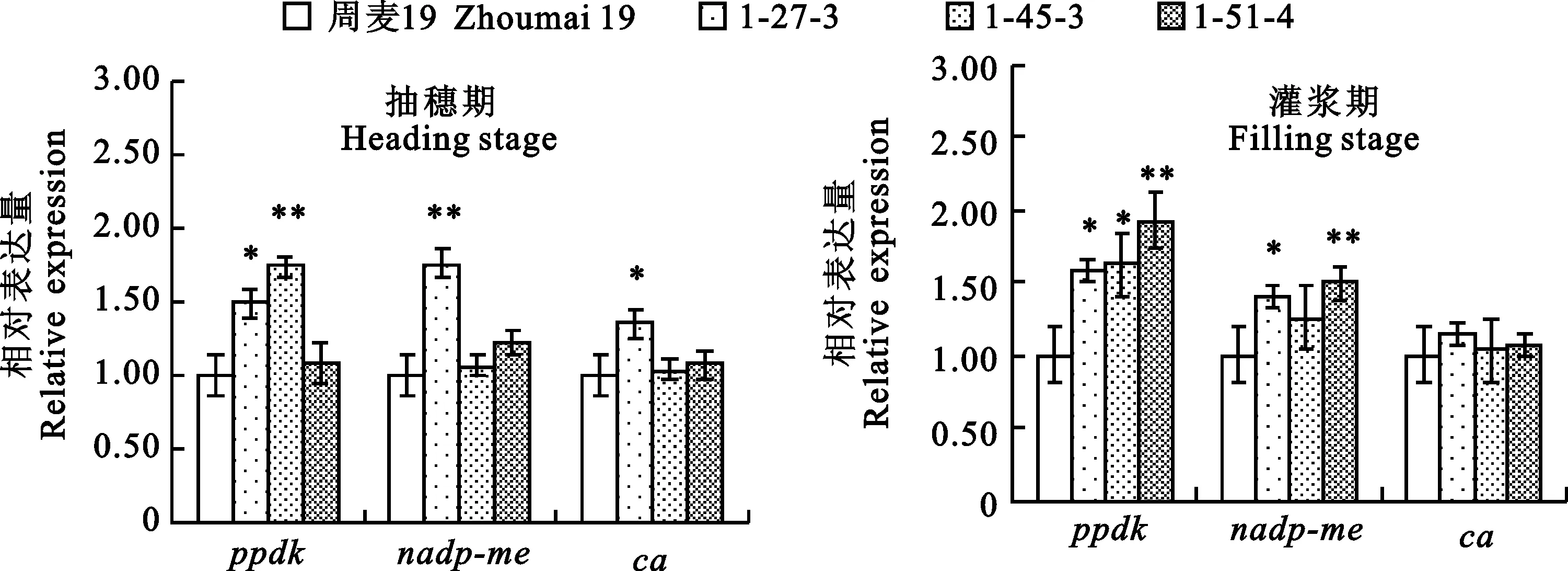
*:P<0.05;**:P<0.01
2.5光合相关酶活性的比较分析
外源pepc基因导入后,各转基因小麦株系的C4循环光合相关酶活性在抽穗期和灌浆期均高于对照植株(图5)。转基因株系1-27-3的PEPC和NADP-ME活性及1-45-3的各C4循环光合相关酶活性在抽穗期和灌浆期均显著高于对照植株;转基因株系1-51-4的PEPC活性在抽穗期及PEPC和PPDK活性在灌浆期均显著高于对照植株。各转基因株系的C3循环光合酶RuBPc活性在抽穗期和灌浆期均显著高于对照植株。

**:P<0.01;*:P<0.05
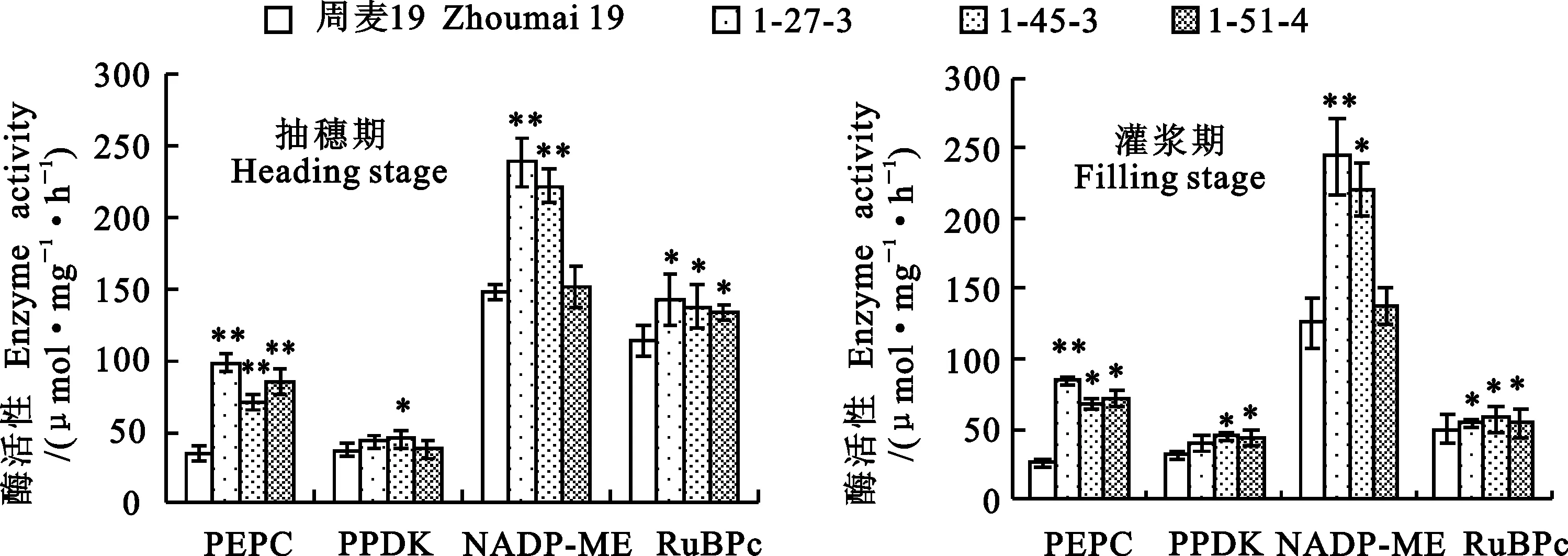
**:P<0.01;*:P<0.05
3讨 论
在植物长期进化过程中,C4植物形成与其光合循环相匹配的“Kranz”结构,但其并不是C4光合途径所必须的。单细胞水生植物黑藻(Hydrillaverticilata)和水蕴草(Egeriadensa)无“Kranz”结构而有C4光合途径的运行,说明在植物叶片的单一细胞中也是可以同时进行C3和C4光合循环的,预示着通过C4光合酶基因向C3植物的转移可以提高C3植物光合作用[38-39]。自Ku等[10]利用农杆菌介导法成功地将玉米C4途径关键酶基因pepc导入水稻进行高光效分子育种以来,在小麦高光效转基因研究领域,陈绪清等[14]和张庆琛等[16]将完整的玉米C4型pepc基因导入到小麦中,并对T0代和T1代转基因小麦植株进行筛选和光合特性初步研究,但至今尚未有较为深入的研究报道。李 艳等[17]和Hu等[18]将玉米C4型pepc基因的cDNA序列转入普通小麦栽培品种中,并对转基因后代材料的分子特征和光合生理特性进行了初步研究和筛选,结果表明,pepc基因以1~3个拷贝整合到转基因小麦基因组的不同位点[31];在田间自然条件下,T2代转基因小麦的单穗重和千粒重较对照均显著提高,PEPC活性比对照提高了2.8和1.6 倍[23],植株的光饱和点和羧化效率较对照分别提高20%和22.5%[18];对T3代转基因小麦时空表达特性的研究结果表明,转基因小麦各生育时期叶片Pn和PEPC活性均高于对照,灌浆期增幅最大,较对照分别增加21%和2.4倍,差异达显著水平,转基因植株各器官中PEPC活性总体变化趋势为叶>穗>鞘和茎[32]。本研究以经前期研究筛选到的T4代高光效转基因株系为实验材料进行研究,结果显示,抽穗期和灌浆期转基因小麦中PEPC活性和Pn均显著高于对照周麦19。这与前期吴 琼等[23]、Hu等[18]和Han等[32]对转pepc基因小麦植株光合生理特性的研究结果相一致。由此可见,玉米pepc基因对转基因小麦植株Pn的提高是能够稳定遗传的,C4光合途径关键酶基因在小麦产量遗传改良中具有潜在的利用价值。
在许多C3植物的绿色器官中,不仅存在着RuBPc,也存在着PEPC、NADP-MDA、NADP-ME和PPDK等C4途径酶系统,但是其活性很低[25-26]。有报道指出,虽然在C3植物中的C4途径酶活性较低,但当在内外环境发生变化时,其活性也将会发生变化,如小麦或大豆在干旱条件下,PEPC活性显著提高[27]。Ku等[11]对转pepc基因水稻和野生型水稻进行分析发现,转基因水稻中除PEPC活性明显高于野生型水稻外,碳酸酐酶活性比对照高2倍左右,RuBPc活性与对照相近。季本华等[30]对转pepc基因水稻和野生型水稻叶内光合相关酶活性进行分析发现,转基因水稻中除PEPC活性明显高于野生型水稻外,PPDK、NADP-ME、NADP-MDH、碳酸酐酶以及C3光合酶RuBPc的活性均与对照相近,其研究结果还表明PEPC是C3植物水稻中C4微循环中的限速酶,如果能够进一步提高现有高产品种中的PEPC活性,则还可以进一步提高植株的光合潜力。本研究对转玉米pepc基因小麦中C4光合酶PEPC、NADP-ME、PPDK和C3光合酶RuBPc在转录水平和相应酶活性水平上进行分析,表明小麦中存在有内源的C4微循环。外源C4植物的pepc基因的高表达及活性的增加,提高了C4途径PDK、NADP-ME和C3光合酶RuBPc的转录和酶活性,改善了小麦中内源C4微循环,使细胞有可能通过“CO2泵”的方式提高光合碳循环的CO2浓度,使Rubisco的催化方向朝着有利于形成碳水化合物的方向运转。光合速率的提高是一个复杂的过程,受诸多因素影响,本研究的结果将为进一步解析玉米pepc基因导入C3作物小麦后增强光合碳同化的作用机理提供了试验依据。
参考文献:
[1]Endo T,Mihara Y,Furumoto T,etal.Maize C4-form phosphoenolpyruvate carboxylase engineered to be functional in C3plants:mutations for diminished sensitivity to feedback inhibitors and for increased substrate affinity [J].JournalofExperimentalBotany,2008,59(7):1811-1818.
[2]Miyagawa Y,Tamoi M,Shigeoka S.Overexpression of a cyanobacterial fructose-1,6-/sedoheptulose-1,7-bisphosphatase in tobacco enhances photosynthesis and growth [J].NatureBiotechnology,2001,19(10):965-969.
[3]Tamoi M,Shigeoka S.Improvement of photosynthesis in higher plants [M]//Plant Responses to Air Pollution and Global Change.Tokyo:Springer Japan,2005:141-147.
[4]Chen S,Hajirezaei M,Peisker M,etal.Decreased sucrose-6-phosphate phosphatase level in transgenic tobacco inhibits photosynthesis,alters carbohydrate partitioning,and reduces growth [J].Planta,2005,221(4):479-492.
[5]Chida H,Nakazawa A,Akazaki H,etal.Expression of the algal cytochrome c6 gene inArabidopsisenhances photosynthesis and growth [J].PlantandCellPhysiology,2007,48(7):948-957.
[6]Feng L,Han Y,Liu G,etal.Overexpression of sedoheptulose-1,7-bisphosphatase enhances photosynthesis and growth under salt stress in transgenic rice plants [J].FunctionalPlantBiology,2007,34(9):822-834.
[7]Kumar A,Li C,Portis Jr A R.Arabidopsisthalianaexpressing a thermostable chimeric Rubisco activase exhibits enhanced growth and higher rates of photosynthesis at moderately high temperatures [J].PhotosynthesisResearch,2009,100(3):143-153.
[8]Suzuki Y,Miyamoto T,Yoshizawa R,etal.Rubisco content and photosynthesis of leaves at different positions in transgenic rice with an overexpression of RBCS [J].Plant,Cell&Environment,2009,32(4):417-427.
[9]Ruan C H,Shao H B,Teixeira da Silva J A.A critical review on the improvement of photosynthetic carbon assimilation in C3plants using genetic engineering [J].CriticalReviewsinBiotechnology,2012,32(1):1-21.
[10]Ku M S,Agarie S,Nomura M,etal.High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plants [J].NatureBiotechnology,1999,17(1):76-80.
[11]Ku M S B,Ranade U,Hsu T P,etal.Photosynthetic performance of transgenic rice plants overexpressing maize C4photosynthesis enzymes [J].StudiesinPlantScience,2000,7:193-204.
[12]Fukayama H,Hatch M D,Tamai T,etal.Activity regulation and physiological impacts of maize C4-specific phosphoenolpyruvate carboxylase overproduced in transgenic rice plants [J].PhotosynthesisResearch,2003,77(2-3):227-239.
[13]Bandyopadhyay A,Datta K,Zhang J,etal.Enhanced photosynthesis rate in genetically engineeredindicarice expressingpepcgene cloned from maize [J].PlantScience,2007,172(6):1204-1209.
[14]陈绪清,张晓东,梁荣奇,等.玉米C4型pepc基因的分子克隆及其在小麦的转基因研究 [J].科学通报,2004,49(19):1976-1982.
Chen C Q,Zhang X D,Liang R Q,etal.Cloning maize C4phosphoenolpyruvate carboxylase gene and transformation in wheat [J].ChineseScienceBulletin,2004,49(19):1976-1982.
[15]张 彬,丁在松,张桂芳,等.根癌农杆菌介导获得稗草Ecppc转基因小麦的研究 [J].作物学报,2007,33(3):356-362.
Zhang B,Ding Z S,Zhang G F,etal.Introduction of Phosphoenolpyruvate carboxylase gene fromEchinochloacrusgalliinto wheat mediated byAgrobacteriumtumefaciens[J].ActaAgronomicaSinica,2007,33(3):356-362.
[16]张庆琛,许为钢,胡 琳,等.玉米C4型全长pepc基因导入普通小麦的研究 [J].麦类作物学报,2010,30(2):194-197.
Zhang Q C,Xu W G,Hu L,etal.Development of transgenic wheat plants with maize C4-specificpepcgene by particle bombardment [J].JournalofTriticeaeCrops,2010,30(2):194-197.
[17]李 艳,许为钢,胡 琳,等.玉米磷酸烯醇式丙酮酸羧化酶基因高效表达载体构建及其导入小麦的研究 [J].麦类作物学报,2009,29(5):741-746.
Li Y,Xu W G,Hu L,etal.Construction of a high efficient expression vector for maize phosphoenolpyruvate carboxylase gene and its transformation in wheat [J].JournalofTriticeaeCrops,2009,29(5):741-746.
[18]Hu L,Li Y,Xu W,etal.Improvement of the photosynthetic characteristics of transgenic wheat plants by transformation with the maize C4phosphoenolpyruvate carboxylase gene [J].PlantBreeding,2012,131(3):385-391.
[19]Hudspeth R L,Grula J W,Dai Z,etal.Expression of maize phosphoenolpyruvate carboxylase in transgenic tobacco effects on biochemistry and physiology [J].PlantPhysiology,1992,98(2):458-464.
[20]Sheriff A,Meyer H,Riedel E,etal.The influence of plant pyruvate,orthophosphate dikinase on a C3plant with respect to the intracellular location of the enzyme [J].PlantScience,1998,136(1):43-57.
[21]李 霞,焦德茂,戴传超,等.转育PEPC基因的杂交水稻的光合生理特性 [J].作物学报,2001,27(2):137-143.
Li X,Jiao D M,Dai C C,etal.Photosynthetic characteristics for rice hybrids with transgenic PEPC parent HPTER-01 [J].ActaAgronomicaSinica,2001,27(2):137-143.
[22]Jiao D,Huang X,Li X,etal.Photosynthetic characteristics and tolerance to photo-oxidation of transgenic rice expressing C4photosynthesis enzymes [J].PhotosynthesisResearch,2002,72(1):85-93.
[23]吴 琼,许为钢,李 艳,等.田间条件下转玉米C4型pepc基因小麦的光合生理特性 [J].作物学报,2011,37(11):2046-2052.
Wu Q,Xu W G,Li Y,etal.Physiological characteristics of photosynthesis in transgenic wheat with maize-pepcgene under field conditions[J].ActaAgronomicaSinica,2011,37(11):2046-2052.
[24]凌丽俐,林宏辉,焦德茂.转PEPC基因水稻种质的稳定光合生理特性 [J].作物学报,2006,32(4):527-531.
Ling L L,Lin H H,Jiao D M.The stable photosynthetic characteristics of a PEPC transgenic rice germplasm [J].ActaAgronomicaSinica,2006,32:527-531.
[25]Duffus C M,Rosie R.Some enzyme activities associated with the chlorophyll containing layers of the immature barley pericarp [J].Planta,1973,114(3):219-226.
[26]Agarie S,Miura A,Sumikura R,etal.Overexpression of C4PEPC caused O2-insensitive photosynthesis in transgenic rice plants [J].PlantScience,2002,162(2):257-265.
[27]李卫华,郝乃斌,戈巧英,等.C3植物中C4途径的研究进展 [J].植物学报,1999,16(2):97-106.
Li W H,Hao N B,Ge Q Y,etal.Advances in study on C4pathway in C3plant [J].ChineseBulletinofBotany,1999,16(2):97-106.
[28]丁在松,赵 明,荆玉祥,等.玉米ppc基因过表达对转基因水稻光合速率的影响 [J].作物学报,2007,33(5):717-722.
Ding Z S,Zhao M,Jing Y X,etal.Effect of overexpression of maizeppcgene on photosynthesis in transgenic rice plants [J].ActaAgronomicaSinica,2007,33(5):717-722.
[29]Jiao D M,Kuang T Y,Li X,etal.Physiological characteristics of the primitive CO2concentrating mechanism in PEPC transgenic rice [J].ScienceinChinaSeriesC:LifeSciences,2003,46:438-446.
[30]季本华,朱素琴,焦德茂.转玉米C4光合酶基因水稻株系中的光合C4微循环 [J].作物学报,2004,30(6):536-543.
Ji B H,Zhu S Q,Jiao D M.Photosynthetic C4-microcycle in transgenic rice plant lines expressing the maize C4-photosynthetic enzymes [J].ActaAgronomicaSinica,2004,30(6):536-543.
[31]张建红,许为钢,王会伟,等.转玉米C4型高光效pepc基因小麦的分子特征及光合特性研究 [J].麦类作物学报,2012,32(6):1043-1048.
Zhang J H,Xu W G,Wang H W,etal.Molecular characteristics and photosynthetic property of the transgenic wheat expressing a maize C4-typepepcgene [J].JournalofTriticeaeCrops,2012,32(6):1043-1048.
[32]Han L L,Xu W G,Hu L,etal.Preliminary study on the physiological characteristics of transgenic wheat with maize C4-pepcgene in field conditions [J].CerealResearchCommunications,2013,42(1):70-80.
[33]Livak K J,Schmittgen T D.Analysis of relative gene expression date using real-time quantitative PCR and 2-ΔΔCtmethod [J].Methods,2001,25:402-408.
[34]Hatch M D,Slack C R.Pyruvate,Pidikinase from leaves [J].MethodsinEnzymology,1975,42:212-219.
[35]陈景治,陈冬兰,吴敏贤,等.高粱和小麦叶片苹果酸酶某些特性比较 [J].植物生理学报,1981,4(4):345-350.
Chen J Z,Chen D L,Wu M X,etal.Comparison of some characteristics of NADP-malic enzyme from sorghum and wheat leaves [J].ActaPhytophysiolSinica,1981,4(4):345-350.
[36]魏锦城,王仁雷,程光宇.杂交稻核酮糖二磷酸羧化酶的动力学性质 [J].植物生理学报,1994,1(1):55-60.
Wei J C,Wang R L,Cheng G Y.Studies on the kinetics properties of ribulose-1,5-bisphosphate carboxylase from F1hybrid rice [J].ActaPhytophysiologicaSinica,1994,1(1):55-60.
[37]Kung S D,Chollet R,Marsho T V.Crystallization and assay procedures of tobacco ribulose-1,5-bisphosphate carboxlase-oxygenase [J].MethodsinEnzymology,1980,69:326-336.
[38]Magnin N C,Cooley B A,Reiskind J B,etal.Regulation and localization of key enzymes during the induction of Kranz-less,C4-type photosynthesis inHydrillaverticillata[J].PlantPhysiology,1997,115(4):1681-1689.
[39]Voznesenskaya E V,Franceschi V R,Kiirats O,etal.Kranz anatomy is not essential for terrestrial C4plant photosynthesis [J].Nature,2001,414(6863):543-546.
Effect ofpepcGene from Maize on Photosynthesis-related Genes Expression in Transgenic Wheat
WANG Yongxia1,2,XU Weigang1,2,HU Lin2,LI Yan2,
QI Xueli2,WANG Huiwei2,LI Xiaobo1,2
(1.Nanjing Agricultural University/Natinal Key Laboratory of Crop Genetics and Germplasm Enhancement,Nanjing,Jiangsu 210095,China; 2.Wheat Research Insitute,Henan Academy of Agricultural Sciences/National Laboratory,of Wheat Engineering/Henan Laboratory of Wheat Biology,Zhengzhou,Henan 450002,China)
Abstract:To investigate how pepc gene from maize regulates the expression of endogenous photosynthesis-related genes in transgenic wheat plants,T4 transgenic wheat lines were developed by particle bombardment.The expression level of photosynthesis-related genes in the flag leaf was investigated by using PCR test,qRT-PCR and enzyme activity analysis.The results showed that exogenous gene pepc up-regulated the expression of several wheat endogenous genes,i.e.,ppdk(Pyruvate orthophosphate dikinase),nadp-me(NADP-malic enzyme),ca(Carbonic anhydrase)and rbcL(Rubisco large subunit)at heading stage.At filling stage,the expression levels of pepc,ppdk and nadp-me in transgenic plants were increased,whereas there was no change in the expression levels of ca,rbcL and rbcS(Rubisco small subunit) gene in transgenic plants.In transgenic plants,the enzyme activities of the corresponding genes were higher than those in untransformed plants and the increase rate reached the maximum at filling stage.Net photosynthetic rate(Pn) of transgenic plants were 10.35%-22.77% higher than that of untransformed plants at filling stage,with a maximum increase rate.Individual plant yield components analysis indicated that the grain number per spike and harvest index of transgenic plants were higher than those of untransformed plants.Introduction of pepc gene from maize into wheat plants resulted in up-regulation of both C3 and C4 photosynthetic enzymes,and increased corresponding enzyme activity,and improved photosynthetic capacity and grain yield.The results obtained from this study gave us a better understanding on the regulation mechanism of maize pepc gene in wheat for improving their photosynthesis ability.
Key words:Phosphoenolpyruvate carboxylase(PEPC); Transgenic wheat; Gene expression; Net photosynthetic rate
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)01-0001-08
通讯作者:许为钢(E mail:xuwg1958@163.com)
基金项目:国家自然科学基金项目(31371707); 国家转基因生物新品种培育科技重大专项(2011ZX08002-003/005); 国家现代产业技术体系专项(CARS-3-1-19); 国家科技支撑计划项目(2011BAD07B01)
收稿日期:2015-10-16修回日期:2015-11-19
网络出版时间:2016-01-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160108.1820.002.html
第一作者E-mail:wangyongxia005@163.com

