慢性肾脏病患者贫血治疗中铁剂的应用
李 川 综述 龚德华 审校
·血液净化·
慢性肾脏病患者贫血治疗中铁剂的应用
李 川 综述 龚德华 审校
铁元素本身化学活性很高,正常量铁在人体内发挥重要的生理作用。但铁缺乏或超载均可对人体造成损伤。尤其慢性肾脏病(CKD)后期和终末期肾病(ESRD)的透析或非透析患者常需要补铁治疗,随着各种铁剂的逐渐普及,人们对铁剂使用利弊的认识也在改变。如何有效补铁,如何尽量减少并发症,仍是目前尚待解决的问题。本文就目前铁剂治疗相关问题和新型铁剂的应用进行简述。
慢性肾脏病 贫血 铁剂
贫血是慢性肾脏病(CKD)特别是终末期肾病(ESRD)患者常见并发症[1],肾脏促红细胞生成素(EPO)合成减少是其主要原因。因此,使用EPO类药物(ESAs)是治疗贫血的主要手段。在使用ESAs的同时,亦需补充铁剂以纠正铁缺乏所致的ESAs治疗低反应/抵抗现象,改善ESAs疗效,减少ESAs用量。鉴于近来对ESAs高剂量可能的副作用及费用方面考虑,铁剂的应用日渐广泛[2-3]。 口服剂和静脉剂(IVI)是铁剂的两种主要剂型,两者在吸收、利用机制上差别,导致相关的疗效、不良反应和药代动力学特点也不同。本文拟对ESRD患者中铁剂的应用作一简述,主要着重于其治疗作用、不同剂型及其药代动力学特点、临床疗效、不良反应等方面及新型铁剂的临床应用前景,以期为CKD,尤其是ESRD患者此类药物的应用提供参考。
ESRD患者的铁缺乏及铁超载
健康成人铁总量约4 000 mg,是人体内含量最丰富的微量元素之一。铁在体内循环再利用活跃,仅红细胞破坏、生成中每日铁循环量可达20 mg,但吸收、排泄途径极为有限,日均量仅1~2 mg。CKD患者铁缺乏机制复杂,既有储备不足(绝对缺乏),也有利用障碍(功能性缺乏)(表1)。尿毒症特别是透析患者由于肠道吸收减少、失血增加及可能存在微炎症状态致网状内皮细胞铁滞留等因素,铁缺乏更明显。这不仅会导致CKD患者贫血和ESAs抵抗,还会引起神经递质合成障碍、影响髓鞘形成,致使中枢神经系统功能紊乱、发育不良及不宁腿综合征等[4]。
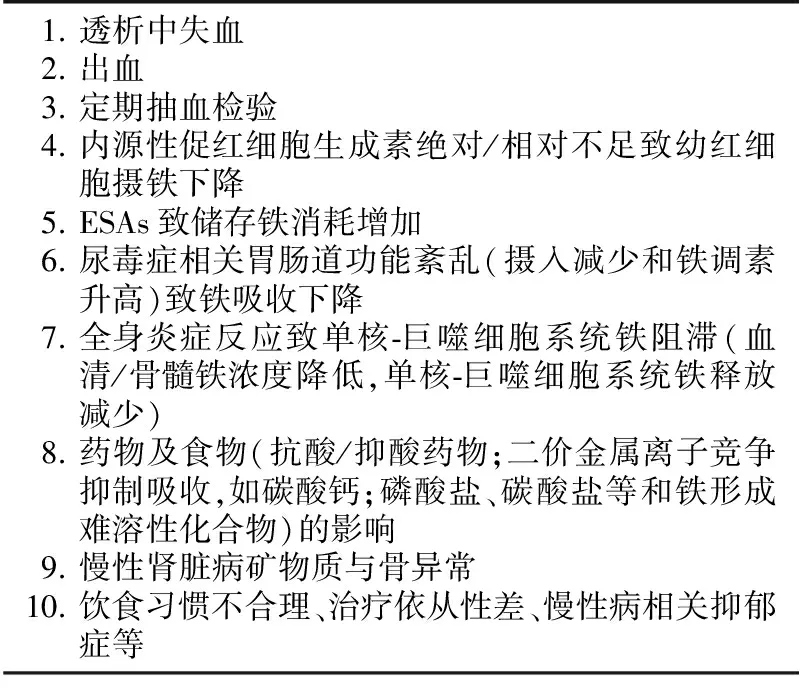
表1 慢性肾脏病及终末期肾病透析/非透析患者缺铁原因
这些患者补充铁剂理想状态是达到铁的零平衡,即补充量等于丢失量,维持铁稳态但通常由于个体差异,具体失铁量并不清楚,难以确定精确补铁剂量,因此易补充过量,带来铁超载。由于铁具有毒性,铁超载对患者预后的不良影响应得到重视。
铁毒性主要源于游离铁离子通过Fenton反应产生的活性氧,后者刺激脂质过氧化、蛋白质和核酸破坏,这些反应总称为氧化应激。除了细胞毒性外,铁还因其基因毒性被视为中等致癌物。吸收的铁在血液中迅速与转铁蛋白结合,避免其游离形式所带来的毒性,并输送至靶细胞(如骨髓网织红细胞)以利用,或以铁蛋白及含铁血黄素形式在肝和网状内皮系统中贮存。铁超载的形式有两种:一是急性(一过性),主要是短期输入量过多,超过正常转运结合能力,以致游离形式增加带来的急性中毒;另一种是长期慢性贮存量过多,在体内逐渐蓄积,在肝、脾、胰、心脏、中枢系统等部位沉积引起慢性中毒。后者造成的继发病理变化除了普遍存在的组织坏死、纤维化外,还导致相应器官功能障碍:如引起肝功能不全;破坏胰岛细胞,诱发糖尿病;破坏胃肠黏膜上皮细胞,引起消化道症状,甚至出血;可能促进动脉粥样硬化;损伤心肌细胞,使得心肌缺血耐受力下降;骨质疏松;脑铁过载在神经退行性疾病如帕金森病、老年痴呆症、亨廷顿病等发病过程中起着重要作用。血中铁升高,亦会导致肾脏排泄增加及肾小管上皮细胞损伤,甚至发生急性肾损伤。铁超载的毒性大小取决于多种因素,包括:(1)铁超载累及的细胞类型:实质细胞内铁及游离铁过量毒性更大,而网状内皮(RES)细胞贮存铁危害较小[5-6];(2)铁过量持续时间、蓄积的程度和速度;(3)患者预期寿命及并发症等情况。由于铁长期过量对机体的影响主要来自于遗传性血色素沉着症及职业性慢性铁中毒的研究,这些患者为终生性铁超载,而CKD患者中铁积蓄的程度、分布及持续时间相对较短,可能还不足以产生与血色素沉着病患者类似的器官损伤。此外,IVI在临床广泛应用时间不长[7-8],尚不足以充分观察到其长期不良影响。
除毒性外,由于铁是细菌分裂增殖和某些病毒(如丙型肝炎病毒)复制所必需,血清铁浓度升高,有利于细菌/病毒增殖,因此铁剂使用所带来的感染风险增加,也需引起重视。一般建议在细菌感染急性期避免使用铁剂。
铁剂补充的主要途径及比较
主要补铁途径 铁剂除口服和静脉两种给药途径,近来又出现经透析液补充途径,主要形式有Fe2+、Fe3+和非离子铁三种。早期的亚铁盐——硫酸亚铁,存在因大量游离铁离子释放所致的严重胃肠道不良反应,后来的富马酸亚铁和琥珀酸亚铁缓释片和薄膜片则经化学成分及剂型改良,提高了含铁率而延缓了游离铁释放,从而提高了补铁效率、降低了胃肠不良反应。多糖铁复合物口服剂型是将铁元素整合在大分子多糖链中,除小部分经胃酸作用游离出铁离子外,大部分以分子形式被直接吸收,避免了游离铁对胃肠道的刺激作用。
口服铁剂吸收机制可能存在以下三种方式:(1)一般以Fe2+形式被小肠黏膜上皮细胞绒毛侧的二价金属离子转运蛋白1(DMT1)吸收入细胞内,再被细胞基底侧膜铁转运蛋白(FPN1)和膜铁辅助转运蛋白(HP)以Fe3+形式释放入血,并迅速与转铁蛋白结合。而无机Fe3+首先需通过小肠黏膜上皮细胞绒毛侧的十二指肠细胞色素b还原成Fe2+形式再被吸收。(2)血红素铁则以整分子形式在肠黏膜上皮细胞绒毛侧通过血红素载体蛋白1(HCP1)介导,经细胞内吞作用入胞,随后在血红素加氧酶1(HO-1)的作用下,解离出Fe2+,进入上述非血红素铁循环途径。此途径较前者吸收效率更高,正常人每日约2/3铁通过此途径被吸收,新型口服铁剂血红素铁多肽即可能通过此途径被吸收。(3)此外,在经口摄入大剂量铁时,可造成胃肠道内铁(分子或离子形式)高浓度并形成较大浓度梯度差,在后者作用下铁通过细胞间紧密连接直接入血,枸橼酸铁即可能通过此途径被吸收。口服铁吸收受多种因素影响,主要有:小肠黏膜细胞的自控作用、机体铁状态(缺乏或过载)、药物铁形式(有机或无机铁)、药物剂型(缓释、薄膜等)、食物促进(动物蛋白、维生素C、有机酸、还原剂、焦磷酸盐、乳酸盐、氧化还原对胃肠黏膜铁摄入屏障的破坏)、食物抑制(植酸盐、多酚、钙及其他二价阳离子、磷酸盐、碳酸盐、胰液、碳酸氢盐)、胃肠道酸碱环境、药物剂量大小等。
IVI的结构一般采用大分子碳水化合物形成的外壳包裹氢氧化铁而形成纳米粒水溶胶制剂,外壳起稳定铁核、延缓铁释放和保持颗粒悬浮性的作用。IVI的核心一般都为氢氧化铁,不同剂型的差别在于碳水化合物外壳成分、纳米颗粒和铁核大小,这些特性影响药物的铁释放率/生物利用度和清除率,最终影响疗效和不良反应发生率。IVI入血后经两个途径吸收且以后者为主:一是解离、释放的铁大部分直接与脱铁转铁蛋白结合,少部分以非转铁蛋白结合铁(NTBI)形式存在;前者使转铁蛋白饱和度(TSAT)短期内升高,成为可利用铁,后者则具有毒性,是IVI毒性的主要原因;二是以完整分子形式到达靶细胞(如巨噬细胞)后经内吞作用入胞,再解离出铁离子,被贮存或利用,铁剂毒性小。根据铁解离速度(化学动力学特性)和络合物稳定性(化学热力学特性)、毒性大小等特点,可将IVI分为4类(表2)[9]。从 Ⅰ 类到 Ⅲ 类分子量逐渐减小,化学稳定性降低,体内解离释放铁速度加快,毒性也随之增大(LD50减小),但与转铁蛋白直接结合增多,利用度提高。因此第 Ⅲ 类IVI化学活性高,入血后解离释放游离铁多,利用度高,但毒性大,不适合大剂量静脉输注,以免即刻NTBI浓度升高带来毒性反应,通常以小剂量或与其他铁剂混合成第 Ⅳ 类IVI用于临床。Ⅲ 和 Ⅳ 类铁剂在使用时需缓慢静脉滴注及严密医疗监护。
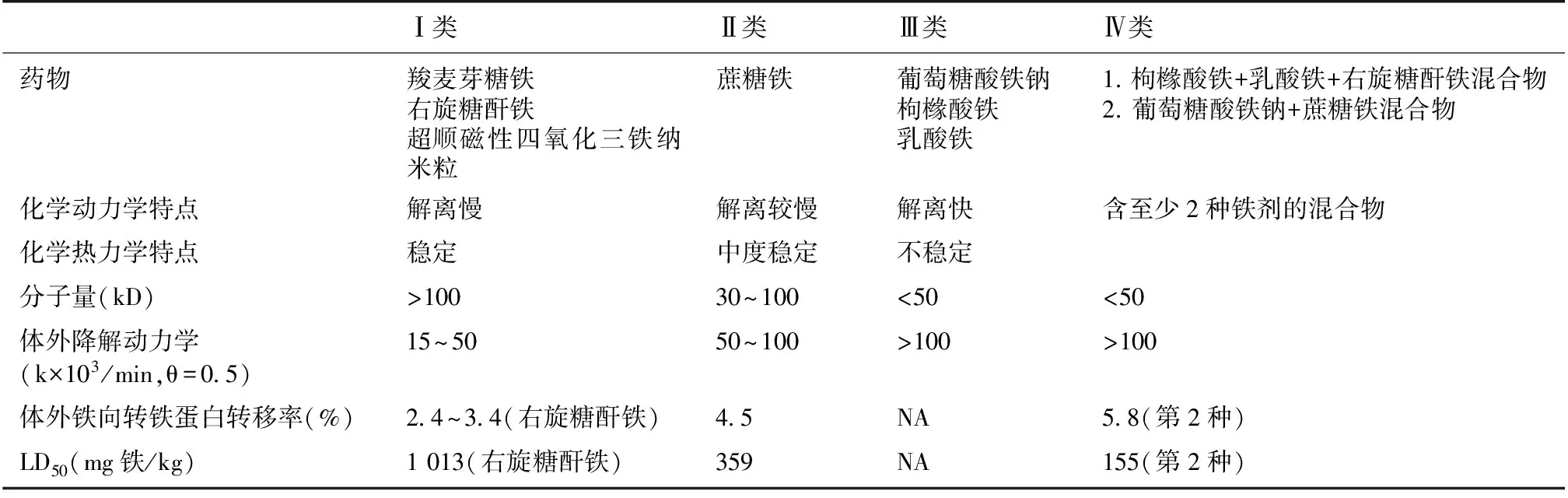
表2 静脉铁剂(铁-碳水化合物络合物)分类
LD50:小白鼠半数致死量
除铁的毒性外,IVI的毒副作用还包括其包裹外壳所致超敏反应,主要见于右旋糖酐铁,此类(Ⅰ类)铁剂分子量大,化学性质稳定,在血液中很少释放游离铁,需经靶细胞吞噬处理后再解离释放铁以被贮存或利用,铁相关毒性小,但因外壳大分子右旋糖酐具有抗原性,存在严重超敏反应风险。此后出现的Ⅰ类药——羧麦芽糖铁和超顺磁四氧化三铁纳米颗粒去除了右旋糖酐链,降低了超敏反应发生风险,可安全、短时、快速输注,操作方便,使用时无需额外医疗监护,但国内未售。蔗糖铁注射液(Ⅱ类)过敏反应少,虽然铁毒性高于Ⅰ类药,但铁利用率更高,而与Ⅲ类药相比则游离铁产生少、毒性低,目前临床应用最普遍。
口服铁剂与IVI的比较 两者临床应用各有利弊(表3)。口服铁剂主要缺点为吸收差、胃肠道反应重、依从性差,尤其是血液透析患者本身存在胃肠道功能紊乱,更限制了其应用。IVI采取大剂量、间断补充的方式,可能存在给药即刻,机体短时间内铁过载所致相应损害。关于两者比较的临床研究不少。Albaramki等[10]对比口服铁剂和IVI在CKD患者中的应用,结果显示IVI可更有效升高血红蛋白(Hb)、铁蛋白和TSAT水平;该综述纳入的研究中,有9篇报道了给药方式对ESA剂量的影响,显示IVI的优势;关于不良反应方面的8篇文献显示,IVI过敏反应和低血压发生率更高(风险差0.02; 95%CI 0.00~0.04),口服铁剂消化道不良反应更高(风险差-0.17; 95%CI -0.27~ -0.06);关于全因和心血管死亡率仅有2篇和5篇异质性大的研究,显示无差异。2008年的另一项系统性综述纳入了7项研究,显示MHD患者用静脉铁剂后,Hb和铁蛋白水平较口服铁剂升高更明显,但TSAT变化不明显[11]。而其他的3项研究显示口服和IVI无差别[12-14]。特别值得关注的是FIND-CKD研究[15],随访56周,开放、多中心设计,纳入626例非透析CKD合并缺铁性贫血患者。受试者按1∶ 1∶ 1随机分配到高剂量静脉羧麦芽糖铁组(目标血清铁蛋白水平 400~600 ng/ml),低剂量静脉羧麦芽糖铁组(目标血清铁蛋白水平200~400 ng/mL)和口服硫酸亚铁三组中。结果显示高剂量IVI能更快升高并维持Hb水平,而感染和心血管事件发生率和其他组无差别,但其口服硫酸亚铁组剂量100 mg 2次/d,仅相当于每日摄取元素铁40 mg,远低于KDIGO(2012年贫血指南)每日口服元素铁200 mg的推荐剂量。近来一项长期、随机试验显示,CKD贫血患者采用IVI心血管事件和感染发生率较口服铁剂分别升高2.15倍和2.12倍[16],但对炎症状态标志物的影响尚不清楚。

表3 不同给药途径优缺点比较
近来,CKD患者静脉补铁还是口服补铁争论颇多,有人提出存在一些疾病状态时(如感染)时不能静脉补铁,且当继续提升Hb时先静脉补铁,以后则改为维持口服补铁。但目前一般认为IVI疗效比口服铁剂更确切,但严重并发症风险可能相对升高。关于两者优劣的比较,仍需注意以下问题:(1)由于目前已有的研究都存在周期短的缺点,不足以充分观察到潜在慢性铁超载的远期不良影响,尤其对于一些硬终点(全因死亡率、感染、心血管事件等)影响的差异,需随访时间更长的大样本、多中心研究来进一步显示;(2)目前铁剂的治疗目标是将TSAT提高到50%,此目标高出健康成年人正常TSAT水平(33%)很多,有导致IVI过量的风险;(3)虽然口服铁剂胃肠道吸收效率低,以二价离子经DMT1介导吸收,受铁调素调控,但仍存在导致血液中NTBI水平升高的可能[9],因此也存在与和IVI类似的、由于血液中游离铁增加所致的氧化应激、加重感染的风险。
铁剂补充的新方式
由于认识到口服及IVI都存在各自缺点,难以完全满足临床需要,因此发展新的铁剂补充方式显得仍有必要。这方面的进展主要有IVI给药方式的改变,新型口服铁剂及经透析液补铁。
静脉铁小剂量多次给药 针对静脉注射铁剂单次大剂量注射有导致铁过载的风险,有研究提示小剂量多次静脉补铁可能会降低这种风险。2002年一项研究比较了复合葡萄糖酸铁以每次透析6.26~21.3 mg及每1~4周一次62.5 mg的方式给药的差别,至第16周时,多次小剂量给药组的Hb升高程度更明显[17],但该研究未比较不良反应发生风险的差异。来自USRDS数据的报告显示IVI频率及剂量偏高患者的感染相关死亡风险增加14%~45%;而DCI®(Dialysis Clinics Inc.,USA)的数据则显示,平均每次透析IVI剂量高的患者相较于剂量低或未使用者,随访6个月时死亡风险高且与高剂量独立相关[18]。Brookhart等[19]纳入117 050例患者的研究比较了不同IVI用法的死亡率差异,结果显示,短期内大剂量给药(≥100 mg/次)与小剂量(<100 mg/次)定期维持给药相比,感染相关住院风险增加,其中有留置导管和近期存在感染的患者风险最高;同时这种冲击疗法亦与感染相关死亡率相关;而小剂量维持给药和未补铁患者相比,不良预后风险无差别。对于这种给药方式,由于目前静脉铁剂包装规格(例如:蔗糖铁100 mg/支)较大,开封后无法留待下次使用,剩余药物丢弃则成本高,因此还无法在临床上推广。
新型口服铁剂 血红素铁多肽是一种新型口服铁剂,它在胃肠道的吸收途径不同于无机铁,主要以分子形式经肠道上皮细胞绒毛侧内吞入胞,在HO-1作用下释放出Fe2+,不受胃肠道酸碱环境、其他二价金属离子等影响离子铁吸收的因素影响,绕过了铁离子吸收的限速环节——DMT1,因此在HD患者中使用的口服吸收效率高,胃肠道刺激作用小[20],但尚需进一步研究来验证其与传统口服剂型相比在疗效和安全性方面的优势[21]。
枸橼酸铁是一种新型磷结合剂,但研究证实亦可有效增加透析患者体内铁储备[22]。有数据显示,与醋酸钙或司维拉姆比较,枸橼酸铁不仅能有效控制高磷血症,还能增加血清铁蛋白、TSAT和Hb水平,同时降低IVI和ESAs用量。枸橼酸铁组指标变化具体结果为:血清铁蛋白平均升高114.1 ng/ml,在前24周内升高最明显,此后保持相对稳定,至52周时达895 ng/ml;平均TSAT值在12周时升高8.62%,并稳定波动于39%~40%。在52周内,枸橼酸铁组患者IVI中位剂量低(12.9 mg/周vs26.8 mg/周,P<0.001),无需IVI患者比例高(P<0.001), 52周累计ESAs用量低(平均每周EPO用量5 303Uvs6 954U,P=0.04)。针对此项枸橼酸铁研究的述评提醒人们需注意长期使用枸橼酸铁存在慢性铁超载可能,因为以控制血磷为目标的每日枸橼酸铁剂量相当于2 000 mg元素铁,尽管最终被吸收量不清楚,且TSAT和血清铁蛋白水平分别在12周、24周时达到平台期,但有近20%的患者至少有一次血清铁蛋白水平>1 500 ng/ml (而对照组比例为10%),说明枸橼酸铁也会出现铁超载。因此有必要在使用此药时常规检测铁指标,并且根据TSAT和/(或)血清铁蛋白水平来调整剂量。枸橼酸铁最常见的急性副作用是腹泻,发生率为25.6%,但总不良反应发生率与对照组相近(90.3%vs89.3%)[22,23]。枸橼酸铁生物活性高于传统口服铁剂的机制尚不明确,可能与其阴离子基团性质及可能经囊泡或细胞旁途径转运有关,后者与二价金属转运蛋白途径完全不同,使其吸收部位不仅限于十二指肠和空肠上段,并克服了尿毒症所致肠上皮细胞结构和功能异常。另外枸橼酸铁处方剂量铁含量很高(相当于1 200~2 400 mg/d元素铁,传统口服铁剂仅为200 mg/d),可通过超高的铁浓度形成的浓度梯度差克服调节屏障而增加铁的吸收。枸橼酸根还可络合肠道上皮细胞间紧密连接中的钙,从而可能使三价铁和铝等金属离子得以通过细胞旁方式吸收[24],但研究并未观察到血清铝水平的组间差异[25]。
透析液补铁 Gupta等[26]于1999年首次报道了通过透析液加入焦磷酸枸橼酸铁来补铁,发现使用6个月后患者对IVI需求量下降。此后这种铁盐透析液补充的效果又得到两项安慰剂对照的大型随机对照研究证实,并于2015年获美国FDA批准上市。第一项为PRIME研究[27],随机、安慰剂对照设计,纳入规律使用ESAs、Hb水平稳定的血液透析患者108例,治疗36周,期间根据TSAT和血清铁蛋白水平调整IVI用量,根据Hb水平及波动情况调整ESAs处方剂量。结果显示,实验组对Hb水平的影响与对照组无差异,但使患者IVI需求量降低了48%(P=0.044),ESA使用量降低了35%,并未有不良反应、炎症和氧化应激指标方面的差异。另一项为CRUISE研究[28],包括2个Ⅲ期、多中心、单盲、随机、安慰剂对照试验。研究纳入患者需先经4周筛选观察(期间禁用IVI,ESA剂量不变,Hb稳定者入选),纳入后不调整ESA剂量,并在出现下列情况之一时达到终点:Hb<9 g/dl或>12 g/dl;血清铁蛋白<100 ng/dl;Hb水平>11.5 g/dl且在4周后上升1 g/dl;研究达48周。最终纳入599例患者,完成研究者413例,在主要观察终点指标——平均Hb浓度变化上,治疗组稳定,而安慰剂对照组则下降0.3~0.4 g/dl(P=0.011),并伴网织红细胞Hb含量和血清铁蛋白水平明显降低(P<0.001);治疗组血清铁水平升高但铁蛋白水平无变化,有10例患者出现治疗相关不良事件并退出。
焦磷酸枸橼酸铁在透析液中浓度达2 μmol/L(110 μg/L)时,每次透析能补充5~7 mg的元素铁,几乎相当于透析中患者的失铁量,实现了透析中铁的零平衡,对累积性铁缺乏或额外的铁丢失则无影响。透析中焦磷酸枸橼酸铁通过透析膜进入血液,所含铁离子与焦磷酸解离并迅速与亲和力更高的脱铁转铁蛋白结合,解离铁离子并不会超过转铁蛋白结合能力,因此几乎不存在游离铁。目前的焦磷酸枸橼酸铁只能与碳酸氢盐透析液混合使用,因此又发展出配合透析干粉使用的、可直接静脉用药的注射剂型,但仍在应用评估阶段并有待FDA批准。
铁负荷及补铁疗效的评价
精确评估机体铁负荷状态,一方面有助于判断是否缺铁及缺乏程度,决定补铁剂量,同时还可有助于判定补铁效果,避免不足及过量。遗憾的是,目前尚无满意的评估手段,常用的铁蛋白及TSAT在评估铁负荷状态及指导CKD患者补铁治疗方面均存在不足。普通人群绝对铁缺乏的诊断标准为血清铁蛋白浓度<20~30 μg/L,而CKD患者常因炎症反应的存在,血清铁蛋白基础水平高,因此诊断绝对铁缺乏的铁蛋白标准应高于非CKD患者,2012年KDIGO贫血指南的推荐标准为<100 μg/L或200 μg/L。TSAT亦常用于绝对铁缺乏的诊断,标准一般为TSAT<20%,但TSAT≥20%并不能完全排除绝对铁缺乏,特别是CKD患者通常血清转铁蛋白水平低,总铁结合力下降,较低的铁负荷即可能有较高的TSAT。
即使储存铁和循环铁充足,红细胞生成所需铁仍可能供给不足,如大剂量ESAs刺激下需求量增加或炎症状态下巨噬细胞铁释放障碍,此即为相对铁缺乏。对此目前还缺乏广为接受的诊断手段,曾有报道采用低色素红细胞比例及网织红细胞Hb含量[29-30],但由于检测设备不普及、检测需在采血后立即进行、临床可操作性不强,阻碍了其在临床实践中的广泛应用。血清铁调素水平亦曾被提出作为判断患者是否需增加ESAs或静脉铁剂量的指标[31],但临床应用并未证实其作用[30],且目前还缺乏统一的或标准化检测方法。
如何监测铁超载对机体的不良影响目前亦不清楚。血清铁蛋白增高并不绝对反映肝内铁含量增加[32-34],也不能用以区分铁储存在实质细胞还是网状内皮细胞中[35],前者相对危害更大。但需注意,TSAT升高可促进实质细胞铁沉积[36],因此临床需特别注意避免TSAT及血清铁蛋白均升高的情况。已证实磁共振显像(MRI)是评估非CKD患者组织铁含量的可靠方法[37-38],将之应用于血液透析患者发现其肝脏铁含量普遍偏高[39]。但这种无肝酶升高的肝脏铁过载的临床意义尚不明确。目前尚无足够证据支持应用肝脏MRI来指导临床铁剂使用。
小结:补充铁剂是CKD患者贫血纠正的必需手段,但其应用亦可能带来临床不良反应,因此如何正确使用铁剂显得尤为重要。尽管目前尚无公认的精确检查手段来评估机体铁状态以指导临床补铁治疗及减少并发症,但更好地认识及应用常规指标如血清铁蛋白及TSAT却非常重要。我们期待一些更安全、更有效及更便捷的铁剂新剂型、新给药途径不断问世,为临床选择合适方法提供依据。
1 McFarlane SI,Chen SC,Whaley-Connell AT,et al.Prevalence and associations of anemia of CKD: Kidney Early Evaluation Program (KEEP) and National Health and Nutrition Examination Survey (NHANES) 1999-2004.Am J Kidney Dis,2008,51(4 Suppl 2):S46-55.
2 Pfeffer MA,Burdmann EA,Chen CY,et al.A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease.N Engl J Med,2009,361(21):2019-2032
3 Singh AK,Szczech L,Tang KL,et al.Correction of anemia with epoetin alfa in chronic kidney disease.N Engl J Med,2006,355(20):2085-2098.
4 Allen RP,Earley CJ.The role of iron in restless legs syndrome.Mov Disord,2007,22 (Suppl 18):S440-448.
5 Gualdi R,Casalgrandi G,Montosi G,et a.Excess iron into hepatocytes is required for activation of collagen type I gene during experimental siderosis.Gastroenterology, 1994,107(4):1118-1124.
6 Pietrangelo A,Montosi G,Totaro A,et al.Hereditary hemochromatosis in adults without pathogenic mutations in the hemochromatosis gene.N Engl J Med,1999,341(10):725-732.
7 Bailie GR,Larkina M,Goodkin DA,et al.Variation in intravenous iron use internationally and over time: the Dialysis Outcomes and Practice Patterns Study (DOPPS).Nephrol Dial Transplant,2013,28(10):2570-2579.
8 Charytan DM,Pai AB,Chan CT,et al.Considerations and challenges in defining optimal iron utilization in hemodialysis.J Am Soc Nephrol,2015,26(6):1238-1247.
9 Geisser P,Burckhardt S.The pharmacokinetics and pharmacodynamics of iron preparations.Pharmaceutics,2011,3(1):12-33.
10 Albaramki J,Hodson EM,Craig JC,et al.Parenteral versus oral iron therapy for adults and children with chronic kidney disease.Cochrane Database Syst Rev, 2012,1:CD007857.
11 Rozen-Zvi B,Gafter-Gvili A,Paul M,et al.Intravenous versus oral iron supplementation for the treatment of anemia in CKD: systematic review and meta-analysis.Am J Kidney Dis,2008,52(5):897-906.
13 Michael B,Coyne DW,Fishbane S,et al.Sodium ferric gluconate complex in hemodialysis patients: adverse reactions compared to placebo and iron dextran.Kidney Int,2002,61(5):1830-1839.
14 Warady BA,Kausz A,Lerner G,et al.Iron therapy in the pediatric hemodialysis population.Pediatr Nephrol,2004,19(6):655-661.
15 Macdougall IC,Bock AH,Carrera F,et al.FIND-CKD: a randomized trial of intravenous ferric carboxymaltose versus oral iron in patients with chronic kidney disease and iron deficiency anaemia.Nephrol Dial Transplant,2014,29(11):2075-2084.
16 Agarwal R,Kusek JW,Pappas MK.A randomized trial of intravenous and oral iron in chronic kidney disease.Kidney Int,2015,88(4):905-914.
18 Ishida JH,Johansen KL.Iron and infection in hemodialysis patients.Semin Dial,2014,27(1):26-36.
19 Brookhart MA,Freburger JK,Ellis AR,et al.Infection risk with bolus versus maintenance iron supplementation in hemodialysis patients.J Am Soc Nephrol,2013,24(7):1151-1158.
20 Nissenson AR,Berns JS,Sakiewicz P,et al.Clinical evaluation of heme iron polypeptide: sustaining a response to rHuEPO in hemodialysis patients.Am J Kidney Dis,2003,42(2):325-330.
21 Barraclough KA,Brown F,Hawley CM,et al.A randomized controlled trial of oral heme iron polypeptide versus oral iron supplementation for the treatment of anaemia in peritoneal dialysis patients: HEMATOCRIT trial.Nephrol Dial Transplant,2012,27(11):4146-4153.
22 Lewis JB,Sika M,Koury MJ, et al.Ferric citrate controls phosphorus and delivers iron in patients on dialysis.J Am Soc Nephrol,2015,26(2):493-503.
23 Umanath K,Jalal DI,Greco BA,et al.Ferric Citrate Reduces Intravenous Iron and Erythropoiesis-Stimulating Agent Use in ESRD.J Am Soc Nephrol,2015,26(10):2578-2587.
24 Gupta A.Ferric citrate hydrate as a phosphate binder and risk of aluminum toxicity.Pharmaceuticals (Basel),2014,7(10):990-998.
25 Van Buren PN,Lewis JB,Dwyer JP,et al.The Phosphate Binder Ferric Citrate and Mineral Metabolism and Inflammatory Markers in Maintenance Dialysis Patients: Results From Prespecified Analyses of a Randomized Clinical Trial.Am J Kidney Dis,2015,66(3):479-488.
26 Gupta A,Amin NB,Besarab A,et al.Dialysate iron therapy: infusion of soluble ferric pyrophosphate via the dialysate during hemodialysis.Kidney Int,1999,55(5):1891-1898.
27 Gupta A,Lin V,Guss C,et al.Ferric pyrophosphate citrate administered via dialysate reduces erythropoiesis-stimulating agent use and maintains hemoglobin in hemodialysis patients.Kidney Int,2015,88(5):1187-1194.
28 Fishbane SN,Singh AK,Cournoyer SH, et al.Ferric pyrophosphate citrate (Triferic) administration via the dialysate maintains hemoglobin and iron balance in chronic hemodialysis patients.Nephrol Dial Transplant,2015,30(12):2019-2026.
29 Tessitore N,Solero GP,Lippi G,et al.The role of iron status markers in predicting response to intravenous iron in haemodialysis patients on maintenance erythropoietin.Nephrol Dial Transplant,2001,16(7):1416-1423.
30 Tessitore N,Girelli D,Campostrini N,et al.Hepcidin is not useful as a biomarker for iron needs in haemodialysis patients on maintenance erythropoiesis-stimulating agents.Nephrol Dial Transplant,2010,25(12):3996-4002.
31 Swinkels DW,Wetzels JF.Hepcidin: a new tool in the management of anaemia in patients with chronic kidney disease? Nephrol Dial Transplant,2008,23(8):2450-2453.
32 Canavese C,Bergamo D,Ciccone G, et al.Validation of serum ferritin values by magnetic susceptometry in predicting iron overload in dialysis patients.Kidney Int,2004,65(3):1091-1098.
33 Ferrari P,Kulkarni H,Dheda S, et al.Serum iron markers are inadequate for guiding iron repletion in chronic kidney disease.Clin J Am Soc Nephrol,2011,6(1):77-83.
34 Ghoti H,Rachmilewitz EA,Simon-Lopez R,et al.Evidence for tissue iron overload in long-term hemodialysis patients and the impact of withdrawing parenteral iron.Eur J Haematol,2012,89(1):87-93.
35 Arosio P,Yokota M,Drysdale JW.Characterization of serum ferritin in iron overload: possible identity to natural apoferritin.Br J Haematol,1977,36(2):199-207.
36 van Bokhoven MA,van Deursen CT,Swinkels DW.Diagnosis and management of hereditary haemochromatosis.BMJ,2011,342:c7251.
37 Gandon Y,Olivié D,Guyader D,et al.Non-invasive assessment of hepatic iron stores by MRI.Lancet,2004,363(9406):357-362.
38 St Pierre TG,Clark PR,Chua-anusorn W,et al.Noninvasive measurement and imaging of liver iron concentrations using proton magnetic resonance.Blood , 2005,105(2):855-861.
39 Rostoker G,Griuncelli M,Loridon C,et al.Hemodialysis-associated hemosiderosis in the era of erythropoiesis-stimulating agents: a MRI study.Am J Med,2012,125(10):991-999.
(本文编辑 心 平)
Iron supplementation in chronic kidney diseases patients with anemia
LIChuan,GONGDehua
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing20016,China
The chemical activity of iron is very high. It plays an important physiological role in healthy human body. But deficiency or overload of it can cause tissue damage. Especially in early chronic kidney disease (CKD) and end-stage renal disease (ESRD) patients which need or no need for dialysis, who often require iron supplementation. The more popularization and application of kinds of iron therapy in this population is, the better understanding for nephrologists, when they concern about of the pros and cons of iron supplementation. It is still a problem to be solved that how to effectively take iron up and reduce the complications. In this paper, the application of iron treatment related problems and a new type of iron supplement is briefly introduced.
chronic kidney disease anemia iron supplement
10.3969/cndt.j.issn.1006-298X.2016.03.016
南京军区南京总医院肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
2016-05-10
——忌食

