自体造血干细胞移植治疗狼疮性肾炎外周血淋巴细胞亚群的变化与临床疗效
任贵生 黄湘华 王庆文 陈文萃 刘正钊 章海涛 刘志红 胡伟新
自体造血干细胞移植治疗狼疮性肾炎外周血淋巴细胞亚群的变化与临床疗效
任贵生 黄湘华 王庆文 陈文萃 刘正钊 章海涛 刘志红 胡伟新
目的:探讨自体造血干细胞移植(ASCT)治疗顽固性狼疮性肾炎(LN)外周血淋巴细胞亚群的变化及其与临床疗效的关系。 方法:选取2011年6月至2014年6月间18例经免疫抑制治疗未缓解或反复复发的顽固性LN患者接受ASCT治疗。环磷酰胺(CTX)联合粒细胞集落刺激因子行干细胞动员,CTX联合抗胸腺球蛋白多克隆抗体预处理。观察ASCT治疗后外周血CD4+T、CD8+T、CD4+/CD8+比值、调节性T细胞(CD4+CD25+Treg)和CD20+B细胞的变化及其与临床疗效的关系。 结果:ASCT治疗后系统性红斑狼疮疾病活动指数(SLE-DAI)、尿蛋白和自身抗体阳性率显著下降,血清白蛋白和补体水平显著升高。采集后,患者CD4+T细胞计数及CD8+T细胞计数显著下降,回输后出现上升,回输后12个月、18个月CD4+T细胞计数高于采集前,各时间点CD8+T细胞计数均高于采集前;回输后CD4+/CD8+比值持续倒置,患者CD4+CD25+Treg计数显著增加。采集后,患者CD20+B细胞计数显著下降,回输后快速增加。 结论:ASCT治疗顽固性狼疮性肾炎有显著疗效,但淋巴细胞亚群失衡持续存在,CD4+CD25+Treg计数增加可能在治疗中发挥重要作用;6个月后CD20+B细胞增加伴随自身抗体水平升高,表明抗B细胞治疗的必要性。
狼疮性肾炎 自体造血干细胞移植 淋巴细胞亚群
系统性红斑狼疮(SLE)是常见的自身免疫性疾病,可导致肾、关节、血液系统、脑等多系统的损伤,其中肾脏受累即狼疮性肾炎(LN)与SLE的预后关系密切。尽管激素及细胞毒药物的应用改善了LN患者的预后,但仍有部分患者反应欠佳,而药物的不良反应也限制了免疫抑制剂的长期应用。1993年,Marmont[1]首先提出造血干细胞移植有可能用于治疗SLE,1996年自体造血干细胞移植(ASCT)治疗SLE首次在临床实施[2]。ASCT治疗SLE及LN的有效性和安全性已经得到证实[3-4]。我们的研究表明,ASCT治疗重型LN的总缓解率为85%,患者的3年生存率为90%[5]。
在SLE及LN的发病中,外周血淋巴细胞的异常起到重要作用。机体在多种因素作用下,正常的自身免疫耐受被破坏,B细胞过度增殖并功能亢进,产生多种自身抗体,损伤自身组织。T细胞异常为B细胞活化提供了基础,并起到诱导作用。成熟T细胞分为CD4+辅助性T细胞(Th)、CD8+细胞毒T细胞(CTL)和CD4+CD25+调节性T细胞(Treg)。CD4+Th细胞可以分泌不同的细胞因子作用于其他细胞,影响它们的功能。CD8+CTL则通过释放颗粒酶或FasL/Fas通路诱导细胞凋亡,还可分泌多种细胞因子促进细胞免疫效应[6]。目前,有关淋巴细胞在ASCT治疗LN前后的变化及这样的变化在治疗中所起作用的研究甚少。本文回顾性观察了ASCT治疗18例重型LN患者的临床疗效及患者淋巴细胞亚群的变化,并分析了两者间可能存在的联系。
对象和方法
病例选择 2011年6月至2014年6月在我科行ASCT的重型LN患者18例。诊断均符合美国风湿病协会1997年的修订SLE诊断标准[7],并计算SLE疾病活动指数(SLE-DAI)[8]。在ASCT前行肾活检明确病理类型(2003年ISN/RPS分型标准)[9],并行肾组织活动性指数(AI)、肾组织慢性指数(CI)评分。
纳入标准 (1)年龄在18~50岁;(2)复发或难治性LN,肾活检证实为重型LN,且提示肾脏活动性病变;(3)血清肌酐(SCr)<176.8 μmol/L;(4)无心肺等重要器官禁忌;(5)患者及其家属移植意愿强烈。
排除标准 (1)活动性感染;(2)肾脏病理慢性化病变重,CI≥3分;(3)心功能NYHA分级3/4级;(4)氧合功能不佳,不吸氧时氧饱和度<95%。
免疫药物治疗方案 采集和回输前后停用其余免疫抑制剂,仅用泼尼松治疗(10~20 mg/d)。自体造血干细胞(ASC)植入后,如病情持续缓解,则泼尼松逐渐减量至停用;如临床有复发趋势,则予小剂量泼尼松联合免疫抑制剂治疗,包括他克莫司、霉酚酸酯和雷公藤多苷。
ASC的动员和采集 使用环磷酰胺(CTX)联合粒细胞集落刺激因子(G-CSF)动员,CTX 3~4 g/m2,分两天使用。从CTX使用后第四天开始,G-CSF 200 μg/d。于白细胞计数升至>4×109/L时行CD34+细胞计数。当CD34+细胞计数>15个/μl时开始采集。采集目标量为CD34+细胞计数>2×106个/kg。
预处理及ASC的回输 在采集后1个月行ASC回输。回输前使用CTX联合抗胸腺球蛋白多克隆抗体(ATG)预处理。CTX剂量30~40 mg/(kg·d),ASC回输前2~5d连续4d,ATG剂量2.5 mg/(kg·d),ASC回输前2~4d连续3d,同时水化、碱化。应用标准方法复苏干细胞,经颈内静脉置管快速回输。回输后第2天开始使用G-CSF。
淋巴细胞亚群的测定 使用的主要试剂为CD4-FITC/CD8-PE/CD3-PC5,CD20-FITC,CD19-PE,CD25-PC5,CD127-PE,CD4-FITC(美国BECKMAN COULTER公司)。标本管加入对应试剂10 μl,再加入全血50 μl,混匀后置室温避光孵育20 min,溶血,固定。使用流式细胞仪进行检测。检测的指标包括CD4+T细胞计数(参考值651±274个/μl)、CD8+T细胞计数(参考值453±211个/μl)、CD4+T细胞比例(参考值41.0%±7.1%)、CD8+T细胞比例(参考值28.2%±6.3%)、CD4+/CD8+比值(参考值1.6±0.6)、CD4+CD25+Treg计数(参考值33±9个/μl)、CD4+CD25+Treg比例(参考值2.1%±0.6%)、CD20+B细胞计数(参考值125±52个/μl)、CD20+B细胞比例(参考值11.0%±2.9%)。
临床和实验室指标 包括SLE-DAI,SCr(参考值45.1~109.6 μmol/L),ANA和抗-dsDNA,血清白蛋白(Alb)(参考值35~55 g/L),尿蛋白定量(参考值≤0.4 g/24h)和尿沉渣红细胞(RBC)计数(参考值0.8~1.0万/ml)。
疗效分为完全缓解(CR)、部分缓解(PR)和无效(NR)。CR定义为:尿蛋白定量≤0.4 g/d,无活动性尿沉渣(尿RBC正常范围,无白细胞尿及管型尿),Alb≥35 g/L,SCr<109.6 μmol/L,无肾外狼疮活动;PR定义为:尿蛋白定量下降超过基线值的50%且<3.5 g/d,Alb≥30 g/L,SCr正常或上升不超过基础值的25%;未达到CR或PR则定义为NR。
统计学方法 采用SPSS 20.0统计软件进行数据处理,正态分布的计量资料采用均数±标准差表示,采用t检验进行比较,非正态分布的计量资料以中位数(四分位数间距)表示;计数资料采用病例数和(或)百分数描述,采用卡方检验进行比较。P<0.05为差异有统计学意义。
结 果
一般情况 18例患者中男性8例,女性10例,年龄24.5(19.2~31.5)岁。采集前狼疮病程45.5(24.5~71)个月,SLE-DAI 14.8±4.7分。起病时2例合并心脏病变,2例合并中枢神经系统病变,14例存在血液系统损害,7例存在皮肤损害,7例存在关节损害。
肾脏损害 18例患者中3例表现为肾病综合征,2例表现为单纯性镜下血尿,13例表现为镜下血尿合并蛋白尿。2例SCr升高,平均79.6±30.9 μmol/L,无患者需要行肾脏替代治疗。4例有大量蛋白尿(>3.5 g/d),没有患者出现肉眼血尿。
肾脏病理类型 18例患者中Ⅲ型1例,Ⅳ型4例,Ⅳ+Ⅲ型1例,Ⅴ+Ⅳ型9例,Ⅴ+Ⅲ型3例。AI平均9.4±3.2分,CI平均2.0±1.5分。
临床疗效 采集前,回输前,回输后3个月、6个月、12个月、18个月、24个月、30个月的各项肾脏及免疫学指标变化见表1。
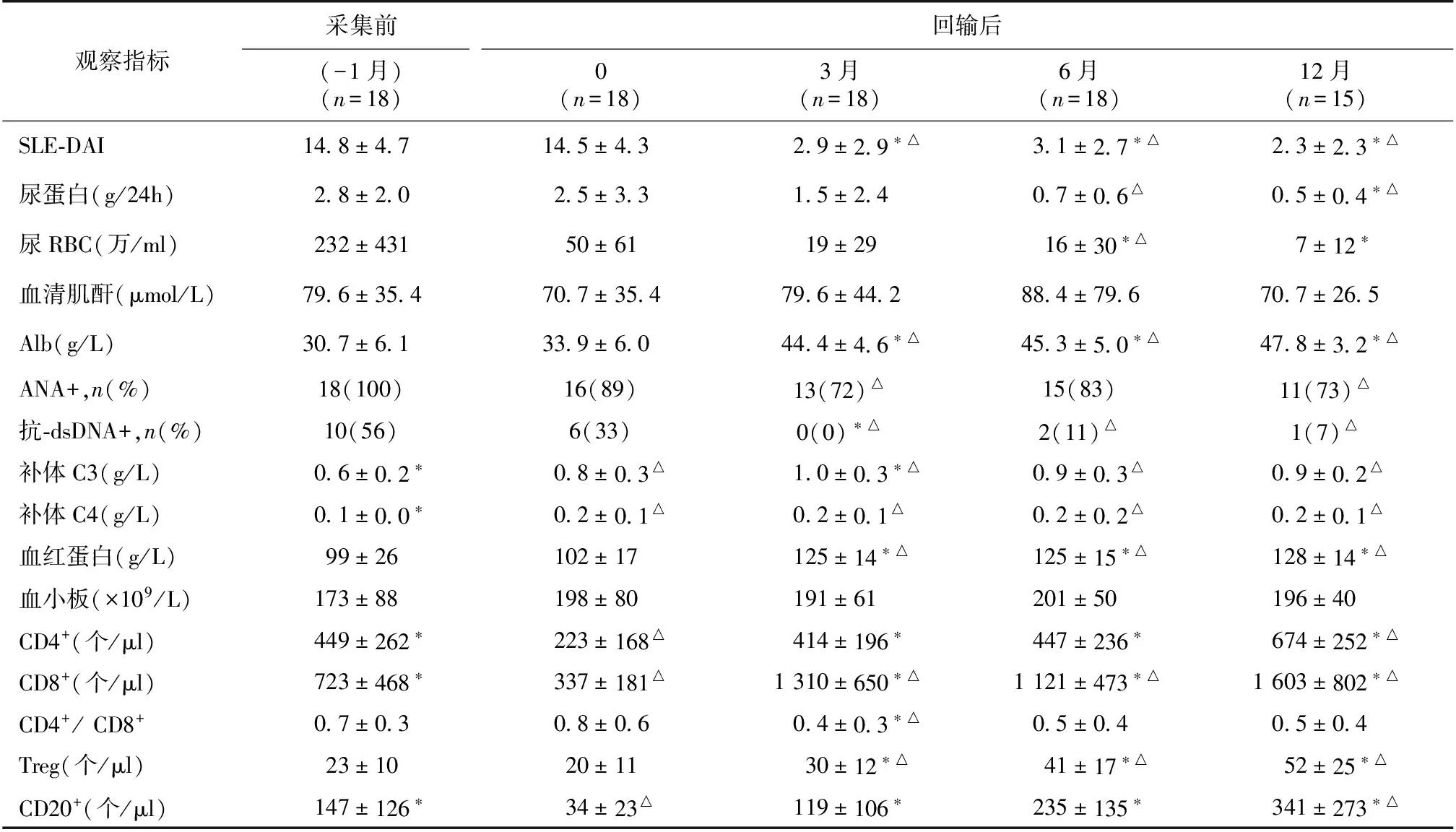
表1 ASCT治疗后临床指标的变化
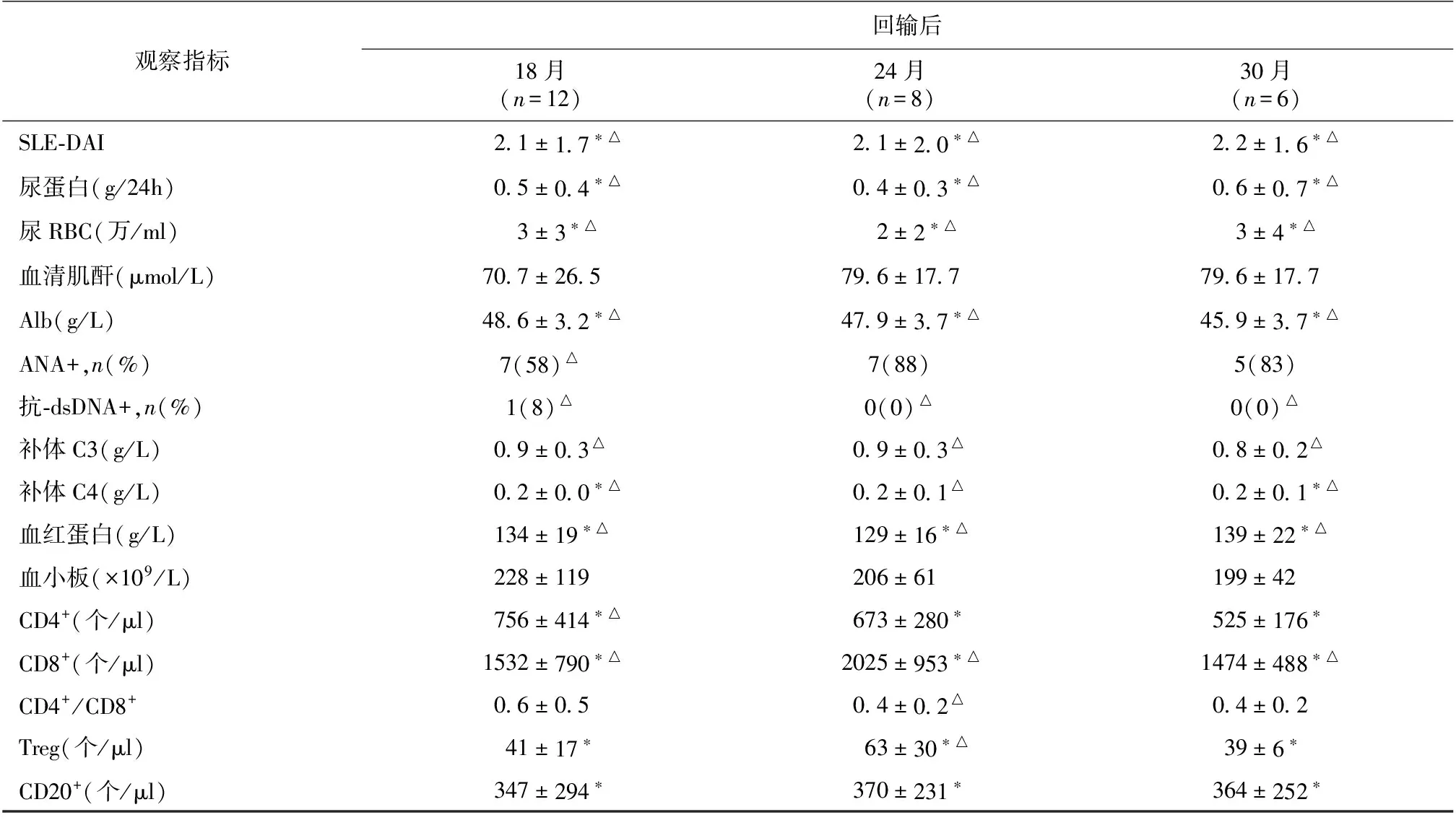
续表1
ASCT:自体外周血造血干细胞移植;SLE-DAI:系统性红斑狼疮活动指数;尿RBC:尿沉渣红细胞计数;Alb:血清白蛋白;*:与回输前相比,P<0.05;△:与采集前相比,P<0.05
淋巴细胞亚群的变化:采集后,患者CD4+T细胞计数及CD8+T细胞计数显著下降,回输后出现上升,回输后12个月、18个月CD4+T细胞计数高于采集前,回输后各时间点CD8+T细胞计数均高于采集前。回输后6个月CD4+T细胞比例低于采集前,3个月、12个月、18个月、24个月、30个月CD8+T细胞比例高于采集前。回输后3个月、24个月、30个月CD4+/ CD8+比值显著低于采集前(图1)。回输后患者CD4+CD25+Treg计数显著增加(图2)。采集后,患者CD20+B细胞计数显著下降,回输后快速增加(图2)。
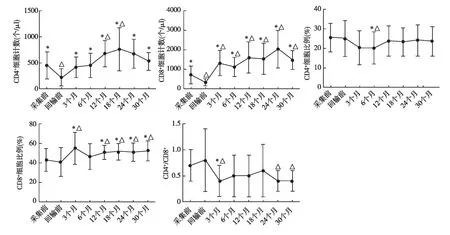
图1 治疗后CD4+T、CD8+T细胞的变化*:与回输前相比,P<0.05;△:与采集前相比,P<0.05
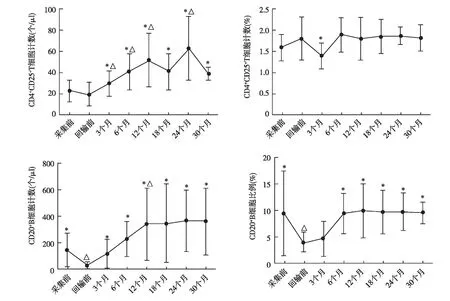
图2 治疗后CD4+CD25+T、CD20+B细胞的变化*:与回输前相比,P<0.05;△:与采集前相比,P<0.05
不良反应 移植过程中,11例出现恶心、呕吐(61.1%),9例出现腹泻(50%),13例发生黏膜炎(72.2%),9例粒缺期出现发热(50%),7例发生皮疹(38.9%),2例发生心律失常(11.1%),2例出现肝酶升高(11.1%)。没有患者因移植导致死亡。
随访观察 患者随访21(6~36)个月。在末次随访时,11例获得CR(61.1%),6例获得PR(33.3%),1例疗效为NR(5.6%),进入腹膜透析。
讨 论
虽然免疫抑制治疗的进步已使SLE和LN患者的预后大大改善,但是传统治疗方法依然存在局限。即使是多种免疫抑制剂的联合治疗,也难以完全控制患者的异常免疫状态。此外,传统免疫抑制治疗对自身反应性记忆细胞和长寿命浆细胞的作用有限,且不能恢复调节性T细胞的功能,无法恢复自身耐受。相比较而言,ASCT治疗SLE和LN具有独特的优势,可恢复免疫耐受,实现疾病长期缓解。
ASCT治疗SLE和LN的机制尚不明确,目前认为预处理时大剂量免疫抑制剂的应用和ASCT后的免疫重建可能发挥了主要作用[10]。治疗成功的关键在于原有的自身免疫性细胞克隆被摧毁,重建正常的免疫细胞体系[11]。ASCT后的免疫重建包括功能B细胞、胸腺及胸腺外T细胞的恢复、杀伤性T细胞与NK细胞的免疫功能重建和免疫系统有效抗原的表达[12]。我们的研究发现,ASCT后患者临床指标显著改善的同时,CD4+/CD8+比值仍持续倒置,这与传统免疫抑制治疗后患者的反应完全不同。这可能是由于LN患者中淋巴细胞的凋亡机制出现了问题,自身反应性淋巴细胞无法通过凋亡被清除,而移植后的免疫重建“校正”了对自身反应性淋巴细胞失效的凋亡机制,但是“矫枉过正”。此外,治疗的有效伴随着CD4+/ CD8+的持续倒置也与大剂量化疗预处理后胸腺的残余功能有关。胸腺的作用在中年后开始退化,使CD4+T细胞在移植后需要经过比较长的时间才能逐渐恢复,与此同时CD8+T细胞却不依赖胸腺的成熟记忆生成[13]。徐景勃等[14]的研究发现这种比值异常甚至在ASCT后2年仍未恢复。Farge等[15]对系统性硬化患者行ASCT,发现治疗无效组的CD4+T细胞较有效组恢复快,而移植后病情平稳时CD4+T细胞显著减少,复发时则大幅度回升。这样的规律可能同样适用于ASCT后的LN患者,即CD4+/ CD8+比值的上升预示着病情的复发,但有待进一步研究加以证实。
CD4+CD25+Treg是一类具有免疫抑制效应的CD4+T细胞亚群,约占CD4+T细胞的10%,可抑制多种效应细胞介导的免疫应答,对于免疫稳态的维持及对自身免疫耐受的诱导起重要的作用。CD4+CD25+Treg数量或功能的下降在许多自身免疫疾病中被观察到,在这些疾病中往往还发生了针对自身抗原的以Th17细胞应答为主的慢性炎症[16,17]。研究发现脐带间充质干细胞可以通过分泌TGF-β使CD4+CD25+Treg的数量增加[18],这可能是其有效治疗SLE的机制之一。许多患者在ASCT后虽未能完全清除自身攻击性的免疫系统,但使其达到了抑制的状态,从而实现了临床缓解。这种免疫重建的部分原因是CD4+CD25+Treg数目和活性的增加。我们研究发现,对于重型LN患者,回输后各项指标改善的同时,CD4+CD25+Treg数量显著增加。这提示ASCT通过增加CD4+CD25+Treg的数量,抑制了Th细胞的活化,降低了B细胞激活因子的水平,最终减少自身抗体的产生,对包括肾脏在内的多个器官起到保护作用。
在SLE及LN患者中,自身免疫性B细胞产生多种自身抗体,导致了疾病的发生。以B细胞为靶点的治疗手段,如CD20单抗的应用已证实有效[19]。我们研究发现,回输后患者自身抗体阳性率下降,补体水平上升,尿蛋白等指标获得改善的同时,B细胞的数量却显著增加。我们推测,这是由于ASCT清除了患者体内致病的B细胞克隆,而在回输后由于并未使用大剂量的免疫抑制剂进行维持治疗,非致病的B细胞克隆迅速恢复。正是基于此,患者自身抗体转阴的同时,正常的体液免疫迅速重建。但是需要指出的是,在回输后6个月,患者的CD20+B细胞计数恢复到比较高的水平,抗-dsDNA抗体的阳性率也上升,提示ASCT后6个月致病的B细胞克隆再次增殖,此时适量加用免疫抑制剂可能可以更好地预防疾病复发。
总之,ASCT治疗重型LN的疗效确切,患者的肾脏及免疫学指标可以获得明显改善。ASCT所导致的免疫重建,包括对失效的淋巴细胞凋亡机制的校正、CD4+CD25+Treg数量的增加、非致病性B细胞数量增加等机制可能发挥了重要作用,但具体的机制仍有待进一步研究。
1 Marmont AM.Immune ablation with stem-cell rescue:a possible cure for systemic lupus erythematosus?Lupus,1993,2(3):151-156.
2 Marmont AM,van Lint MT,Gualandi F,et al.Autologous marrow stem cell transplantation for severe systemic lupus erythematosus of long duration.Lupus,1997,6(6):545-548.
3 Jayne D,Tyndall A.Autologous stem cell transplantation for systemic lupus erythematosus.Lupus,2004,13(5):359-365.
4 Collins E,Gilkeson G.Hematopoetic and mesenchymal stem cell transplantation in the treatment of refractory systemic lupus erythematosus--where are we now? Clin Immunol,2013,148(3):328-334.
5 黄湘华,王庆文,胡伟新,等.自体外周血造血干细胞移植治疗重型狼疮性肾炎的临床观察.肾脏病与透析肾移植杂志,2014,23(6):501-506.
6 Wong P,Pamer EG.CD8 T cell responses to infectious pathogens.Annu Rev Immunol,2003,21:29-70.
7 Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1997,40(9):1725.
8 Bombardier C,Gladman DD,Urowitz MB,et al.Derivation of the SLEDAI.A disease activity index for lupus patients.The Committee on Prognosis Studies in SLE.Arthritis Rheum,1992,35(6):630-640.
9 Weening JJ,D′Agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited.J Am Soc Nephrol,2004,15(2):241-250.
10 Auletta JJ,Lazarus HM.Immune restoration following hematopoietic stem cell transplantation:an evolving target.Bone Marrow Transplant,2005,35(9):835-857.
11 Traynor AE,Barr WG,Rosa RM,et al.Hematopoietic stem cell transplantation for severe and refractory lupus.Analysis after five years and fifteen patients.Arthritis Rheum,2002,46(11):2917-2923.
12 Imamura M,Tsutsumi Y,Miura Y,et al.Immune reconstitution and tolerance after allogeneic hematopoietic stem cell transplantation.Hematology,2003,8(1):19-26.
13 Porter DL,June CH.T-cell reconstitution and expansion after hematopoietic stem cell transplantation:′T′ it up! Bone Marrow Transplant,2005,35(10):935-942.
14 徐景勃,钟淑萍,李学刚,等.系统性红斑狼疮非清髓性自体外周血造血干细胞移植后免疫重建的五年随访.中华风湿病学杂志,2014,18(2):105-109.
15 Farge D,Henegar C,Carmagnat M,et al.Analysis of immune reconstitution after autologous bone marrow transplantation in systemic sclerosis.Arthritis Rheum,2005,52(5):1555-1563.
16 Miossec P,Korn T,Kuchroo VK.Interleukin-17 and type 17 helper T cells.N Engl J Med,2009,361(9):888-898.
17 Sakaguchi S,Yamaguchi T,Nomura T,et al.Regulatory T cells and immune tolerance.Cell,2008,133(5):775-787.
18 Wang D,Huang S,Yuan X,et al.The regulation of the Treg/Th17 balance by mesenchymal stem cells in human systemic lupus erythematosus.Cell Mol Immunol,2015 Oct 5.
19 Weide R,Heymanns J,Pandorf A,et al.Successful long-term treatment of systemic lupus erythematosus with rituximab maintenance therapy.Lupus,2003,12(10):779-782.
(本文编辑 凡 心 旅 程)
Lymphocyte subset changes in patients with lupus nephritis after autologous hematopoietic stem cell transplantation
RENGuisheng,HUANGXianghua,WANGQingwen,CHENWencui,LIUZhengzhao,ZHANGHaitao,LIUZhihong,HUWeixin
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
HUWeixin(E-mail:huwx@vip.163.com)
Objective:To observe the change of lymphocyte subsets in patients with severe lupus nephritis (LN) after the autologous hematopoietic stem cell transplantation (ASCT) and the relationship with clinical curative effect. Methodology:Eighteen patients with severe and refractory LN who underwent ASCT from June 2011 to June 2014 were investigated retrospectively, whose clinical manifestations persisted or recurred frequently after immunosuppressive therapy. Cyclophosphamide(CTX)and granulocyte colony-stimulating factor(G-CSF)were used before stem cell harvest, and the conditioning regimens included CTX and anti-thymocyte globulin(ATG). The therapeutic effect of ASCT on LN, as well as changes in CD4+T cells, CD8+T cells, CD4+CD25+regulatory T cells (CD4+CD25+Treg) and CD20+B cells were analyzed. Results:After ASCT, the patients’ SLE disease activity index (SLE-DAI), urine protein excretion, as well as autoantibody positive rate was decreased significantly, while the levels of serum albumin, C3 and C4 were increased notably. The counts of CD4+T cell and CD8+T cell were decreased after stem cell harvest, and then increased after transfusion. More CD4+T cells were found at 12 months、18 months after transfusion compared with before harvest, and more CD8+T cells were found every time point after transfusion compared with before harvest. The inversion of the CD4+/CD8+ratio persisted. The counts of CD4+CD25+Treg were increased notably after the treatment. The variation trend of CD20+B cells was the same as CD4+T cells and CD8+T cells. Conclusion:ASCT is an effective therapy to severe and refractory LN, but the imbalance of lymphocyte subsets persists. The increase of CD4+CD25+Treg counts may play an important role in the treatment. 6 months after transfusion, the number of CD20+B cells were increased, as well as the positive rate of autoantibodies. This suggests that it may be necessary to give immunosuppressive therapy at that time.
lupus nephritis autologous hematopoietic stem cell transplantation lymphocyte subsets
10.3969/cndt.j.issn.1006-298X.2016.03.005
国家科技支撑计划课题(2013BAI09B04,2015BAI12B05)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
胡伟新(E-mail:huwx@vip.163.com)
2016-02-04
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

