血磷水平与糖尿病肾病患者肾脏损伤及远期预后的关系
邱丹丹 蒋 松 潘 瑜 安 玉 徐 峰 葛永纯 刘志红
血磷水平与糖尿病肾病患者肾脏损伤及远期预后的关系
邱丹丹 蒋 松 潘 瑜 安 玉 徐 峰 葛永纯 刘志红
目的:观察血磷水平与糖尿病肾病(DN)患者肾脏损伤和远期预后之间的关系。 方法:回顾性分析2004年1月至2015年7月南京军区南京总医院肾脏科597例2型糖尿病肾病(DN)患者,中位随访时间36个月,观察高磷血症的发生率,血磷水平与肾脏损伤程度的相关性,并评估高磷血症对肾脏终点风险的预测价值。 结果:基线估计的肾小球滤过率(eGFR)>90 ml/(min·1.73 m2)、60~90 ml/(min·1.73 m2)、<60 ml/(min·1.73 m2)的三组DN患者中,高磷血症(血磷>1.45 mmol/L)的发生率分别为11.7%(25/214)、16.7%(25/150)和30.5%(71/233)。血磷水平与尿液中肾小管间质性损伤标志物表达正相关(P<0.01),与肾小管间质损伤病理评分(间质纤维化和小管萎缩评分、间质炎症评分)存在相关性(P<0.05)。此外,随着血磷水平增加,患者发生终末期肾病(ESRD)的风险增加(对数秩检验,P<0.01)。校正年龄、性别、血压、血脂、体质量指数、24h尿蛋白定量、血钙和基线eGFR后,高磷血症仍然是进展至ESRD的高危因素(P<0.001)。 结论:在DN患者[尤其eGFR≥60 ml/(min·1.73 m2)]中,高磷血症与患者肾小管间质性损伤显著相关,且是发生ESRD的独立风险因素。
糖尿病肾病 高磷血症 肾脏损伤 远期预后
慢性肾脏病(CKD),尤其是CKD 3~5期的患者,其血磷水平升高与肾功能下降、心血管事件的发生和全因死亡密切相关[1-4]。然而,在CKD 1~2期或早期糖尿病肾病(DN)患者中有关高磷血症发生率的研究却很少。
机体内血磷水平主要受到肠道磷吸收、骨代谢以及肾脏磷排泄等因素的影响[3]。肾脏排磷能力与血磷、血钙、尿量、甲状旁腺素、1,25-二羟维生素D、血糖水平密切相关,且受到成纤维细胞生长因子23(FGF-23)和Klotho等分子的调控[5]。肾小球滤过的磷约80%~90%由近端小管NaPi-2a协同转运蛋白重吸收。因此,肾脏损伤可影响对磷的滤过和重吸收功能。DN早期即可出现肾小球和肾小管间质损伤[6],并与疾病进展密切相关[7]。
因此,我们推测高磷血症可能与肾脏损伤及肾脏远期预后存在相关性。尽管部分肾切除的SD大鼠模型研究表明,高磷血症与肾小管损伤之间存在相关性[8],但目前仍然缺少相关的临床研究来证实两者之间的关系。基于以上背景,本文旨在评估各期DN患者高磷血症的发生率,探索血磷水平与肾脏损伤以及肾脏远期预后的关系。
对象和方法
研究对象 选取2004年1月至2015年7月南京军区南京总医院肾脏科2型糖尿病肾病(DN)患者597例。入选标准:(1)符合美国糖尿病协会(ADA)2型糖尿病诊断标准;(2)经过肾活检诊断为DN或临床符合DN特点,持续尿白蛋白定量≥30 mg/24h和(或)估计的肾小球滤过率(eGFR)<60 ml/(min·1.73m2)。排除标准:(1)合并有其他肾脏疾病的患者(如IgA肾病、膜性肾病等);(2)出现大量血尿或肉眼血尿、短期内出现大量蛋白尿或肾病综合征、GFR快速降低、伴其他系统性疾病或低血压等与糖尿病不符的临床表现的患者;(3)多发性骨髓瘤、淋巴瘤、白血病等肿瘤病史、甲状旁腺功能异常、软骨病、处于骨骼愈合期及服用雄激素、合成类激素等可导致血磷异常的患者。其中有414例(69.3%)患者接受肾活检,并被诊断为DN。
临床及实验室指标 收集肾活检或入院前后1个月内的临床资料作为基线资料,包括年龄、性别、糖尿病病程、血压、体重、身高、空腹血糖(FBG)、糖化血红蛋白(HbA1c)、血清肌酐、24h尿蛋白定量、估算的肾小球滤过率(eGFR)、血清白蛋白、总胆固醇、三酰甘油、血清钙、血清磷、尿液中N-乙酰-β-D-氨基葡萄糖苷酶(NAG)、视黄醇结合蛋白(RBP)及中性粒细胞明胶酶相关脂质运载蛋白(NGAL)等指标。其中血清钙和血清磷采用自动生化仪比色法进行检测。
肾脏组织病理改变评分 所有肾活检标本均进行光镜、免疫荧光、电镜检查,光镜检查包括HE、PAS、PASM-Masson 及Masson 三色染色。所有评分标准均在PAS 染色上进行。评分标准严格按照Tervaert 等[9]提出的病理分型标准执行。所有标本均由一不知晓临床结果的病理医师进行评分。为了评估评分的可靠性和重复性,由另一位病理医师从中随机选取100张病理切片进行独立评分。
肾脏结局 终末期肾病(ESRD)定义为eGFR<15 ml/(min·1.73m2)或开始接受维持性肾脏替代治疗。对于未达到肾脏终点的患者,最后一次随访数据作为他们的最终数据。
统计学方法 采用Stata/SE software 12 (Stata Corp) 软件进行统计分析。血磷水平采用四分位间距(Q25th=1.17 mmol/L,Q75th=1.45 mmol/L)进行分类。连续性变量采用方差分析,分类资料采用卡方检验。未校正的每1 000人/年的发生率(95%置信区间)用来计算ESRD的发生率。比较血磷水平与病理学特征之间的相关性,采用Fisher精确检验。Kaplan-Meier曲线用于分析血磷水平与肾脏结局之间的关系。采用COX风险模型及限制性样条回归模型预测肾脏终点的风险,并对患者的年龄、性别、eGFR、FBG、HbA1c、血脂水平和白蛋白变量进行校正,设定正常血磷水平1.17 mmol/L的风险比(HR)为1。所有检验均为双侧检验,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
患者基线资料及高磷血症发生率 597例DN患者的平均年龄为49.43±9.34岁,基线eGFR为73.17±0.63 ml/(min·1.73m2)。根据患者基线血磷水平四分位间距将其分为三组(表1),血磷水平分别为<1.17 mmol/L,1.17~1.45 mmol/L和>1.45 mmol/L。与血磷<1.17 mmol/L和血磷1.17~1.45 mmol/L组相比,高磷血症组(>1.45 mmol/L)患者年龄较低(P=0.094)、蛋白尿水平升高(P<0.001)、血清总胆固醇升高(P<0.001)、血钙降低(P=0.001)、血清白蛋白降低(P<0.001)、基线eGFR较低 (P<0.001)。基线eGFR>90 ml/(min·1.73m2)、60~90 ml/(min·1.73m2)和<60 ml/(min·1.73m2)的DN患者的高磷血症发生率分别为11.7%(25/214)、16.7%(25/150)、30.5%(71/233)。病理分期为Ⅰ、Ⅱ、Ⅲ、Ⅳ期的DN患者的高磷血症的发生率分别为12.7%(8/63)、11.7%(15/128)、31.5%(52/165)和23.2%(13/56)。
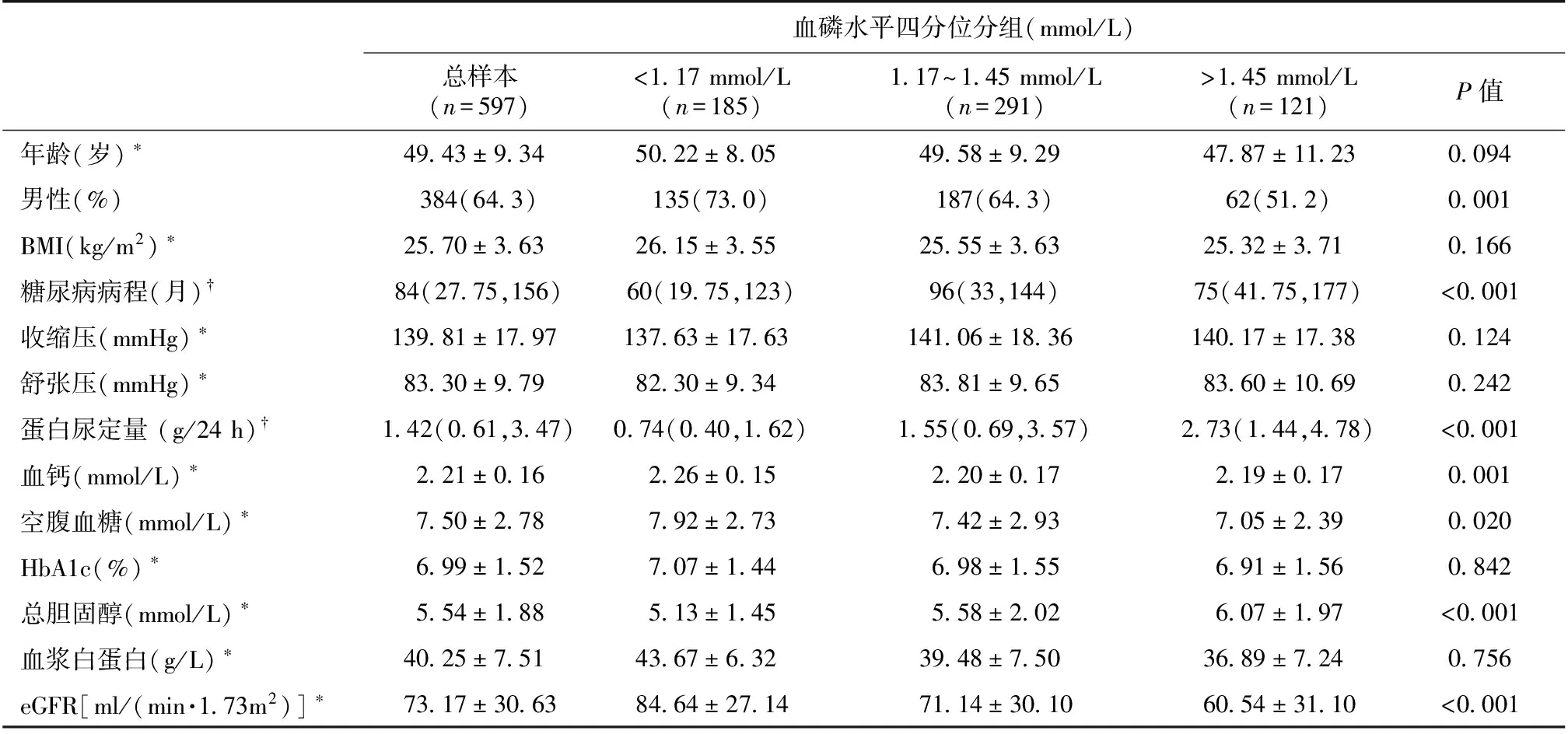
表1 根据血磷浓度四分位分组后患者的基线临床资料
BMI:体质量指数;HbA1c:糖化血红蛋白;*:数据用均数±标准差表示;†:数据用中位数(25th,75th)表示;:连续性变量用方差分析,分类变量采用卡方检验
血磷水平与肾小管间质损伤评分的相关性 我们观察了患者基线血磷水平与尿液中肾小管间质损伤标志物NAG、RBP和NGAL水平的关系。结果显示,当患者血磷>1.45 mmol/L时,尿液NAG(P<0.01),RPB(P<0.01)和NGAL(P<0.01)均明显升高,提示高磷血症同肾小管间质损伤相关。为此我们进一步评价了血磷水平同患者肾脏损伤评分[9]之间的关系。在eGFR>90 ml/(min·1.73m2)、60~90 ml/(min·1.73m2)、<60 ml/(min·1.73m2)三组DN患者中,血磷水平与间质性纤维化和小管萎缩评分(IFTA)之间存在显著相关性(P<0.01)。在eGFR 60~90 ml/(min·1.73m2)、<60 ml/(min·1.73m2)的两组患者中,血磷水平与间质炎症评分之间也存在相关性(P<0.01)。但是,血磷水平与肾小球病理分型之间缺乏相关性(表2)。
在eGFR≥60 ml/(min·1.73m2)的DN患者中,血磷水平与24h尿蛋白存在相关性(r2=0.1122,P<0.001),而与基线eGFR无相关性(r2=0.009 6,P=0.062)。
高磷血症对DN患者肾脏远期预后的预测 209例DN患者在随访过程中进入ESRD。血磷<1.17 mmol/L、1.17~1.45 mmol/L、>1.45 mmol/L三组中,ESRD的发生率分别为每1 000人年31.70(95%CI 20.87~48.14)、121.39(95%CI 101.58~145.07)和165.86(95%CI 130.31~211.12)。Cox回归模型显示血磷1.17~1.45 mmol/L较血磷<1.17 mmol/L 组ESRD风险增加,HR=3.94(95%CI 2.50~6.22);而血磷>1.45 mmol/L 组较血磷<1.17 mmol/L 组ESRD风险增加更为明显,HR=5.41(95%CI 3.33~8.77)。即使在校正年龄、性别、血压、血脂、BMI、蛋白尿、血钙和基线eGFR等影响因子后,基线血磷水平升高仍然同ESRD发生风险增加相关(P<0.001)(表3)。Kaplan-Meier生存曲线显示,高血磷组患者的ESRD累积事件发生率增加(对数秩检验,P<0.01)(图1)。Spline回归模型亦显示,在校正年龄、性别、BMI、血压、蛋白尿和基线eGFR等混杂因素后,随着血磷水平升高,ESRD发生风险升高(图2)。

表2 血磷水平与肾脏病理损伤程度的相关性
IFTA,间质纤维化和肾小管萎缩;eGFR:估算的肾小球滤过率;采用Fisher精确检验

表3 根据血磷浓度四分位分组后ESRD的风险比(n=597)
†模型1:未校正;模型2:模型1+校正年龄和性别;模型3:模型2+校正糖尿病病程、血压、血脂、体质量指数和蛋白尿;模型4:模型3+校正血钙;模型5:模型4+校正;EGFR:估算的肾小球滤过率;ESRD:终末期肾病
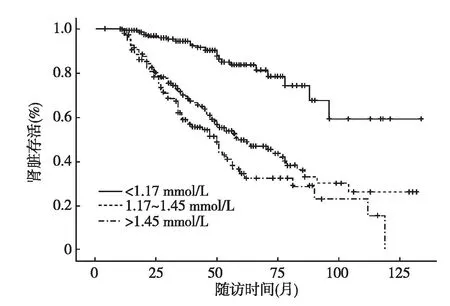
图1 Kaplan-Meier曲线分析不同血磷浓度的肾脏存活率
进一步观察不同基线eGFR分层后,DN患者血磷水平同肾脏结局发生的关系。在基线eGFR>90 ml/(min·1.73m2)的患者中,校正年龄、性别、血压、蛋白尿后,血磷>1.45 mmol/L将增加ESRD的风险(HR=1.26,95%CI 1.00~1.58,P=0.004),但是血磷水平在1.17~1.45 mmol/L时,出现ESRD的风险不增高;在eGFR 60~90 ml/(min·1.73m2)的患者中,血磷>1.45 mmol/L时,ESRD的风险率显著升高(HR=1.60 95%CI 1.12~2.30,P<0.001),并且血磷水平在1.17~1.45 mmol/L也可增加ESRD的风险(HR=1.45,95%CI 1.19~1.77,P<0.001)。
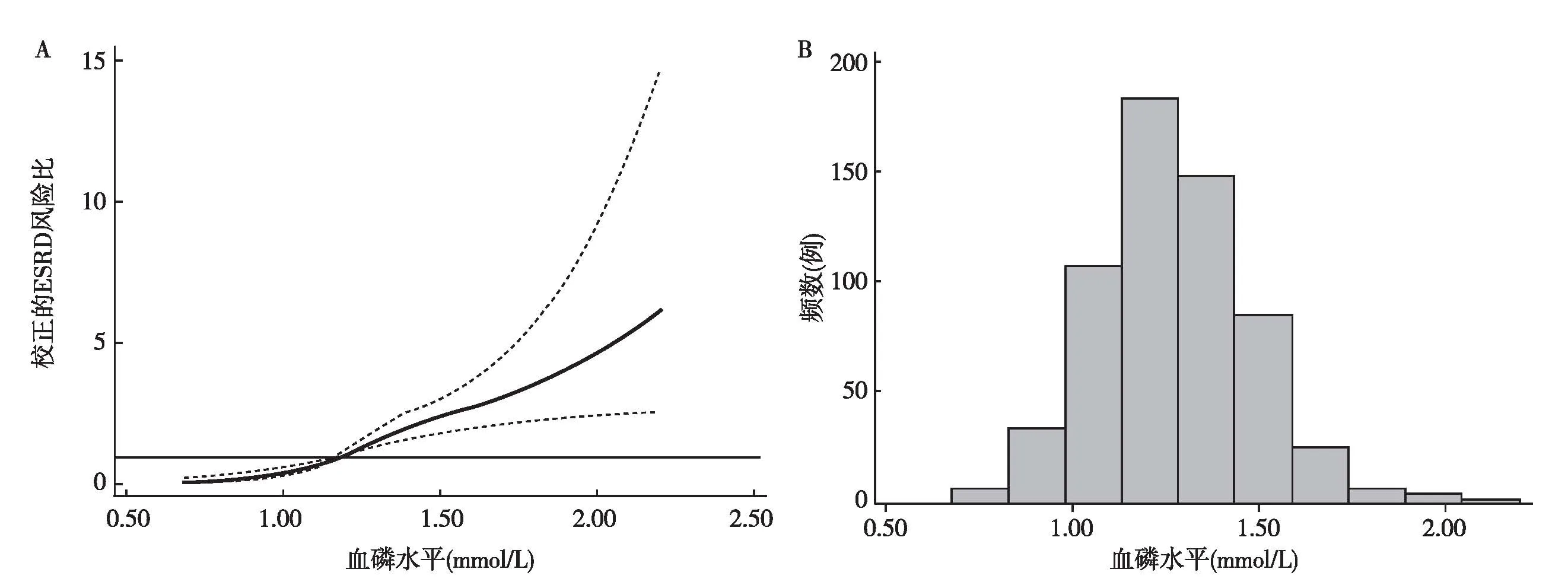
图2 血磷水平升高增加ESRD的风险ESRD:终末期肾病;A:Spline回归显示血磷水平升高可增加ESRD的风险,设定血磷水平1.17 mmol/L的HR=1;B:糖尿病肾病患者血磷水平分布图
讨 论
高磷血症可增加CKD患者心血管事件的风险已得到广泛研究[10]。但在eGFR≥60 ml/(min·1.73m2)的CKD早期患者中高磷血症的发生率,及其同肾脏损伤程度和肾脏预后的关系尚未得到足够重视。本研究发现,在eGFR>90 ml/(min·1.73m2)和eGFR 60~90 ml/(min·1.73m2)的2型DN患者中,高磷血症(血磷>1.45 mmol/L)发生率分别为11.7%和16.7%,均高于之前在CKD人群中的报道[11-12]。同时,本文提示年轻、女性、蛋白尿量大、胆固醇水平高的患者倾向于血磷水平较高。与已有研究报道的CKD人群中血磷水平与年龄呈负相关,并且女性患者高于男性的结论一致[13]。de Seigneux等[14]证实蛋白尿可通过增加近端小管NaPi-2a的表达增加血磷浓度。高胆固醇可导致动脉粥样硬化,而高磷血症也可促进动脉粥样硬化的发生,增加心血管事件的风险,两者之间可能存在相关性。提示在临床工作中需密切监测大量蛋白尿、高胆固醇的年轻女性患者的血磷水平。
DN患者在肾功能正常时发生高磷血症的机制仍不清楚。肾脏是重要的血磷调节器官。表达于近端小管的NaPi-2a 和 NaPi-2c型钠磷协同转运蛋白,具有重吸收磷的作用,肾小球滤过的磷80%~90%将被重吸收。FGF-23和膜结合型Klotho对NaPi-2a 和 NaPi-2c具有调节作用[15]。DN早期阶段可出现高滤过状态,导致肾小球滤过的磷增加。因此我们推测DN早期高磷血症的发生可能与肾小管对磷的重吸收增加有关。在肾脏疾病发生早期,即可出现肾内Klotho表达下降。体内研究表明,在eGFR≥60 ml/(min·1.73m2) 的CKD人群中,与IgA肾病和微小病变肾病的患者相比,DN患者肾脏Klotho的表达下降更加明显[16],提示DN患者早期即有可能出现FGF-23抵抗。本研究发现,eGFR≥60 ml/(min·1.73m2)的DN患者,血磷水平与基线eGFR无关而与蛋白尿水平相关。临床研究表明,蛋白尿可独立于eGFR和其他混杂因素,与血磷浓度相关。动物实验也证实,当出现蛋白尿时,肾脏中Klotho表达下降,而NaPi转运体表达上升,导致肾脏对磷的重吸收增加,引起磷在体内滞留[14]。上述因素均可能是DN早期即出现明显高磷血症的原因,但其具体机制仍需进一步研究证实。
DN患者肾小球对磷的滤过和肾小管对磷的重吸收增加,均可导致肾脏内磷的蓄积。高磷可产生细胞毒性,导致间质纤维化、小管萎缩和间质炎症[8]。因此高磷血症可能和DN患者肾脏损伤程度存在相关性。本研究发现,血磷水平与尿液中NAG、RBP和NGAL等肾小管间质性损伤标志物的表达正相关,并且肾脏组织病理评分显示,高血磷组患者IFTA和间质炎症的程度更加严重。这均证实了磷负荷增加所带来的肾脏毒性。
肾小管间质损伤与DN患者肾脏预后不良显著相关[7]。肾小管间质性损伤可导致管球反馈失衡,进一步加重肾小球的滤过压[17];肾小管上皮细胞受损可导致溶酶体吞噬降解白蛋白的功能障碍,增加尿白蛋白的排泄[18]。肾小管间质损伤可使肾脏维持磷平衡受损,出现高磷血症,导致肾单位的丢失。此外,肾小管间质磷负荷增加可诱导肾脏局部的炎症反应、营养不良和血管钙化[19],这些因素均可参与疾病的进展和ESRD的发生。在本研究中,DN患者血磷升高可增加ESRD的风险。在eGFR ≥60 ml/(min·1.73m2)的DN患者中,高磷血症(>1.45 mmol/L)预示着不良的肾脏远期预后,提示磷负荷增加可进一步损伤肾脏。
综上所述,在DN早期[eGFR≥60 ml/(min·1.73m2)]即有较高的高磷血症发生率,高磷血症同患者肾小管间质性损伤显著相关,并且是ESRD发生的独立风险因素。
1 Schwarz S,Trivedi BK,Kalantar-Zadeh K,et al.Association of disorders in mineral metabolism with progression of chronic kidney disease.Clin J Am Soc Nephrol,2006,1(4):825-831.
2 Adeney KL,Siscovick DS,Ix JH,et al.Association of serum phosphate with vascular and valvular calcification in moderate CKD.J Am Soc Nephrol,2009,20(2):381-387.
3 Bellasi A,Mandreoli M,Baldrati L,et al.Chronic kidney disease progression and outcome according to serum phosphorus in mild-to-moderate kidney dysfunction.Clin J Am Soc Nephrol,2011,6(4):883-891.
4 Tangri N,Stevens LA,Griffith J,et al.A predictive model for progression of chronic kidney disease to kidney failure.JAMA,2011,305(15):1553-1559.
5 Jüppner H.Phosphate and FGF-23.Kidney Int Suppl,2011 (121):S24-27.
6 Ekinci EI,Jerums G,Skene A,et al.Renal structure in normoalbuminuric and albuminuric patients with type 2 diabetes and impaired renal function.Diabetes Care,2013,36(11):3620-3626.
7 An Y,Xu F,Le W,et al.Renal histologic changes and the outcome in patients with diabetic nephropathy.Nephrol Dial Transplant,2015,30(2):257-266.
8 Haut LL,Alfrey AC,Guggenheim S,et al.Renal toxicity of phosphate in rats.Kidney Int,1980,17(6):722-731.
9 Tervaert TW,Mooyaart AL,Amann K,et al.Pathologic classification of diabetic nephropathy.J Am Soc Nephrol,2010,21(4):556-563.
10 Hruska KA,Mathew S,Lund R,et al.Hyperphosphatemia of chronic kidney disease.Kidney Int,2008,74(2):148-157.
11 Drion I,Joosten H,Dikkeschei LD,et al.eGFR and creatinine clearance in relation to metabolic changes in an unselected patient population.Eur J Intern Med,2009,20(7):722-727.
12 Inker LA,Coresh J,Levey AS,et al.Estimated GFR,albuminuria,and complications of chronic kidney disease.J Am Soc Nephrol,2011,22(12):2322-2331.
13 Ferraro PM,Bonello M,Gambaro A,et al.Age- and sex-tailored serum phosphate thresholds do not improve cardiovascular risk estimation in CKD.J Nephrol,2011,24(4):446-452.
14 de Seigneux S,Courbebaisse M,Rutkowski JM,et al.Proteinuria Increases Plasma Phosphate by Altering Its Tubular Handling.J Am Soc Nephrol,2015,26(7):1608-1618.
15 Schiavi SC,Kumar R.The phosphatonin pathway:new insights in phosphate homeostasis.Kidney Int,2004,65(1):1-14.
16 Asai O,Nakatani K,Tanaka T,et al.Decreased renal α-Klotho expression in early diabetic nephropathy in humans and mice and its possible role in urinary calcium excretion.Kidney Int,2012,81(6):539-547.
17 Thomson SC,Vallon V,Blantz RC.Kidney function in early diabetes:the tubular hypothesis of glomerular filtration.Am J Physiol Renal Physiol.2004 Jan;286(1):F8-15.
18 Osicka TM,Kiriazis Z,Pratt LM,et al.Ramipril and aminoguanidine restore renal lysosomal processing in streptozotocin diabetic rats.Diabetologia,2001,44(2):230-236.
19 Yamada S,Tokumoto M,Tatsumoto N,et al.Phosphate overload directly induces systemic inflammation and malnutrition as well as vascular calcification in uremia.Am J Physiol Renal Physiol,2014,306(12):F1418-F1428.
(本文编辑 凡 心 莫 非)
Hyperphosphatemia:a marker of kidney injury and outcome in patients with diabetic nephropathy
QIUDandan,JIANGSong,PANYu,ANYu,XUFeng,GEYongchun,LIUZhihong
NationalClinicalResearchCenterofKidneyDiseases,ResearchInstituteofNephrology,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China
LiuZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:To investigate the association between hyperphosphatemia and renal injuries and long-term outcome in patients with type 2 diabetes and diabetic nephropathy (DN). Methodology:From January 2004 to July 2015 in National Clinical Research Center of Kidney Diseases, Jinling Hospital, a total of five hundred ninety seven patients with type 2 diabetes and DN were enrolled in this retrospective study. The median follow-up period was 36 months. The prevalence of hyperphosphatemia and the association between hyperphosphatemia and renal injuries and the risk of renal outcome were analyzed. Results:The prevalence of hyperphosphatemia (serum phosphate >1.45 mmol/L) in the enrolled DN patients with eGFR>90, between 60 and 90, and <60 ml/(min·1.73 m2) were 25/214 (11.7%), 25/150 (16.7%), and 71/233 (30.5%), respectively. Hyperphosphatemia was associated with enhanced tubulointerstitial injury markers (P<0.01) as well as a high rate of tubulointerstitial injury (interstitial fibrosis tubular atrophy scores and interstitial inflammation scores,P<0.05). Additionally, the patients with baseline serum phosphate levels in higher quartiles had a higher cumulative incidence of end-stage renal disease (ESRD) (log-rank,P<0.01). Risk persisted after adjusting for age, sex, blood pressure, lipid level, body mass index, proteinuria, plasma calcium and eGFR (P<0.001). Conclusion:These findings suggested that hyperphosphatemia is an independent risk factor of ESRD and significantly associated with tubulointerstitial injury in patients with DN, especially in patients with eGFR ≥60 ml/(min·1·73 m2).
diabetic nephropathy hyperphosphatemia renal injury long-term outcome
10.3969/cndt.j.issn.1006-298X.2016.03.002
国家自然科学基金(81500548),国家科技支撑计划课题(2013BAI09B04,2015BAI12B05)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(邱丹丹) 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
刘志红(E-mail:liuzhihong@nju.edu.cn)
2016-03-01
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有

