胚胎发育相关基因-1对人肺癌细胞增殖及凋亡的影响
史红阳, 邓文静, 张玉萍, 张德信(西安交通大学第二附属医院呼吸内科,西安 710004; 通讯作者,E-mail:shihy2003@126.com)
胚胎发育相关基因-1对人肺癌细胞增殖及凋亡的影响
史红阳*, 邓文静, 张玉萍, 张德信(西安交通大学第二附属医院呼吸内科,西安710004;*通讯作者,E-mail:shihy2003@126.com)
摘要:目的探讨一种新近克隆的胚胎发育相关基因-1(embryonic development associated gene-1,EDAG-1)对人肺癌细胞增殖及凋亡的影响。方法构建真核表达载体pcDNA3.1(+)-EDAG-1,以脂质体法稳定转染入人肺癌细胞A549和H460,分别通过qRT-PCR和Western blot检测EDAG-1基因mRNA和蛋白的表达,同时检测细胞的增殖及凋亡。结果转染EDAG-1后,A549和H460细胞中EDAG-1的mRNA和蛋白表达水平均显著性升高(P<0.01)。与转染空载体的A549和H460对照组细胞相比,转染EDAG-1的A549和H460细胞增殖明显受到抑制,细胞凋亡率显著性升高(P<0.01)。结论EDAG-1可以抑制肺癌细胞增殖,促进其凋亡,其可能在肺癌的发生中起着重要作用。
关键词:胚胎发育相关基因;肺癌;基因表达;细胞增殖;细胞凋亡
恶性肿瘤中存在可自我更新及多向分化成各种癌细胞的初始未分化癌细胞[1]。有关研究证实多种调控基因,如c-myc,n-myc,c-myb,p53,c-fos,c-ski等,参与细胞增殖、分化与癌变过程。研究调控基因作用将有助于揭示细胞恶性变化的生物学机制。定位于9q22的胚胎发育相关基因-1(embryonic develop associated gene-1,EDAG-1),该基因mRNA稳定性差,半衰期短[2,3],其mRNA 3′端非翻译区序列含2个拷贝AUUUA结构,而该结构多出现于生长因子及原癌基因的3′端序列[4]。据此,EDAG-1可能具有重要的生物学意义。
大量研究报道表明,EDAG-1基因参与调控细胞增殖与分化过程,在某种程度上其高表达与维持细胞未分化状态有关[2],可能与基因表达发生改变或脱离正常调控途径有关。分子机制研究表明,EDAG通过某些途径激活c-myc、Bcl-2及Bcl-xl等凋亡相关蛋白的表达[2,5-8]。EDAG在多种白血病细胞系(如K562、KG-la、Jukret、Namalva细胞系)中表达水平均较高,而在HL-60、NB4和6J-1细胞系中则没有表达[9]。采用电转染法将过表达EDAG质粒高效转染至TF-1细胞株中,撤除细胞因子后其存活及抗凋亡能力均得以提高,即EDAG过表达能抑制由细胞因子撤除而诱导的细胞凋亡[10]。EDAG转染人白血病细胞系K562后能明显提高其增生能力,与细胞内自激因子作用机制相似[11]。而EDAG敲除小鼠对低剂量辐射诱导的损伤更加敏感[12]。急性白血病患者中EDAG高表达与治疗效果相关[13]。分析EDAG-1基因高表达的原因,可能是某些改变使其表达脱离正常调控途径[14]。
目前认为肺癌的发生与细胞增殖、分化及凋亡的失衡相关,是导致其无限制生长的重要原因。EDAG是一种造血组织特异表达,对造血细胞增殖、分化起重要调控作用的新基因[2,13],可能参与了造血发生多个过程的调控,但对其功能及作用机制尚缺乏深入的了解。既往研究发现,EDAG-1基因与细胞增殖与分化调控密切相关,且其可能参与细胞的凋亡过程[2,13,15]。EDAG-1在正常人肺组织中表达量极低或不表达[4],其在肺癌中的表达尚不明确。基于此,本文拟探讨EDAG-1基因与肺癌的关系。因此,通过体外构建EDAG-1真核表达载体并将其稳定转染入人肺癌细胞系内,观察重组pcDAN3.1(+)-EDAG-1真核表达载体对细胞增殖及凋亡的影响,探讨EDAG-1对于肺癌恶性生物学行为的影响。
1材料与方法
1.1菌株、质粒、细胞、试剂
EDAG-1基因片段(约1 500 bp)由上海Sangon公司合成。大肠杆菌JM109由本实验室保存;真核表达载体pcDNA3.1质粒购自于美国Invitrogen公司。人肺癌细胞株(A549,H460)系本实验室保存,37 ℃、5%CO2完全饱和湿度下培养于含10%胎牛血清的RPMI 1640中。Western blot试验试剂与Taqman MicroRNA反转录试剂盒购自于日本Takara公司。脂质体转染试剂LipofectamineTM2000与质粒DNA提取试剂盒购自美国Promega公司。
1.2pcDNA3.1(+)-EDAG-1表达载体的构建
将EDAG-1基因片段连接至真核表达载体pcDNA3.1(+),转入大肠杆菌JM109中,使用100 mg/L氨苄青霉素筛选出两种以上阳性克隆,选取几个克隆经PCR和EcoRⅠ+XhoⅠ双酶切检测阳性菌落,并小量制备质粒,进行DNA测序。
1.3pcDNA3.1(+)-EDAG-1表达载体的转染及鉴定
常规培养A549和H460肺癌细胞系,取对数生长期细胞重悬,以1.0×106-2.5×106个分别接种至60 mm 96孔板中。待70%-80%细胞融合后,使用阳离子脂质体LipofectamineTM2000介导载体(8 μg/孔)进行重组载体转染。6-8 h后换液,连续培养24 h,10倍稀释细胞后施加筛选压力,改用含G418培养基培养,每3 d换1次培养液,14 d后挑选并保存单克隆细胞。将转染成功的细胞悬浮培养于含10%胎牛血清的RPM1640培养液中。
1.4Western blot检测EDAG-1蛋白表达水平
取对数生长期转染细胞,调整细胞浓度为1×106个,预冷PBS冲洗2次后加入400 μl RIPA(临用前加入PMSF以抑制蛋白酶肽)于冰上裂解细胞30 min,4 ℃ 12 000×g离心30 min,移取上清液定量后进行SDS-PAGE电泳。目标条带电转至硝酸纤维素膜上,用含50 g/L脱脂奶粉的1×TBS-T 4 ℃封闭过夜,一抗(C末端单抗)按1∶2 000反应60 min,TBS-T冲洗4次;二抗按1∶2 000反应60 min,TBS-T冲洗4次后显影。
1.5Real-time PCR检测EDAG-1 mRNA表达
按照Trizol使用说明书提取A549和H460细胞系的总RNA,使用紫外分光光度计测定其浓度。然后按照Taqman MicroRNA反转录试剂盒使用说明反转录合成cDNA,将cDNA加入到Taqman MicroRNA real-time PCR试剂盒中,在RT-PCR仪上进行定量。采用2-ΔΔCt方法分析EDAG-1在不同细胞中的相对表达水平。
1.6MTT检测细胞增殖
取转染组(转染EDAG-1的肺癌细胞系)及对照组(转染空载体的肺癌细胞系)细胞,以2×103个/孔接种于96孔板后加入无血清培养液,置于37 ℃,5% CO2的恒温培养箱中培养4 d。每天检测细胞含量。待稳定后,每孔先加入10 μl(5 g/L)的MTT溶液,37 ℃继续孵育4 h,然后换液,每孔加入150 μl二甲亚砜,放入摇床中轻微振荡直至MTT完全溶解并转化生成紫色甲臜。用酶标仪检测各孔在490 nm处的吸光度。
1.7细胞凋亡的检测
取转染组及对照组细胞用于实验。严格按照Annexin-V-FITC/PI细胞凋亡检测试剂盒说明书进行操作,将细胞(2×105个)加入到100 μl 1×Binding缓冲液重悬,添加2.5 μl Annexin Ⅴ-FITC和5 μl PI染料,振荡混匀,暗处放置10 min,然后用流式细胞仪进行检测,计算凋亡细胞数量。应用Western blot检测凋亡蛋白caspase-3和Bcl-2的表达情况,实验方法同1.4。
1.8统计学分析
采用SPSS19.0对数据进行统计学分析,组间比较采用配对样品t检验,P<0.05为差异有统计学意义。
2结果
2.1pcDNA3.1(+)-EDAG-1载体的转染与鉴定
将构建载体分别进行PCR和酶切验证,结果显示,产物大小与合成EDAG-1片段一致(见图1)。上述结果表明,EDAG-1真核载体已成功构建。

M.Marker;1.pcDNA3.1(+)-EDAG-1载体PCR产物,大小约为1 492 bp;2.EcoRⅠ和XhoⅠ双酶切空载体pcDNA3.1;3.9EcoRⅠ和XhoⅠ双酶切重组质粒pcDNA3.1(+)-EDAG -EDAG-1图1 pcDNA3.1(+)-EDAG-1 PCR与酶切结果Figure 1 PCR and enzyme digestion results of pcDNA3.1(+)-EDAG-1
2.2EDAG-1的mRNA表达
将转染组用Real-time PCR检测其mRNA表达情况。结果表明,A549转染组细胞中EDAG-1的mRNA表达水平较A549对照组明显增高;H460转染组的EDAG-1的mRNA表达水平较H460对照组亦明显提高,差异具有统计学意义(P<0.01,见图2)。
2.3EDAG-1的蛋白表达
与EDAG-1mRNA表达结果相一致,A549转染组及H460转染组细胞中的EDAG-1蛋白表达水平分别较其对照组有明显升高(β-actin为内参,见图3)。

1.A549对照组;2.A549转染组;3.H460对照组;4.H460转染组与其相应对照组比较,**P<0.01图2 qRT-PCR检测EDAG-1的mRNA表达Figure 2 Expression of EDAG-1 mRNA after transfection by qRT-PCR
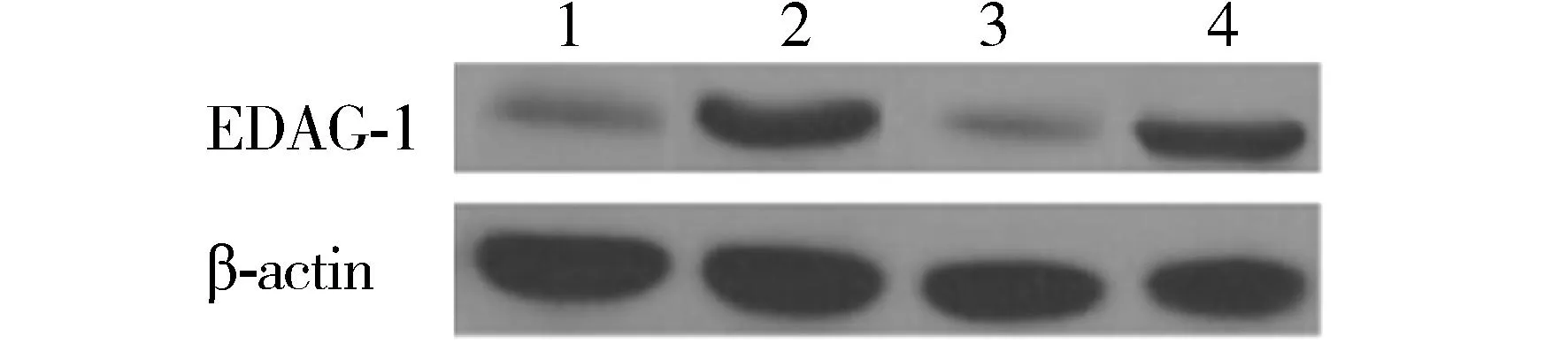
1.A549对照组;2.A549转染组;3.H460对照组;4.H460转染组图3 Western blot检测EDAG-1的蛋白表达Figure 3 Protein expression of EDAG-1 after transfection by Western blot
2.4过表达EDAG-1对肺癌细胞增殖的影响
将A549及H460转染组与A549及H460对照组细胞在相同条件下培养96 h,采用MTT法测定生长曲线(λ=490 nm)。实验结果表明,72 h和96 h时转染组较对照组的细胞增殖速度明显减慢,具有显著性差异(P<0.01,见图4),即转染EDAG-1可以抑制肺癌细胞的增殖。

A.A549细胞 B.H460细胞 与其相应对照组比较,**P<0.01图4 EDAG-1对肺癌细胞增殖的影响Figure 4 Effects of EDAG-1 on proliferation of lung cancer cell line
2.5过表达EDAG-1对肺癌细胞凋亡的影响
流式细胞仪检测结果表明,A549及H460转染组肺癌细胞的凋亡率明显高于其相应对照组(P<0.01,见图5)。与其相应对照组比较,转染组的caspase-3表达量较高,而Bcl-2的表达量较低(β-actin为内参,见图6),这与流式细胞仪检测结果相一致,表明高表达EDAG-1促进肺癌细胞的凋亡。
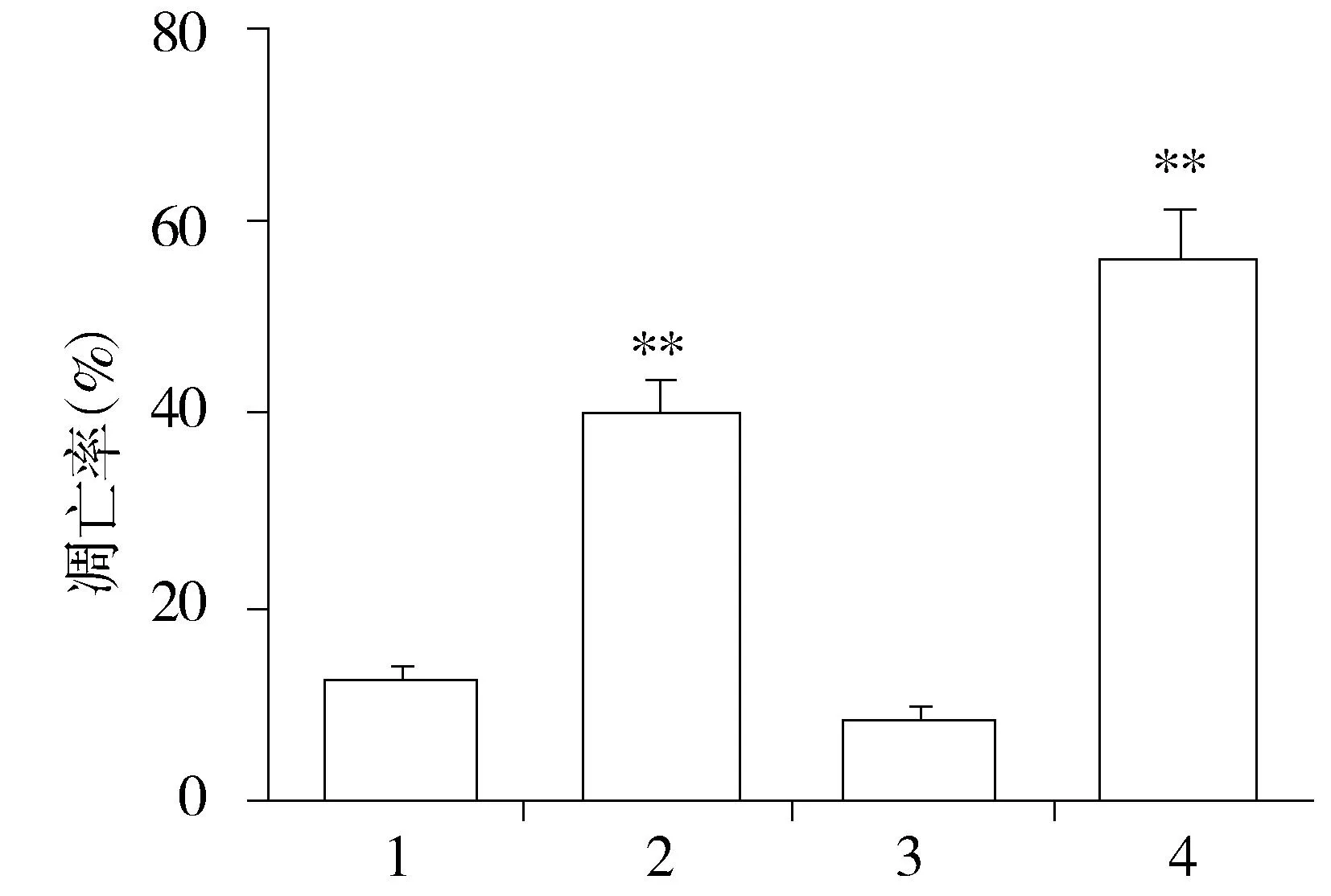
1.A549对照组; 2.A549转染组; 3.H460对照组; 4.H460转染组与其相应对照组比较,**P<0.01图5 EDAG-1对肺癌细胞凋亡的影响Figure 5 Effect of EDAG-1 on the apoptosis of lung cancer cell line
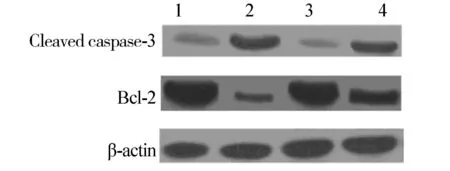
1.A549对照组;2.A549转染组;3.H460对照组;4.H460转染组图6 EDAG-1对肺癌细胞相关凋亡蛋白的影响Figure 6 Effect of EDAG-1 on the apoptosis-related protein expression of lung cancer cells
3讨论
EDAG-1是一种与细胞增殖、分化调控相关的新型基因。相关研究证实,该基因主要分布在人胚胎肝及骨髓等造血组织,常高表达于多种白血病细胞株及白血病患者外周血中。进而研究人员推测EDAG-1基因与细胞,特别是血液细胞,增殖、分化调控等密切相关,且该基因高表达可能与细胞维持未分化或低分化状态相关[16]。其基因产物是核蛋白,可能与其他核内因子作用后间接发挥作用[3]。Yang等[3]在解析EDAG表达蛋白的氨基酸序列时发现,EDAG基因内部存在核定位信号与环绕结构域,指示与其他蛋白聚合的可能性,但具体功能与相关蛋白仍未获知。肺癌是我国发病率较高的癌症之一。EDAG-1在正常人肺组织中表达量极低或不表达[4]。但其在肺癌中的表达尚不明确。本研究将体外合成的EDAG-1基因亚克隆至真核表达载体pcDNA3.1(+)上,并通过脂质体介导成功转染至人肺癌细胞株中。研究表明,转染后A549细胞和H460细胞均过表达EDAG-1;同时过表达EDAG-1可抑制肺癌细胞的增殖并促进其凋亡。
经证实,Bcl-2蛋白是细胞凋亡抑制成分。作为Bcl-2家族中的主要成员,Bcl-2在凋亡信号传导过程中,常作为caspase的上游调控机制[17]。多数情况下,过量表达的Bcl-2能有效抑制住各种因素所诱发的caspase激活和凋亡。Zhan等[18]报道了Bcl-2可阻止具肾毒性的顺铂诱导的肾上皮细胞caspase-3的激活与凋亡。而Bcl-2转基因后的高表达抑制了caspase-3和caspase-6的激活和其他凋亡事件[19]。本研究发现,EDAG-1转染组的肺癌细胞凋亡率明显高于对照组(转染空载体),且转染组的caspase-3表达量较高,Bcl-2表达量较低,表明高表达EDAG-1可能通过Bcl-2家族及caspase-3家族促进肺癌细胞的凋亡,但其具体机制仍需进一步实验证明。
参考文献:
[1]董强刚,姚明,耿沁,等.人肺腺癌干细胞的分离及鉴定[J].肿瘤,2008,28(1):1-7.
[2]闾军,许望翔,汪思应,等.EDAG-1,一种与造血调控密切相关新基因的分离和确认[J].生物化学与生物物理学报,2001,33(6):641-646.
[3]Yang LV,Nicholson RH,Kaplan J,etal.Hemogen is a novel nuclear factor specifically expressed in mouse hematopoietic development and its human homologue EDAG maps to chromosome 9q22,a region containing breakpoints of hematological neoplasms[J].Mech Dev,2001,104(1-2):105-111.
[4]Li B,Quyang B,Pan H,etal.Prk a cytokine-inducible human protein serine/threonine kinase whose expression appears to be down-regulated in lung carcinomas[J].J Biol Chem,1996(271):19402-19408.
[5]Prochownik EV,Kukowska J.Deregulated expression of c-myc bymurine erythroleukaemia cells prevents differentiation[J].Nature,1986,322(6082):848-850.
[6]Eva A,Aaronson SA.Isolation of a new human oncogene from a diffuse B-cell lymphoma[J].Nature,1985,316(6025):273-275.
[7]闾军,许望翔,汪思应,等.在NIH3T3细胞中高表达EDAG-1基因导致细胞恶性转化[J].生物化学与生物物理学报,2002,34(1):95-98.
[8]Li CY,Zhan YQ,Xu CW,etal.EDAG regulates the proliferation and differentiation of hematopoietic cells and resists cell apoptosis through the activation of nuclear factor-kappa B[J].Cell Death Differ,2004,11(12):1299-1308.
[9]石洋.胚胎发育相关基因-EDAG的诱导表达及蛋白纯化[D].北京:中国协和医科大学,2006.
[10]郑巍薇,张美江,尹荣华,等.人红系分化相关基因高表达提高TF-1细胞系存活能力[J].生物技术通讯,2013,24(4):462-466.
[11]安莉莉,吴克复,马小彤,等.EDAG在白血病细胞系K562中的细胞内自激因子作用[J].白血病·淋巴瘤,2005,14(4):197-200.
[12]潘婷婷,尹荣华,董小明,等.红细胞分化相关基因敲除小鼠对低剂量辐射损伤敏感性的研究[J].军事医学,2015,39(6):423-426.
[13]An LL,Li G,Wu KF,etal.High expression of EDAG and its significance in AML[J].Leukemia,2005,19(8):1499-1502.
[14]程勇,周颖,张红雁,等.RACE策略扩增EDAG-1基因3′端及序列分析[J].临床输血与检验,2007,9(4):289-292.
[15]Li CY,Zhan YQ,Xu CW,etal.EDAG regulates the proliferation and differentiation of hematopoietic cells and resists cell apoptosis through the activation of nuclear factor-kappa B[J].Cell Death Differ,2004,11(12)1299-1308.
[16]Zheng WW,Dong XM,Yin RH,etal.EDAG positively regulates erythroid differentiation and modifies GATA1 acetylation through recruiting p300[J].Stem Cells,2014,32(8):2278-2289.
[17]Swanton E,Savory P,Cosulich S,etal.Bcl-2 regulates a Caspase-3/Caspase-2 apoptotic cascade in cytosolic ex-tracts[J].Oncogene,1999,18(10):1781.
[18]Zhan Y,van de Water B,Wang Y,etal.The roles of caspase-3 and bcl-2 in chemically-induced apoptosis but not necrosis of renal epithelial cells[J].Oncogene,1999,18(47):6505.
[19]Granville DJ,Jiang H,An MT,etal.Bcl-2 overexpression blocks Caspase activation and downstream apoptotic events instigated by photodynamic therapy[J].Br J Cancer,1999,79(1):95-100.
Effects of embryonic development associated gene-1 on the proliferation and apoptosis of human lung cancer cell lines
SHI Hongyang*, DENG Wenjing, ZHANG Yuping, ZHANG Dexin
(DepartmentofRespiratoryMedicine,SecondAffiliatedHospitalofMedicalCollege,Xi’anJiaotongUniversity,Xi’an710004,China;*Correspondingauthor,E-mail:shihy2003@126.com)
Abstract:ObjectiveTo explore the effects of newly-cloned embryonic development associated gene-1(EDAG-1) on proliferation and apoptosis of human lung cancer cells. MethodsThe eukaryotic expression vector, pcDNA3.1(+)-EDAG-1, was successfully constructed and stably transfected into the A549 and H460 cells by liposome method. Then the EDAG-1 mRNA and protein expression levels were determined by qRT-PCR and Western blot, respectively. At the same time, the proliferation and apoptosis of cells were detected.ResultsAfter transfection, the mRNA and protein expression levels of EDAG-1 in A549 and H460 cells were significantly increased(P<0.01). Compared with A549 and H460 cells transfected with empty vectors, the proliferation of A549 and H460 cells transfected with EDAG-1 was significantly inhibited, and the apoptosis rate was significantly increased(P<0.01). ConclusionEDAG-1 can inhibit the proliferation of lung cancer cells and promote its apoptosis, which may play an important role in the occurrence of lung cancer.Key words:EDAG-1;lung cancer;gene expression;proliferation;apoptosis
[收稿日期:2015-11-13]
作者简介:史红阳,女,1976-07生,博士,主治医师,E-mail:shihy2003@126.com.
中图分类号:R734.2
文献标志码:A
文章编号:1007-6611(2016)01-0026-05
DOI:10.13753/j.issn.1007-6611.2016.01.007
基金项目:中央高校基本科研业务费专项基金资助项目(XJJ2012057);西安交通大学医学院第二附属医院科研基金资助项目(Yj(QN)201101)

