恐惧声音心理应激孕鼠的子代空间学习记忆能力研究
倪 磊, 王爱英, 罗 迈, 白济瑜, 刘利英(西安交通大学医学部细胞生物学与遗传学系,西安 7006;西安交通大学医学部;西安交通大学医学部生物医学研究实验中心,环境与疾病相关基因教育部重点实验室;通讯作者,E-mail:llying@mail.xjtu.edu.cn)
恐惧声音心理应激孕鼠的子代空间学习记忆能力研究
倪磊1, 王爱英1, 罗迈1, 白济瑜2, 刘利英3*(1西安交通大学医学部细胞生物学与遗传学系,西安710061;2西安交通大学医学部;3西安交通大学医学部生物医学研究实验中心,环境与疾病相关基因教育部重点实验室;*通讯作者,E-mail:llying@mail.xjtu.edu.cn)
摘要:目的探讨恐惧声音心理应激模型孕鼠子代青春期记忆与学习能力。方法实验采用昆明雌鼠,受孕后将其随机分成应激组和对照组。应激组以小鼠恐惧声音为应激源,每日上、下午各播放2 h,持续2周,对照组为正常饲养小鼠。统计两组的子代出生率,并正常环境下饲养至35-40 d。应用Morris水迷宫测试小鼠学习与记忆成绩。结果应激组子代出生率低于对照组,对照组为11±1.85只/窝,而应激组下降到7±1.58只/窝(P<0.05)。Morris水迷宫实验表明,应激组子代逃逸潜伏期比对照组子代明显增长,尤其在第1,4,5天,两组间的差异具有显著性(P<0.05)。雌雄鼠分别统计,发现雌性子代小鼠的逃离潜伏期与对照组相比无明显升高,而雄性子代小鼠的逃离潜伏期与对照组相比明显升高(P<0.05)。在空间探索能力检测中发现,应激组子代小鼠的空间探索次数低于对照组(2.58±1.76 vs 3.35±1.89,P<0.05);将雌鼠与雄鼠分别分析,发现应激组子代雄鼠的空间探索次数为(1.59±1.37)次,对照组子代雄鼠为(3.08±2.03)次,两组之间有统计学意义(P<0.05);而子代雌性小鼠的空间探索次数与对照组相比无明显差异。结论恐惧声音心理应激可损伤应激孕鼠雄性子代的学习和记忆能力。
关键词:恐惧声音;小鼠;学习与记忆能力;Morris水迷宫
精神压力不仅可以引起抑郁症、心血管疾病、肿瘤等重大疾病的发生,而且可以应激子代神经系统的发育,影响子代成年后的学习与记忆。目前,应用于精神压力的模型包括力竭游泳、束缚、热以及电击等,均可引起躯体应激和心理应激,因此难以评估单纯心理应激的效应[1-3]。本研究组前期建立了不引起躯体应激的心理应激模型—恐惧声音心理应激模型。该模型可以引起多种应激激素以及应激相关的神经递质的改变,同时也可导致小鼠免疫功能下降,进而促进荷瘤小鼠的肿瘤的生长[4-8]。但是,单纯心理应激是否可以引起孕鼠子代的学习记忆的损伤,尚无相关报道。本研究应用恐惧声音心理应激模型应激孕鼠,并检测其后代青春期的学习与记忆,探讨心理应激对子鼠学习与记忆能力的影响。
1材料与方法
1.1实验动物
昆明清洁级小白鼠雄鼠20只以及动情期雌鼠60只,每只雄鼠与三只雌鼠合笼。每天8∶00查看小鼠阴栓。选择阴栓雌鼠30只,随机分为两组:对照组与应激组各15只。
1.2实验仪器
漫步者声迈X100V 音箱(北京爱德发高科技集团);Morris水迷宫(北京硕林苑科技有限公司);ND6脉冲精密声级计(中国江西国营红声器材厂);398B型VCD;Morris 动物行为实验软件。
1.3动物模型的制备
空白对照组在正常饲养环境中饲养。恐惧声音心理应激组模型的制备参照本小组此前造模方法[9],即每天上午和下午进行心理应激,强度为65-85 dB,应激后置于正常饲养环境,持续14 d。各组小鼠自由进食进水,直至生育。子鼠出生后,统计每组子鼠数目,计算每只孕鼠子鼠生殖个数,并置于正常饲养环境中饲养至40 d。空白对照组和恐惧声音心理应激组子鼠各16只,其中雄鼠与雌鼠各8只。
1.4Morris水迷宫实验
定位航行实验:用于测量小鼠在水迷宫中的学习和记忆能力。实验时间持续5 d,实验前一天让小鼠自由游泳2 min以习惯实验环境。正式实验分上、下午两个实验阶段,上、下午各4次,每次120 s,顺时针从水池东、南、西、北4个入水点将小鼠面向池壁放入水中,观察并记录小鼠找到并爬上平台所需的时间(逃避潜伏期)。如果小鼠120 s内找不到平台,则将其引上平台,并且逃离潜伏期记为120 s。小鼠在平台上至少停留15 s。
空间探索实验:于第6天进行测试。撤去平台,任选一个入水点将小鼠面向池壁放入水中,记录小鼠在120 s内经过平台所在位置的次数,检测试验小鼠的记忆保持能力。
1.5统计学分析
2结果
2.1恐惧声音心理应激对孕鼠子鼠出生率的影响
恐惧声音具有显著的应激效应。小鼠在恐惧声音播放期间,大小便次数显著增加,而摄食和饮水量下降。对照组孕鼠子鼠的出生率为11±1.85只/窝,恐惧声音应激组为7±1.58只/窝,两组差异有统计学意义(P<0.05)。
2.2恐惧声音对应激孕鼠的子鼠定位航行影响
经过5 d的定位航行实验,对照组和应激组小鼠的逃离潜伏期均迅速下降。从定位航行第一天开始,每天的小鼠逃离潜伏期均较前一天有明显下降。但是,应激孕鼠的子代较对照组的逃离潜伏期有所升高,在第1天、第4天和第5天,两组间的差异具有显著性(P=0.047,见图1)。将应激孕鼠子代的雌雄分别分析,结果表明应激孕鼠的雌性子代与对照组的逃离潜伏期差异无显著性(P=0.376,见图2),而应激孕鼠的雄性子代逃离潜伏期较对照组明显上升(P=0.008,见图3)。

与对照组比较,*P<0.05图1 恐惧声音心理应激对孕鼠子鼠逃离潜伏期的影响Figure 1 The effect of scream sound stress on the escape latency in offsprings of pregnant mice
2.3恐惧声音对应激孕鼠的子鼠空间探索能力的影响
恐惧声音心理应激对应激孕鼠的子鼠空间探索能力具有明显的抑制作用(P=0.049,见表1)。将应激孕鼠子代的雌雄分别分析,结果显示应激孕鼠的雌性子代与对照组的空间探索能力差异无显著性(P=0.435,见表1),而应激孕鼠的雄性子代空间探索能力较对照组明显下降(P=0.014,见表1)。
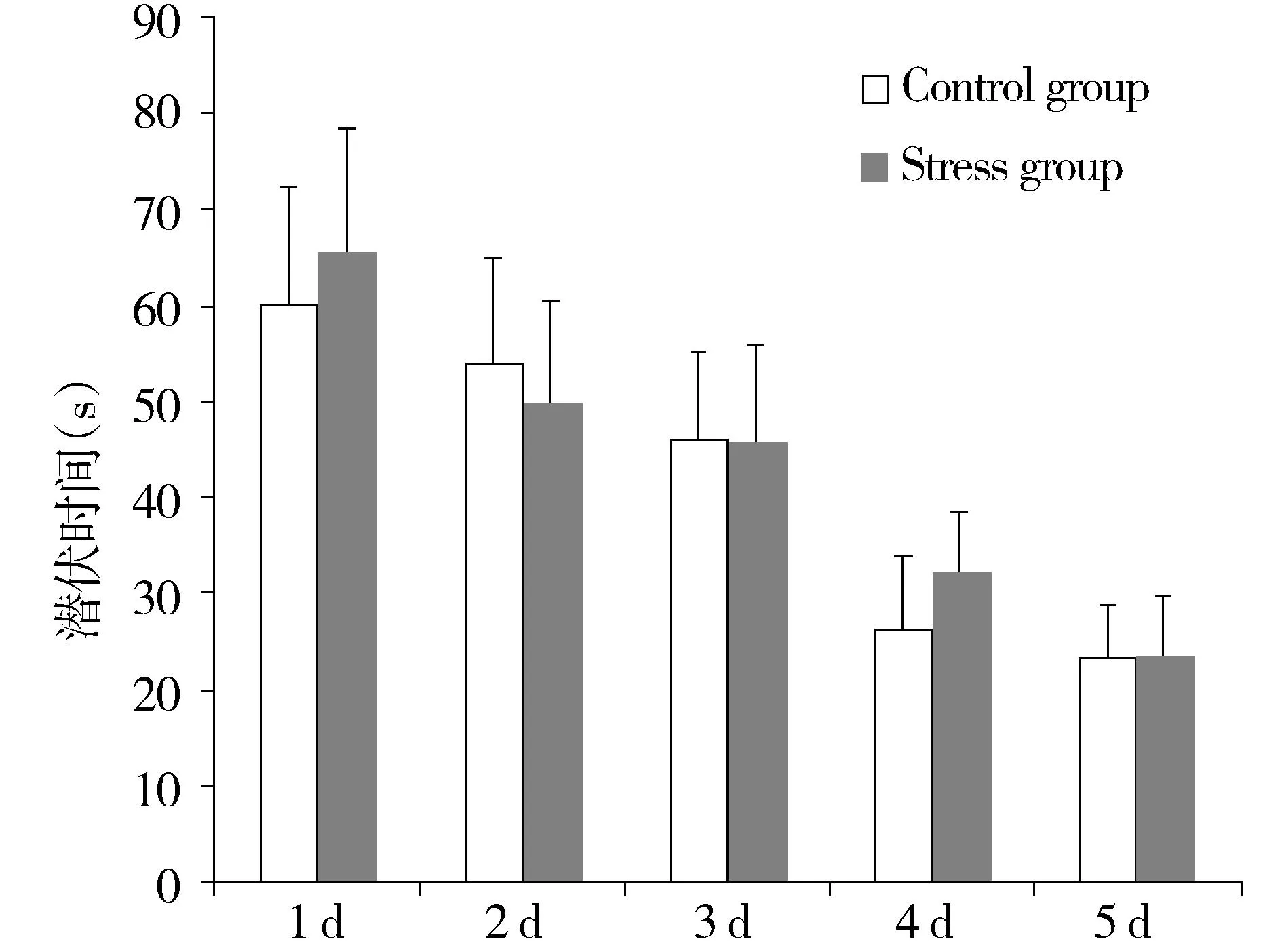
图2 恐惧声音心理应激对孕鼠雌性子鼠逃离潜伏期的影响Figure 2 The effect of scream sound stress on the escape latency in female offspring of pregnant mice
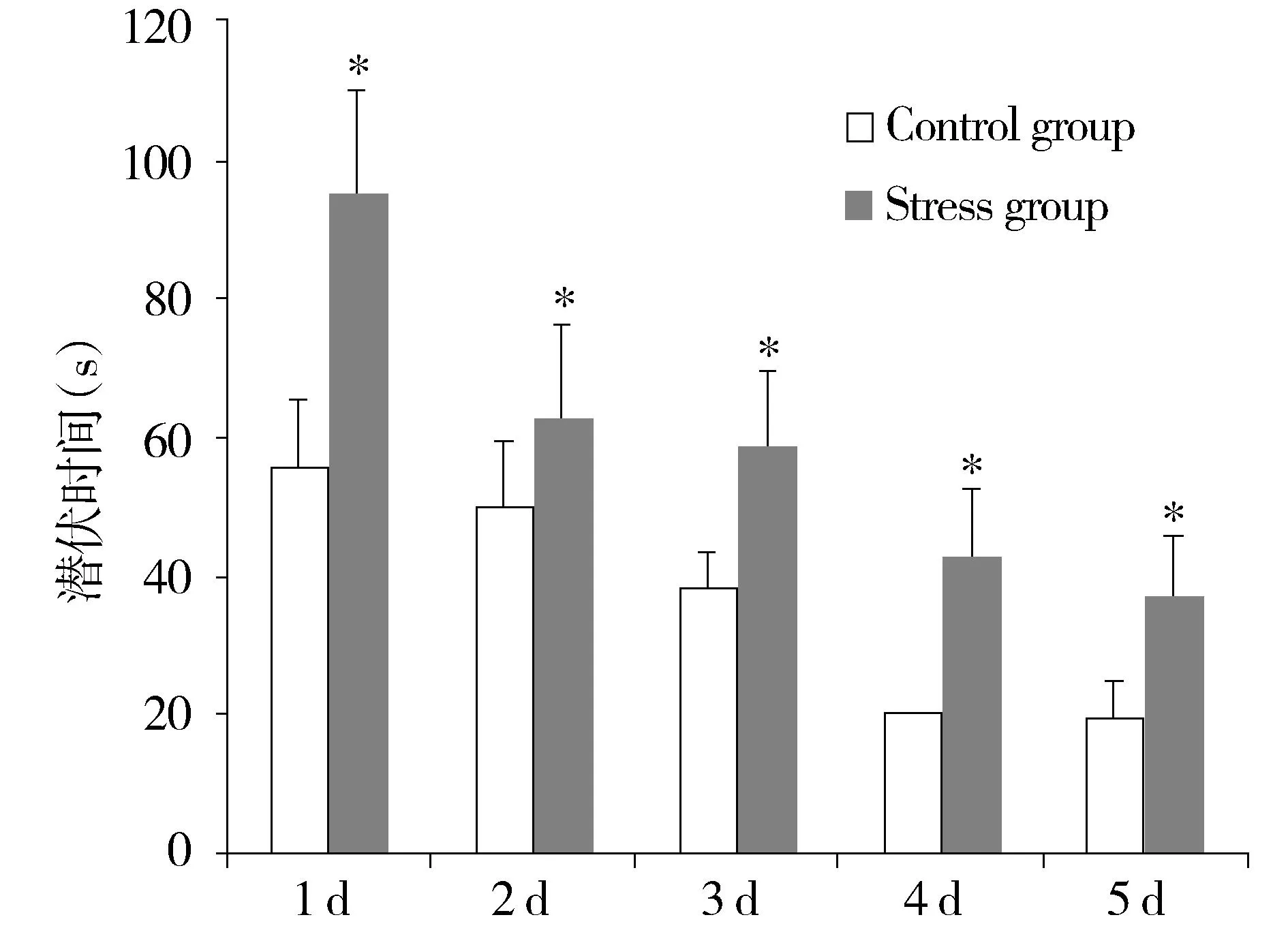
与对照组比较,*P<0.05图3 恐惧声音心理应激对孕鼠雄性子鼠逃离潜伏期的影响Figure 3 The effect of scream sound stress on the escape latency in male offspring of pregnant mice


组别子鼠(n=16)雌性子鼠(n=8)雄性子鼠(n=8)对照组3.35±1.893.63±2.243.08±2.03应激组2.58±1.76*3.61±2.091.59±1.37*
与对照组相比,*P<0.05
3讨论
近年来的研究表明,生命早期母体营养不良、或暴露于不良环境,如化学物质、电磁辐射等,或精神压力过大,都会造成子代成年期疾病的发生,如心血管疾病、2型糖尿病、免疫功能异常或肿瘤等疾病的发生。并明确这些疾病发生的关键时期是在胚胎期、胎儿期与婴儿期,即“胎源学说”,并引出了人类“健康与疾病发育起源(development origins of health and disease)”的新学说[10]。在以上诸多的母体暴露或应激因素中,心理应激逐渐成为影响人类生存质量的重要原因之一。已有大量的研究工作表明,孕期复合应激可以引起小鼠子代的淋巴细胞数和粒细胞数以及血浆皮质醇降低[11];引起子代海马结构异常,导致记忆和空间辨别能力下降。人类的流行病调查研究显示,孕期应激可以提高母亲皮质醇水平,并通过胎盘传递给胎儿,导致新生儿脐血中皮质醇含量升高,使胎儿处于应激状态[12],导致子代行动紊乱,注意力缺陷,尤其与男孩多动症独立相关[13]。但是以上研究存在的问题是不能区分躯体应激与心理应激的影响。
本研究首次应用恐惧声音应激模型研究了孕鼠应激后子代的学习记忆行为。该模型具有以下优点:避免了躯体应激,设备要求简单,操作简便易行。研究结果表明,恐惧声音应激孕鼠的子代出生数目明显下降。Wainstock等[14]比较研究了对火箭袭击有预期城市的1 345名孕妇与无预期城市的2 143名孕妇的历史资料,其结论与本研究一致,孕期应激与自发流产的发生风险相关。
Morris水迷宫是一种能够准确反映动物的空间学习记忆能力的研究手段。Morris水迷宫研究结果显示,应激孕鼠子代的逃离潜伏期与对照组相比增长,并且空间探索穿越平台的次数下降,说明孕期应激对子代的学习记忆过程存在损伤效应。Barzegar等[15]以噪声为应激手段应激受孕大鼠,证明应激孕鼠子代LTP水平较低,皮质酮水平较高,水迷宫结果与本研究结果一致。将子鼠按照性别分别分析,结果显示雌性子鼠与对照组学习记忆无显著性差异,而雄性子鼠学习记忆损伤严重。目前,产前孕妇应激对不同性别子代的生物学效应结论不尽相同。Walder等[16]研究了产前孕妇应激与子代自闭症的关系,自闭症筛查问卷(ASSQ)结果显示,6.5岁孩子中男孩的ASSQ评分高于女孩。Weston等[17]分别应用Pb暴露以及束缚应激处理雌鼠或孕鼠,研究了不同暴露对不同性别子代的神经损伤,结果表明雄鼠受到明显的影响,而雌鼠变化不明显。有关雌鼠对应激保护作用的机制研究鲜见报道,雌激素可能参与了保护作用。Komesaroff等[18]研究发现补充雌激素可以降低绝经期的妇女由于心理应激而引起的糖皮质激素和儿茶酚胺反应。综上说述,恐惧声音可损伤应激孕鼠雄性子代的学习和记忆能力。
参考文献:
[1]邹涛,程明,朱熊兆,等.急性心理应激对小鼠记忆的影响[J].中国行为医学科学,2005,14(1):23-25.
[2]朱熊兆,亓晓丽,姚树桥,等.心理应激与热应激对小鼠情绪及其学习能力的影响[J].中国行为医学科学,2004,13(4):364-366.
[3]刘能保,李辉,刘向前,等.慢性复合应激增强大鼠空间学习和记忆能力[J].生理学报,2004,56(5):615-619.
[4]Hu L,Zhao X,Yang J,etal.Chronic scream sound exposure alters memory and monoamine levels in female rat brain[J].Physiol Behav,2014,137:53-59.
[5]Yang J,Hu L,Wu Q,etal.A terrified-sound stress induced proteomic changes in adult male rat hippocampus[J].Physiol Behav,2014,128:32-38.
[6]Yang J,Hu L,Song T,etal.Proteomic changes in female rat hippocampus following exposure to a terrified sound stress[J].J Mol Neurosci,2014,53(2):158-165.
[7]Hou N,Zhang X,Zhao L,etal.A novel chronic stress-induced shift in the Th1 to Th2 response promotes colon cancer growth[J].Biochem Biophys Res Commun,2013,439(4):471-476.
[8]Hu L,Yang J,Song T,etal.A new stress model,a scream sound,alters learning and monoamine levels in rat brain[J].Physiol Behav,2014,123:105-113.
[9]刘喜娟,宋土生,杨章民,等.恐惧声音心理应激对青年小鼠空间学习记忆能力的影响[J].中国行为医学科学,2008,17(4):310-312.
[10]Hanson MA,Gluckman PD.Developmental origins of health and disease-global public health implications[J].Best Pract Res Clin Obstet Gynaecol,2015,29(1):24-31.
[11]Götz AA,Stefanski V.Psychosocial maternal stress during pregnancy affects serum corticosterone,blood immune parameters and anxiety behaviour in adult male rat offspring[J].Physiol Behav,2007,90(1):108-115.
[12]Otten W,Kanitz E,Tuchscherer M,etal.Effects of adrenocorticotropin stimulation on cortisol dynamics of pregnant gilts and their fetuses:implications for prenatal stress studies[J].Theriogenology,2004,61(9):1649-1659.
[13]Grizenko N,Shayan YR,Polotskaia A,etal.Relation of maternal stress during pregnancy to symptom severity and response to treatment in children with ADHD[J].J Psychiatry Neurosci,2008,33(1):10-16.
[14]Wainstock T,Lerner-Geva L,Glasser S,etal.Prenatal stress and risk of spontaneous abortion[J].Psychosom Med,2013,75(3):228-35.
[15]Barzegar M,Sajjadi FS,Talaei SA,etal.Prenatal exposure to noise stress:anxiety,impaired spatial memory,and deteriorated hippocampal plasticity in postnatal life[J].Hippocampus,2015,25(2):187-196.
[16]Walder DJ,Laplante DP,Sousa-Pires A,etal.Prenatal maternal stress predicts autism traits in 6.5 year-old children:project ice storm[J].Psychiatry Res,2014,219(2):353-360.
[17]Weston HI,Weston DD,Allen JL,etal.Sex-dependent impacts of low-level lead exposure and prenatal stress on impulsive choice behavior and associated biochemical and neurochemical manifestations[J].Neurotoxicology,2014,44:169-183.
[18]Komesaroff PA,Esler MD,Sudhir K.Estrogen supplementation attenuates glucocorticoid and catecholamine responses to mental stress in perimenopausal women[J].J Clin Endocrinol Metab,1999,84(2):606-610.
Effect of scream voice stress on spatial learning and memory capability in offspring of pregnant mice
NI Lei1, WANG Aiying1, LUO Mai1, BAI Jiyu2, LIU Liying3*
(1DepartmentofCellBiologyandGenetics,Xi’anJiaotongUniversityHealthScienceCenter,Xi’an710061,China;2Xi’anJiaotongUniversityHealthScienceCenter;3CenterLaboratoryforBiomedicalResearch,Xi’anJiaotongUniversity,EnvironmentandGenesRelatedtoDiseasesKeyLaboratoryofEducationMinistry;*Correspondingauthor,E-mail:llying@mail.xjtu.edu.cn)
Abstract:ObjectiveTo explore the on the memory and learning ability of the offsprings of scream voice stress pregnant mice. MethodsKunming female mice were chosen as experimental animals. Pregnant mice were randomly divided into stress group and control group. Pregnant mice in stress group were exposed to scream voice stress for 2 h at the morning and afternoon respectively for 2 weeks. In control group the mice were fed under the normal situation. The natality was noted in the two groups. Descendant mice were continuously raised for 35-40 d. Learning and memory abilities of the offspring were further measured by the Morris water maze. ResultsThe natality was lower in stress group(7±1.58/nest)than that in control group(11±1.85/nest,P<0.05). Escape latency was significantly higher in offsprings of stress mice than that of control mice, especially at day 1,4,5(P<0.05). The escape latency of the male offsprings mice was longer in stress group than that in control group(P<0.05), but there was no difference in female offspring mice between two groups. The spatial probe test showed that the times of searching the platform of offspring mice in stress group was lower than in control group(2.58±1.76 vs 3.35±1.89,P<0.05). The times of searching the platform of male offsprings in stress group was significantly lower than in control group(1.59±1.37 vs 3.08±2.03,P<0.05). However, there was no difference in spatial probe test of female offsprings between two groups. ConclusionScream voice stress may damage the learning and memory of male offspring mice.
Key words:scream sound;mice;learning and memory abilities;Morris water maze
[收稿日期:2015-09-28]
作者简介:倪磊,女,1965-11生,本科,实验师,E-mail:nilei@mail.xjtu.edu.cn.
中图分类号:R338
文献标志码:A
文章编号:1007-6611(2016)01-0022-04
DOI:10.13753/j.issn.1007-6611.2016.01.006
基金项目:陕西省科技资源开放共享平台基金资助项目(2015FWPT-14);陕西省自然科学基础研究计划基金资助项目(2014JM2-3032)

